肝样细胞的体外诱导及小分子化合物在肝样细胞诱导中的应用
2023-04-29唐薇王冬梅
唐薇 王冬梅

摘要:体外诱导肝样细胞(HLC)是获取大量具有应用价值的肝细胞的有效途径之一,这些 HLC可以用于构建疾病模型、药物设计和药物毒理学评价等。目前,HLC的体外诱导主要通过引入外源转录因子、细胞因子或小分子化合物组合的处理。小分子化合物因其结构多样性、时间和剂量的可控性及操作上的便利和安全等优势,让科学家们致力于筛选小分子化合物来取代外源转录因子和细胞因子,其在再生医学领域的应用前景广阔。本文主要对体外诱导多能干细胞及其他成体细胞分化成HLC的研究进行概述,并总结了小分子化合物在体外诱导HLC中的应用,以期为HLC的体外诱导研究提供思路和借鉴。
关键词:肝样细胞; 小分子化合物; 再生医学
基金项目:福建省自然科学基金项目(2020J05038); 福建省教育厅项目(JAT190090)
Advances in in vitro induction of hepatocyte-like cells and the application of small-molecule compounds in inducing hepatocyte-like cells
TANG Wei, WANG Dongmei. (Fujian Key Laboratory of Development and Neurobiology, College of Life Sciences, Fujian Normal University, Fuzhou 350117, China)
Corresponding author:
TANG Wei, 40720007@qq.com (ORCID:0000-0001-8841-4125)
Abstract:
The induction of hepatocyte-like cells (HLCs) in vitro is one of the effective ways to obtain a large number of useful hepatocyte, and these HLCs can be used in disease modeling, drug design, and toxicological evaluation. At present, the induction of HLCs in vitro is mainly achieved by introducing exogenous transcription factors, cytokines or small-molecule compounds. Since small-molecule compounds have the advantages of structural diversity, controllable time and dose, and convenient and safe operation, scientists are devoted to screening out the small-molecule compounds to replace exogenous transcription factors and cytokines, and such compounds have a promising application prospect in the field of regenerative medicine. This article reviews the studies on the in vitro induction of HLCs from pluripotent stem cells and other adult stem cells and summarizes the application of small-molecule compounds in the in vitro induction of HLCs, in order to provide ideas and references for the in vitro induction of HLCs.
Key words:
Hepatocyte-Like Cells; Small Molecules; Regenerative Medicine
Research funding:
Natural Science Foundation of Fujian Province (2020J05038); Fujian Education Department (JAT190090)
肝臟疾病一直威胁着全人类的健康,终末期肝病更是有着较高的致死率。肝移植被认为是治疗肝脏代谢类疾病、终末期肝病和急性肝病最为有效的方法[1-3]。然而可用于移植手术的肝脏供体器官非常紧缺,一般肝移植较为常见的方法是进行肝细胞移植[4],即向患者体内移植正常的肝细胞进行治疗,这样可以有效扩大供体肝脏的使用效率,并具有操作简便、创伤小的优点[5]。
目前将肝细胞移植技术广泛运用于临床治疗仍然面临着许多问题,如缺少高质量的供体肝脏,缺少临床级别的冻存和复苏肝细胞的方法,以及合适的免疫抑制试剂等。如果在肝细胞来源方面有进一步突破,细胞移植将会更有效地应用于临床,为患者提供更好的治疗,提高生存机会。另一方面,肝细胞是药物研发的重要工具,可以用于评价药物毒性、稳定性等。如果能在体外大量获得肝样细胞(hepatocyte-like cells,HLC)将非常有利于肝脏疾病的治疗和新药研发[6-7]。近年来,国内外科研工作者一直致力于获得不依赖于供体肝脏的功能型HLC。随着干细胞技术、细胞转分化技术的大力发展,诱导其他细胞分化为HLC的研究工作已成为再生医学的研究热点。众多研究[1,8-9]表明胚胎干细胞、诱导多能性干细胞以及其他终末分化的细胞可通过导入外源基因、小分子化合物处理、细胞共培养或添加特定细胞因子、3D培养等方式来实现向肝细胞的诱导分化。小分子化合物因其作用靶点相对清晰、操作简便等独特优势,让科研工作者们更致力于探索用小分子化合物的方法来不断优化细胞肝向分化的诱导过程。
1 HLC的体外诱导
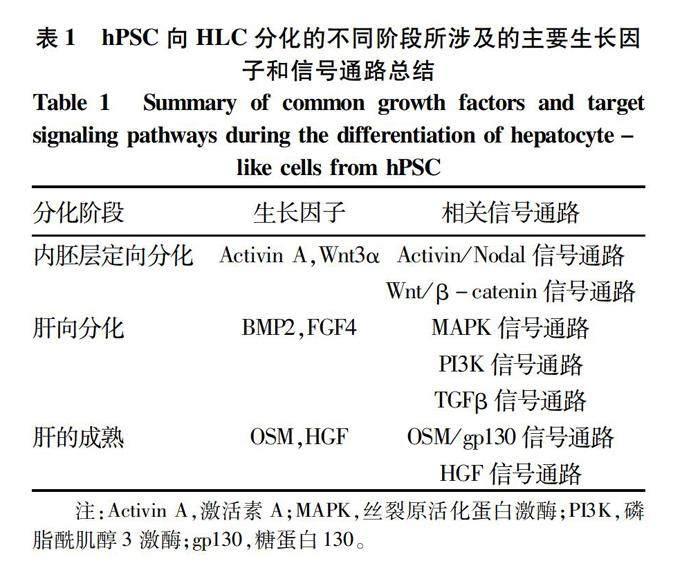
1.1 多能干细胞来源的HLC 人多能干细胞(human pluripotent stem cells,hPSC)包含了人胚胎干细胞(human embryonic stem cells,hESC)和人诱导多能性干细胞(human-induced pluripotent stem cells,hiPSC)。hPSC体外诱导分化成肝细胞常见的方法有:细胞因子与胞外基质共同诱导、化合物诱导、遗传修饰以及与分化的成體细胞共培养等[5]。目前科学家在诱导hPSC体外分化成肝细胞时采用的主要策略是模拟人体胚胎发育过程中肝脏的形成[1]。主要经历了3个阶段的分化:(1)激活Activin/Nodal通路,促使胚胎干细胞向内胚层分化;(2)生长因子骨形态发生蛋白(bone morphogenetic protein,BMP)和成纤维细胞生长因子(fibroblast growth factor,FGF)刺激内胚层向胎肝分化发育;(3)添加肝细胞生长因子(HGF)和抑瘤素 M(oncostatin M,OSM)促进肝细胞的成熟。具体的诱导肝向分化所涉及的细胞因子与相关信号通路如表1所示。目前已有研究通过优化细胞培养基[10]、细胞共培养[11-12]、过表达相关转录因子[13]等方式来提高诱导得到的HLC的成熟性。已有研究[14-15]表明肝细胞的极性对于胆管和膜转运体的形成至关重要。Dao Thi等[15]将hESC诱导分化成柱状极化的HLC,这些极化的HLC可以用于药代动力学、药物之间相互作用的研究。
科研人员在将hESC诱导分化成肝细胞的研究上已经取得了很大的进展,构建了多种分化诱导体系[4]。但hESC的使用依然面临着伦理道德及个体间免疫排斥等问题,在一定程度上也限制了其临床的应用。而hiPSC来源的肝细胞可以有效避免此问题。可以先用患者自身的体细胞体外诱导成 hiPSC,再进一步将 hiPSC定向诱导分化为人肝样细胞(hHLC),这类细胞被称为hiPSC-HLC[9,16]。从患者自身取材诱导得到的细胞可以有效缓解免疫排斥的情况,且不存在伦理道德争议。hiPSC-HLC还可用于构建肝类器官,这种3D的肝类器官可以用于模拟肝脏的发育过程,探究肝脏疾病发病机制、药物疗效、细胞间以及细胞与基质间的相互作用[17-19]。
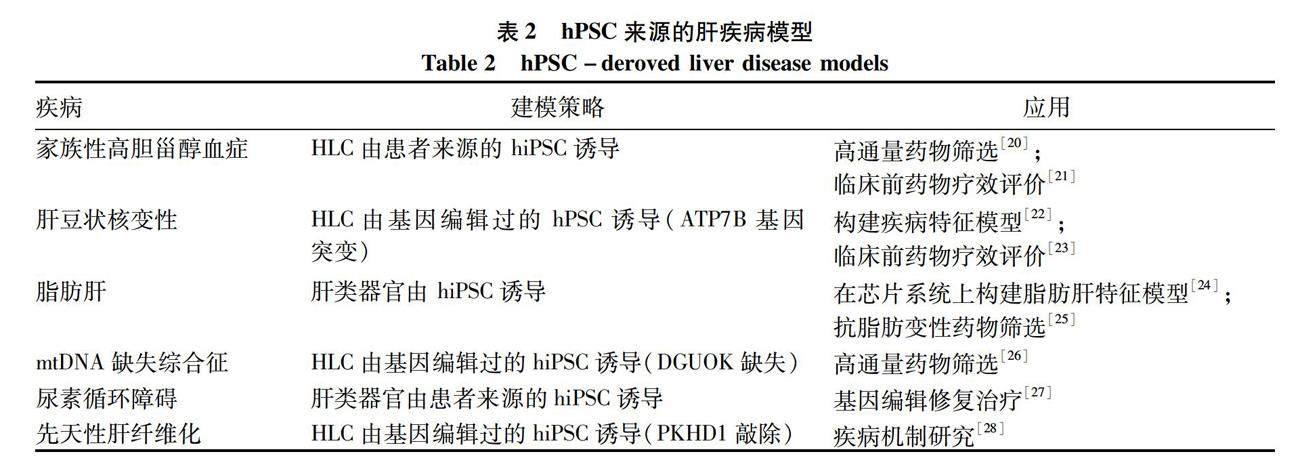
hPSC来源的HLC已成功开发为多种肝相关疾病的细胞模型和类器官模型,在一定程度上解决了病理样品有限的问题,可将其用于探究肝疾病发病机制,并设计针对性的治疗方案。表2总结了一些 hPSC来源的肝疾病模型及其应用。hPSC来源的HLC在高通量药物筛选、药物毒性分析、药代动力学和个体化差异作用评价等领域都发挥了重要价值[20-28]。
1.2 其他成体细胞来源的HLC 细胞转分化技术也称为谱系重编程,实质是将分化成熟的体细胞直接转变成其他谱系的功能细胞或者祖细胞,该过程无需经历干细胞的多能性状态。转分化技术操作简便,较好地避免了多能干细胞技术在细胞疗法中潜在的致瘤性,能够为诱导培养功能型肝细胞、解决肝病患者需求提供新思路。
2011年中国科学家惠利健研究团队[29]在Nature报道了采用3种转录因子 Foxa3、Hnf1α、Gata4 可以实现将小鼠皮肤细胞转分化成HLC。这些HLC具有典型的上皮样细胞形态,表达肝细胞特异性基因并具有类似肝细胞的功能,且在移植到Fah-/-小鼠体内后能够发挥一定的治疗作用。有研究[30]表明,Foxa蛋白家族作为“先锋因子”,可招募Hnf4α共同结合到染色质上来激活肝特异性基因的表达。而Foxa3不同于Foxa1和Foxa2的是,其能迁移到目标基因的转录起始区与RNA聚合酶Ⅱ结合,共同调控基因的表达。胡以平课题组[31]报道了利用另外两种转录因子Hnf1β和Foxa3可将小鼠的胚胎成纤维细胞转分化为肝脏祖细胞,而肝脏祖细胞可以进一步分化为肝细胞和胆管细胞。随着小鼠体系的转分化诱导技术的成熟,科学家们也开始实现将人的成纤维细胞转分化成hHLC。惠利健课题组[32]通过对人成纤维细胞过表达Foxa3、Hnf1α和Hnf4α而成功将其转分化为hHLC。Inada等[33]采用外源转录因子Foxa3、Hnf1α和Hnf6将人脐静脉和外周血源性内皮细胞转分化成肝前体细胞,通过体外3D培养来实现肝前体细胞向肝细胞和胆管细胞的分化。这些研究成果表明多种成体细胞是可以通过导入外源转录因子来实现向肝细胞的转分化,但是外源转录因子的导入可能会引起细胞基因组插入后突变,而病毒的使用可能具有一定的致瘤性。目前有许多研究者致力于采用化合物诱导的方法来取代外源转录因子,让细胞肝向转分化的过程更加简便、可控,且具有医学应用价值。
2 小分子化合物在体外诱导HLC中的应用
2.1 小分子化合物在促进多能干细胞肝向分化中的应用 小分子化合物在细胞重编程过程中取代转录因子的作用要追溯到iPSC的体外诱导。2013年邓宏魁课题组[34]采用7个小分子化合物VPA(丙戊酸)、CHIR99021、Repsox、Parnate、Forskolin、DZNep和TTNPB成功将小鼠体细胞诱导为iPSC,首次实现了全化合物组合的方法诱导体细胞重编程,实现了里程碑式的突破。运用全化合物诱导得到的iPSC被命名为化合物诱导多能性干细胞(chemical induced pluripotent stem cells,CiPSC)。CiPSC的出现也让科学家们更多的尝试将小分子化合物用于诱导多能干细胞的定向分化。Tasnim等[35]采用小分子化合物三步诱导法促使hPSC分化为HLC:LY294002和BIO(6-溴-靛玉红-3′-肟)诱导定形内胚层的形成;丁酸钠(sodium butyrate,SB)和DMSO诱导内胚层分化为肝前体细胞;最后联合SB431542 将肝前体细胞诱导分化为HLC。Asumda等[36]发现小分子化合物组合(CHIR99021、DMSO和Dihexa)可以诱导hPSC分化为HLC。Du等[37]利用CHIR99021和DMSO促进 hPSC向定形内胚层分化,然后采用A83-01、SB和 DMSO诱导内胚层肝向分化,最后加入FH1和 FPH1促进HLC的成熟。
2.2 小分子化合物在促进其他细胞肝向分化中的应用 相较于细胞因子较为昂贵的价格和外源转录因子导入较为繁琐的操作,小分子化合物因其结构多样性、操作便利可控及价格上的优势,使其成为体外诱导其他细胞重编程为 HLC的优先选择。目前已有不少研究结果表明小分子化合物可以促进其他成体细胞体外转分化为HLC。Guo等[38]采用小分子化合物组合CRVPTD(C,CHIR99021;R,RepSox;V,VPA;P,Parnate;T,TTNPB;D,DZNep)結合外源转录因子Foxa3可以诱导小鼠成纤维细胞向肝细胞转分化,并在肝损伤小鼠(Fah-/-小鼠)中验证了这些HLC的功能;Tang等[39]将小分子化合物组合CRVPTD结合单个转录因子(Foxa3/Hnf1α/Hnf4α)诱导人尿细胞转分化为 HLC;Lim等[40]发现单个转录因子(Hnf1α 或Hnf4α)结合BMP4、小分子化合物A-83-01和CHIR99021可以将小鼠成纤维细胞转分化为HLC。然而,将小分子化合物A-83-01与化合物组合CRVPTD结合却不能实现全化合物诱导成纤维细胞向肝细胞的转分化[39]。也有研究将小分子化合物应用于间充质干细胞的体外肝向分化诱导。Panta等[41]发现丁酸钠可以诱导间充质干细胞分化为肝前体细胞,并促进其体外成熟;Luo等[42]采用小分子化合物组合(IDE1、CHIR99021、LY294002、FH1)诱导人间充质干细胞体外分化为HLC;Cipriano等[43]采用表观遗传调控分子曲古菌素A(TSA)、5-氮杂胞苷(5-AZA)联合DMSO诱导人脐带来源间充质干细胞分化为HLC。表3将不同小分子化合物在体外诱导其他细胞分化为HLC中的应用进行了总结和归纳。
小分子化合物也可用于诱导原代肝细胞转化为具有增殖能力的肝前体细胞。Katsuda等[44]发现小分子化合物Y-27632、A-83-0和CHIR99021可使小鼠肝细胞转化为可增殖的、并具有双向分化潜能的前体细胞,以实现小鼠肝细胞的体外增殖,并将该技术用于治疗肝疾病小鼠。惠利健课题组[45]则发现在条件培养基中加入Y-27632和A-83-01可促使人原代肝细胞进入一种可增殖的中间过渡态(具有一定分化潜能),实现人肝细胞的体外增殖并诱导其定向分化。这些研究成果为体外大量获得功能性肝细胞提供了非常好的策略,但其原代肝细胞的获得仍需依赖于供体肝脏。如何实现全化合物诱导其他细胞分化成具有成熟肝细胞功能的HLC,而不再依赖于供体肝脏是科学界未来想要解决的问题。
3 小分子化合物在HLC诱导中的作用机制
小分子化合物在HLC诱导过程中的作用机制可以大致分为两个方面(表4)。在诱导多能干细胞肝向分化的第一阶段——定形内胚层的形成,常用到的小分子化合物有CHIR99021、BIO、IDE1和LY294002。作为糖原合成激酶3(GSK-3)抑制剂的CHIR99021和BIO,主要是通过激活Wnt/β-catenin通路来上调内胚层标志性基因的表达,促进定形内胚层的形成[35-37]。IDE是一种定形内胚层诱导物,作用与Activin A相似,通过介导Smad2磷酸化,激活Activin/Nodal通路来促进内胚层的形成[42,46]。第二阶段是细胞肝向分化和HLC的成熟。许多研究[35-37]表明适当浓度的DMSO能够驱动定形内胚层的肝向分化,促进HLC的成熟。但也有研究者对此持不同意见。Wang等[51]认为细胞的肝向分化效率并不受DMSO影响。DMSO作为含硫有机化合物,可以与蛋白质的疏水基团相互作用,引起蛋白质变性,进而影响细胞的代谢活动,这对其在细胞肝向分化中的作用带来了一定的争议性,具体作用机制有待阐明。
有些小分子化合物能推进体细胞的重编程,加速细胞从间质向上皮的转化(MET,调节细胞命运转换的关键过程),如 A83-01和RepSox作为活化素受体样激酶抑制剂(抑制TGFβ)能够促进细胞MET的过程[8,37,48],从而有利于肝前体细胞的生成和肝细胞的成熟。组蛋白去乙酰化抑制剂(如SB、VPA和TSA)也常用于诱导细胞肝向分化,其可以促进肝细胞代表性基因的表达,有利于内胚层向肝细胞分化[41,43,47]。还有一些表观遗传调控分子,如Parnate(赖氨酸特异性脱甲基酶抑制剂)、DZNep(组蛋白甲基化抑制剂)和 5-AZA(DNA甲基化酶抑制剂),能够创造一种开放的状态来调节染色质结构,实现在基因转录水平上促进细胞向肝脏谱系的转化[8,43,49]。TTNPB 可通过激活视黄酸受体参与调控肝核受体介导的信号通路,从而推动细胞的肝向转分化[50]。小分子化合物FH1和FPH1可以分别取代细胞因子HGF和OSM来促进肝细胞的成熟[37]。目前,小分子化合物在促进其他细胞向肝细胞的转化过程中所发挥的精确作用和机制尚不完全清楚,未来需要筛选更多的小分子化合物并确定最优的组合和适用浓度,以实现对细胞肝向分化诱导的精准调控。
4 总结与展望
肝移植是治疗终末期肝病唯一有效的方法,但因为供体肝脏的短缺以及需要忍受长期的免疫抑制治疗而无法被广泛应用。肝细胞体外诱导技术的发展是解决供体肝脏不足的有效方法,尤其是hPSC来源的HLC在产量上能够实现无限供给,可以广泛用于肝疾病药物开发、肝疾病模型建立、个性化药物设计、药物毒理学评价等领域。且hiPSC-HLC还可取材于患者自身细胞,用于体外功能性肝脏器官的诱导,具有重大的临床意义。体外诱导HLC主要采用的是外源性细胞因子诱导、外源基因导入以及小分子化合物的定向诱导。小分子化合物的诱导方式相比转基因操作要更加安全、可控且易于操作。目前小分子化合物还不能完全取代外源转录因子和细胞因子在诱导其他细胞肝向分化中的作用,需要寻找更多有效、安全的小分子化合物来实现全化合物诱导以及提高诱导得到的HLC的成熟性。未来,如何更高效、安全地获得HLC以及科学、系统地评价获得的HLC的功能用途是体外诱导细胞肝向分化研究的努力方向。
利益沖突声明:所有作者均声明不存在利益冲突。
作者贡献声明:唐薇参与文献调研和文章撰写;王冬梅参与文章的文献查阅与内容修改。
参考文献:
[1]LI Y, YANG X, PLUMMER R, et al. Human pluripotent stem cell-derived hepatocyte-like cells and organoids for liver disease and therapy[J]. Int J Mol Sci, 2021, 22(19): 10471. DOI: 10.3390/ijms221910471.
[2]FAN Q, LI Z. Liver transplantation for acute-on-chronic liver failure[J]. Ogran Transplant, 2022, 13(3): 333-337. DOI: 10.3969/j.issn.1674-7445.2022.03.008.
范祺, 李照. 慢加急性肝衰竭的肝移植治疗[J]. 器官移植, 2022, 13(3): 333-337. DOI: 10.3969/j.issn.1674-7445.2022.03.008.
[3]XIA Q, SHA M. Progress and prospect of living donor liver transplantation[J]. Chin J Dig Surg, 2022, 21(1): 39-42. DOI: 10.3760/cma.j.cn115610-20211205-00622.
夏强, 沙朦. 活体肝移植的进展与展望[J]. 中华消化外科杂志, 2022, 21(1): 39-42. DOI: 10.3760/cma.j.cn115610-20211205-00622.
[4]
LUCE E, MESSINA A, DUCLOS-VALLE JC, et al. Advanced techniques and awaited clinical applications for human pluripotent stem cell differentiation into hepatocytes[J]. Hepatology, 2021, 74(2): 1101-1116. DOI: 10.1002/hep.31705.
[5]MESSINA A, LUCE E, HUSSEIN M, et al. Pluripotent-stem-cell-derived hepatic cells: hepatocytes and organoids for liver therapy and regeneration[J]. Cells, 2020, 9(2): 420. DOI: 10.3390/cells9020420.
[6]LIU JT, LAMPRECHT MP, DUNCAN SA. Using human induced pluripotent stem cell-derived hepatocyte-like cells for drug discovery[J]. J Vis Exp, 2018, 135: 57194. DOI: 10.3791/57194.
[7]DEGUCHI S, TAKAYAMA K, MIZUGUCHI H. Generation of human induced pluripotent stem cell-derived hepatocyte-like cells for cellular medicine[J]. Biol Pharm Bull, 2020, 43(4): 608-615. DOI: 10.1248/bpb.b19-00740.
[8]ROMBAUT M, BOECKMANS J, RODRIGUES RM, et al. Direct reprogramming of somatic cells into induced hepatocytes: Cracking the Enigma code[J]. J Hepatol, 2021, 75(3): 690-705. DOI: 10.1016/j.jhep.2021.04.048.
[9]XIE Y, YAO J, JIN W, et al. Induction and maturation of hepatocyte-like cells in vitro: focus on technological advances and challenges[J]. Front Cell Dev Biol, 2021, 9: 765980. DOI: 10.3389/fcell.2021.765980.
[10]TOBA Y, DEGUCHI S, MIMURA N, et al. Comparison of commercially available media for hepatic differentiation and hepatocyte maintenance[J]. PLoS One, 2020, 15(2): e0229654. DOI: 10.1371/journal.pone.0229654.
[11]TAKAGI C, YAGI H, HIEDA M, et al. Mesenchymal stem cells contribute to hepatic maturation of human induced pluripotent stem cells[J]. Eur Surg Res, 2017, 58(1-2): 27-39. DOI: 10.1159/000448516.
[12]SGODDA M, DAI Z, ZWEIGERDT R, et al. A scalable approach for the generation of human pluripotent stem cell-derived hepatic organoids with sensitive hepatotoxicity features[J]. Stem Cells Dev, 2017, 26(20): 1490-1504. DOI: 10.1089/scd.2017.0023.
[13]BOON R, KUMAR M, TRICOT T, et al. Amino acid levels determine metabolism and CYP450 function of hepatocytes and hepatoma cell lines[J]. Nat Commun, 2020, 11(1): 1393. DOI: 10.1038/s41467-020-15058-6.
[14]BUSHWELLER L, ZHAO Y, ZHANG F, et al. Generation of human pluripotent stem cell-derived polarized hepatocytes[J]. Curr Protoc, 2022, 2(1): e345. DOI: 10.1002/cpz1.345.
[15]DAO THI VL, WU X, BELOTE RL, et al. Stem cell-derived polarized hepatocytes[J]. Nat Commun, 2020, 11(1): 1677. DOI: 10.1038/s41467-020-15337-2.
[16]CHEN YF, TSENG CY, WANG HW, et al. Rapid generation of mature hepatocyte-like cells from human induced pluripotent stem cells by an efficient three-step protocol[J]. Hepatology, 2012, 55(4): 1193-1203. DOI: 10.1002/hep.24790.
[17]RAMLI M, LIM YS, KOE CT, et al. Human pluripotent stem cell-derived organoids as models of liver disease[J]. Gastroenterology, 2020, 159(4): 1471-1486. e12. DOI: 10.1053/j.gastro.2020.06.010.
[18]WANG S, WANG X, TAN Z, et al. Human ESC-derived expandable hepatic organoids enable therapeutic liver repopulation and pathophysiological modeling of alcoholic liver injury[J]. Cell Res, 2019, 29(12): 1009-1026. DOI: 10.1038/s41422-019-0242-8.
[19]MARSEE A, ROOS F, VERSTEGEN M, et al. Building consensus on definition and nomenclature of hepatic, pancreatic, and biliary organoids[J]. Cell Stem Cell, 2021, 28(5): 816-832. DOI: 10.1016/j.stem.2021.04.005.
[20]CAYO MA, MALLANNA SK, DI FURIO F, et al. A drug screen using human iPSC-derived hepatocyte-like cells reveals cardiac glycosides as a potential treatment for hypercholesterolemia[J]. Cell Stem Cell, 2017, 20(4): 478-489.e5. DOI: 10.1016/j.stem.2017.01.011.
[21]YANG J, WANG Y, ZHOU T, et al. Generation of human liver chimeric mice with hepatocytes from familial hypercholesterolemia induced pluripotent stem cells[J]. Stem Cell Reports, 2017, 8(3): 605-618. DOI: 10.1016/j.stemcr.2017.01.027.
[22]OVEREEM AW, KLAPPE K, PARISI S, et al. Pluripotent stem cell-derived bile canaliculi-forming hepatocytes to study genetic liver diseases involving hepatocyte polarity[J]. J Hepatol, 2019, 71(2): 344-356. DOI: 10.1016/j.jhep.2019.03.031.
[23]KIM D, KIM SB, RYU JL, et al. Human embryonic stem cell-derived Wilsons disease model for screening drug efficacy[J]. Cells, 2020, 9(4): 872. DOI: 10.3390/cells9040872.
[24]WANG Y, WANG H, DENG P, et al. Modeling human nonalcoholic fatty liver disease (NAFLD) with an organoids-on-a-chip system[J]. ACS Biomater Sci Eng, 2020, 6(10): 5734-5743. DOI: 10.1021/acsbiomaterials.0c00682.
[25]MUN SJ, RYU JS, LEE MO, et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids[J]. J Hepatol, 2019, 71(5): 970-985. DOI: 10.1016/j.jhep.2019.06.030.
[26]JING R, CORBETT JL, CAI J, et al. A screen using iPSC-derived hepatocytes reveals NAD+ as a potential treatment for mtDNA depletion syndrome[J]. Cell Rep, 2018, 25(6): 1469-1484. e5. DOI: 10.1016/j.celrep.2018.10.036.
[27]ZABULICA M, JAKOBSSON T, RAVAIOLI F, et al. Gene editing correction of a urea cycle defect in organoid stem cell derived hepatocyte-like cells[J]. Int J Mol Sci, 2021, 22(3): 1217. DOI: 10.3390/ijms22031217.
[28]TSUNODA T, KAKINUMA S, MIYOSHI M, et al. Loss of fibrocystin promotes interleukin-8-dependent proliferation and CTGF production of biliary epithelium[J]. J Hepatol, 2019, 71(1): 143-152. DOI: 10.1016/j.jhep.2019.02.024.
[29]HUANG P, HE Z, JI S, et al. Induction of functional hepatocyte-like cells from mouse fibroblasts by defined factors[J]. Nature, 2011, 475(7356): 386-389. DOI: 10.1038/nature10116.
[30]HORISAWA K, UDONO M, UENO K, et al. The dynamics of transcriptional activation by hepatic reprogramming factors[J]. Mol Cell, 2020, 79(4): 660-676. e8. DOI: 10.1016/j.molcel.2020.07.012.
[31]YU B, HE ZY, YOU P, et al. Reprogramming fibroblasts into bipotential hepatic stem cells by defined factors[J]. Cell Stem Cell, 2013, 13(3): 328-340. DOI: 10.1016/j.stem.2013.06.017.
[32]HUANG P, ZHANG L, GAO Y, et al. Direct reprogramming of human fibroblasts to functional and expandable hepatocytes[J]. Cell Stem Cell, 2014, 14(3): 370-384. DOI: 10.1016/j.stem.2014.01.003.
[33]INADA H, UDONO M, MATSUDA-ITO K, et al. Direct reprogramming of human umbilical vein- and peripheral blood-derived endothelial cells into hepatic progenitor cells[J]. Nat Commun, 2020, 11(1): 5292. DOI: 10.1038/s41467-020-19041-z.
[34]HOU P, LI Y, ZHANG X, et al. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds[J]. Science, 2013, 341(6146): 651-654. DOI: 10.1126/science.1239278.
[35]TASNIM F, PHAN D, TOH YC, et al. Cost-effective differentiation of hepatocyte-like cells from human pluripotent stem cells using small molecules[J]. Biomaterials, 2015, 70: 115-125. DOI: 10.1016/j.biomaterials.2015.08.002.
[36]ASUMDA FZ, HATZISTERGOS KE, DYKXHOORN DM, et al. Differentiation of hepatocyte-like cells from human pluripotent stem cells using small molecules[J]. Differentiation, 2018, 101: 16-24. DOI: 10.1016/j.diff.2018.03.002.
[37]DU C, FENG Y, QIU D, et al. Highly efficient and expedited hepatic differentiation from human pluripotent stem cells by pure small-molecule cocktails[J]. Stem Cell Res Ther, 2018, 9(1): 58. DOI: 10.1186/s13287-018-0794-4.
[38]GUO R, TANG W, YUAN Q, et al. Chemical cocktails enable hepatic reprogramming of mouse fibroblasts with a single transcription factor[J]. Stem Cell Reports, 2017, 9(2): 499-512. DOI: 10.1016/j.stemcr.2017.06.013.
[39]TANG W, GUO R, SHEN SJ, et al. Chemical cocktails enable hepatic reprogramming of human urine-derived cells with a single transcription factor[J]. Acta Pharmacol Sin, 2019, 40(5): 620-629. DOI: 10.1038/s41401-018-0170-z.
[40]LIM KT, LEE SC, GAO Y, et al. Small molecules facilitate single factor-mediated hepatic reprogramming[J]. Cell Rep, 2016, 15(4): 814-829. DOI: 10.1016/j.celrep.2016.03.071.
[41]PANTA W, IMSOONTHORNRUKSA S, YOISUNGNERN T, et al. Enhanced hepatogenic differentiation of human Wharton's Jelly-derived mesenchymal stem cells by using three-step protocol[J]. Int J Mol Sci, 2019, 20(12): 3016. DOI: 10.3390/ijms20123016.
[42]LUO S, AI Y, XIAO S, et al. Functional hit 1 (FH1)-based rapid and efficient generation of functional hepatocytes from human mesenchymal stem cells: a novel strategy for hepatic differentiation[J]. Ann Transl Med, 2021, 9(13): 1087. DOI: 10.21037/atm-21-2829.
[43]CIPRIANO M, CORREIA JC, CAMOES SP, et al. The role of epigenetic modifiers in extended cultures of functional hepatocyte-like cells derived from human neonatal mesenchymal stem cells[J]. Arch Toxicol, 2017, 91(6): 2469-2489. DOI: 10.1007/s00204-016-1901-x.
[44]KATSUDA T, KAWAMATA M, HAGIWARA K, et al. Conversion of terminally committed hepatocytes to culturable bipotent progenitor cells with regenerative capacity[J]. Cell Stem Cell, 2017, 20(1): 41-55. DOI: 10.1016/j.stem.2016.10.007.
[45]ZHANG K, ZHANG L, LIU W, et al. In vitro expansion of primary human hepatocytes with efficient liver repopulation capacity[J]. Cell Stem Cell, 2018, 23(6): 806-819. e4. DOI: 10.1016/j.stem.2018.10.018.
[46]XU F, LIU J, DENG J, et al. Rapid and high-efficiency generation of mature functional hepatocyte-like cells from adipose-derived stem cells by a three-step protocol[J]. Stem Cell Res Ther, 2015, 6: 193. DOI: 10.1186/s13287-015-0181-3.
[47]KONDO Y, IWAO T, YOSHIHASHI S, et al. Histone deacetylase inhibitor valproic acid promotes the differentiation of human induced pluripotent stem cells into hepatocyte-like cells[J]. PLoS One, 2014, 9(8): e104010. DOI: 10.1371/journal.pone.0104010.
[48]SGODDA M, MOBUS S, HOEPFNER J, et al. Improved hepatic differentiation strategies for human induced pluripotent stem cells[J]. Curr Mol Med, 2013, 13(5): 842-855. DOI: 10.2174/1566524011313050015.
[49]LI W, DING S. Small molecules that modulate embryonic stem cell fate and somatic cell reprogramming[J]. Trends Pharmacol Sci, 2010, 31(1): 36-45. DOI: 10.1016/j.tips.2009.10.002.
[50]ANG LT, TAN A, AUTIO MI, et al. A roadmap for human liver differentiation from pluripotent stem cells[J]. Cell Rep, 2018, 22(8): 2190-2205. DOI: 10.1016/j.celrep.2018.01.087.
[51]WANG ZY, LI WJ, LI QG, et al. A DMSO-free hepatocyte maturation medium accelerates hepatic differentiation of HepaRG cells in vitro[J]. Biomed Pharmacother, 2019, 116: 109010. DOI: 10.1016/j.biopha.2019.109010.
收稿日期:
2022-09-05;錄用日期:2022-10-12
本文编辑:王莹
