脾体积对肝硬化门静脉高压性胃病及其严重程度的预测价值
2023-04-29张志强陈伟刘波
张志强 陈伟 刘波
摘要:目的 探討脾体积(SV)对肝硬化患者门静脉高压性胃病(PHG)及重度PHG的预测价值。方法 回顾性分析2018年1月—2022年8月湖北医药学院附属襄阳市第一人民医院收治的168例肝硬化患者临床资料,以胃镜检查结果为“金标准”,将患者分为无PHG组(n=115)和PHG组(n=53),轻度PHG组(n=26)和重度PHG组(n=27),所有患者均行电子胃镜、腹部磁共振及相关血清学检查,获取相关指标及参数。正态分布的计量资料两组间比较采用成组t检验;非正态分布的计量资料两组间比较采用 Mann-Whitney U检验。计数资料两组间比较采用χ2检验。通过多因素Logistic回归分析筛选出PHG、重度PHG的独立危险因素,利用受试者工作特征曲线(ROC曲线)比较相关指标或参数的预测价值。ROC曲线下面积的比较采用Delong检验。结果 单因素分析显示:PHG组和非PHG组性别、有无腹水、Hb、PLT、AST、TBil、Alb、PT、INR、Child-Pugh分级、FIB-4评分、King评分、Lok评分、脾长径(SD)、SV、血小板/脾长径(PSDR)、血小板/脾体积(PSVR)比较,差异均有统计学意义(P值均<0.05);轻度PHG组和重度PHG组Hb、PLT、Alb、SD、SV、PSDR、PSVR比较,差异均有统计学意义(P值均<0.05)。多因素Logistic回归分析显示:FIB-4评分(OR=1.280,95%CI:1.009~1.625)和SV(OR=1.007,95%CI:1.001~1.013)是PHG发生的独立危险因素(P值均<0.05);SV(OR=0.990,95%CI:0.980~1.000)是重度PHG发生的独立影响因素(P<0.05)。ROC曲线分析结果显示:在预测PHG发生时,SV的曲线下面积为0.884,高于FIB-4评分的0.825(P<0.05),其最佳临界值为406.82,敏感度为0.774,特异度为0.870;在预测重度PHG发生时,SV的曲线下面积为0.782,最佳临界值为714.63,敏感度为0.593,特异度为0.962。结论 SV对PHG和重度PHG的发生均具有较好的预测价值。
关键词:肝硬化; 门静脉高压性胃病; 预测
基金项目:湖北省自然科学基金(2018CFB619)
Value of spleen volume in predicting portal hypertensive gastropathy and its severity in patients with liver cirrhosis
ZHANG Zhiqiang, CHEN Wei, LIU Bo. (Department of Gastroenterology, Xiangyang No. 1 Peoples Hospital Affiliated to Hubei University of Medicine, Xiangyang, Hubei 441000, China)
Corresponding author:
CHEN Wei, chenweiyf@163.com (ORCID:0000-0002-6985-4595)
Abstract:
Objective To investigate the value of spleen volume (SV) in predicting portal hypertensive gastropathy (PHG) and severe PHG in patients with liver cirrhosis. Methods A retrospective analysis was performed for the clinical data of 168 patients with liver cirrhosis who were admitted to Xiangyang No.1 Peoples Hospistal Affiliated to Hubei University of Medicine from January 2018 to August 2022, and with the results of gastroscopy as the gold standard, these patients were divided into non-PHG group with 115 patients and PHG group with 53 patients; the PHG group was further divided into mild PHG group with 26 patients and severe PHG group with 27 patients. All patients underwent electronic gastroscopy, abdominal magnetic resonance imaging, and serological examination to obtain related indices and parameters. The group t-test was used for comparison of normally distributed continuous data between two groups, and the Mann-Whitney U test was used for comparison of non-normally distributed continuous data between two groups; the chi-square test was used for comparison of categorical data between two groups. A multivariate Logistic regression analysis was used to screen out the independent risk factors for PHG and severe PHG, and the receiver operating characteristic (ROC) curve was used to compare the predictive value of related indices or parameters. The area under the Roccurve is compared using Delong test. Results The univariate analysis showed that there were significant differences between the PHG group and the non-PHG group in sex, presence or absence of ascites, hemoglobin (Hb), platelet count (PLT), aspartate aminotransferase, total bilirubin, albumin (Alb), prothrombin time, international normalized ratio, Child-Pugh class, FIB-4 score, King score, Lok score, spleen diameter (SD), SV, platelet count/spleen diameter ratio (PSDR), and platelet count/spleen volume ratio (PSVR) (all P<0.05), and there were significant differences in Hb, PLT, Alb, SD, SV, PSDR, and PSVR between the mild PHG group and the severe PHG group (all P<0.05). The multivariate Logistic regression analysis showed that FIB-4 score (odds ratio [OR]=1.280, 95% confidence interval [CI]: 1.009-1.625, P<0.05) and SV (OR=1.007, 95% CI: 1.001-1.013, P<0.05) were independent risk factors for PHG, and SV (OR=0.990, 95% CI: 0.980-1.000, P<0.05) was an independent influencing factor for severe PHG. The ROC curve analysis showed that in predicting PHG, SV had a larger area under the ROC curve (AUC) than FIB-4 score (0.884 vs 0.825, P<0.05), with a sensitivity of 0.774 and a specificity of 0.870 at the optimal cut-off value of 406.82; in predicting the onset of severe PHG, SV had an AUC of 0.782, with a sensitivity of 0.593 and a specificity of 0.962 at the optimal cut-off value of 714.63. Conclusion SV has a good value in predicting the onset of PHG and severe PHG.
Key words:Liver Cirrhosis; Portal Hypertensive Gastropathy; Forecasting
Research funding:
Hubei Provincial Natural Science Foundation Project(2018CFB619)
门静脉高压性胃病(portal hypertensive gastropathy,PHG)是各种原因引起门静脉高压导致的胃黏膜非炎性病變,常见于肝硬化门静脉高压症,可并发消化道出血,是肝脏疾病中除食管胃底静脉曲张引起消化道出血的第二大原因,严重者可危及生命[1]。相较于食管胃底静脉曲张,PHG在慢性肝病中常常被低估,其发生率为20.0%~98.0%,仅在内镜检查或治疗过程中偶然发现[2-3],PHG患者还会随着胃肠道的血流动力和黏膜变化引起急性或慢性消化道出血,急性上消化道出血发生率可达2%~12%(高达95%的患者有重度PHG),慢性出血发生率为3%~26%,并导致缺铁性贫血[4-5],因此早期内镜下PHG分级有助于评估出血风险。上消化道内镜检查是诊断PHG的金标准,但其是一种侵入性检查,对于未明确是否存在PHG的肝硬化患者不能常规评价PHG的发生及发展情况,因此,迫切需要非侵入性方法来检测PHG的发生概率,以提前采取相应诊疗措施确诊PHG并减缓其发展程度,甚至早期筛查出重度PHG伴有出血风险的患者。有研究[6-7]分别从一维脾脏长度(spleen longest diameter,SD)和二维脾指数的角度认为脾脏大小与PHG的发生及发展有关。近年来,多维脾体积(spleen volume,SV)被认为更能反映脾脏大小,并且能较好地预测PHG及食管静脉曲张的发生[8-9]。本研究旨在进一步探究SV对PHG及重度PHG的预测价值。
1 资料与方法
1.1 研究对象 回顾性选取2018年1月—2022年8月在本院消化内科确诊的肝硬化患者,诊断依据2019年版《肝硬化诊治指南》[10]中对于肝硬化的诊断标准。所有患者入院后均行电子胃镜、腹部磁共振及血清学检测。以胃镜检查作为判断PHG及严重程度的金标准,依据Baveno Ⅲ共识会议提出的改良分级系统[11],对不同程度的患者进行分组。排除标准:(1)有原发性血液系统疾病史;(2)有严重基础疾病(心衰竭、呼吸衰竭、肾衰竭及恶性肿瘤患者);(3)近期服用过免疫抑制剂或其他可能影响血小板(PLT)计数药物史;(4)有肝脏相关手术及局部治疗史;(5)有脾切手术或脾动脉介入栓塞术史;(6)近3个月有消化道出血及其他出血临床表现;(7)有肝性脑病、肝肾综合征等严重并发症;(8)非肝硬化性门静脉高压症,如门静脉海绵样变、布加综合征等。
1.2 研究方法
1.2.1 一般资料及血清学指标 采集患者入院后2天内的清晨空腹血样,使用自动血液分析仪、生化分析仪对血样进行检测,检测项目包括血常规、肝肾功能、电解质、凝血功能,统计并记录患者年龄、性别、病因、烟酒史、高血压病史、血红蛋白(Hb)、PLT、ALT、AST、TBil、Alb、PT、INR、Child-Pugh 评分等。
1.2.2 腹部磁共振指标 由1名具备5年以上工作经验的医师采用GE Signa 3.0T MR对患者进行矢状位、冠状位以及轴状位扫描,并使用MRI图像分别获取脾脏的长径(L)、宽径(W)以及厚径(T),其中长径定义为冠状面上脾脏最上内侧至最下外侧的长度,宽为横截面上脾脏的最大前后径,厚为在测量宽度截面上的脾门至脾对侧缘的径线,使用传统的SV计算公式:0.524×W×T×L[12-14]。
1.2.3 胃镜检查 由1名具备5年以上工作经验的医师使用Olympus CV-290胃镜对患者行内镜检查。判断有无PHG以及评估PHG的严重程度,根据在Baveno Ⅲ门静脉高压会议上提出的改良分级系统对PHG进行分级:当没有红色或黑褐色斑点迹象的马赛克样黏膜图案存在时定义为轻度;当出现具有红点病变或樱桃红色斑点或黑褐色斑点的马赛克样黏膜图案时为重度。
1.2.4 相关评分及参数的计算方法 FIB-4评分= (年龄×AST)/(PLT×ALT1/2);King评分=年龄×AST×INR/PLT;Lok评分=-5.56-0.008 9×PLT(103/mm3)+ 1.26×AST /ALT+5.27×INR;PSDR=PLT/SD;PSVR=PLT/SV。
1.3 统计学方法 采用 SPSS 24.0统计软件包对数据进行分析。符合正态分布的计量资料用x±s表示,两组间比较采用成组t检验;不符合正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。计数资料组间比较采用χ2检验。影响因素分析采用Logistic回归模型分析,并计算危险因素的OR值和95%CI ,进一步计算具有诊断效能参数的敏感度、特异度,并绘制相应的受试者工作特征曲线(ROC曲线)。ROC曲线下面积(AUC)的比较采用Delong检验。P<0.05为差异有统计学意义。
2 结果
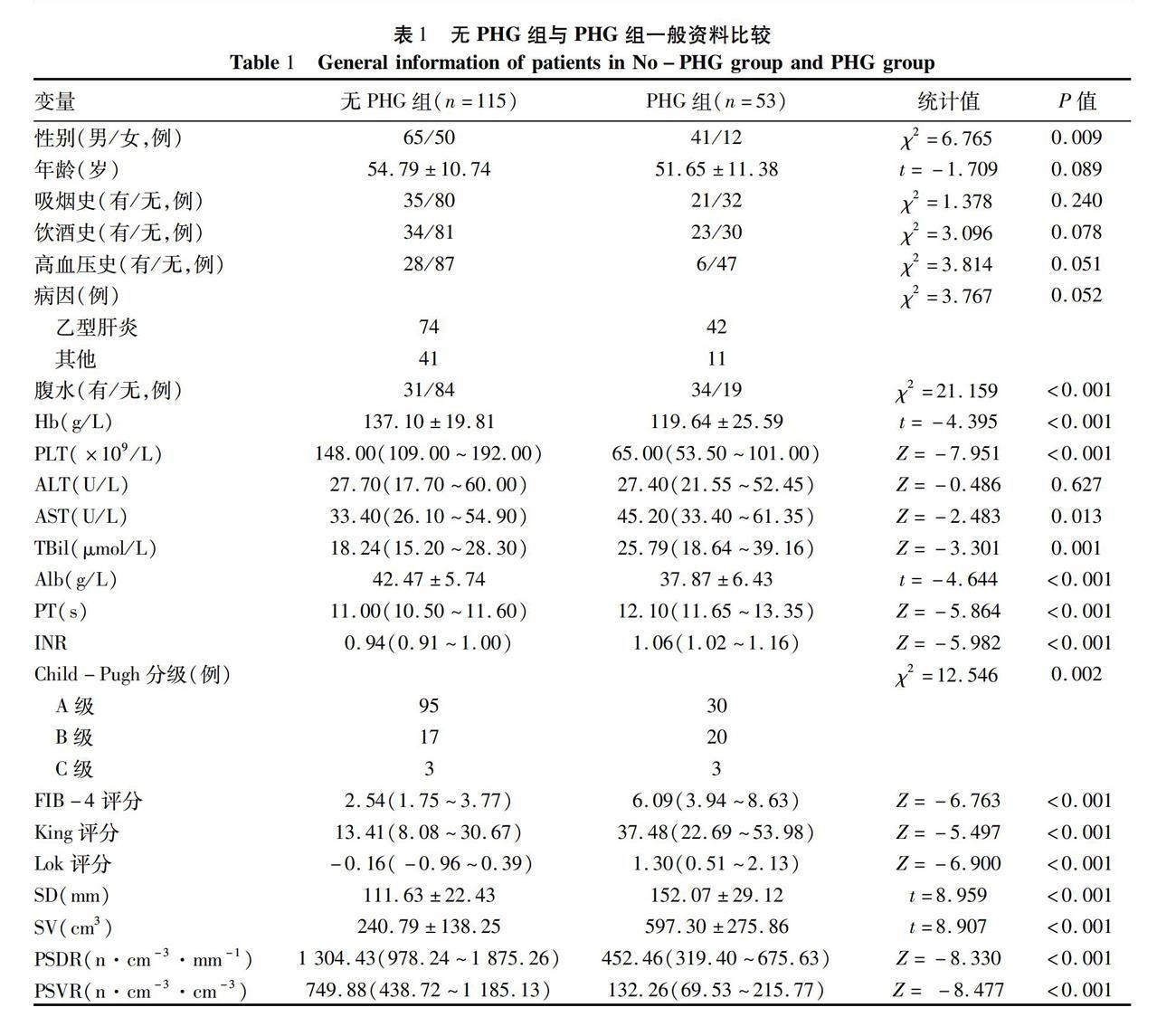
2.1 一般资料 共纳入患者168例,以胃镜检查结果为“金标准”,根据是否有PHG,分为PHG组(n=53)和无PHG组(n=115),两组患者性别、有无腹水、Hb、PLT、AST、TBil、Alb、PT、INR、Child-Pugh分级、FIB-4评分、King评分、Lok评分、SD、SV、PSDR、PSVR比较,差异均有统计学意义(P值均<0.05)(表1)。轻度PHG组26例,重度PHG组27例,两组患者Hb、Alb、PLT、SD、SV、PSDR、PSVR比较,差异均有统计学意义(P值均<0.05)(表2)。
2.2 多因素Logistic回归分析PHG、重度PHG发生的独立影响因素 分别以肝硬化患者有无PHG作为因变量(无PHG=0, PHG=1)、PHG的严重程度为因变量(轻度PHG=0,重度PHG=1),将上述表1、表2中单因素分析差异有统计学意义的指标作为自变量,运用容忍度、方差膨胀因子进行共线性检验,剔除变量,分别进行Hosmer-Lemeshow检验后采用二元Logistic回归分析,结果显示,SV、FIB-4评分为肝硬化患者发生PHG的独立影响因素(P值均<0.05)(表3);SV为重度PHG发生的独立影响因素(P<0.05)(表4)。
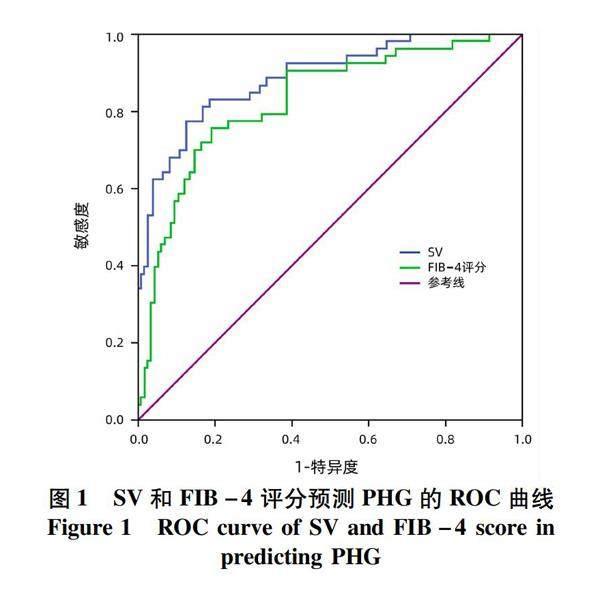
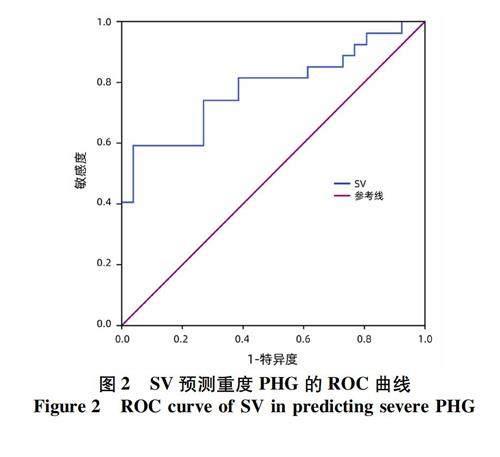
2.3 诊断效能评价 运用ROC曲线分析SV和FIB-4评分对PHG,SV对重度PHG的诊断效率与预测价值,结果显示SV在预测PHG的发生时,其AUC为0.884,高于FIB-4评分的AUC值0.825(P<0.05),其最佳临界值为406.82,此时对应的敏感度为0.774,特异度为0.870(图1,表5)。在预测重度PHG时,SV的AUC值为0.782,此时的最佳临界值为714.63,对应的敏感度为0.593,特异度为0.962(图2,表5)。
3 討论
PHG是肝硬化的主要并发症之一, BavenoⅣ共识[15]首次建议使用非侵入工具对门静脉高压症进行预测,但仅对静脉曲张的指标及发展的预测因素进行了重点提及,相较于食管胃底静脉曲张,同为门静脉高压症结局之一的PHG往往在临床较少被重视[16]。近些年,国外对PHG非侵入性诊断的研究逐渐被重视,国内仍相对较少,故本研究拟进一步对其当前的无创性诊断进行探讨及补充。
门静脉高压是PHG发生的始动环节[4],最新的Baveno Ⅶ专家共识[17]指出,代偿期晚期慢性肝病具有内镜下风险的门静脉高压症可以通过肝脏硬度、单独或结合PLT、脾脏大小、脾脏硬度等指标进行预测评估。本研究结合临床实验室指标、磁共振下SD、SV以及相关联合指标和评分对PHG及重度PHG的发生进行分析,结果表明SV和FIB-4评分是PHG发生的独立影响因素,两者对PHG均具有良好的预测价值,但SV的AUC值高于FIB-4评分,敏感度和特异度也更高,故对于PHG的非侵入性诊断方面,SV有更好的预测效果;在重度PHG的预测性诊断上,仅发现SV与重度PHG的发生独立相关,其同样具有较好的预测效果,故SV对PHG的发生及严重程度均具有良好的预测价值。这与Nishino等[7]和Min等[8]的脾脏大小是预测PHG的独立危险因素结果一致,但前者从二维(脾脏指数,cm2)角度描述脾脏大小,相较于SV,不能更准确地反映脾脏肿大的程度[9];后者虽采用脾体积多维指数(M指数,cm3)且进一步建立了更好的预测模型VAP 评分系统,但该研究将食管胃底静脉曲张和PHG共同纳入进行分析,未单独予以分组区分。有研究[18-19]指出,食管胃底静脉曲张与PHG关系尚不清楚,两者的发生及发展并不相关。本研究通过模拟标准长椭球体,运用传统SV计算公式对磁共振图像进行测量,更能准确地反映脾脏的大小程度,ROC曲线分析结果显示,SV在预测PHG时的最佳截断值为406.82,敏感度为0.774,特异度为0.870;预测重度PHG时的最佳截断值为714.63,敏感度为0.593,特异度为0.962。本研究基于MRI图像对脾体积进行测量,但在实际工作中也可使用超声或CT检查,后者可能更经济实用。
有研究[20]表明FIB-4评分、King评分及Lok评分对肝硬化合并食管静脉曲张具有较好的预测价值,但相关无创评分模型预测PHG的研究尚少。Amer等[5]将上述三个评分纳入PHG的无创性预测研究,结果显示King评分是独立的预测因子。本研究同样将上述评分系统纳入对PHG的预测性研究中,结果显示FIB-4评分与PHG的发生独立相关,且具有良好的预测价值,最佳截断值为4.05,此时的敏感度为0.755,特异度为0.809,而King评分和Lok评分未发现与PHG的发生及发展独立相关,这与Amer等的结果有所不同,这种差异可能受到种族特征影响,此外血清学参数会随着抽血时间、样本运送时间以及肝功能的状况而动态变化,这同样从侧面表示,相较于FIB-4,应用SV预测PHG的发生更加稳定。
相较于单独的血清学指标和影像学参数,联合性指标同样被广泛研究于门静脉高压性疾病。Mandhwani等[21]和Amer等[5]的研究表明,PSDR对PHG的发生有一定的预测价值,前者研究的临界值为1 326.58,敏感度为87.23%,但特异度仅为5.88%;后者的临界值为1 290,敏感度为88%,特异度为72%。近年来,更有新的研究[9]将PSVR用于预测食管胃底静脉曲张的发生。本研究同样将PSDR和PSVR纳入,结果单因素分析表明PSDR、PSVR分别在有无PHG和有无重度PHG的组间比较时,差异均有统计学意义(P值均<0.05),但多因素Logistic回归分析表明,两者与PHG和重度PHG的发生均无关系(P值均>0.05)。这与上述研究结果有所差异,可能与种族特征、样本量不足、未将肝硬化的病因进行单独研究以及对SV的计算方法有所不同等有关,尚需更多大样本、多中心、前瞻性的研究进行补充。
然而,脾脏增大并不是肝硬化门静脉高压所特有的临床特征,一些原发性脾亢类疾病,如先天性溶血性贫血、原发性脾源性粒细胞减少症、原发性血小板减少性紫癜等,以及其他继发性因素,如脾静脉梗阻、布加综合征、充血性心力衰竭、淋巴瘤、白血病、淀粉样变性,甚至部分感染性疾病,如风疹、伤寒、水痘、结核等均可导致SV的增大[22]。因此,笔者在利用脾脏大小对PHG进行预测时,需对上述非门静脉高压性脾肿大予以排除,结合临床病史特点、血液学、影像学以及骨髓学检查,有助于脾肿大原因的判断和鉴别。
本研究尚存在不足。首先,本研究是单中心、小样本的回顾性研究,可能会造成数据资料的缺失甚至影响结果的准确性;其次,笔者未对肝硬化的病因以及肝功能进行更细致的亚组分析,并且脾不是标准的椭球体,对SV的计算必然存在误差。另外少数内镜下PHG的诊断有时难以与胃窦毛细血管扩张症鉴别,尚需借助活检或组织学证据更加精确地予以区分。
综上所述,本研究结果表明SV对PHG和重度PHG的发生均具有较好的预测价值,在肝硬化患者PHG低风险人群中达到较好的特异度而减少有创检查的痛苦及成本,同时在重度PHG的高出血风险患者中具有较高的敏感度,从而可进一步指导后续是否需行内镜下检查及治疗,为临床医师判断PHG提供简单可靠、安全无创的初筛工具。因此,临床上可能将SV作为肝硬化患者诊断工作的一部分。但仍需多中心、大样本、前瞻性的研究进行验证。
倫理学声明:本研究方案于2022年9月8日经由湖北医药学院附属襄阳市第一人民医院伦理委员会批准,批号:XYYYE20220087。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张志强负责课题设计,资料分析,撰写论文;陈伟、刘波参与修改文章关键内容并最后定稿。
参考文献:
[1]LIU XJ, CHEN MK. Research advances in portal hypertensive gastropathy[J]. Chin J Dig Endosc, 2020, 37(10): 762-765. DOI: 10.3760/cma.j.cn321463-20191014-00688.
刘小娇, 陈明锴.门脉高压性胃病研究进展[J]. 中华消化内镜杂志, 2020, 37(10): 762-765. DOI: 10.3760/cma.j.cn321463-20191014-00688.
[2]ROCKEY DC. An update: Portal hypertensive gastropathy and colopathy[J]. Clin Liver Dis, 2019, 23(4): 643-658. DOI: 10.1016/j.cld.2019.07.002.
[3]LYLES T, ELLIOTT A, ROCKEY DC. A risk scoring system to predict in-hospital mortality in patients with cirrhosis presenting with upper gastrointestinal bleeding[J]. J Clin Gastroenterol, 2014, 48(8): 712-720. DOI: 10.1097/MCG.0000000000000014.
[4]WANG WS, CHEN DF, WEN LZ. Highlights in portal hypertensive gastropathy[J]. J Prac Hepatol, 2019, 22(4): 601-604. DOI: 10.3969/j.issn.1672-5069.2019.04.038.
王文生, 陈东风, 文良志. 门脉高压性胃病临床研究进展[J]. 实用肝脏病杂志, 2019, 22(4): 601-604. DOI: 10.3969/j.issn.1672-5069.2019.04.038.
[5]AMER IF, EL SHENNAWY EM, EL BATEA H, et al. Accuracy of noninvasive tests in the prediction of portal hypertensive gastropathy in Egyptian patients with cirrhosis[J]. JGH Open, 2021, 5(2): 286-293. DOI: 10.1002/jgh3.12486.
[6]EL-KALLA F, MANSOUR L, KOBTAN A, et al. Blood ammonia level correlates with severity of cirrhotic portal hypertensive gastropathy[J]. Gastroenterol Res Pract, 2018, 2018: 9067583. DOI: 10.1155/2018/9067583.
[7]NISHINO K, KAWANAKA M, MANABE N, et al. Portal hypertensive gastropathy in liver cirrhosis: Prevalence, natural history, and risk factors[J]. Intern Med, 2022, 61(5): 605-613. DOI: 10.2169/internalmedicine.7943-21.
[8]MIN YW, BAE SY, GWAK GY, et al. A clinical predictor of varices and portal hypertensive gastropathy in patients with chronic liver disease[J]. Clin Mol Hepatol, 2012, 18(2): 178-184. DOI: 10.3350/cmh.2012.18.2.178.
[9]YU S, CHEN W, JIANG Z. Platelet count/spleen volume ratio has a good predictive value for esophageal varices in patients with hepatitis B liver cirrhosis[J]. PLoS One, 2021, 16(12): e0260774. DOI: 10.1371/journal.pone.0260774.
[10]Chinese Society of Hepatology, Chinese Medical Association. Chinese guidelines on the management of liver cirrhosis[J]. J Clin Hepatol, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006.
中华医学会肝病学分会. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006.
[11]DE FRANCHIS R. Updating consensus in portal hypertension: report of the Baveno III Consensus Workshop on definitions, methodology and therapeutic strategies in portal hypertension[J]. J Hepatol, 2000, 33(5): 846-852. DOI: 10.1016/s0168-8278(00)80320-7.
[12]BADRAN DH, KALBOUNEH HM, AL-HADIDI MT, et al. Ultrasonographic assessment of splenic volume and its correlation with body parameters in a Jordanian population[J]. Saudi Med J, 2015, 36(8): 967-972. DOI: 10.15537/smj.2015.8.11809.
[13]MOROZOV SV, IZRANOV VA. Methods of ultrasound spleen morphometry[J]. J Ultrasound Med, 2022, 41(9): 2123-2133. DOI: 10.1002/jum.15901.
[14]LI Y, WANG ZH, LI PP, et al. 3D visualization technology for measuring the spleen volume of normal Chinese adult [J]. J Hepatobiliary Surg, 2018, 26(5): 340-343. DOI: 10.3969/j.issn.1006-4761.2018.05.007.
李曜, 王志恒, 李鵬鹏, 等. 三维可视化技术测定中国正常成人脾脏体积的研究[J]. 肝胆外科杂志, 2018, 26(5): 340-343. DOI: 10.3969/j.issn.1006-4761.2018.05.007.
[15]DE FRANCHIS R. Evolving consensus in portal hypertension. Report of the Baveno IV consensus workshop on methodology of diagnosis and therapy in portal hypertension[J]. J Hepatol, 2005, 43(1): 167-176. DOI: 10.1016/j.jhep.2005.05.009.
[16]CHEN SY, LIN QY, HUANG XQ. Studies on diagnosis and pathogenesis of portal hypertensive gastropathy[J]. J Diagn Concepts Pract, 2016, 15(5): 451-454. DOI: 10.16150/j.1671-2870.2016.05.003.
陈世耀, 林秋燕, 黄晓铨. 门静脉高压性胃病的诊断及发病机制研究[J]. 诊断学理论与实践, 2016, 15(5): 451-454. DOI: 10.16150/j.1671-2870.2016.05.003.
[17]DE FRANCHIS R, BOSCH J, GARCIA-TSAO G, et al. Baveno VII - Renewing consensus in portal hypertension[J]. J Hepatol, 2022, 76(4): 959-974. DOI: 10.1016/j.jhep.2021.12.022.
[18]SALEEM K, BAIG FA, NIDA M, et al. Correlation between severity of portal hypertensive gastropathy and size of oesophageal varices in cirrhotic hepatitis-C patients[J]. J Ayub Med Coll Abbottabad, 2018, 30(1): 54-57.
[19]SIMBRUNNER B, BEER A, WRAN K, et al. Portal hypertensive gastropathy is associated with iron deficiency anemia[J]. Wien Klin Wochenschr, 2020, 132(1-2): 1-11. DOI: 10.1007/s00508-019-01593-w.
[20]SUN DY. Prediction of FIB-4、Lok and King score measurement for esophageal varices in cirrhosis[D]. Hefei: Anhui Medical University, 2021.
孙迪一. FIB-4、Lok和King评分对肝硬化食管静脉曲张的预测价值[D]. 合肥: 安徽医科大学, 2021.
[21]MANDHWANI R, HANIF FM, UL HAQUE MM, et al. Noninvasive clinical predictors of portal hypertensive gastropathy in patients with liver cirrhosis[J]. J Transl Int Med, 2017, 5(3): 169-173. DOI: 10.1515/jtim-2017-0025.
[22]JIANG A, LI ZF. Common causes and treatment strategies of hyperslenism[J/OL]. Chin J Hepat Surg (Electronic Edition), 2018, 7(2): 97-99. DOI: 10.3877/cma.j.issn.2095-3232.2018.02.003.
蒋安,李宗芳. 脾功能亢进常见原因及治疗策略[J/OL]. 中华肝脏外科手术学电子杂志, 2018, 7(2): 97-99. DOI: 10.3877/cma.j.issn.2095-3232.2018.02.003.
收稿日期:
2022-09-17;录用日期:2022-10-20
本文编辑:王亚南
