中国戊型病毒性肝炎院内筛查管理流程专家共识(2023年版)
2023-04-29中国戊型肝炎研究协助组中国医师协会感染科医师分会国家感染性疾病临床医学研究中心
中国戊型肝炎研究协助组(CCSHE) 中国医师协会感染科医师分会 国家感染性疾病临床医学研究中心
摘要:戊型病毒性肝炎(简称戊型肝炎)是由戊型肝炎病毒(HEV)引起的一种急慢性传染病。全球每年约发生2 000万例HEV感染,其中约有330万例戊型肝炎,7万例与HEV感染相关的死亡病例。过去10年我们对戊型肝炎的认识发生了巨大变化,我国仍有大部分HEV感染者,尤其是重症及慢性戊型肝炎患者被漏诊或误诊。根据世界卫生组织提出的到2030年消除病毒性肝炎这一公共卫生危害的目标,并基于医疗机构是目前我国诊断和治疗HEV的主要场所这一事实,中国戊型肝炎研究协助组(CCSHE)、中国医师协会感染科医师分会和国家感染性疾病临床医学研究中心共同制订了共识,希望促进医疗机构管理、疾病预防控制、临床、检验、感染控制的多学科、多部门联合,有效筛查和诊断HEV感染人群;帮助戊型肝炎患者及时会诊和转诊,优化患者随访及复诊管理流程,提供正确的治疗方法。同时加强非感染、非肝病专科医师对戊型肝炎的认知,以便在日常医疗活动中及时发现HEV感染者。
关键词:戊型肝炎; 普查; 诊断; 治疗学; 专家共识
Expert consensus on the process of in-hospital screening and management of viral hepatitis E in China (2023)
Chinese Consortium for the Study of Hepatitis E(CCSHE), Chinese Physician Association for Infectious Disease, National Clinical Research Center for Infectious Diseases
Corresponding author:
LI Lanjuan, ljli@zju.edu.cn
Abstract:
Hepatitis E caused by hepatitis E virus (HEV) infection is an acute /chronic infectious disease with significant morbidity and mortality, which has become an important global health issue. Our understanding of HEV has changed completely over the past decade. Every year 20 million people are infected with HEV, among whom hepatitis E occur in 3.3 million cases and 70 thousands die from HEV infection-related diseases globally. However, a majority of HEV infections, especially fulminant or chronic hepatitis E, are missed diagnosed or misdiagnosed in China. According the goal of eliminating viral hepatitis as a public health threat by 2030 set by the World Health Organization and based on the fact that medical institutions are the main facilities for diagnosis and treatment of Hepatitis E in China, we developed the Expert Consensus on the process of in-hospital screening and management of viral hepatitis E in China. The consensus intends to promote multi-disciplinary and multi-departmental collaboration in health care institutions, including hospital administration, infection control division, clinical departments and laboratory, to strengthen the screen, diagnosis, consultation, referral and treatment of patients with hepatitis E. Meanwhile, the consensus also intends to raise the awareness of hepatitis E among non-infectious and non-hepatic specialists, which would be conducive to timely detection and early diagnosis of hepatitis E.
Key words:Hepatitis E; Mass Screening; Diagnosis; Therapeutics; Expert Consensus
戊型病毒性肝炎(簡称戊型肝炎)属于《中华人民共和国传染病防治法》所规定的乙类传染病,由戊型肝炎病毒(hepatitis E virus, HEV)感染引起。HEV是一种非包膜、正股、单链RNA病毒,直径为27~32 nm[1]。基因1型和2型HEV仅感染人类,主要分布在环境与水源卫生条件较差的发展中国家,主要通过粪-口途径传播。基因3型和4型为人畜共患病毒,多呈散发性感染,主要流行于发达国家[2]。基因5型和6型HEV在野猪宿主中被发现[3-5]。基因7型和8型HEV在骆驼粪便中被检测到[6-7],同时7型HEV在经常食用骆驼肉和骆驼奶的患者中也曾被检测到[8]。
全球每年约发生2 000万例HEV感染,其中约330万戊型肝炎病例,7万例与HEV感染相关的死亡病例[9]。据世界卫生组织[10]统计,2015年HEV感染造成约4.4万例死亡,占病毒性肝炎死亡病例的3.3%。我国属于戊型肝炎高发国家,近年来戊型肝炎已成为急性病毒性肝炎的常见病因,发病人数已超过甲型肝炎[11]。2020年,国家统计局数据显示我国戊型肝炎发病率为1.355 8/10万,病死率为0.000 9/10万[12]。我国人口基数大,应尤为重视HEV感染。流行病学研究[13]显示,我国HEV感染者大部分为4型HEV,小部分为1型HEV,主要为散发性病例。我国戊型肝炎由先前的以基因1型为主转变为以基因4型为最常见基因型,这与国内卫生基础设施明显改善相关。
HEV感染通常为无症状感染或自限性病毒性肝炎,病死率较低,急性戊型肝炎通常表现与其他病毒性肝炎相似,一般起病急,黄疸多见。半数有发热,伴有乏力、恶心、呕吐和肝区痛。约1/3有关节痛。常见胆汁淤积状,如皮肤瘙痒、大便色变浅,较甲型肝炎明显。多见肝肿大,脾肿大较少见。大多数患者黄疸于2周左右消退,病程6~8周[14-15]。其中,0.5%~4%的戊型肝炎患者会发展为急性或慢加急性肝衰竭,病死率较高,在孕妇、老年人和有基础肝病患者群中尤其明显[16-19]。孕晚期孕妇中戊型肝炎病死率可达15%~25%[20]。在肝移植的患者中,由于长期使用免疫抑制剂,急性HEV感染易发展成慢性感染,之后发展成肝纤维化及肝硬化[21-22]。目前,由于部分地区HEV感染筛查范围有限、检测方法敏感度低,加之非感染、非肝病专科临床医师对戊型肝炎认识不足,检测普及率不高,国内戊型肝炎的实际负担可能被严重低估。临床上常忽略特殊人群中的HEV感染,最终导致戊型肝炎慢性化、肝衰竭等严重后果。
1 目的
根据《戊型病毒性肝炎诊断标准》(WS 301-2008)[23]构建《中国戊型病毒性肝炎院内筛查管理流程》,以期加强医疗机构从业人员对戊型肝炎的重视程度。联合感染、肝病、检验、医院感染、信息及医务等多科室、多部门,促进戊型肝炎的诊治、防控及健康管理;完善HEV感染检测方法,有效筛查和诊断HEV感染人群,特别是戊型肝炎高危人群;幫助戊型肝炎患者及时会诊和转诊,为相应患者提供正确的治疗方法,减少HEV院内接触或血液传播,避免交叉感染,优化患者随访及复诊管理流程。同时加强非感染、非肝病专科医师对戊型肝炎的认知,以便在日常医疗活动中及时发现HEV感染者并提供诊断和治疗。
2 使用范围
本流程适用于所有医疗机构,包括乡镇卫生院和社区卫生服务中心。
3 组织管理、部门及相关职责
3.1 组织管理
3.1.1 管理总负责人及其职责 主管医疗或医院感染副院长任命为本流程管理总负责人,全面、统一、管理、协调本流程在医院内的执行,同时确保流程的持续改进。
3.1.2 管理小组及其职责 医院感染管理科或医务科牵头成立戊型肝炎院内筛查和管理小组,以便确保遵守法律法规,贯彻落实规范标准。结合本流程制订管理方法,明确部门职责,督促工作实施和协调相应问题,以推进院内戊型肝炎的筛查与管理工作,具体内容如下:
(1)明确质量管理目标和要求;(2)明确各部门职责分工;(3)制订质量管理计划和方法;(4)定期举办质量管理会议,按季度各部门报告应时数据,探讨下季度的计划和目标,严格落实,进行考核评价。管理质量控制指标应作为重点评定标准(附件1)。
3.2 感染管理科专人跟踪管理 戊型肝炎主要经粪-口途径传播,亦可经与患者密切接触和输血传播。HEV对乙醇类消毒剂有一定的抵抗作用,医疗机构应选择合适的消毒剂,加强物体表面清洁消毒和个人手卫生,尤其对可能传播HEV的重点场所,须加强排泄物和污水处理,防止污染水源和周围环境。医疗机构食堂加工肉食、海产品时应生熟分开,防止污染。
感染管理科应设立专人管理,落实《传染病防治法》等相关法律法规,建议定期前往相关科室进行实地检查和指导。内容应包括(但不限于):(1)根据戊型肝炎的危险因素,对高危人群进行抗-HEV抗体检测,检测率应>90%;(2)抽查戊型肝炎患者报卡工作,防止漏报、错报;(3)实施专人监督实施HEV感染预防措施,精准落实各项管理职责。
3.3 医务科专人培训与上报 医务科设立专人负责培训,对相关医学人员进行戊型肝炎预防、诊断和治疗知识培训,并向公众宣传健康知识。培训与宣传内容应包括(但不限于):HEV感染防控、诊断、治疗及院内管理等。分配专人负责戊型肝炎的上报工作。
3.4 检验科 戊型肝炎报告单明确呈现抗-HEV(HEV IgM及IgG)抗体及HEV RNA检测结果,对HEV IgM抗体阳性注明建议进一步筛查HEV RNA,应检尽检,阳性结果及时上报医院医务科。按季度向管理小组报告入院患者、高危人群的抗-HEV筛查率、抗-HEV阳性率及HEV IgM抗体阳性患者的HEV RNA检测率。入院高危人群抗-HEV检测率应>90%。
3.5 信息科 根据管理要求,为优化诊疗系统,实现HEV IgM抗体检测阳性、HEV RNA阳性预警系统,建议按季度进行汇总和质量控制。定期收集汇总数据。同时,联合医院信息系统、检验信息系统等,收集戊型肝炎检测、诊断、治疗流程的相关信息并进行指标评估,为卫生行政主管部门和疾病预防控制部门提供有效管理支持。具体指标包括:(1)侵入性检查、手术、住院患者抗-HEV筛查率;(2)重点群体抗-HEV筛查率;(3)抗-HEV阳性者成功转诊率;(4)HEV IgM阳性者HEV RNA检测率;(5)HEV RNA阳性率;(6)HEV RNA阳性者抗病毒治疗接受率;(7)需进行抗病毒治疗戊型肝炎患者的治疗完成率;(8)治疗成功率。特别是HEV RNA阳性者成功转诊率、专科就诊率或会诊率应>70%;HEV RNA阳性者失访率应<10%,并详细记录失访原因。
3.6 肝病及感染相关科室 包括感染性疾病科、肝病科和消化科等相关科室,对具有指征人群进行筛查、对转诊的抗-HEV阳性者提供咨询和确诊检测、对HEV RNA阳性者提供治疗咨询,对符合条件者进行治疗并监测,提高患者依从性。同时,科室协助制订戊型肝炎筛查和管理制度、岗位职责和工作程序,参与管理质量控制指标分析,落实好传染病报告和临床诊断、治疗和随访的工作。
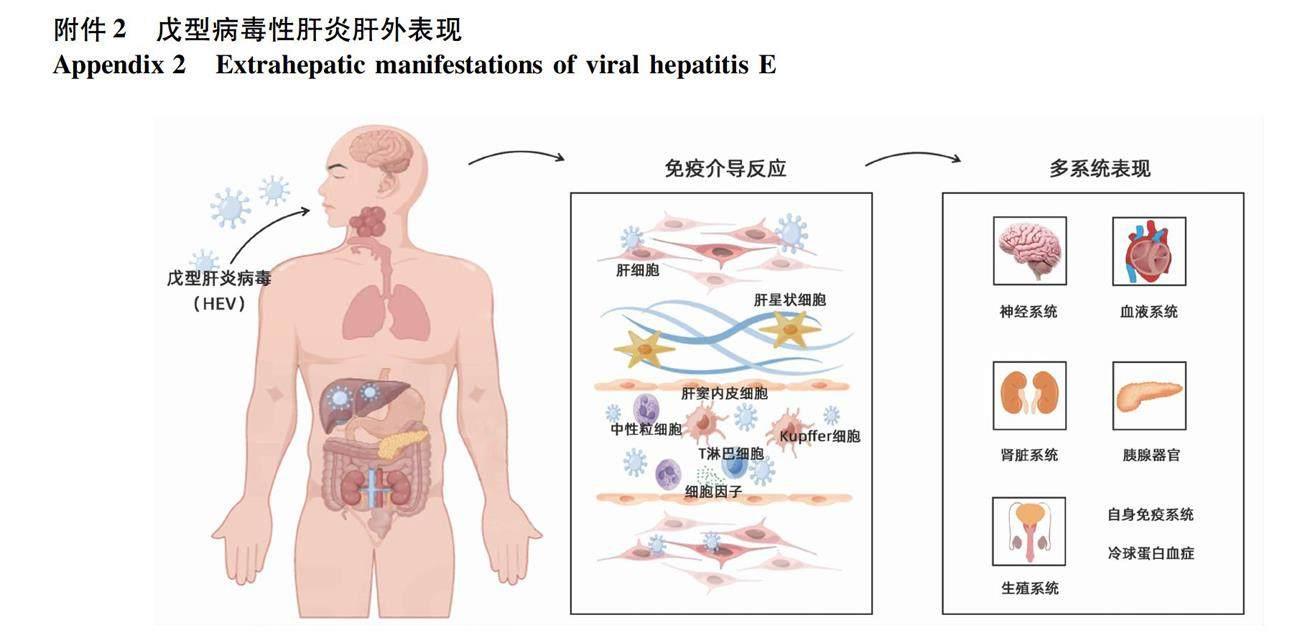
3.7 戊型肝炎肝外表现相关疾病科室 戊型肝炎感染应被视为一种全身性疾病,而不仅是一种肝脏疾病(附件2)。据研究报道,戊型肝炎感染与众多肝外表现有关[24-25],其中主要包括神经系统疾病[26-27]、肾脏系统疾病[28-29]、冷球蛋白血症[30-31]、血液系统疾病[32-33]、急性胰腺炎[34-35]、男性不孕症[36-37]及自身免疫性疾病[38-39]等。因此,建议神经内科、血液科、肾脏内科、自身免疫科等相关科室应对有指征人群开展早期戊型肝炎感染筛查,协助肝病及感染相关科室,对出现肝外表现的转诊患者进行治疗咨询,对符合条件患者进行及时治疗并开展治疗监测。
3.8 其他科室 其他科室主要包括手术、侵入性操作科室以及大型体检中心等,负责戊型肝炎初步筛查,将HEV感染相关检测作为必要筛查项目纳入。为抗-HEV阳性者及时提供会诊和转诊。
4 HEV感染建议筛查人群
戊型肝炎感染建议筛查人群分为易感人群及高危人群。易感人群主要为:畜牧和海产品养殖加工人员、经常外出就餐者、援外人员、戊型肝炎患者的密切接触者及聚集性人群。高危人群主要为:老年人、有基础肝病者及育龄期妇女。因此,医疗机构内的HEV感染筛查建议囊括医院就诊的所有患者,包含门诊和住院患者。其中,有基础肝病患者(慢性乙型肝炎、丙型肝炎、乙型肝炎病毒携带者、脂肪肝及肝硬化等患者)、育龄期妇女(备孕女性)、老年人感染HEV后易重症化,应重点筛查。具体如下:(1)所有具有急性肝炎症状人群;(2)不明原因慢性肝炎人群;(3)持续转氨酶异常的免疫抑制人群;(4)出现不明原因神经系统症状人群,如吉兰-巴雷综合征、病毒性脑炎等,不明原因的血液病、肾病、免疫性疾病及胰腺炎等人群;(5)需鉴别诊断人群(甲型肝炎、药物性肝损伤及自身免疫性肝病等);(6)输血后出现转氨酶异常人群等。
5 HEV感染检测相关方法
HEV感染相关检测由血清学检测和核酸检测组成。血清学检测包括抗-HEV IgM和抗-HEV IgG检测,核酸检测为HEV RNA检测。对于有基础肝病患者(慢性乙型肝炎、丙型肝炎、乙型肝炎病毒携带者、脂肪肝及肝硬化等患者)、育龄期妇女(备孕女性)、老年人,患有自身免疫性疾病、艾滋病及长期使用免疫抑制剂的器官移植患者等免疫抑制人群院内核酸检测样本类型建议为粪便样本,其他常规人群院内核酸检测样本类型建议为血液样品。
6 戊型肝炎的诊断
6.1 急性感染 根据《戊型病毒性肝炎诊断标准》(WS 301-2008)[23]:(1)血清抗-HEV IgM阳性,和/或抗-HEV IgG滴度相较于正常值增加4倍以上,和/或可检测到HEV RNA;(2)出现急性肝炎临床表现,肝酶升高和/或黄疸和/或非特异性症状,如疲劳、瘙痒和恶心。
6.2 慢性感染 部分HEV 感染患者体内病毒血症至少持续3~6个月,总体病程超过6个月[40]。患者体内HEV RNA持续存在超过3个月被认为是慢性HEV感染。患有自身免疫性疾病、艾滋病及长期使用免疫抑制剂的器官移植患者等免疫抑制人群在感染HEV后难以自发清除易发展成为HEV慢性感染。由于免疫抑制人群抗体表达水平较低,建议使用HEV RNA检测慢性感染。慢性戊型肝炎的临床表现通常是非特异性症状。大多数患者无症状,少数患者出现疲劳、腹痛、发热和乏力[41]。
6.3 既往感染 患者血清抗-HEV IgG阳性被认为是HEV既往感染。
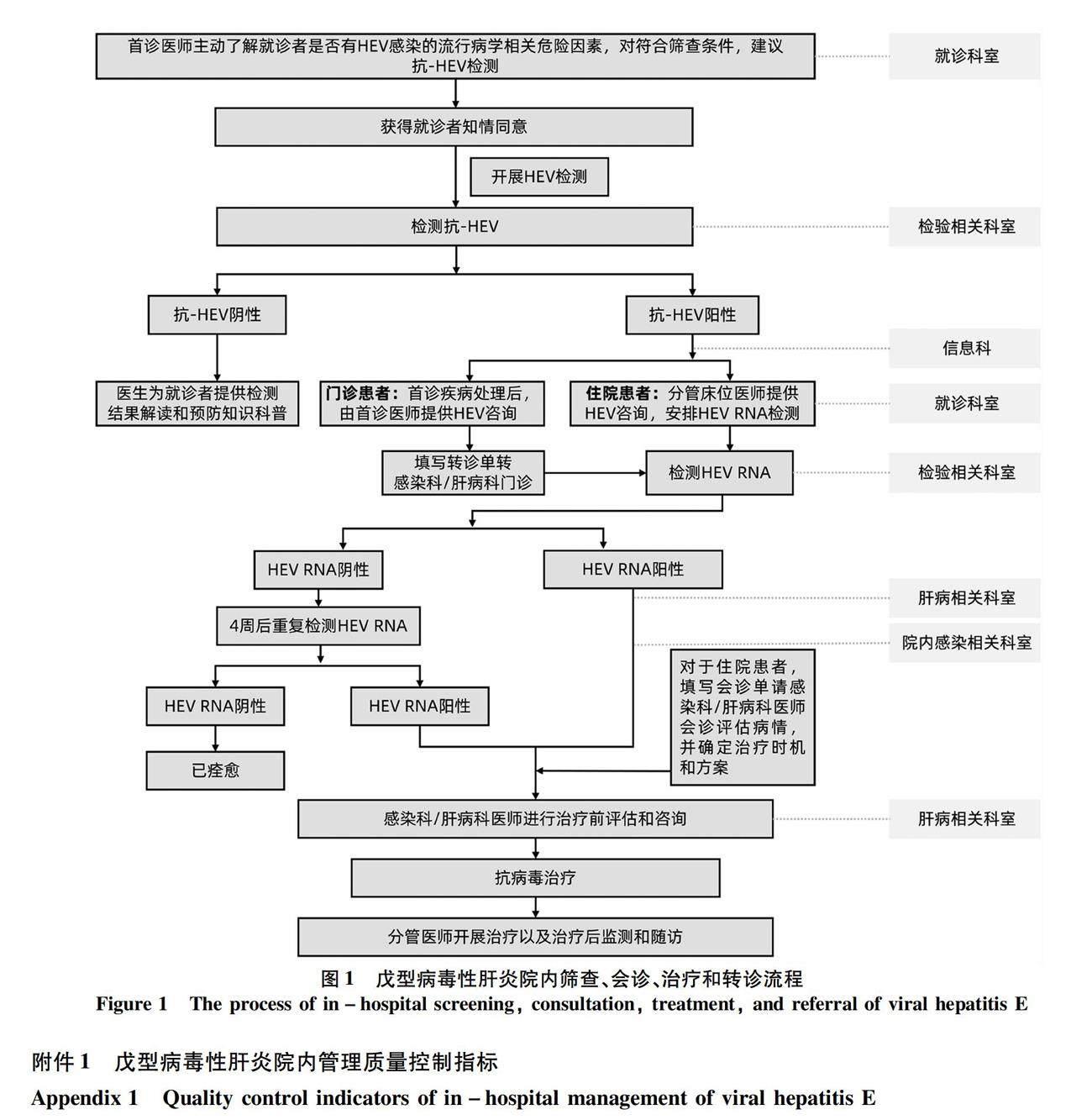
7 戊型肝炎院内会诊和转诊流程
若抗-HEV结果阴性可基本排除HEV感染。如果患者出现抗-HEV IgM阳性,应及时信息反馈给就诊临床科室,建议患者进行HEV RNA检测并前往肝病及感染相关科室会诊,适时转诊(图1)。
8 戊型肝炎的治疗流程
8.1 普通戊型肝炎人群治療 急性HEV感染一般为自限性疾病,患者大多可完全恢复[42]。急性期患者应卧床休息、清淡饮食,辅以保肝、降转氨酶、退黄疸药物使用,一般不采用抗病毒治疗。
8.2 急性重症戊型肝炎人群治疗 部分急性HEV感染患者会出现急性肝衰竭或慢加急性肝衰竭[43]。除重症监护支持外,需积极提供内科综合治疗,包括抗病毒治疗、李氏人工肝支持治疗及微生态调节治疗。急性肝衰竭患者使用利巴韦林治疗获益[44]。使用皮质类固醇在少数病例中可减缓肝衰竭进展,但需慎重使用[45]。急性重症HEV感染孕妇可能需要考虑终止妊娠并接受肝移植。李氏人工肝支持治疗是治疗肝衰竭确切有效的方法,适应证、禁忌证参照《人工肝支持系统治疗指征、标准及技术指南》[46]。戊型肝炎患者存在肠道微生态失衡,益生菌减少,有害菌增加[14-15,47],微生态制剂可改善患者预后。
8.3 慢性戊型肝炎人群治疗 减少免疫抑制剂用量是一线治疗方案,可使1/3慢性戊型肝炎患者HEV自发清除[41]。但是大多数患者难以停用免疫抑制剂,该方法使用受限。聚乙二醇干扰素和利巴韦林均可用于慢性HEV的治疗。聚乙二醇干扰素已成功治疗少数肝移植患者[48-49]。利巴韦林可治疗慢性HEV感染实体器官移植受者[50-52],持续病毒应答率可达78%[53],会出现贫血、干咳和皮肤反应等不良反应。伴有肾功能损伤或贫血相关疾病患者应谨慎使用利巴韦林[54]。同时,聚乙二醇干扰素、利巴韦林及两者联用可治疗非移植免疫抑制患者[55-60]。
9 随访及复诊管理
治疗期间,定期监测血液学、生化指标和HEV RNA,评估患者的肝外表现和不良反应。应在基线、治疗4周、治疗结束时、治疗结束后12周分别评估肝、肾功能,抗-HEV水平等。对未治疗或治疗失败的患者,应综合分析原因,并在合适时机采取或调整恰当的治疗方案。
10 戊型肝炎的院内科普教育
定期开展戊型肝炎院内科普教育,其内容形式包括(但不限于)分享科普短文、科普视频,分发科普手册,进行科普宣讲等。
对医院就诊患者积极科普戊型肝炎,有助于提高患者对戊型肝炎的认知。戊型肝炎高危患者能够尽早接受筛查,及时接受治疗。戊型肝炎确诊患者能够主动避免高危行为,控制戊型肝炎传播。科普教育能增强患者治疗信心,让患者配合治疗取得更好疗效,有效控制戊型肝炎传播。
非感染肝病专业医师需接受戊型肝炎科普教育,除普及相关基本常识外,需强调需要检测的人群,依据指征和病情为就诊者提供戊型肝炎检测;对抗-HEV阳性者提供咨询,以及对接后续复核确诊、治疗服务,同时建议共同居住人进行相关检查和随访等。对非感染肝病专业医师的科普教育有利于医师尽早发现可能的HEV感染患者,并尽早为其提供筛查和转诊服务,以免耽误患者治疗。
1.入院患者HEV感染筛查率(%)= 入院患者抗-HEV检测数/同期住院患者数×100%
2.重症高危人群HEV感染筛查率(%)= 重症高危人群抗-HEV检测数/同期就诊重症高危患者数×100%
3.HEV RNA检测率(%)= HEV RNA检测数/同期抗-HEV阳性患者数×100%
4.肝外表现专科就诊率或会诊率(%)=戊型肝炎确诊患者肝外表现专科或会诊数/同期戊型肝炎确诊患者数×100%
5.HEV就诊患者治疗率(%)=戊型肝炎确诊患者治疗数/同期戊型肝炎确诊患者就诊数×100%
6.HEV患者失访率(%)=戊型肝炎确诊患者失访数/同期戊型肝炎确诊患者就诊数×100%
7.HEV患者重症化率(%)=戊型肝炎确诊患者重症化数/同期戊型肝炎确诊患者就诊数×100%
8.HEV患者慢性化率(%)=戊型肝炎确诊患者慢性化数/同期戊型肝炎确诊患者就诊数×100%
神经系统:主要包括吉兰-巴雷综合征、神经性肌肉萎缩、脑炎和肌炎。
肾脏系统:以肾小球肾炎最为常见,主要表现为两种组织学类型,分别为膜性增生性肾小球肾炎和膜性肾小球肾炎。
冷球蛋白血症:典型临床表现包括紫癜、皮疹、疲劳和关节痛,伴有胃肠道、心脏、肺和神经系统血管炎的症状。
血液系统:主要包括贫血、血小板减少、造血综合征、纯红细胞发育不全和意义未明的单克隆免疫球蛋白血症。
胰腺器官:主要为急性胰腺炎。
生殖系统:主要为男性不孕症。
自身免疫系统:主要包括急性关节炎、自身免疫性肝炎和甲状腺疾病。
利益冲突声明:所有作者均声明不存在利益冲突。
主要起草人:
李兰娟 浙江大学医学院附属第一医院传染病诊治国家重点实验室
吴 健 南京医科大学附属苏州医院(北区)检验科
王艺瑾 南方科技大学医学院
祁小龙 东南大学附属中大医院门静脉高压中心
曹红翠 浙江大学医学院附属第一医院传染病诊治国家重点实验室
参与修订、讨论和定稿的专家(按姓氏拼音排序):
安纪红 内蒙古自治区人民医院感染科
鲍万国 吉林大学第一医院感染科
曹红翠 浙江大学医学院附属第一医院传染病诊治国家重点实验室
苏智军 福建医科大学附属泉州第一医院感染科
成 军 解放军联勤保障部队第九○三医院检验科
丁向春 宁夏医科大学总医院感染科
高志良 中山大学附属第三医院感染科
高 燕 北京大学人民医院感染科
高海女 树兰(杭州)医院感染科
龚作炯 武汉大学人民医院感染科
韩 涛 天津市人民医院消化科
侯金林 南方醫科大学南方医院感染科
黄 燕 中南大学湘雅医院感染科
黄 芬 昆明理工大学医学院
李 冬 同济大学附属同济医院检验科
李兰娟 浙江大学医学院附属第一医院传染病诊治国家重点实验室
李智伟 中国医科大学附属盛京医院感染科
李 军 南京医科大学第一附属医院感染科
李用国 重庆医科大学附属第一医院感染科
李家斌 安徽医科大学第一附属医院感染科
李树臣 哈尔滨医科大学附属第二医院感染科
李太生 中国医学科学院北京协和医院感染科
连建奇 空军军医大学第二附属医院感染科
梁跃东 贵阳市公共卫生救治中心感染科
林 锋 海南省人民医院感染科
刘建昆 中国人民解放军联勤保障部队第九二○医院消化科
鲁晓擘 新疆医科大学第一附属医院感染科
毛 青 陆军军医大学第一附属医院感染科
祁小龙 东南大学附属中大医院门静脉高压中心
钱雪峰 苏州大学附属第一医院感染管理处
任万华 山东省立医院感染科
盛吉芳 浙江大学医学院附属第一医院传染病诊治国家重点实验室
石 荔 西藏自治区人民医院感染科
尚 佳 河南省人民医院感染科
商安全 连云港市第二人民医院检验科
唐 红 四川大学华西医院感染性疾病中心
汤灵玲 树兰(杭州)医院感染科
万 红 兰州市第二人民医院感染科
王贵强 北京大学第一医院感染科
王利新 宁夏医科大学附属医院检验科
王艺瑾 南方科技大学医学院
王 凯 山东大学齐鲁医院肝病科
王 滢 苏州市立医院(北区)感染管理科
韦 嘉 云南大学附属医院云南省病毒性肝炎研究中心
吴 健 南京醫科大学附属苏州医院(北区)检验科
邬小萍 南昌大学第一附属医院感染科
肖永红 浙江大学医学院附属第一医院传染病诊治国家重点实验室
向 泽 浙江大学医学院
谢 青 上海交通大学医学院附属瑞金医院感染科
胥 萍 苏州市第五人民医院检验科
俞 炯 浙江大学医学院附属第一医院传染病诊治国家重点实验室
张缭云 山西医科大学第一医院感染科
张文宏 复旦大学附属华山医院感染科
赵彩彦 河北医科大学第三医院感染科
郑子峥 厦门大学国家传染病诊断试剂与疫苗工程技术研究中心
周伯平 深圳市人民医院龙华分院肝病科
祖红梅 青海省第四人民医院(青海省传染病医院)肝病科
朱传武 苏州市第五人民医院肝病科
参考文献:
[1]KAMAR N, IZOPET J, PAVIO N, et al. Hepatitis E virus infection[J]. Nat Rev Dis Primers, 2017, 3: 17086. DOI: 10.1038/nrdp.2017.86.
[2]XIANG Z, JIANG B, LI W, et al. The diagnostic and prognostic value of serum exosome-derived carbamoyl phosphate synthase 1 in HEV-related acute liver failure patients[J]. J Med Virol, 2022, 94(10): 5015-5025. DOI: 10.1002/jmv.27961.
[3]TAKAHASHI K, TERADA S, KOKURYU H, et al. A wild boar-derived hepatitis E virus isolate presumably representing so far unidentified “genotype 5” [J]. Kanzo, 2010, 51(9): 536-538. DOI: 10.2957/kanzo.51.536.
[4]TAKAHASHI M, NISHIZAWA T, SATO H, et al. Analysis of the full-length genome of a hepatitis E virus isolate obtained from a wild boar in Japan that is classifiable into a novel genotype[J]. J Gen Virol, 2011, 92(Pt 4): 902-908. DOI: 10.1099/vir.0.029470-0.
[5]TAKAHASHI M, NISHIZAWA T, NAGASHIMA S, et al. Molecular characterization of a novel hepatitis E virus (HEV) strain obtained from a wild boar in Japan that is highly divergent from the previously recognized HEV strains[J]. Virus Res, 2014, 180: 59-69. DOI: 10.1016/j.virusres.2013.12.014.
[6]WOO PC, LAU SK, TENG JL, et al. New hepatitis E virus genotype in bactrian camels, Xinjiang, China, 2013[J]. Emerg Infect Dis, 2016, 22(12): 2219-2221. DOI: 10.3201/eid2212.160979.
[7]WOO PC, LAU SK, TENG JL, et al. New hepatitis E virus genotype in camels, the Middle East[J]. Emerg Infect Dis, 2014, 20(6): 1044-1048. DOI: 10.3201/eid2006.140140.
[8]LEE GH, TAN BH, TEO EC, et al. Chronic infection with camelid hepatitis E virus in a liver transplant recipient who regularly consumes camel meat and milk[J]. Gastroenterology, 2016, 150(2): 355-357.e3. DOI: 10.1053/j.gastro.2015.10.048.
[9]NIMGAONKAR I, DING Q, SCHWARTZ RE, et al. Hepatitis E virus: advances and challenges[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(2): 96-110. DOI: 10.1038/nrgastro.2017.150.
[10]ASRANI SK, DEVARBHAVI H, EATON J, et al. Burden of liver diseases in the world[J]. J Hepatol, 2019, 70(1): 151-171. DOI: 10.1016/j.jhep.2018.09.014.
[11]MA JX, LIU YY, LI Q, et al. Study on the safety and immunogenicity of simultaneous vaccination on both hepatitis E and hepatitis B vaccines[J]. Chin J Epidemiol, 2019, 40(4): 451-456. DOI: 10.3760/cma.j.issn.0254-6450.2019.04.015.
馬建新, 刘瑶瑶, 李倩, 等. 戊型肝炎疫苗和乙型肝炎疫苗联合接种的安全性及免疫原性研究[J]. 中华流行病学杂志, 2019, 40(4): 451-456. DOI: 10.3760/cma.j.issn.0254-6450.2019.04.015.
[12]National Health Commission of the Peoples Republic of China. The epidemic situation of statutory reporting infectious diseases in 2020[EB/OL]. (2021-03-12) [2022-09-01]. http://www.nhc.gov.cn/jkj/s3578/202103/f1a448b7df7d4760976fea6d55834966.shtml.
国家卫生健康委员会. 2020年全国法定传染病疫情概况[EB/OL]. (2021-03-12) [2022-09-01]. http://www.nhc.gov.cn/jkj/s3578/202103/f1a448b7df7d4760976fea6d55834966.shtml.
[13]WANG W, CHEN KY, WU LM, et al. Genetic characteristics of hepatitis E in Shanghai, 2017—2020[J]. Dis Surveill, 2022, 37(1): 1-6. DOI: 10.3784/jbjc.202106210349.
王葳, 陈恺韵, 吴立梦, 等. 2017—2020 年上海市人和猪戊型肝炎病毒基因型特征研究[J]. 疾病监测, 2022, 37(1): 1-6. DOI: 10.3784/jbjc.202106210349.
[14]WU J, XU Y, CUI Y, et al. Dynamic changes of serum metabolites associated with infection and severity of patients with acute hepatitis E infection[J]. J Med Virol, 2022, 94(6): 2714-2726. DOI: 10.1002/jmv.27669.
[15]WU J, BORTOLANZA M, ZHAI G, et al. Gut microbiota dysbiosis associated with plasma levels of Interferon-γ and viral load in patients with acute hepatitis E infection[J]. J Med Virol, 2022, 94(2): 692-702. DOI: 10.1002/jmv.27356.
[16]European Association for the Study of the Liver. EASL clinical practice guidelines on hepatitis E virus infection[J]. J Hepatol, 2018, 68(6): 1256-1271. DOI: 10.1016/j.jhep.2018.03.005.
[17]LIU Y, MEI X, ZHANG YY, et al. Clinical features and risk factors of acute hepatitis E[J]. Chin Hepatol, 2022, 27(2): 218. DOI: 10.14000/j.cnki.issn.1008-1704.2022.02.022.
刘玉, 梅雪, 张宇一, 等. 急性戊型肝炎临床特征及危险因素分析[J]. 肝脏, 2022, 27(2): 218. DOI: 10.14000/j.cnki.issn.1008-1704.2022.02.022.
[18]WU J, CHENG J, SONG S, et al. Value of red cell distribution width and red cell distribution width to platelet ratio in diagnosis and prognosis of HEV-related liver failure[J]. Chin J Clin Infect Dis, 2020, 13(6): 434-438. DOI: 10.3760/cma.j.issn.1674-2397.2020.06.007.
吴健, 成娟, 宋曙, 等. 红细胞分布宽度及红细胞分布宽度与血小板比值在HEV相关肝衰竭患者诊断及预后中的价值评估[J]. 中华临床感染病杂志, 2020, 13(6): 434-438. DOI: 10.3760/cma.j.issn.1674-2397.2020.06.007.
[19]WANG Y, LIU H, LIU S, et al. Incidence, predictors and prognosis of genotype 4 hepatitis E related liver failure: A tertiary nested case-control study[J]. Liver Int, 2019, 39(12): 2291-2300. DOI: 10.1111/liv.14221.
[20]PHAN T, DESMOND C. Hepatitis E infection with acute liver failure[J]. ACG Case Rep J, 2020, 7(3): e00361. DOI: 10.14309/crj.0000000000000361.
[21]WANG Y, METSELAAR HJ, PEPPELENBOSCH MP, et al. Chronic hepatitis E in solid-organ transplantation: the key implications of immunosuppressants[J]. Curr Opin Infect Dis, 2014, 27(4): 303-308. DOI: 10.1097/QCO.0000000000000074.
[22]KAMAR N, ROSTAING L, IZOPET J. Hepatitis E virus infection in immunosuppressed patients: natural history and therapy[J]. Semin Liver Dis, 2013, 33(1): 62-70. DOI: 10.1055/s-0033-1338115.
[23]Ministry of Health, the Peoples Republic of China. Diagnostic criteria for viral hepatitis E (WS-2008)[S]. Beijing: 2008.
中華人民共和国卫生部. 戊型病毒性肝炎诊断标准(WS-2008)[S]. 北京: 2008.
[24]WU J, XIANG Z, ZHU C, et al. Extrahepatic manifestations related to hepatitis E virus infection and their triggering mechanisms[J]. J Infect, 2021, 83(3): 298-305. DOI: 10.1016/j.jinf.2021.07.021.
[25]PISCHKE S, HARTL J, PAS SD, et al. Hepatitis E virus: Infection beyond the liver?[J]. J Hepatol, 2017, 66(5): 1082-1095. DOI: 10.1016/j.jhep.2016.11.016.
[26]WANG Y, WANG S, WU J, et al. Hepatitis E virus infection in acute non-traumatic neuropathy: A large prospective case-control study in China[J]. EBioMedicine, 2018, 36: 122-130. DOI: 10.1016/j.ebiom.2018.08.053.
[27]KAMAR N, BENDALL RP, PERON JM, et al. Hepatitis E virus and neurologic disorders[J]. Emerg Infect Dis, 2011, 17(2): 173-179. DOI: 10.3201/eid1702.100856.
[28]WALLACE SJ, SWANN R, DONNELLY M, et al. Mortality and morbidity of locally acquired hepatitis E in the national Scottish cohort: a multicentre retrospective study[J]. Aliment Pharmacol Ther, 2020, 51(10): 974-986. DOI: 10.1111/apt.15704.
[29]EL-MOKHTAR MA, SEDDIK MI, OSMAN A, et al. Hepatitis E virus mediates renal injury via the interaction between the immune cells and renal epithelium[J]. Vaccines (Basel), 2020, 8(3): 454. DOI: 10.3390/vaccines8030454.
[30]HAFFAR S, BAZERBACHI F, LAKE JR. HEV-associated cryoglobulinaemia and extrahepatic manifestations of hepatitis E[J]. Lancet Infect Dis, 2015, 15(3): 268. DOI: 10.1016/S1473-3099(15)70034-4.
[31]PISCHKE S, POLYWKA S, HAAG F, et al. Association of hepatitis E virus and essential cryoglobulinemia? [J]. J Clin Virol, 2015, 67: 23-24. DOI: 10.1016/j.jcv.2015.03.020.
[32]ABDELMAWLA D, MOEMEN D, DARWISH A, et al. Hepatitis E virus prevalence in Egyptian children with transfusion-dependent thalassemia[J]. Braz J Infect Dis, 2019, 23(1): 40-44. DOI: 10.1016/j.bjid.2019.01.007.
[33]WU J, ZHANG X, LIU H, et al. RDW, NLR and RLR in predicting liver failure and prognosis in patients with hepatitis E virus infection[J]. Clin Biochem, 2019, 63: 24-31. DOI: 10.1016/j.clinbiochem.2018.11.012.
[34]RAJ M, KUMAR K, GHOSHAL UC, et al. Acute hepatitis E-associated acute pancreatitis: A single center experience and literature review[J]. Pancreas, 2015, 44(8): 1320-1322. DOI: 10.1097/MPA.0000000000000402.
[35]HAFFAR S, BAZERBACHI F, GARG S, et al. Frequency and prognosis of acute pancreatitis associated with acute hepatitis E: A systematic review[J]. Pancreatology, 2015, 15(4): 321-326. DOI: 10.1016/j.pan.2015.05.460.
[36]HUANG F, LONG F, YU W, et al. High prevalence of hepatitis E virus in semen of infertile male and causes testis damage[J]. Gut, 2018, 67(6): 1199-1201. DOI: 10.1136/gutjnl-2017-314884.
[37]HORVATITS T, WIβMANN JE, JOHNE R, et al. Hepatitis E virus persists in the ejaculate of chronically infected men[J]. J Hepatol, 2021, 75(1): 55-63. DOI: 10.1016/j.jhep.2020.12.030.
[38]WU J, GUO N, ZHU L, et al. Seroprevalence of AIH-related autoantibodies in patients with acute hepatitis E viral infection: a prospective case-control study in China[J]. Emerg Microbes Infect, 2020, 9(1): 332-340. DOI: 10.1080/22221751.2020.1722759.
[39]SERRATRICE J, DISDIER P, COLSON P, et al. Acute polyarthritis revealing hepatitis E[J]. Clin Rheumatol, 2007, 26(11): 1973-1975. DOI: 10.1007/s10067-007-0595-0.
[40]WANG Y, CHEN G, PAN Q, et al. Chronic hepatitis E in a renal transplant recipient: the first report of genotype 4 hepatitis E virus caused chronic infection in organ recipient[J]. Gastroenterology, 2018, 154(4): 1199-1201. DOI: 10.1053/j.gastro.2017.12.028.
[41]MA Z, de MAN RA, KAMAR N, et al. Chronic hepatitis E: Advancing research and patient care[J]. J Hepatol, 2022, 77(4): 1109-1123. DOI: 10.1016/j.jhep.2022.05.006.
[42]VELAVAN TP, PALLERLA SR, JOHNE R, et al. Hepatitis E: An update on One Health and clinical medicine[J]. Liver Int, 2021, 41(7): 1462-1473. DOI: 10.1111/liv.14912.
[43]ASLAN AT, BALABAN HY. Hepatitis E virus: Epidemiology, diagnosis, clinical manifestations, and treatment[J]. World J Gastroenterol, 2020, 26(37): 5543-5560. DOI: 10.3748/wjg.v26.i37.5543.
[44]PRON JM, DALTON H, IZOPET J, et al. Acute autochthonous hepatitis E in western patients with underlying chronic liver disease: a role for ribavirin? [J]. J Hepatol, 2011, 54(6): 1323-1324; author reply 1324-1325. DOI: 10.1016/j.jhep.2011.01.009.
[45]MANKA P, BECHMANN LP, COOMBES JD, et al. Hepatitis E virus infection as a possible cause of acute liver failure in Europe[J]. Clin Gastroenterol Hepatol, 2015, 13(10): 1836-1842.e2; quiz e157-158. DOI: 10.1016/j.cgh.2015.04.014.
[46]LI LJ, WANG YM. Indications, standards and technical guidelines for artificial liver support system[J]. Chin J Clin Infect Dis, 2002, 20(4): 254-258. DOI: 10.3760/j.issn:1000-6680.2002.04.027.
李兰娟, 王宇明. 人工肝支持系统治疗指征, 标准及技术指南[J]. 中華传染病学杂志, 2002, 20(4): 254-258. DOI: 10.3760/j.issn:1000-6680.2002.04.027.
[47]WU J, HUANG F, LING Z, et al. Altered faecal microbiota on the expression of Th cells responses in the exacerbation of patients with hepatitis E infection[J]. J Viral Hepat, 2020, 27(11): 1243-1252. DOI: 10.1111/jvh.13344.
[48]KAMAR N, ROSTAING L, ABRAVANEL F, et al. Pegylated interferon-alpha for treating chronic hepatitis E virus infection after liver transplantation[J]. Clin Infect Dis, 2010, 50(5): e30-e33. DOI: 10.1086/650488.
[49]HAAGSMA EB, RIEZEBOS-BRILMAN A, van den BERG AP, et al. Treatment of chronic hepatitis E in liver transplant recipients with pegylated interferon alpha-2b[J]. Liver Transpl, 2010, 16(4): 474-477. DOI: 10.1002/lt.22014.
[50]MALLET V, NICAND E, SULTANIK P, et al. Brief communication: case reports of ribavirin treatment for chronic hepatitis E[J]. Ann Intern Med, 2010, 153(2): 85-89. DOI: 10.7326/0003-4819-153-2-201007200-00257.
[51]KAMAR N, ROSTAING L, ABRAVANEL F, et al. Ribavirin therapy inhibits viral replication on patients with chronic hepatitis e virus infection[J]. Gastroenterology, 2010, 139(5): 1612-1618. DOI: 10.1053/j.gastro.2010.08.002.
[52]PISCHKE S, HARDTKE S, BODE U, et al. Ribavirin treatment of acute and chronic hepatitis E: a single-centre experience[J]. Liver Int, 2013, 33(5): 722-726. DOI: 10.1111/liv.12114.
[53]KAMAR N, IZOPET J, TRIPON S, et al. Ribavirin for chronic hepatitis E virus infection in transplant recipients[J]. N Engl J Med, 2014, 370(12): 1111-1120. DOI: 10.1056/NEJMoa1215246.
[54]KAMAR N, CHATELUT E, MANOLIS E, et al. Ribavirin pharmacokinetics in renal and liver transplant patients: evidence that it depends on renal function[J]. Am J Kidney Dis, 2004, 43(1): 140-146. DOI: 10.1053/j.ajkd.2003.09.019.
[55]ALRIC L, BONNET D, LAURENT G, et al. Chronic hepatitis E virus infection: successful virologic response to pegylated interferon-alpha therapy[J]. Ann Intern Med, 2010, 153(2): 135-136. DOI: 10.7326/0003-4819-153-2-201007200-00256.
[56]ALRIC L, BONNET D, BEYNES-RAUZY O, et al. Definitive clearance of a chronic hepatitis E virus infection with ribavirin treatment[J]. Am J Gastroenterol, 2011, 106(8): 1562-1563. DOI: 10.1038/ajg.2011.158.
[57]TAVITIAN S, PERON JM, HUGUET F, et al. Ribavirin for chronic hepatitis prevention among patients with hematologic malignancies[J]. Emerg Infect Dis, 2015, 21(8): 1466-1469. DOI: 10.3201/eid2108.150199.
[58]DALTON HR, KEANE FE, BENDALL R, et al. Treatment of chronic hepatitis E in a patient with HIV infection[J]. Ann Intern Med, 2011, 155(7): 479-480. DOI: 10.7326/0003-4819-155-7-201110040-00017.
[59]NEUKAM K, BARREIRO P, MACíAS J, et al. Chronic hepatitis E in HIV patients: rapid progression to cirrhosis and response to oral ribavirin[J]. Clin Infect Dis, 2013, 57(3): 465-468. DOI: 10.1093/cid/cit224.
[60]HAJJI H, GROLAMI R, SOLAS C, et al. Chronic hepatitis E resolution in a human immunodeficiency virus (HIV)-infected patient treated with ribavirin[J]. Int J Antimicrob Agents, 2013, 41(6): 595-597. DOI: 10.1016/j.ijantimicag.2013.02.005.
收稿日期:
2023-03-10;錄用日期:2023-03-30
本文编辑:邢翔宇
