丁型肝炎流行病学筛查检测指标及适宜人群
2023-04-29迟秀梅牛俊奇
迟秀梅 牛俊奇
摘要:HDV感染需要借助HBV的参与,感染后会加速疾病的进展,具有很高的发展为肝硬化、肝癌等终末期肝病的风险。近年来全社会对丁型肝炎的认识逐渐增强,一些针对丁型肝炎的治疗药物也成为研究的热點,伴随着临床检验手段的逐步完善,对于丁型肝炎的流行病学调查开始被研究者重视。针对国内HDV感染的具体情况虽已有多项研究,但由于研究队列小、区域性强而数据偏差较大。本文就目前丁型肝炎流行病学调查中的调查人群及调查方法检测指标等进行简要综述,并对其中的关键问题进行讨论,以期未来获取更准确的流行病学资料,能够更有效地筛查HDV感染者,为临床早期的干预和治疗提供帮助。
关键词:δ肝炎病毒; 流行病学; 诊断技术和方法
基金项目:国家自然科学基金(81970519); 吉林省自然科学基金(YDZJ202201ZYTS016)
Epidemiological screening and detection indicators for hepatitis D and suitable populations
CHI Xiumei1, NIU Junqi2. (1. Gene Therapy Laboratory, Center of Infectious Diseases and Pathogen Biology, The First Hospital of Jilin University, Changchun 130061, China; 2. Department of Hepatology, Center of Infectious Diseases and Pathogen Biology, The First Hospital of Jilin University, Changchun 130021, China)
Corresponding author:NIU Junqi, junqiniu@jlu.edu.cn (ORCID:0000-0001-5415-2024)
Abstract:
Hepatitis D virus (HDV) infection requires the participation of hepatitis B virus (HBV), which accelerates disease progression after infection and induces a high risk of progression to end-stage liver diseases such as liver cirrhosis and liver cancer. With the gradual increase in the understanding of hepatitis D in the whole society, some therapeutic drugs for hepatitis D have become a research hotspot in recent years, and with the further improvement in clinical testing methods, researchers have started to pay attention to the epidemiological investigation of hepatitis D. Although many studies have been conducted for the specific situation of HDV infection in China, large data deviation is observed due to small cohorts with strong regional features. This article briefly reviews the population, methods, and indicators in the current epidemiological investigation of hepatitis D and discusses related key issues, in order to obtain more accurate epidemiological data, effectively screen out HDV infection, and provide help for early clinical intervention and treatment.
Key words:
Hepatitis Delta Virus; Epidemiology; Diagnostic Techniques and Procedures
Research funding:National Natural Science Foundation of China (81970519); Natural Science Foundation of Jilin Province (YDZJ202201ZTYS016)
HDV是慢性丁型肝炎的致病因素,其可以与HBV同时感染,也可以继发于慢性HBV感染之后,是病毒性肝炎最严重的形式[1]。2017年10月世界卫生组织国际癌症研究机构将HDV列入三类致癌物清单。若能早期准确地筛选未知的HDV感染者,并对丁型肝炎流行病学有准确的数据,临床工作者就可以尽早进行干预,控制病情进展,合理分配医疗资源,为提高患者生存质量作出贡献。本文就目前丁型肝炎流行病学调查中的检测指标和方法及调查人群等进行简要综述,提出部分问题,仅供参考。
1 HDV生命周期
HDV是缺陷病毒,需要借助HBV来完成其生命周期。HDV的包膜蛋白正是HBV的包膜蛋白(HBsAg),HDV与HBV一样需要借助于肝细胞表面的牛磺胆酸钠共转运多肽(NTCP)进入到细胞内,在细胞浆中HDV的核糖核蛋白(RNP)复合物被释放,形成HDV基因组和HDV抗原(HDAg)两部分[2-3]。 HDV的基因组是环状单链反义RNA(HDV RNA),有8种基因型(HDV1~HDV8),根据基因型的不同含有1 672~1 697个核苷酸[3-4],各种分型之间的序列分化度最高是1型和3型[5],可高达40%。基因组进入到细胞核中首先生成反义基因组RNA(agRNA)和转录组mRNA,再进行HDV RNA的复制和产生病毒抗原蛋白。在宿主腺苷脱氨酶1的作用下,agRNA被修饰,从而产出两种不同的病毒抗原蛋白L-HDAg和S-HDAg[6-8]。这两种蛋白连接到病毒基因组形成RNP,在细胞浆中利用HBsAg形成包膜,再由内质网和高尔基体分泌至细胞外[9],准备进行下一次的感染。
通过对HDV感染生命周期的分析可以看出参与HDV感染的两个必要条件,即HBsAg的存在和HDV的入侵,是否存在HBV DNA可能并不重要。在该生命周期中有HDV RNA和HDAg。人体免疫细胞针对HDV将产生特异性的抗体,包括免疫球蛋白 M(IgM)抗体(抗HDV-IgM)和免疫球蛋白G(IgG)抗体(抗HDV-IgG),这些都将是HDV感染的检测指标。
2 HDV感染的诊断标准
我国在2009年6月实施《丁型病毒性肝炎诊断标准》(卫生行业标准号WS300-2008)后至今还没有正式的丁型肝炎诊疗指南。单纯根据临床表现特征进行诊断不准确,但是可以作为实验室诊断的线索:(1)HDV流行区内HBsAg携带者发生肝炎。(2)急性乙型肝炎出现血清ALT和胆红素波动。(3)病情已趋稳定的非活动性肝炎患者突然出现活动性肝炎,或慢性乙型肝炎病程中表现进行性恶化。(4)HBV复制指标已降低或消失而临床表现反见恶化的病例。但是,美国肝病学会在2018年的乙型肝炎治疗指南[10]中明确指出,关于HDV感染确诊决定于HDV组织学或血清学标志的检测,必须有血清HDV RNA的检出。组织学诊断:肝活检标本肝细胞核内HDV(HDAg或HDV RNA)组织染色为阳性。血清中抗HDV-IgM和抗HDV-IgG检测阳性可以初步判断已有HDV感染,但仍需要进一步检测血清HDV RNA[10-12],若确为阳性才能诊断。
3 HDV筛查的各项检测指标
3.1 抗HDV-IgM/抗HDV-IgG检测 目前,抗体检测通常用作HDV感染的主要筛查手段。抗HDV-IgM可在症状发作后2~3周被检测到,并在急性感染后2个月消失[2,13],一般用于疾病的早期诊断。然而,慢性丁型肝炎患者在疾病发作期间抗HDV-IgM也会升高[14],因此抗HDV-IgM的检测不能明确区分急性和慢性HDV感染。当慢性HDV感染或HDV重叠感染时,抗HDV-IgG是识别慢性丁型肝炎的主要标志。抗HDV-IgG在HDV感染和慢性HDV感染急性缓解患者中均呈阳性,并且在病毒清除后持续很长时间,虽然难以区分现症和既往HDV感染,但仍是进行丁型肝炎初筛时的必要指标。鉴于抗HDV-IgM存在时间较短,而抗HDV-IgG在体内存在时间较长的优势,因此在筛选过程中进行抗体检测时建议采用抗HDV-IgG。
抗体检测普遍公认的方法是酶联免疫吸附测定(ELISA)。ELISA方法检测HDV抗体时受到许多因素的影响:(1)急性HDV感染时,HDV抗体存在时间很短很难检出,所以HDV抗体阴性不能否定丁型肝炎的发生;而慢性HDV感染时,血液中的HDV抗体和抗原形成免疫复合物,会对检测结果造成影响。(2)通常使用间接法检测抗HDV-IgG,但是容易出现假阳性结果,不同厂家的试剂盒质量参差不齐,抗HDV-IgG与肝细胞受损和炎症活动密切相关,因此只能作为临床HDV感染的初步筛查,明确诊断还需要联合血清HDV RNA的检测结果才能确诊。
由于抗体检测手段有一定的局限性,很多研究者开始探索更优化的检测方法。例如,目前ELISA试剂盒普遍使用酶催化底物的显色反应,存在灵敏度不高,特异度不强的缺点。对HDAg重新表达和纯化,将其固定于固相载体,并且进一步与纳米酶显色技术相结合,可进一步提高检测的灵敏度和稳定性。此外,抗HDV-IgG可以通过定量微阵列抗体捕获(Q-MAC)方法进行定量检测,这种定量荧光检测的方法大大提高了检测的灵敏度[11,15]。德国海德堡大学Urban团队[16]开发了一种试纸条式快速诊断HDV抗体的试剂。试剂开发基于一种新型重组肝炎δ抗原,该抗原在所有已知的HDV基因型中具有泛基因型活性。该方法在474例患者样本队列中发现与ELISA方法相比,其灵敏度为94.6%(314/332),特异度为100%(142/142)。因其快速的诊断和便捷的方法,可以预见该新型HDV快速检测方法将成为流行病学研究和临床诊断的重要工具,特别是在目前缺乏可靠HDV检测的地区。
3.2 HDAg检测 HDAg存在于受感染的细胞内和外周,出现比较早,但仅持续1~2周,由于检测不及时,往往呈阴性反应[17]。检测血清HDAg,如为阳性,有助于早期诊断。慢性HDV感染时,由于血清中抗HDV-IgG滴度高,HDAg多以免疫复合物形式存在,游离状态的抗原保持在低滴度水平[17-18]。
血清中抗原检测一般采用免疫酶法或放射免疫法。血清HDAg的檢出有限,在急性感染的前2周可检测到[17]。放射免疫测定是以放射性核素为标志物的标记分析法,用于定量检测受检标本中的抗原。这种检测方法既具有免疫反应的高特异性,又具有放射性测量的高灵敏度,因此能精确测定各种具有免疫活性的极微量的物质。但该检测方法也不乏缺点,由于放射免疫分析是竞争性反应,测量值是相对量而非绝对量;另外存在放射线辐射和污染等问题尚不能被广泛应用。肝内HDAg可采用免疫荧光法或免疫组化技术检测,能够发现HDAg位于肝细胞核内或位于肝细胞浆中,有利于诊断。也可应用免疫印迹法分离HDAg,可检测到HDAg-P24和HDAg-P27蛋白[19],方法较为复杂。但以上方法在临床应用中较少,仅在研究性文章中有所描述。
3.3 HDV RNA检测 HDV RNA是当前诊断HDV感染的“金标准”[20-21],HDV RNA阳性是HDV复制和HDV感染的直接证据。同时HDV RNA的定量测定也用于监测抗病毒治疗的应答[22-25]。
检测血清HDV RNA可用逆转录-聚合酶链式反应(RT-PCR)。RT-PCR方法是实验室常用的检测手段。实时定量逆转录PCR(RT-qPCR)是在传统PCR的基础上增加信号系统,以达到对样品进行实时定量检测的目的。根据信号的不同,可分为荧光染料法和探针法[26]。目前,有许多商用试剂盒可用于定量测定HDV RNA。这些技术旨在靶向编码HDAg或核酶结构域保守区域的序列。HDV基因组具有强大的二级结构,可通过在逆转录步骤前加入热休克处理来破坏[27],从而提高逆转录效率。使用一步法RT-qPCR可降低逆转录和扩增过程中的污染风险[28]。大多数已发表的研究[27-28]中使用的标准是HDV质粒DNA,但这并不评估逆转录步骤。其他研究使用体外合成的RNA作为标准,虽然可以评估逆转录步骤,但合成的RNA不具有很强的二级结构,HDV基因组的二级结构也会影响病毒的定量[20]。目前RT-PCR检测灵敏度可以达到103拷贝/μL,巢式PCR检测下限可以达到10拷贝/μL[21]。尽管RT-PCR检测具有快速、方便、特异等优点,但是HDV RNA中GC含量和互補性高,为HDV扩增带来了巨大的技术挑战,而且HDV的高度遗传变异性也使得需要精心设计其引物和探针。由于HDV RNA的广泛遗传变异性,迄今为止尚无完全标准化的PCR检测技术。不同实验室的结果也不具有可比性。一项对全球12个国家的实验室进行的综合分析[12]表明,由于检测技术和程序的差异,以及引物或探针设计的目标区域不同,结果存在高度异质性。因此,有必要建立国际上对HDV RNA进行定量的检测系统。
RT-qPCR检测方法已经开发完成。然而,仍需要开发新的检测方法,不仅具有较高的灵敏度和特异度,而且可以监测HDV RNA提取、逆转录和定量等一系列过程,从而降低假阴性率,更早地识别丁型肝炎患者,并及时控制HDV传播。目前针对核酸检测技术有了很多新的进展。首先,基于微滴数字PCR技术,建立了可以绝对定量丁型肝炎患者体内HDV RNA水平的ddPCR技术检测方法[20-21],检测下限可低至单个拷贝[20]。其次,使用最新的CRISPR/Cas13a检测技术建立了对HDV RNA进行精准、快速的检测方法,检测下限分别低至10拷贝/μL和100拷贝/μL。相信经过努力,未来研究成果可以投入HDV的临床应用检测,更有利于HDV感染的早期筛查,为更多的临床医生和患者提供帮助。此外,还需要建立标准化程序,例如样品类型、提取方法、引物/探针设计、实验流程、使用仪器和检测国际化单位的确定。因此,未来的目标是将这一检测标准化。新的方法如质谱和实时生物传感平台[11],可能也会应用至对HDV RNA或其成分的监测中。
4 HDV筛查人群
美国肝病学会建议仅对高风险人群进行检测,如HBV/HCV共感染者、HBV/HIV共感染者、乙型肝炎基础上合并有静脉吸毒者、高危险性行为者等[10],而欧洲肝病学会/亚太肝病学会则建议对所有HBsAg阳性的肝病患者进行HDV抗体检测[29-30]。多项Meta数据分析及综述[2,5,11-12,31]都对HDV的流行病学进行了描述,但文中数据差距较大。Rizzetto等[31]分析指出,对HDV低风险无症状HBsAg携带者的调查并不能反映感染的真实状况,更应该关注重症和终末期乙型肝炎患者的HDV合并感染的情况。经Meta分析[5]显示美国和欧洲的HBsAg阳性患者中丁型肝炎患病率分别为2.6%和19.5%。最近的一项研究[32]结果显示,在一个涉及1 556例的队列中整体HDV感染率为15.2%,其中静脉吸毒者HDV感染率为50.5%。由于北美地区与欧洲/亚太地区丁型肝炎感染率的差距明显,因此美国肝病学会与欧洲肝病学会/亚太肝病学会的建议不一致。我国因HBV感染人群基数较大,对于重点人群应做到应检尽检,对于普通HBsAg阳性人群则可以根据具体情况选择性筛查。关于优化筛选人群,可以参考患者已知的HBsAg定量和HBV定量两项指标确定是否有必要进行丁型肝炎的筛查。本团队研究(未发表数据)吉林省共计5 594例乙型肝炎患者进行抗HDV-IgG检测,发现抗HDV-IgG阳性者中71%其HBsAg定量>250 IU/mL,93%抗HDV-IgG阳性患者的HBV DNA定量<2 000 IU/mL。城镇居民对于健康意识较强,可能会主动进行体检或筛查。而对于很多农村地区、医疗资源不足的地区以及体检意识较弱的大众群体,疾控部门应该有组织地对这些人员进行筛查。为了更有效地发现潜在的丁型肝炎患者,又能最大限度地节约资源,笔者建议筛查的主要对象应该针对高危人群和已知的乙型肝炎患者(HBsAg>250 IU/mL和/或HBV RNA<2 000 IU/mL),做到应检尽检。虽然这种筛查人员的选择可能遗漏部分可能的HDV感染者,但是能够更高效地利用医疗资源。此外,还可以根据个人意愿及临床症状等随时进行丁型肝炎的检测,做到愿检尽检,多方共同参与,尽可能完成完善的丁型肝炎筛查工作。
5 小结
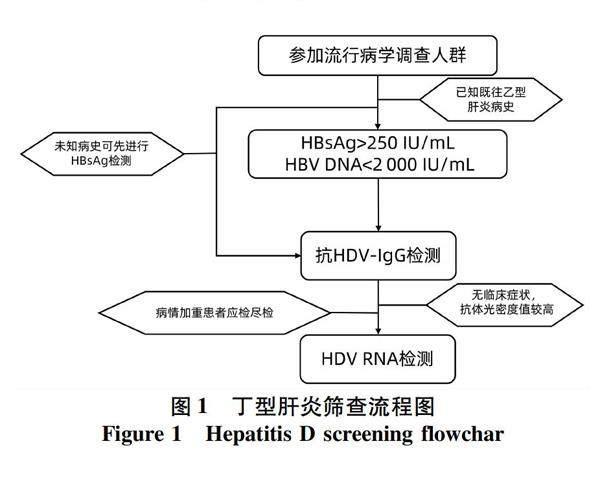
综上所述,结合我国目前的临床和试剂检测等各方面的条件,在既有效又节约资源的前提下,为进一步了解HDV感染的总体情况,掌握基本可靠的流行病学数据,除对重症和终末期乙型肝炎患者及时进行HDV检测外,普通大众可以仅对已知HBsAg>250 IU/mL和/或HBV RNA<2 000 IU/mL的患者,进行抗HDV-IgG检测。对于抗HDV-IgG阳性者根据临床表现和抗体检测光密度值判断是否有进行HDV RNA检测确诊的必要。丁型肝炎筛查流程总结见图1。
图1 丁型肝炎筛查流程图
Figure 1 Hepatitis D screening flowchar
利益沖突声明:所有作者均声明不存在利益冲突。
作者贡献声明:迟秀梅负责查阅文献,收集资料,撰写文稿;牛俊奇负责拟定写作思路,修改审阅文稿及最后定稿。
参考文献:
[1]URBAN S, NEUMANN-HAEFELIN C, LAMPERTICO P. Hepatitis D virus in 2021: virology, immunology and new treatment approaches for a difficult-to-treat disease[J]. Gut, 2021, 70(9): 1782-1794. DOI: 10.1136/gutjnl-2020-323888.
[2]MENTHA N, CLMENT S, NEGRO F, et al. A review on hepatitis D: From virology to new therapies[J]. J Adv Res, 2019, 17: 3-15. DOI: 10.1016/j.jare.2019.03.009.
[3]LEMPP FA, NI Y, URBAN S. Hepatitis delta virus: insights into a peculiar pathogen and novel treatment options[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(10): 580-589. DOI: 10.1038/nrgastro.2016.126.
[4]WANG W, LEMPP FA, SCHLUND F, et al. Assembly and infection efficacy of hepatitis B virus surface protein exchanges in 8 hepatitis D virus genotype isolates[J]. J Hepatol, 2021, 75(2): 311-323. DOI: 10.1016/j.jhep.2021.03.025.
[5]STOCKDALE AJ, KREUELS B, HENRION M, et al. The global prevalence of hepatitis D virus infection: Systematic review and meta-analysis[J]. J Hepatol, 2020, 73(3): 523-532. DOI: 10.1016/j.jhep.2020.04.008.
[6]ZI J, GAO X, DU J, et al. Multiple regions drive hepatitis delta virus proliferation and are therapeutic targets[J]. Front Microbiol, 2022, 13: 838382. DOI: 10.3389/fmicb.2022.838382.
[7]GILLICH N, ZHANG Z, BINDER M, et al. Effect of variants in LGP2 on MDA5-mediated activation of interferon response and suppression of hepatitis D virus replication[J]. J Hepatol, 2023, 78(1): 78-89. DOI: 10.1016/j.jhep.2022.08.041.
[8]KOHSAR M, LANDAHL J, NEUMANN-HAEFELIN C, et al. Human hepatitis D virus-specific T cell epitopes[J]. JHEP Rep, 2021, 3(4): 100294. DOI: 10.1016/j.jhepr.2021.100294.
[9]LUCIFORA J, DELPHIN M. Current knowledge on hepatitis delta virus replication[J]. Antiviral Res, 2020, 179: 104812. DOI: 10.1016/j.antiviral.2020.104812.
[10]TERRAULT NA, LOK A, MCMAHON BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67(4): 1560-1599. DOI: 10.1002/hep.29800.
[11]CHEN LY, PANG XY, GOYAL H, et al. Hepatitis D: challenges in the estimation of true prevalence and laboratory diagnosis[J]. Gut Pathog, 2021, 13(1): 66. DOI: 10.1186/s13099-021-00462-0.
[12]LAZARUS JV, AL-RIFAI A, SANAI FM, et al. Hepatitis delta virus infection prevalence, diagnosis and treatment in the Middle East: A scoping review[J]. Liver Int, 2022. DOI: 10.1111/liv.15338. [Online ahead of print]
[13]VLACHOGIANNAKOS J, PAPATHEODORIDIS GV. New epidemiology of hepatitis delta[J]. Liver Int, 2020, 40 Suppl 1: 48-53. DOI: 10.1111/liv.14357.
[14]WRANKE A, HEIDRICH B, ERNST S, et al. Anti-HDV IgM as a marker of disease activity in hepatitis delta[J]. PLoS One, 2014, 9(7): e101002. DOI: 10.1371/journal.pone.0101002.
[15]CHEN X, OIDOVSAMBUU O, LIU P, et al. A novel quantitative microarray antibody capture assay identifies an extremely high hepatitis delta virus prevalence among hepatitis B virus-infected mongolians[J]. Hepatology, 2017, 66(6): 1739-1749. DOI: 10.1002/hep.28957.
[16]LEMPP FA, ROGGENBACH I, NKONGOLO S, et al. A rapid point-of-care test for the serodiagnosis of hepatitis delta virus infection[J]. Viruses, 2021, 13(12): 2371. DOI: 10.3390/v13122371.
[17]HOBLOS R, KEFALAKES H. Immunology of hepatitis D virus infection: General concepts and present evidence[J]. Liver Int, 2022. DOI: 10.1111/liv.15424. [Online ahead of print]
[18]DANDRI M, BERTOLETTI A, LTGEHETMANN M. Innate immunity in hepatitis B and D virus infection: consequences for viral persistence, inflammation, and T cell recognition[J]. Semin Immunopathol, 2021, 43(4): 535-548. DOI: 10.1007/s00281-021-00864-x.
[19]YAO T, LV M, MA S, et al. Ubiquitinated hepatitis D antigen-loaded microvesicles induce a potent specific cellular immune response to inhibit HDV replication in vivo[J]. Microbiol Spectr, 2021, 9(3): e0102421. DOI: 10.1128/Spectrum.01024-21.
[20]XU L, ZHANG X, CAO Y, et al. Digital droplet PCR for detection and quantitation of hepatitis delta virus[J]. Clin Transl Gastroenterol, 2022, 13(7): e00509. DOI: 10.14309/ctg.0000000000000509.
[21]PFLGER LS, NRZ D, VOLZ T, et al. Clinical establishment of a laboratory developed quantitative HDV PCR assay on the cobas6800 high-throughput system[J]. JHEP Rep, 2021, 3(6): 100356. DOI: 10.1016/j.jhepr.2021.100356.
[22]PALOM A, SOPENA S, RIVEIRO-BARCIELA M, et al. One-quarter of chronic hepatitis D patients reach HDV-RNA decline or undetectability during the natural course of the disease[J]. Aliment Pharmacol Ther, 2021, 54(4): 462-469. DOI: 10.1111/apt.16485.
[23]ZHANG Z, NI Y, LEMPP FA, et al. Hepatitis D virus-induced interferon response and administered interferons control cell division-mediated virus spread[J]. J Hepatol, 2022, 77(4): 957-966. DOI: 10.1016/j.jhep.2022.05.023.
[24]ROULOT D, BRICHLER S, LAYESE R, et al. Origin, HDV genotype and persistent viremia determine outcome and treatment response in patients with chronic hepatitis delta[J]. J Hepatol, 2020, 73(5): 1046-1062. DOI: 10.1016/j.jhep.2020.06.038.
[25]SCHWARZ C, CHROMY D, BANGERT C, et al. Immediate-type hypersensitivity reaction to bulevirtide and successful desensitization in a patient with HBV/HDV-associated compensated cirrhosis[J]. J Hepatol, 2022, 77(1): 254-255. DOI: 10.1016/j.jhep.2022.03.004.
[26]LIN YX, QIN YL, ZHANG JM. Clinical significance and methods of hepatitis D virus RNA detection[J]. J Clin Hepatol, 2022, 38(12): 2830-2835. DOI: 10.3969/j.issn.1001-5256.2022.12.028.
林妍雪, 秦艳丽, 张继明. HDV RNA检测的临床意义与方法[J]. 临床肝胆病杂志, 2022, 38(12): 2830-2835. DOI: 10.3969/j.issn.1001-5256.2022.12.028.
[27]KATSOULIDOU A, MANESIS E, ROKKA C, et al. Development and assessment of a novel real-time PCR assay for quantitation of hepatitis D virus RNA to study viral kinetics in chronic hepatitis D[J]. J Viral Hepat, 2013, 20(4): 256-262. DOI: 10.1111/jvh.12000.
[28]SCHOLTES C, ICARD V, AMIRI M, et al. Standardized one-step real-time reverse transcription-PCR assay for universal detection and quantification of hepatitis delta virus from clinical samples in the presence of a heterologous internal-control RNA[J]. J Clin Microbiol, 2012, 50(6): 2126-2128. DOI: 10.1128/JCM.06829-11.
[29]European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-398. DOI: 10.1016/j.jhep.2017.03.021.
[30]SARIN SK, KUMAR M, LAU GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update[J]. Hepatol Int, 2016, 10(1): 1-98. DOI: 10.1007/s12072-015-9675-4.
[31]RIZZETTO M, HAMID S, NEGRO F. The changing context of hepatitis D[J]. J Hepatol, 2021, 74(5): 1200-1211. DOI: 10.1016/j.jhep.2021.01.014.
[32]BGUELIN C, ATKINSON A, BOYD A, et al. Hepatitis delta infection among persons living with HIV in Europe[J]. Liver Int, 2023. DOI:10.1111/liv.15519. [Online ahead of print]
收稿日期:
2023-02-09;錄用日期:2023-03-09
本文编辑:葛俊
