基于TCGA数据库分析甲状腺癌微环境中免疫细胞组分及免疫调节因子变化
2023-04-11占天鹏周剑辉李兰兰卢建中付生军刘善辉
何 魏 程 岳 张 勐 占天鹏 周剑辉 陶 燕 李兰兰 卢建中 付生军 张 静 刘善辉▲
1.兰州大学第二临床医学院,甘肃兰州 730000;2.新疆石河子市人民医院呼吸内分泌科,新疆石河子 832061;3.兰州大学第二医院泌尿外科研究所,甘肃兰州 730000
甲状腺癌(thyroid cancer,THCA)是内分泌系统中最常见的恶性肿瘤之一。THCA的发病率在过去几十年中一直在不断增长[1]。虽然通过传统干预措施治疗后,THCA患者病死率有所降低[2-3],但传统疗法治疗后患者通常预后不良[4]。近年调节肿瘤免疫的相关治疗取得了重要进展[5-6]。肿瘤微环境中免疫组分同肿瘤预后密切相关[7-8],有研究表明巨噬细胞靶向治疗可用于浸润性THCA,尤其是肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)含量高的THCA[9]。尽管免疫调节因子抑制剂及单抗已经在临床中应用于治疗多种癌症[10],但对于免疫调节同THCA的相关性尚无系统研究。本研究使用TCGA数据库中THCA患者的基因表达谱数据和临床信息,利用多种生物信息学方法分析22种免疫细胞组分和重要免疫因子在THCA和癌旁组织中的变化。现报道如下。
1 资料与方法
1.1 数据来源
2019年10月20日本研究从TCGA数据库中下载THCA旁和癌组织的相关表达谱数据及患者临床信息。计算癌旁和癌组织中22种免疫细胞含量[11];比较各免疫细胞在癌旁和癌组织中含量差异及其与预后的关系。
1.2 统计学分析
本研究中表达谱数据分析基于R 3.4.2平台[12]。所有数据分析均在SPSS 25.0统计学软件进行,利用方差分析以评估免疫细胞与临床特征的关系;采用t检验评估免疫细胞组成和免疫因子表达的差异。P< 0.05为差异有统计学意义。
2 结果
2.1 样本的临床特征
本研究共获得20例THCA旁组织和227例THCA组织的临床数据,包括年龄、性别、肿瘤淋巴结转移分期(TNM)[13]、淋巴结转移和生存状态(表1),其中“占比”指各样本数占THCA患者总数的百分比,“有效率”指各样本数占剔除“未知”的THCA患者例数的百分比。

表1 THCA患者临床特征
2.2 THCA中的非特异性免疫细胞浸润变化
本研究发现在THCA中静息态树突状细胞、M0型巨噬细胞、M2型巨噬细胞和肥大细胞的含量高于癌旁组织,M1型巨噬细胞的含量低于癌旁组织,差异有统计学意义(P< 0.05),见图 1。

图1 THCA组织和甲状腺组织中的非特异性免疫细胞
2.3 THCA中的特异性免疫细胞浸润变化
与癌旁组织相比,THCA中B细胞、浆细胞、CD4+T细胞、CD8+T细胞、Tfh细胞和γδT细胞的浸润水平较低,差异有统计学意义(P< 0.05),见图2。

图2 THCA组织和THCA旁组织中的特异性免疫细胞
2.4 THCA中的免疫调节因子表达水平
CMTM6、CXCL8、CD47和 CD276等在 THCA中表达水平较高,CTLA4、PDCD1、LAG3、TIGIT和ICOS等在THCA中表达较低,差异有统计学意义(P< 0.05),见图 3。
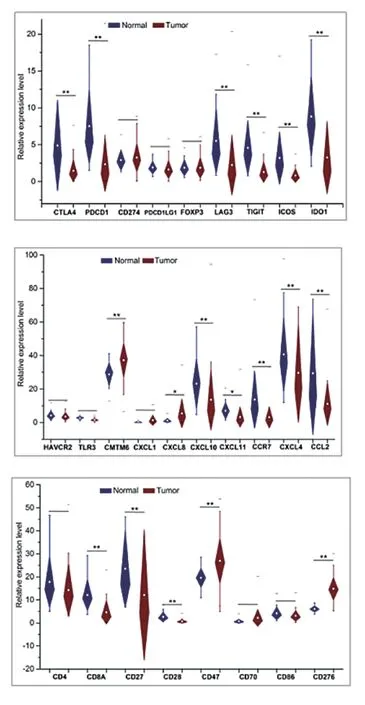
图3 THCA和THCA旁组织中的关键免疫调节因子表达模式
2.5 免疫细胞评估THCA患者预后的价值
CD8+T细胞(HR=0.174,95%CI:0.046~0.653)高表达时患者生存期更长,差异有统计学意义(P< 0.05);活化的记忆 CD4+T 细胞(HR=0.609,95%CI:0.114~3.269)高表达时患者生存期更长,差异无统计学意义(P> 0.05);而在 Tregs细胞(HR=0.931,95%CI:0.250~ 3.462)和 M2巨噬细胞(HR=1.659,95%CI:0.442~ 6.235)的高低表达组中,差异无统计学意义(P> 0.05),见图 4。

图4 THCA患者中Tregs细胞、M2型巨噬细胞、CD8+T细胞和活化记忆CD4+T细胞的Kaplan-Meier曲线和存活率
2.6 THCA的临床特征与四种免疫细胞的关系
Tregs细胞同T分期(Ⅲ~Ⅳ)(HR=1.370,95%CI:0.917 ~ 2.046)、恶 性 分 期(HR=0.642,95%CI:0.429~0.961)和年龄(HR=0.777,95%CI:0.521~1.163)具有明显相关性,差异有统计学意义(P< 0.05)。CD8+T细胞与患者年龄(HR=1.035,95%CI:0.688~1.557)、性别(HR=0.984,95%CI:0.626 ~ 1.546)、T分期(Ⅲ~Ⅳ)(HR=1.104,95%CI:0.734~1.633)、恶性程度(HR=1.115,95%CI:0.737~ 1.687)和有无转移(HR=1.626,95%CI:1.042~ 2.534)均密切相关,差异有统计学意义(P< 0.05),见图 5。
2.7 THCA中免疫调节因子与预后相关免疫细胞之间的关系
CD47(HR=0.826,95%CI:0.553 ~ 1.235)、CCR3(HR=1.743,95%CI:1.165~2.608)、CMTM6(HR=0.923,95%CI:0.624 ~ 1.375)和 FOXP3(HR=1.509,95%CI:1.008~2.258)中多种免疫调节因子同Tregs细胞的含量具有较强相关性,差异有统计学意义(P< 0.05)。CD8+T 细 胞 浸 润 同 CD47(HR=1.064,95%CI:0.712~1.591),CMTM6(HR=1.059,95%CI:0.707~1.588)和 TLR3(HR=1.447,95%CI:0.962~ 2.175)显著相关,差异有统计学意义(P< 0.05),见图 5。
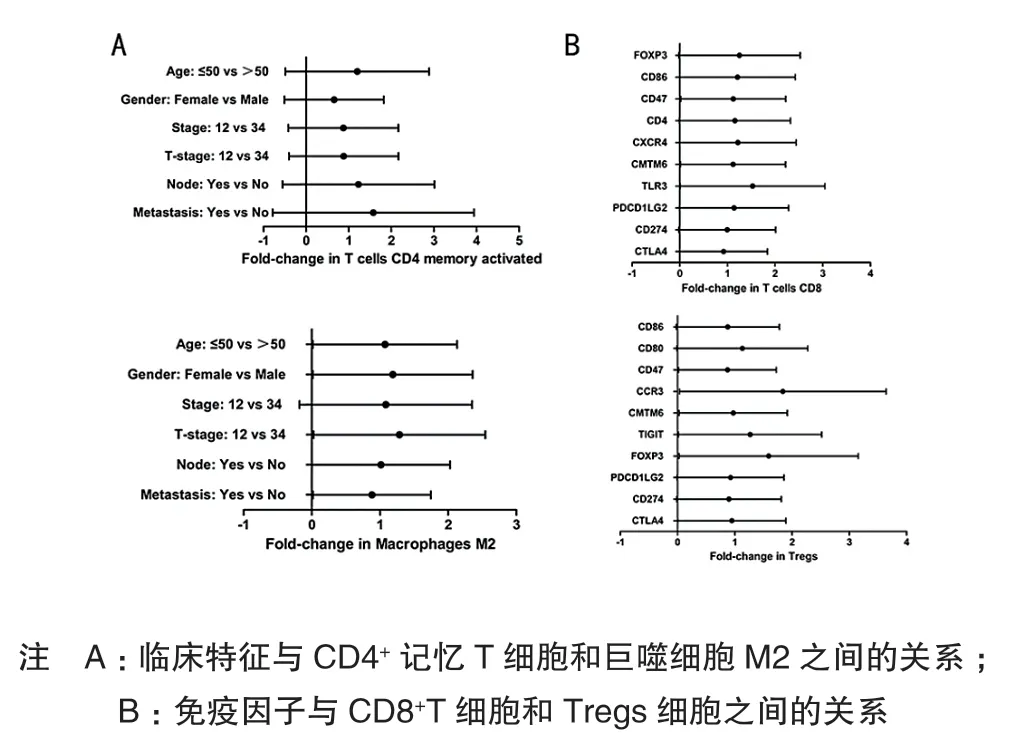
图5 THCA中免疫调节因子与预后相关免疫细胞之间的关系
3 讨论
THCA的发生、发展及预后与THCA肿瘤微环境中免疫组分密切相关[14-15]。T淋巴细胞是肿瘤微环境中重要的后天免疫组分[16]。本研究结果表明,THCA中CD8+T细胞的含量较低。高表达的CD47同CD8+/Foxp3+T细胞比例下调相关[17]。TLR3可增强白介素-12介导的CD4+T/CD8+T细胞在脾脏中增殖以及淋巴细胞介导的抗肿瘤作用[18]。此外,T细胞表面上多个免疫抑制分子可抑制T细胞的肿瘤杀伤效应作用[19]。当这些免疫抑制因子与相应的配体结合时,传递的信号可以抑制T细胞活化,从而导致肿瘤细胞中T细胞增殖和杀伤性细胞因子分泌的下调,使大多数T细胞处于功能丧失状态[20]。而对肿瘤发生发展具有促进作用的调节性T细胞在THCA肿瘤组织中具有较高程度的浸润[21-22],Tregs细胞含量的增加同THCA的恶性发展呈正相关,而肿瘤微环境中Tregs细胞的表达受到CD47、CCR3、CMTM6和FOXP3调控并影响肿瘤的发生发展。据报道,CD47介导的Tregs细胞的高表达对Her2阳性乳腺癌的预后有恶化的作用[23],CCR3募集的Tregs细胞可抑制炎症反应,提示CCR3在肿瘤的发生发展中起促进作用[24]。本研究发现调节CD47、CCR3和CMTM6表达量可能抑制THCA中Tregs细胞的表达,这可能对靶向抑制THCA中Tregs细胞功能具有重要提示作用。
M2型巨噬细胞可以通过抑制免疫清除,促进肿瘤细胞增殖和刺激血管生成促进肿瘤生长,而M1型巨噬细胞可抑制肿瘤的生长、转移及其对放化疗的耐受性,与患者良好预后密切相关[25]。本研究发现M2巨噬细胞与THCA的总体生存期相关,这表明目前靶向肿瘤微环境中TAM的相关治疗研究对THCA可能同样具有重要意义。
综上所述,本研究确定了THCA中的多种免疫细胞和免疫调节因子的表达差异,这为系统了解THCA肿瘤微环境中的免疫调节提供了重要参考价值。
