酿酒酵母多糖对葡萄酒果香酯类物质水解呈香的表观基质效应
2023-04-11孔彩琳许引虎黄杰冯林严忻怡陶永胜
孔彩琳,许引虎,黄杰,冯林,严忻怡,陶永胜,3
酿酒酵母多糖对葡萄酒果香酯类物质水解呈香的表观基质效应
孔彩琳1,许引虎2,黄杰1,冯林1,严忻怡1,陶永胜1,3
1西北农林科技大学葡萄酒学院,陕西杨凌 712100;2安琪酵母有限公司,湖北宜昌 443003;3陕西省葡萄与葡萄酒重点实验室,陕西杨凌 712100
【目的】研究酿酒酵母多糖对葡萄酒果香酯类物质水解呈香的表观基质效应,探究酿酒酵母多糖在稳定产品果香、延长货架期方面的应用潜力。【方法】以酿酒酵母为材料,利用热水浸提法、碱法提取得到酵母多糖,并通过紫外分光光度计、气相色谱以及高效液相色谱解析酿酒酵母多糖的基本组分。配置含有果香酯类物质常规浓度的模拟葡萄酒溶液,并作酵母多糖处理,多糖浓度在0—2.0 g·L-1范围作梯度设置。酵母多糖对果香酯类物质挥发性的影响采用静态顶空方法分析,随后不同处理模拟酒在4℃下贮藏6个月,定期取样监测果香酯类物质的含量变化。最后通过感官分析评价6个月后不同处理模拟酒的香气特征。【结果】通过仪器分析得到酿酒酵母多糖总多糖含量占比为(72.61±3.29)%,蛋白质含量占比为(11.20±0.02)%,其主要单糖组成为甘露糖和葡萄糖,二者的摩尔比1.790∶1;该多糖的高分子量组分为18、163和21 819 kD,低分子量组分为576 Da。静态顶空分析方法表明,多糖处理可以降低模拟酒中乙酸酯的挥发性,以0.8 g·L-1的多糖处理效果最好;而多糖处理可以提高模拟酒中乙醇酯的挥发性。定期采样数据结果发现,在模拟葡萄酒贮藏6个月期间,乙醇酯的水解速率显著高于乙酸酯;相比于对照组,0.4—0.8 g·L-1多糖处理可以分别将乙酸酯和乙醇酯的水解率降低10%—40%和3.7%—26.7%。感官分析结果显示,在贮藏6个月后,多糖处理的模拟酒中温带酸果、温带甜果、蜜饯类和花香香气特征值会显著高于对照组。【结论】经模拟体系研究得出,在葡萄酒贮藏期间添加0.4—0.8 g.L-1酿酒酵母多糖可以减缓果香酯类物质的水解,稳定葡萄酒的果香,对延长产品货架期有潜在的应用价值。
酵母多糖;果香酯类物质;水解;基质效应
0 引言
【研究意义】葡萄酒的香气轮廓取决于香气物质的组成,其中果香酯类物质是葡萄酒果香和花香重要的贡献者。然而在葡萄酒贮藏阶段,果香酯类物质会逐渐水解为高级醇和脂肪酸等前体物质,导致果香特征逐渐丢失,产品品质下降。在酒精发酵过程中,葡萄醪中的主要发酵微生物是酿酒酵母,发酵完成后酵母菌体自溶会释放多糖等大分子物质,从而影响葡萄酒的品质。酵母多糖是葡萄酒中一类重要的活性大分子物质,对于产品质量和稳定都起着重要的作用。因此,研究酿酒酵母多糖对果香酯类物质水解呈香的基质效应,可为稳定葡萄酒果香,延长产品的货架期提供理论指导和技术支撑。【前人研究进展】酯类物质是重要的酒精发酵副产物,其含量约占葡萄酒发酵挥发性物质总量的30%,其中乙酸高级醇酯和脂肪酸乙酯具有典型的果香特征,且其中一些具有很低的嗅觉阈值,如乙酸异丁酯(阈值1 mg∙L-1,草莓、果香)、乙酸异戊酯(30 µg∙L-1,香蕉)、己酸乙酯(20 µg∙L-1,青苹果、果香)、辛酸乙酯(5 µg∙L-1,甜果)[1]。酵母多糖主要来源于酵母细胞壁,包括-葡聚糖、甘露糖蛋白和几丁质等[2]。研究发现,酵母多糖可以提高葡萄酒的颜色稳定性[3-4];抑制单宁酸聚集和降低葡萄酒的涩味[5-6]、降低葡萄酒中热敏性蛋白的浑浊[7]、提高起泡酒的起泡性能[8]。此外,有研究发现甘露糖蛋白与葡萄酒香气物质存在分子互作关系,对香气的稳定性有作用[9-10]。【本研究切入点】酿酒酵母是主导葡萄酒酒精发酵的微生物,葡萄酒贮藏期间酵母多糖对其香气和品质方面的研究鲜有报道,酵母多糖对果香酯类物质水解呈香的基质效应尚不清楚。【拟解决的关键问题】从酿酒酵母细胞中提取制备酵母多糖,仪器分析其基本组分;并研究果香酯类物质在不同浓度酵母多糖基质下的顶空挥发特性和水解呈香的特点,获得酵母多糖对果香酯类物质水解呈香的表观基质效应,为酵母多糖在稳定葡萄酒果香,延长产品货架期上的应用提供理论依据和技术支持。
1 材料与方法
试验于2021年在西北农林科技大学葡萄酒学院实验中心进行。
1.1 仪器与试剂
SPME萃取纤维(DVB/CWR/PDMS涂层,1.1 mm×20 mm×120 μm),气相色谱质谱联用仪(GC-MS)QP2020(岛津,日本),气相色谱(GC-FID)GC-2010 pro(岛津,日本),气相色谱柱DB-WAX(60 m×0.25 mm×0.25 μm,Agilent,美国),SK-1701(30 m×0.25 mm×0.25 µm,岛津,日本),高效液相色谱Waters 2695(Waters,美国),液相色谱柱Ultrahydrogel Linear Column(10 μm×7.8 mm×300 mm,Waters,美国)。
色谱纯化学试剂(纯度≥97%):D-海藻糖、D-核糖、L-(+)-阿拉伯糖、D-甘露糖、D-(+)-葡萄糖、肌醇、乙酸乙酯、丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、乙酸异戊酯、乙酸苯乙酯和苯乙酸乙酯购自北京Sigma-Aldrich公司,右旋糖酐标准套(D0—D2000)购自中国食品药品检定研究院。分析纯化学试剂:硫酸、三氯甲烷、苯酚、乙醇、柠檬酸、氢氧化钠等试剂购于天津化学试剂公司。
1.2 试验方法与设计
1.2.1 酵母多糖的提取和制备 采用YEPD培养基活化酿酒酵母菌株,经过YEPD培养基培养和发酵培养基发酵后,将发酵培养液离心(8 000 r/min,15 min)得到细胞菌体,利用热水浸提法(121℃,3.5 h)对酿酒酵母细胞菌体进行水解,离心分离(8 000 r/min,25 min)得到沉淀为酵母细胞壁,酵母细胞壁在3%氢氧化钠溶液中,80℃下水解6 h,随后离心得到上清液,上清液进行冷冻浓缩、真空干燥(-50℃以下,40 pa以下),得到酵母粗多糖粉末。
1.2.2 酵母多糖基本组分的测定 采用苯酚-硫酸法测定粗多糖的总糖含量[11],以无水葡萄糖作为标准品,利用紫外分光光度计在490 nm下的吸光值绘制总糖含量的标准曲线,依据公式计算得到水溶性酵母多糖含量。采用高效凝胶渗透色谱法(HPGPC)对多糖的纯度和多糖分子量进行测定[12]。用右旋糖酐标准品(D0—D2000)进行分子量标准曲线的绘制。称取标准品或酵母多糖固体粉末2 mg,1 mL蒸馏水溶解,过0.22 µm滤膜进行分子量测定,每个样重复3次。仪器参数:Waters 2695高效液相配有示差折光检测器,色谱柱为Ultrahydrogel Linear Column(10 μm×7.8 mm×300 mm),检测器温度35℃,柱温35℃,流动相为0.1 mol∙L-1硝酸钠溶液,流速0.6 mL∙min-1。单糖组分的测定参考Watrelot等[13]的方法,将酵母多糖水解、衍生后通过气相色谱测定其单糖组成。酵母多糖中蛋白质含量的测定按照BRADFORD[14]的考马斯亮蓝法进行。以牛血清蛋白(0.2—1.5 g∙L-1)制作蛋白质标准曲线。
1.2.3 果香酯类物质挥发性测定 在模拟葡萄酒(12%乙醇、5 g∙L-1酒石酸、pH 3.5)中加入8种典型果香酯类物质,初始浓度为C0(表1)。随后加入1.1中提取制备的酵母多糖至模拟酒中,设置其浓度水平分别为0、0.4、0.8、1.2、1.6和2.0 g∙L-1(CK、YP1、YP2、YP3、YP4、YP5)。参考CAMELEYRE等[15]方法,略作修改,利用静态顶空方法测定8种果香酯类物质在不同多糖浓度下的挥发性和气液相分配系数。具体方法为:在15 mL的顶空瓶中加入8 mL酒样和20 µL内标(2-辛醇,0.016 g∙L-1),置于20℃下进行热力学平衡24 h后,利用GC-MS分别测定体系中液体部分和气体部分的香气物质含量。
1.2.4 酵母多糖对果香酯类物质水解的影响 配置18 L模拟葡萄酒溶液,在溶液中加入8种典型果香酯类物质,初始浓度为C0。分别取1 L含有果香酯类物质的模拟酒溶液加入1.1中提取制备的酵母多糖,设置其浓度水平分别为0、0.4、0.8、1.2、1.6和2.0 g∙L-1,每个处理重复3次。为了更好地保留模拟酒中的果香酯类物质,本试验将样品置于4℃下贮藏,定期取样(10 mL)监测果香酯类物质的种类和含量变化,利用感官分析评价模拟酒贮藏半年后香气特征的变化。
1.2.5 模拟葡萄酒中果香酯类物质含量和种类测定 采用顶空固相微萃取技术(HS-SPME)结合AOC-6000自动进样器和SPME萃取纤维对模拟葡萄酒中果香酯类物质进行吸附。酒样(8 mL)、2-辛醇(0.016 g∙L-1,20 μL)和氯化钠(2.000 g)添加到15 mL顶空瓶中,在40℃下加热15 min,随后,纤维暴露在40℃下30 min(转速600 r/min),而后取出插入GC进样口,250℃解析5 min取出。
GC-MS分析方法[16]:色谱柱为DB-WAX,不分流进样,载气为氦气(99.999%),流速为1.5 mL∙min-1。GC的升温程序为:40℃保持3 min,再以4℃∙min-1的速率提高到160℃,接着以7℃∙min-1升高至220℃,保持5 min。连接杆和离子源的温度分别为220℃和200℃,电子源电压70 eV,灯丝流量0.2 mA,检测器电压350 V。质谱为电离轰击模式(EI),全扫描质谱范围35—350 m/z,扫描频率0.2次/s。
定性定量方法:采用酯类物质标准品进行定性,通过C7—C40系列烷烃测定保留指数(RI),使用内标-标准曲线法进行定量分析。
1.2.6 感官分析 模拟葡萄酒样品的香气特征采用感官量化品评法进行分析[17]。品评小组由本单位葡萄酒专业的自愿学生组成(女18人,男12人)。首先,品评小组进行54香的葡萄酒标准香气物质(Le Nez du Vin®,法国)闻香训练,直到每个品评员对每个香气特征的识别准确率在95%以上。随后进行模拟葡萄酒样品的香气感官品评,所有样品一式3份。将模拟葡萄酒(30 mL)倒入透明的黑色INAO玻璃杯中,杯上标有3个随机数字代码。要求品评员使用葡萄酒标准香气特征中4—6个特征描述样品的香气,并使用5点标度法量化其强度,1:弱;2:较弱;3:中等;4:较强;5:强。最终量化强度值MF(%)由品尝小组对某一香气特征词汇的使用频率F(%)和强度平均值I(%)表示,计算公式为:

1.3 数据处理方法
使用Microsoft Excel 2019(Microsoft, USA)进行数据的常规统计分析,采用SPSS 25.0(SPSS Inc., Chicago, IL, USA)进行数据的单因素方差分析、多重比较分析(Duncan检验)。果香酯类物质含量变化以及数据主成分分析的图表使用Origin 2021(OriginLab, Northampton, MA, USA)绘制。
2 结果
2.1 酿酒酵母多糖的基本组成
酵母多糖的分子量有4个不同的分布区域,主要分布在高分子量区域,其高分子量分别为18、163和21 819 kD,低分子量组分为576 Da(图1)。
酿酒酵母多糖的组成如图2所示,其总多糖含量为(72.61±3.29)%,总蛋白质含量为(11.20±0.02)%,其单糖组成包括甘露糖(41.22%)、葡萄糖(23.03%)、阿拉伯糖(2.31%)、海藻糖(4.12%)和核糖(1.93%),含量较高的甘露糖和葡萄糖的含量分别为1 439.48和804.28 mg∙L-1,二者的摩尔比为1.790﹕1。
2.2 酿酒酵母多糖对果香酯类物质挥发性的影响
表1展示了酿酒酵母多糖不同浓度下8种果香酯类物质的气液相分配系数及其初始浓度和最终的平均浓度,气液分配系数为酒样中液相浓度/气相浓度,>1说明果香酯类物质在液相层的浓度大于气相层。由表可知,酵母多糖处理可以提高乙酸酯的,随着多糖浓度的增大,先增大后减少。不同处理下4种乙酸酯的表现不一样,乙酸异丁酯的最大,乙酸乙酯、乙酸异丁酯和乙酸苯乙酯的在YP2中具有显著优势,而乙酸异戊酯的在YP3中最大。对于乙醇酯,随着碳链的增加,其逐渐降低,多糖处理可以提高己酸乙酯的,以YP3最显著,且YP3提高了辛酸乙酯的,而其他浓度的多糖处理降低了辛酸乙酯、癸酸乙酯和苯乙酸乙酯的。

图1 高效凝胶渗透色谱分析的酿酒酵母多糖的分子量分布图表

图2 酿酒酵母多糖的组分及其含量
2.3 贮藏阶段酿酒酵母多糖对果香酯类物质水解呈香的影响
如图3所示,8种果香酯类物质的含量在4℃贮藏期间逐渐下降,乙酸酯和乙醇酯的含量分别下降了30.0%和90.0%以上。贮藏6个月后,与对照相比,多糖处理对乙酸乙酯的水解无明显作用;YP1对乙酸异丁酯和乙酸异戊酯的水解率分别减缓了30.0%和16.7%,YP3、YP4和YP5反而促进了乙酸异丁酯和乙酸异戊酯的水解,导致它们在YP3、YP4和YP5中的最终浓度低于对照。对于乙醇酯,YP2对己酸乙酯和癸酸乙酯的水解分别减缓了13.3%和20%,多糖处理对癸酸乙酯的水解没有减缓作用。YP1和YP5可以显著减缓乙酸苯乙酯和苯乙酸乙酯的水解,尤其是YP1,这两种酯的水解率减缓了约50%,而其他浓度多糖处理促进了乙酸苯乙酯和苯乙酸乙酯的水解,尤以YP3最高,水解率分别增加了75%和50%。因此,不同浓度多糖基质环境下,乙酸酯和乙醇酯的水解表现不一样,其中YP1和YP2延缓果香酯类物质水解的作用最显著。

图3 不同酵母多糖处理的模拟葡萄酒样品贮藏6个月期间果香酯类物质的含量变化
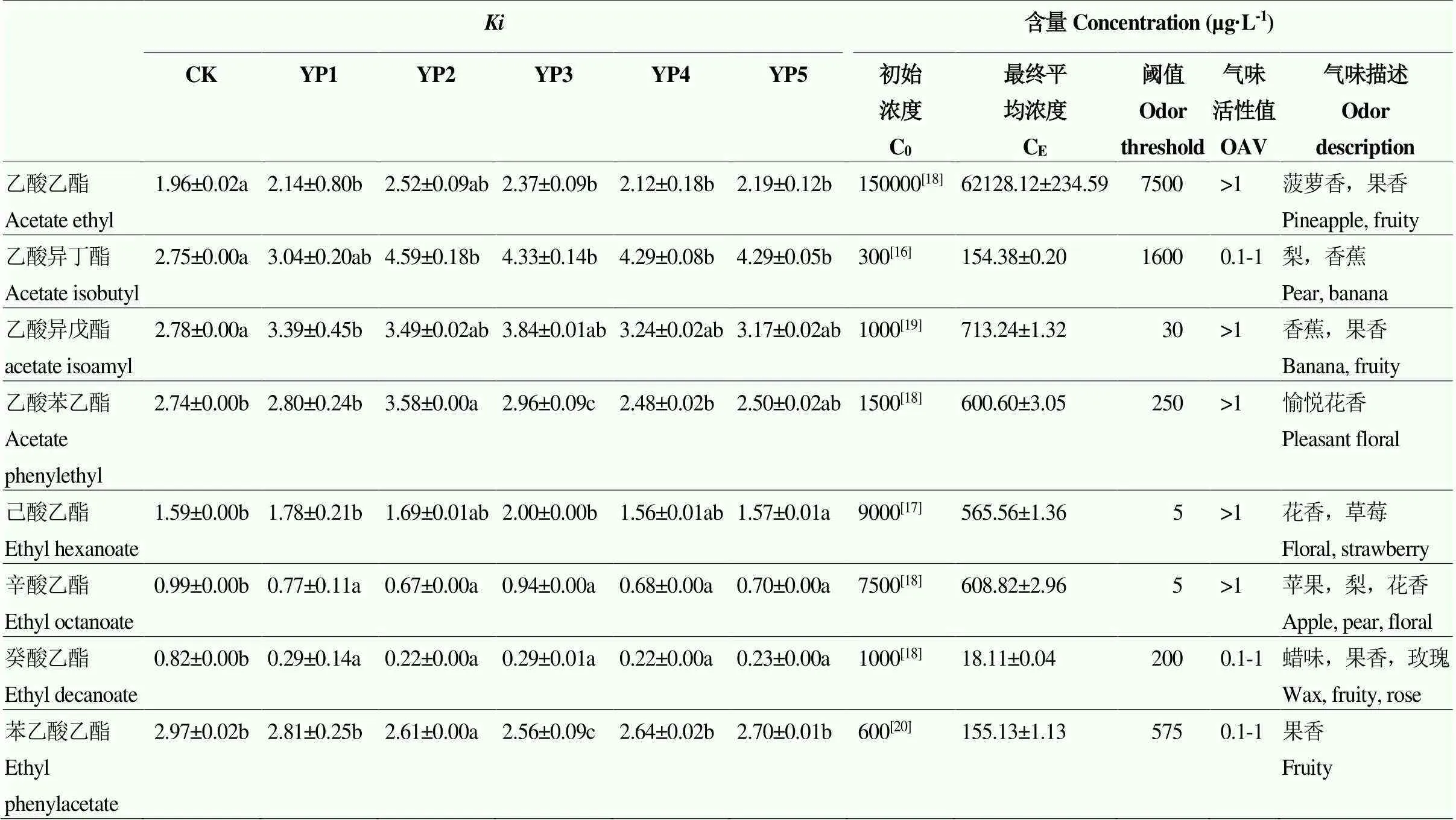
表1 不同处理模拟葡萄酒中果香酯类物质的浓度及其液相/气相分配系数Ki
:模拟酒体系中果香酯类物质液相浓度/气相浓度;CK:空白对照;YP1、YP2、YP3、YP4、YP5分别代表了在模拟葡萄酒中添加0.4、0.8、1.2、1.6和2.0 g.L-1酿酒酵母多糖。表中同一行数据后的不同小写字母表示处理间差异显著(Duncan检验,<0.05)。下同
: Content of fruity esters in liquid/that in gas; CK: Blank control; YP1, YP2, YP3, YP4 and YP5 represented that wine sample treated with 0.4, 0.8, 1.2, 1.6, 2.0 g.L-1yeast polysaccharide, respectively. Data followed by different small letters in a row are significantly different (<0.05) by Duncan test. The same as below
2.4 果香酯类物质在酿酒酵母多糖基质下的香气轮廓
多糖处理样品中的果香和花香特征的强度均明显高于对照,其中柑橘类和花香特征在不同处理中显示出显著差异(图4)。相比于对照,YP1中热带水果和温带甜果呈现较高的MF值,YP2中柑橘类和蜜饯类的MF值最大,YP3中花香香气特征最强烈,YP4和YP5中温带酸果的MF值具有明显优势。

*代表在95%置信水平下差异显著;** 代表在99%置信水平下显著差异
为了进一步解析不同浓度的酿酒酵母多糖处理对模拟葡萄酒中果香酯类物质水解呈香的影响,对贮藏6个月后模拟酒样品的果香酯类物质含量进行主成分分析(PCA),前两个主成分上的果香酯类物质以及酒样的分布见图5,前两个主成分的总方差为81.52%,其中PC1和PC2的方差分别为46.52%和35.00%。由图可知,乙醇酯和YP2分布在第一象限;乙酸酯、苯衍生物酯和YP1分布于第4象限;而YP3和YP4都处于PC1的负向端;YP5在零点处,CK处于PC2的正向端。分析可知,YP1可以显著减缓乙酸酯、乙酸苯乙酯和苯乙酸乙酯的水解;YP2可以减缓乙醇酯的水解;相比于CK,YP3、YP4和YP5对于果香酯类物质的水解没有明显作用。
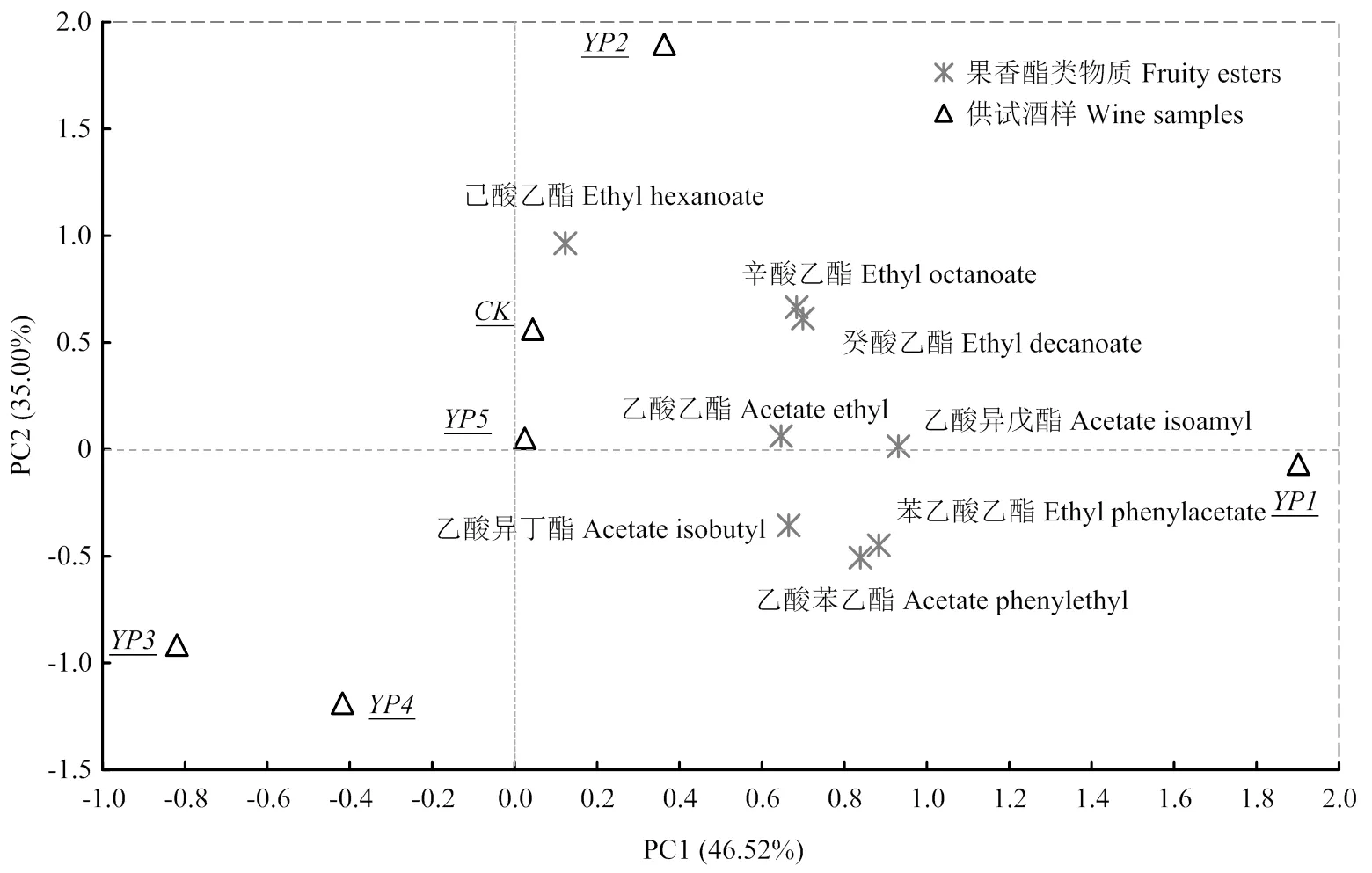
图5 前两个主成分上模拟葡萄酒样品中果香酯类物质的载荷及酒样的分布
3 讨论
3.1 酵母多糖的化学组分
本研究中,酿酒酵母多糖的组分包括甘露糖、葡萄糖和蛋白质,根据其组分可以推断该酵母多糖中可能有葡聚糖和甘露糖蛋白。酵母多糖中的甘露糖蛋白是由甘露聚糖共价连接到蛋白质或多肽,含有约10%的蛋白质和90%的甘露糖[21],其分子量范围为5—800 kD,而葡聚糖的分子量从几万到几千万不等[22]。本试验中酵母多糖的分子量分布在4个区域,且主要集中于高分子量区域(18—21 819 kD),说明酿酒酵母中至少含有4种不同聚合度的多糖,也符合甘露糖蛋白和葡聚糖分子量范围。
3.2 酵母多糖基质下果香酯类物质的挥发性
香气物质的顶空释放取决于香气化合物对基质的亲和力,这种亲和力的大小会显著影响香气物质在气液相的转移速率[19,23]。挥发性物质在气液相的转移速率以其分配系数表征,即体系中气液相香气浓度比,也可以用来解释葡萄酒基质成分对香气物质挥发的作用[24]。有研究发现,非挥发性成分(多糖、多酚等)与香气物质之间的相互作用会影响果香酯类物质在葡萄酒中的挥发和释放[25]。在本研究中添加不同浓度的酿酒酵母多糖可以改变模拟葡萄酒体系的基质,从而影响果香酯类物质的顶空释放。本研究中,8种果香酯类物质的挥发性在不同浓度的酵母多糖基质下有不一样的表现,酵母多糖处理会显著降低乙酸酯的挥发性,最佳处理浓度为0.4—0.8 g∙L-1,但酵母多糖处理却促进了乙醇酯的挥发。TAYLOR等[26]研究报道了葡萄酒中多糖聚合物的网络矩阵可以作为一个物理屏障,抑制低疏水性香气物质的运输,因此,果香酯类物质在不同酵母多糖浓度下的挥发性表现可能与其疏水性强弱也密切相关。
3.3 酵母多糖基质下果香酯类物质的水解呈香特点
本研究中模拟葡萄酒中乙酸酯和乙醇酯在6个月的贮藏期间含量逐渐降低,说明酯类物质在发生化学水解[27],导致果香减弱。有研究发现,5—20 g∙L-1果胶处理对模拟葡萄酒贮藏期间乙酸异戊酯的含量没有显著影响,但添加糖蛋白可以减缓乙酸异戊酯含量的下降[28]。类似地,李惠琳等[29]发现在‘霞多丽’葡萄酒中添加0.2 g∙L-1酵母甘露糖蛋白MP60对‘霞多丽’葡萄酒的香气组成有积极作用。本研究中酵母多糖处理可以显著延缓模拟葡萄酒中果香酯类物质的水解,但是不同浓度水平多糖处理的延缓效果有差异,尤以0.4—0.8 g∙L-1的酵母多糖处理效果最好。葡萄酒中的果香酯类物质是果香和花香特征的重要贡献物质[18],MAO等[30]研究得出,葡萄酒的整体香气轮廓不是香气化合物含量上的简单加成,而是香气物质相互作用的复杂性协同结果。本研究中酵母多糖处理的模拟酒中果香酯类物质的水解程度受到影响,但不同浓度处理以及不同酯类物质之间存在显著差异,低浓度的多糖处理(0.4—0.8 g∙L-1)可以显著减缓乙酸酯和乙醇酯的水解,以0.4 g∙L-1的多糖处理效果最显著;而高浓度的多糖处理(1.2—2.0 g∙L-1)可以减缓乙酸酯的水解,但却促进了乙醇酯和苯衍生物的水解。与CHONG等[31]研究结果一致,本研究中多糖处理引起果香酯类物质在含量和挥发性上的差异,导致不同处理模拟酒样品的香气轮廓表现明显不同。低浓度多糖处理可以增强模拟酒中的热带水果、温带甜果、柑橘类和蜜饯类香气,而高浓度多糖处理提高了模拟酒中温带酸果和花香香气特征值。本研究从表观基质效应上分析了酵母多糖处理对果香酯类物质水解呈香的影响,但酵母多糖对酯类物质挥发与水解的作用机制还需在后续分子互作研究中作进一步探究。
4 结论
本研究利用热水浸提法、碱法从酿酒酵母中提取制备得到酵母多糖,通过仪器分析得到该多糖是一种以甘露糖(41.22%)、葡萄糖(23.03%)和蛋白质(11.20%)为主的杂多糖。利用0—2.0 g∙L-1酵母多糖处理含有果香酯类物质常规浓度的模拟葡萄酒溶液,可以降低乙酸酯的挥发性,尤以0.4—0.8 g∙L-1的酵母多糖处理效果最好。酵母多糖处理模拟酒贮藏6个月期间,分别将乙酸酯和乙醇酯的水解率降低了10%—40%和3.7%—26.7%。在酒样贮藏6个月后,多糖处理的模拟酒中温带酸果、温带甜果、蜜饯类和花香香气特征值明显高于对照。因此,在葡萄酒贮藏期间添加酿酒酵母多糖可以减缓果香酯类物质的水解,稳定葡萄酒果香,对延长产品货架期有潜在的应用价值。
[1] DIAS D A, CLARK A C, SMITH T A, GHIGGINO K P, SCOLLARY G R. Wine bottle colour and oxidative spoilage: whole bottle light exposure experiments under controlled and uncontrolled temperature conditions. Food Chemistry, 2013, 138(4): 2451-2459.
[2] CULBERT J A, MCRAE J M, CONDÉ B C, SCHMIDTKE L M, NICHOLSON E L, SMITH P A, HOWELL K S, BOSS P K, WILKINSON K L. Influence of production method on the chemical composition, foaming properties, and quality of Australian carbonated and sparkling white wines. Journal of Agricultural and Food Chemistry, 2017, 65(7): 1378-1386.
[3] Escot S, Feuilla M T, Dulau L, Charpentier C. Release of polysaccharides by yeasts and the influence of released polysaccharides on colour stability and wine astringency.Australian Journal of Grape and Wine Research,2001, 7(3): 153-159.
[4] 李华. 葡萄酒的香气. 酿酒, 1990, 17(5): 5-9.
Li H. Wine aroma. Liquor Making, 1990, 17(5): 5-9. (in Chinese)
[5] Del Barrio-Galán R, Pérez-Magariño S, Ortega- Heras M, Guadalupe Z, Ayestarán B. Polysaccharide characterization of commercial dry yeast preparations and their effect on white and red wine composition.LWT-Food Science and Technology,2012, 48(2): 215-223.
[6] LEI X Q, ZHU Y Y, WANG X Y, ZHAO P T, LIU P, ZHANG Q T, CHEN T G, YUAN H H, GUO Y R. Wine polysaccharides modulating astringency through the interference on interaction of flavan-3-ols and BSA in model wine. International Journal of Biological Macromolecules, 2019, 139: 896-903.
[7] Ribéreau-Gayon P, Dubourdieu D, Donèche B, Lonvaud A. Handbook of enology, Volume 1: The microbiology of wine and vinifications. John Wiley & Sons, 2006.
[8] KEMP B, CONDÉ B, JÉGOU S, HOWELL K, VASSEROT Y, MARCHAL R. Chemical compounds and mechanisms involved in the formation and stabilization of foam in sparkling wines. Critical Reviews in Food Science and Nutrition, 2019, 59(13): 2072-2094.
[9] Lubbers S, Voilley A, Feuillat M, Charpentier C. Influence of mannoproteins from yeast on the aroma intensity of a model wine. LWT-Food Science and Technology, 1994, 27(2): 108-114.
[10] MARTÍNEZ-LAPUENTE L, APOLINAR-VALIENTE R, GUADALUPE Z, AYESTARÁN B, PÉREZ-MAGARIÑO S, WILLIAMS P, DOCO T. Polysaccharides, oligosaccharides and nitrogenous compounds change during the ageing of Tempranillo and Verdejo sparkling wines. Journal of the Science of Food and Agriculture, 2018, 98(1): 291-303.
[11] Dubois M, Gilles K A, Hamilton J K, Rebers P A, Smith F. Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 1956, 28(3): 350-356.
[12] YIN J Y, NIE S P, ZHOU C, WAN Y, XIE M Y. Chemical characteristics and antioxidant activities of polysaccharide purified from the seeds ofL.. Journal of the Science of Food and Agriculture, 2010, 90(2): 210-217.
[13] WATRELOT A A, SCHULZ D L, KENNEDY J A. Wine polysaccharides influence tannin-protein interactions. Food Hydrocolloids, 2017, 63: 571-579.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72: 248-254.
[15] CAMELEYRE M, LYTRA G, BARBE J C. Static headspace analysis using low-pressure gas chromatography and mass spectrometry, application to determining multiple partition coefficients: a practical tool for understanding red wine fruity volatile perception and the sensory impact of higher alcohols. Analytical Chemistry, 2018, 90(18): 10812-10818.
[16] WANG X C, LI A H, DIZY M, ULLAH N, SUN W X, TAO Y S. Evaluation of aroma enhancement for “Ecolly” dry white wines by mixed inoculation of selectedand. Food Chemistry, 2017, 228: 550-559.
[17] PENG C T, WEN Y, TAO Y S, LAN Y Y. Modulating the formation of Meili wine aroma by prefermentative freezing process. Journal of Agricultural and Food Chemistry, 2013, 61(7): 1542-1553.
[18] Swiegers J H, Bartowsky E J, Henschke P A, Pretorius I S. Yeast and bacterial modulation of wine aroma and flavour. Australian Journal of Grape and Wine Research, 2005, 11(2): 139-173.
[19] Guth H, Rusu M. Food matrices-determination of odorant partition coefficients and application of models for their prediction. Food Chemistry, 2008, 108(4): 1208-1216.
[20] TAO Y S, LIU Y Q, LI H. Sensory characters ofdry red wine from Changli County (China). Food Chemistry, 2009, 114(2): 565-569.
[21] LI S Y, DUAN C Q, HAN Z H. Grape polysaccharides: Compositional changes in grapes and wines, possible effects on wine organoleptic properties, and practical control during winemaking. Critical Reviews in Food Science and Nutrition, 2023, 63(8): 1119-1142.
[22] Jones-Moore H R, Jelley R E, Marangon M, Fedrizzi B. The interactions of wine polysaccharides with aroma compounds, tannins, and proteins, and their importance to winemaking. Food Hydrocolloids, 2022, 123: 107150.
[23] GONÇALVES F, HEYRAUD A, DE PINHO M N, RINAUDO M. Characterization of white wine mannoproteins. Journal of Agricultural and Food Chemistry, 2002, 50(21): 6097-6101.
[24] ATHÈS V, PEÑA Y LILLO M, BERNARD C, PÉREZ-CORREA R, SOUCHON I. Comparison of experimental methods for measuring infinite dilution volatilities of aroma compounds in water/ethanol mixtures. Journal of Agricultural and Food Chemistry, 2004, 52(7): 2021-2027.
[25] POLÁSKOVÁ P, HERSZAGE J, EBELER S E. Wine flavor: Chemistry in a glass. Chemical Society Reviews, 2008, 37(11): 2478-2489.
[26] TAYLOR A J, BESNARD S, PUAUD M, LINFORTH R S.measurement of flavour release from mixed phase gels. Biomolecular Engineering, 2001, 17(4/5): 143-150.
[27] MAKHOTKINA O, KILMARTIN P A. Hydrolysis and formation of volatile esters in New Zealand Sauvignon Blanc wine. Food Chemistry, 2012, 135(2): 486-493.
[28] DUFOUR C, BAYONOVE C L. Influence of wine structurally different polysaccharides on the volatility of aroma substances in a model system. Journal of Agricultural and Food Chemistry, 1999, 47(2): 671-677.
[29] 李惠琳, 王婧, 许引虎, 盛文军, 李敏, 米兰. 不同酵母多糖对霞多丽干白葡萄酒品质的影响. 食品与发酵工业, 2018, 44(4): 142-153.
LI H L, WANG J, XU Y H, SHENG W J, LI M, MI L. Effects of different yeast polysaccharides on quality of chardonnay dry white wine. Food and Fermentation Industries, 2018, 44(4): 142-153. (in Chinese)
[30] Mao D S, Liu H, Li Z F, Niu Y W, Xiao Z B, Zhang F M, Zhu J C. Impact of sensory interactions among volatile compounds of juice of Red Delicious apples. Horticulture, Environment, and Biotechnology, 2020, 61(1): 197-206.
[31] CHONG H H, CLEARY M T, DOKOOZLIAN N, FORD C M, FINCHER G B. Soluble cell wall carbohydrates and their relationship with sensory attributes in Cabernet Sauvignon wine. Food Chemistry, 2019, 298: 124745.
Apparent Matrix Effect of Yeast Polysaccharides fromon the Hydrolysis of Wine Fruity Esters

1College of Enology, Northwest A & F University, Yangling 712100, Shaanxi;2Angel yeast Co., Ltd., Yichang 443003, Hubei;3Shaanxi Key Laboratory of Viticulture and Enology, Yangling 712100, Shaanxi
【Objective】The aim of this study was to investigate the apparent matrix effect of yeast polysaccharide (YP) fromon the hydrolysis of fruity ester, and to explore the potential application of yeast polysaccharide in stabilizing wine aroma profile and expand shelf life of product. 【Method】YP was extracted fromby hot water extraction and alkali methods, and the basic components of YP were analyzed by ultraviolet spectrophotometer (UV), gas chromatography (GC) and high- performance liquid chromatography (HPLC). The model wine containing the conventional concentration of fruity esters was prepared and treated with YP, and the concentration of YP was set in the range of 0-2.0 g·L-1. The effect of YP on the volatility of fruity esters was analyzed by the static headspace method. Next, the model wines with different treatments were stored at 4℃ for 6 months, and the content of fruity esters in model wine was regularly monitored. Finally, sensory analysis was used to evaluate the aroma notes of model wine stored 6-months. 【Result】Instrumental analysis showed that the total polysaccharide content of YP was (72.61±3.29)%, and the protein contents accounts for (11.20±0.02)%. The main monosaccharide composition of YP was mannose and glucose, and their molar ratio was 1.790:1. The high molecular weight components of YP are 18, 163 and 21 819 kD, and the low molecular weight components are 576 Da. Static headspace analysis indicated that YP treatment could reduce the volatility of acetate esters in model wine, especially 0.8 g∙L-1. While YP treatment could increase the volatility of ethyl esters. Data of regular sampling found that the hydrolysis rate of ethyl esters was significantly higher than that of acetate esters during 6 months storage. Compared with the control, 0.4-0.8 g∙L-1YP slowed down the hydrolysis of acetate esters and ethyl esters by 10%-40% and 3.7%-26.7%, respectively. Sensory analysis showed that model wine added with YP showed higher MF% of temperate sour and sweet fruity, and preserved fruit and floral aroma notes of wine samples compared with the control. 【Conclusion】From the study of model wine system, it was concluded that adding 0.4-0.8 g∙L-1YP during wine storage slowed down the hydrolysis of fruity esters, stabilized wine fruity aroma profile, and showed potential application value for prolonging wine shelf life.
yeast polysaccharides; fruity esters; hydrolysis; matrix effect

10.3864/j.issn.0578-1752.2023.06.012
2022-05-25;
2022-09-05
国家自然科学基金(31972199)、陕西省杰出青年基金(2020JC-22)
孔彩琳,E-mail:kongcailin@nwafu.edu.cn。通信作者陶永胜,E-mail:taoyongsheng@nwafu.edu.cn
(责任编辑 赵伶俐)
