采后外源脱落酸处理对雾培微型马铃薯周皮木栓化的影响及其机理
2023-04-11张志鹏谭芸秀李宝军李永才毕阳李守强王小晶张宇胡丹
张志鹏,谭芸秀,李宝军,李永才,毕阳,李守强,王小晶,张宇,胡丹
采后外源脱落酸处理对雾培微型马铃薯周皮木栓化的影响及其机理

1甘肃农业大学食品科学与工程学院,兰州 730070;2甘肃省农业科学院农产品贮藏加工研究所,兰州 730070;3甘肃省种子总站,兰州 730070

雾培微型薯;脱落酸;木栓化;苯丙烷代谢;活性氧代谢
0 引言
【研究意义】马铃薯(L.)属茄科一年生草本植物,是重要的粮菜兼用作物,其加工用途多,产业链条长,在保障粮食安全和农业产业转型升级中发挥着至关重要的作用[1]。但马铃薯在种植生产中易受病虫害的侵袭和非生物胁迫影响,轻则减产,重则绝产[2],严重影响了农业发展和农民的经济收入。马铃薯属无性繁殖作物,优质种薯可以减轻在种植过程中造成的损失,保障马铃薯稳产增收。目前,国内主要采用基质栽培法、水培法、雾培法生产马铃薯种薯,而雾培法是近几年生产马铃薯种薯的一种新型无土栽培技术,生产自动化程度高,不受气候的限制,可以全年全季进行种薯生产[3]。另外,雾培马铃薯结薯率高,由于生产中不需土壤覆盖,有效降低了存在于土壤中的病菌、病毒以及虫害的侵害,使种薯的质量和活力得到保障,因此被广泛应用于马铃薯原原种的生产[4]。但由于雾培马铃薯块茎生长在密闭保湿空间中,且定期喷洒营养液,导致块茎采收前一直处于高湿度的环境中,使块茎体内含水量较高,皮孔较大,表皮脆嫩,采收后极易擦伤,使表皮遭到破坏形成伤口,导致块茎采后失水和病原物侵染,造成块茎采后腐烂损失严重。因此,研发适于雾培微型马铃薯种薯采后周皮快速木栓化的方法,在保持采后种薯品质和活力方面具有重要作用。【前人研究进展】周皮木栓化指在适宜条件下,木栓质在植物周皮细胞壁或植物表面损伤部位细胞壁上沉积而形成的生物学过程[5]。而周皮细胞发生木栓化后,细胞不透水、不透气,可以有效地避免果蔬采后或创伤后体内水分和养分的流失,并且可以阻止外界病原菌及非生物胁迫对果实的二次损害。马铃薯采后在适宜环境条件下,块茎表皮发生木栓化形成周皮组织,有效避免了块茎采后因失水和病原物入侵而造成的损失,保持了块茎采后的品质[6]。而大多数农户通常将马铃薯块茎采摘后在自然条件下进行晾晒,以此来完成周皮木栓化过程,通常需要3—4周时间;长时间露天晾晒不仅会增加块茎体内龙葵素的含量,使块茎出现变绿现象并影响食用安全;而且容易遭受突变低温,造成马铃薯冷害。同时受环境条件影响会导致部分块茎周皮木栓化无法完全形成,为病原菌入侵提供了通道造成块茎腐烂,使贮藏期间块茎的腐烂率高居不下,且影响种薯的活力[7]。脱落酸(abscisic acid,ABA)是一种重要的半萜类植物激素,可以调控植物果实采后的抗逆性过程,目前在果蔬采后保鲜方面也得到了广泛应用[8]。而在采后使用外源脱落酸处理会加速马铃薯块茎周皮木栓化进程,有效地降低块茎在采后贮藏期间的损失。研究发现,采后使用外源ABA浸泡马铃薯块茎,能促进块茎周皮组织中聚酚软木脂(suberin polyphenolic,SPP)和聚酯软木脂(suberin polyaliphatic,SPA)的积累,提高块茎的早期抗病能力[9]。李雪等[10]研究表明,采后外源ABA处理马铃薯块茎可以促进酚类物质的合成,激活块茎愈伤组织中苯丙氨酸解氨酶(phenylalnine ammonia-lyase, PAL)和过氧化物酶(peroxidase,POD)活性,加速软木脂的聚合,促进马铃薯块茎伤口周皮的形成。外源ABA处理猕猴桃果实,激活了愈伤组织的苯丙烷代谢,通过提高PAL、肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)和POD的活性来刺激损伤部位细胞发生木栓化,从而加速受伤猕猴桃果实的伤口愈合[11]。陶晓亚等[12]研究发现采后使用外源ABA处理‘新太阳’番茄果实,促进了果实愈伤组织细胞中木栓质的合成,提高了愈伤组织中POD、超氧化物歧化酶(super oxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性,从而加速了采后番茄果实的伤口愈合。张一冉等[13]研究发现采后ABA处理李果实后,激活了果实愈伤组织中还原型辅酶Ⅱ(NADPH oxidase,NOX)、SOD、CAT酶活性,维持活性氧代谢的平衡,加速了果实采后伤口木栓化形成愈伤组织,保持了果实采后的品质。【本研究切入点】虽然已有研究表明外源ABA处理可以促进采后果蔬周皮细胞发生木栓化,加速伤口愈合,但采后使用外源ABA处理雾培微型马铃薯,加速块茎周皮木栓化进程及其调控机理尚未揭示。【拟解决的关键问题】本研究以‘通薯1号’雾培微型马铃薯为研究对象,使用外源ABA浸泡处理后,于15℃(RH86%—88%)黑暗环境下进行预贮,通过测定贮藏期间块茎的失重率、观察软木脂和木栓质在块茎周皮组织中的沉积过程,分析块茎周皮组织中苯丙烷和活性氧代谢相关酶活性的变化,探讨使用外源ABA处理促进采后雾培微型马铃薯块茎周皮木栓化的机理,为采后雾培微型马铃薯块茎快速完成周皮木栓化提供理论依据和技术支持。
1 材料与方法
试验于2021年在甘肃农业大学果蔬采后生物学技术实验室进行。
1.1 材料与试剂
供试材料‘通薯1号’原原种于2021年7月23日采自甘肃定西市马铃薯研究所,当日运抵实验室,在(4±2)℃下贮藏待用。
丙酮、氯化铝、盐酸羟胺、溴乙酰,国药集团;中性红、甲苯胺蓝、2-甲氧基酚,上海泽叶生物科技有限公司;-巯基乙醇,武汉荣恩伟业化工有限公司;L-苯丙氨酸、-香豆酸,南京聚辉化学试剂公司;F8010 Folin-Phenol、Triton X-100及苯丙烷关键酶提取液,上海源叶有限公司。
1.2 仪器与设备
LRH-105F型恒温培养箱,深圳市奥德玛电子科技有限公司;DW-86L416G型超低温冰箱,青岛海尔股份有限公司;KH20R-II低温高速离心机,湖南凯达仪器有限公司;U-LH100-3型荧光显微镜,西安华宏光电科技有限公司;UV-5BIO型紫外分光光度计,梅特勒科技有限公司;MULTISKA-FC型酶标仪,赛默飞世尔仪器有限公司;DDS-307A型电导仪,上海雷磁仪器有限公司。
1.3 试验方法
1.3.1 ABA溶液配制 参考李雪等[10]的方法并稍作修改。用纯度为99%的外源ABA粉末,配制成浓度分别为25、50和100 mg·L-1的稳定溶液,低温避光保存待用。
1.3.2 块茎处理 块茎回温24 h,挑选大小均匀、无损伤的雾培微型马铃薯块茎,用1.5%的次氯酸钠溶液清洗消毒2—3 min后,用自来水再冲洗一遍,晾干。然后将块茎分别浸入不同浓度的ABA溶液中浸泡处理10 min,取出自然晾干,按处理浓度分别装入黑色聚乙烯塑料袋中,在温度为15℃、环境湿度为86%—88%的条件下进行贮藏。每组处理使用雾培微型马铃薯块茎200个,以清水浸泡作为对照组。在块茎贮藏的第0、1、3、5、7、14和21天进行取样分析。
1.3.3 周皮木栓化效果评价
1.3.3.1 失重率的测定 采用称重法。每个处理用3个块茎,重复9次。
1.3.3.2 软木脂和木质素沉积的观察 聚酚软木脂(suberin polyphenolic,SPP)、聚酯软木脂(suberin polyaliphatic,SPA)和木质素的沉积参照张志鹏等[14]的方法,进行染色拍照观察。拍摄得到的照片参照VAN OIRSCHOT等[15]的方法,使用IS Capture软件对块茎周皮组织细胞中软木脂和木质素的沉积厚度进行量化分析。
1.3.4 生化取样 参照JIANG等[16]的方法并修改。以块茎愈伤的第0、1、3、5、7、14和21天为时间点,刮取块茎表面及以下2—3 mm的周皮组织,迅速放入液氮中冷冻,研磨成粉末状保存于-80℃待测。
1.3.5 木质素、总酚、类黄酮含量的测定 木质素、总酚、类黄酮的含量参照张志鹏等[14]的方法进行提取测定,木质素含量以OD280·g-1FW表示,总酚含量以GAE mg/100 g FW表示,类黄酮含量以CE mg/100 g FW表示。
1.3.6 苯丙烷代谢关键酶活性的测定 PAL活性的测定参照张志鹏等[14]的方法,以U∙h-1∙g-1FW表示。
4-香豆酸辅酶A连接酶(4-coumarate coenzyme A ligase,4CL)活性的测定参照VOO等[17]的方法,以U∙min-1∙g-1FW表示。
肉桂酸-4-羟化酶(Cinnamic acid 4-hydroxylase,C4H)活性测定参照LAMB等[18]的方法,以U∙min-1∙g-1FW表示。
CAD活性参照GOFFNER等[19]的方法,以U·min-1·g-1FW表示。
1.3.7 细胞膜透率和丙二醛含量的测定 细胞膜透率的测定参照REN等[20]的方法。将块茎分割为1 cm×0.5 cm×0.5 cm左右的长方体组织,去离子水冲洗3遍后,浸泡3 h(25℃),用电导仪记录起始值E0和终止值E1。沸水浴30 min,置于冰上进行冷却,测定电导率E2。计算公式为:细胞膜渗透率(%)=(E1-E0)/ E2×100。
MDA含量的测定参照REN等[20]的方法并修改。称取1 g冷冻样品,加入3 mL 5% TCA,浸提10 min后在4℃,8 000×离心30 min。分离上清液2 mL,加入2 mL 0.67%的TBA,90—95℃水浴30 min。用自来水冷却后,分别测定波长在600、450和532 nm的混合液OD值。MDA含量=[6.45×(OD532-OD600)- (0.56×OD450)]×Vt×Vr/(Vs×m)。Vt、Vr和Vs分别表示反应体系中提取液、反应混合物溶液和提取液的总体积,m表示样品质量。MDA含量以µmol∙mg-1FW表示。

1.3.9 ROS代谢关键酶活性的测定 NOX、SOD、CAT活性用苏州科铭生物试剂盒,测定波长在600 nm(NOX)、560 nm(SOD)和240 nm(CAT)处吸光值,酶活性按样品质量计算,NOX和SOD活性以U∙g-1FW表示,CAT活性以nmol∙min-1∙g-1FW表示。
POD活性的测定参照张志鹏等[14]的方法,以ΔOD470∙min-1∙g-1FW表示。
1.3.10 AsA-GSH循环代谢酶活性的测定 抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)、脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)、谷胱甘肽还原酶(glutathione reductase,GR)活性用苏州科铭生物试剂盒测定。测定波长在290 nm(APX)、340 nm(MDHAR)、265 nm(DHAR)和340 nm(GR)处吸光值,酶活性按样品质量计算,APX、MDHAR、DHAR、GR活性均以nmol∙min-1∙g-1FW表示。
1.3.11 AsA-GSH循环底物含量的测定 抗坏血酸(ascorbic acid,ASA)、脱氢抗坏血酸(dehydroascorbate,DHA)、还原型谷胱甘肽(reduced glutathione,GSH)、氧化型谷胱甘肽(glutathione,GSSG)的含量用苏州科铭生物试剂盒测定。测定波长在420 nm(ASA)、265 nm(DHA)和412 nm(GSH和GSSG)处吸光度值,含量按样品质量计算,ASA含量以μg∙g-1FW表示,DHA含量以nmol∙g-1FW表示,GSH和GSSG含量以µmol∙g-1FW表示。
1.4 数据分析
每一项指标至少重复测定3次。使用 Microsoft Excel 2010进行结果计算、SPSS Statistics 25显著性差异分析、Origin2018进行图表绘制(<0.05)。
2 结果
2.1 ABA处理对雾培微型马铃薯块茎贮藏期间失重率的影响
随着贮藏时间的延长,马铃薯块茎的失重率均逐渐上升,但ABA处理的块茎失重明显低于对照(图1)。其中25 mg∙L-1ABA处理块茎的失重率显著低于其他浓度处理的块茎,第7天时,25 mg∙L-1ABA处理块茎的失重率分别较50和100 mg∙L-1ABA处理和对照块茎低40.94%、27.31%和65.59%(<0.05),表明25 mg∙L-1ABA处理能有效控制采后块茎木栓化期间的失重率。
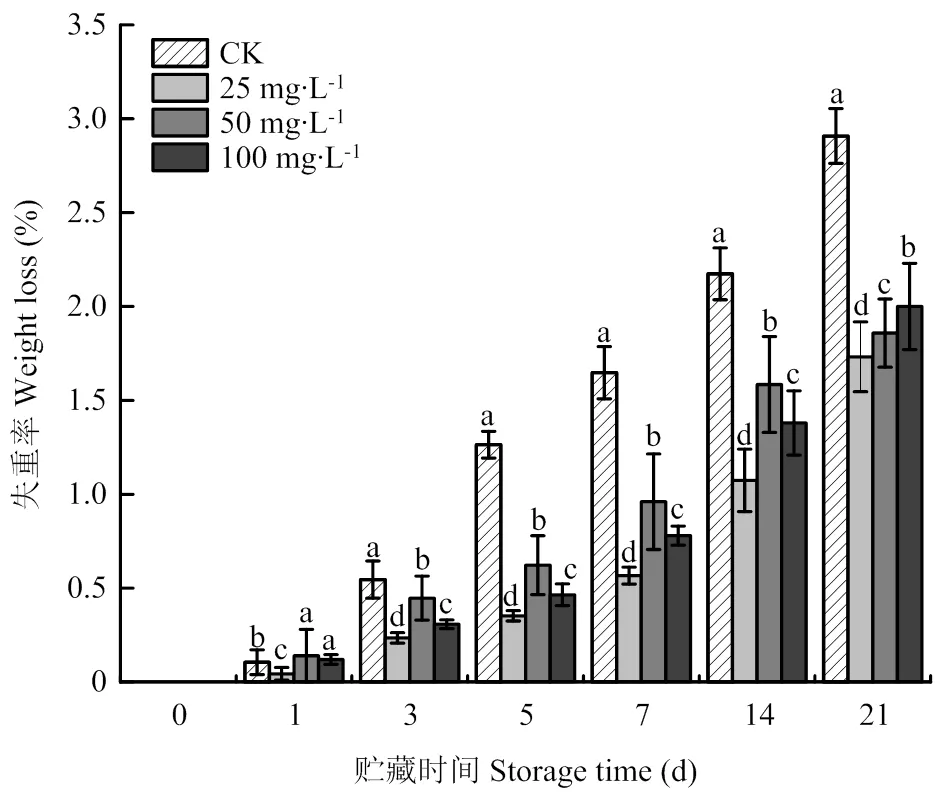
不同字母表示同一贮藏时间不同组别差异显著(P<0.05)。下同
2.2 ABA处理对雾培微型马铃薯块茎贮藏期间周皮处软木脂沉积的影响
ABA处理能促进块茎周皮细胞中SPP和SPA积累(图2-A、B)。其中25 mg∙L-1ABA处理的块茎,贮藏期间周皮中软木脂的积累量显著高于其他处理,第21天时,25 mg∙L-1ABA处理块茎的SPP积累量,分别较50和100 mg∙L-1ABA处理和对照块茎高23.84%、20.32%和27.50%(<0.05)(图3-A),25 mg∙L-1ABA处理块茎的SPA积累量也显著高于其他处理(图3-B)。贮藏期间,木栓质的积累速度和积累量也随贮藏时间的延长逐渐增加(图2-C,图3-C),在第21天时,25 mg∙L-1ABA处理块茎的木栓质积累量,分别较50和100 mg∙L-1ABA处理和对照块茎高15.16%、13.99%、19.02%(<0.05)(图3-C)。
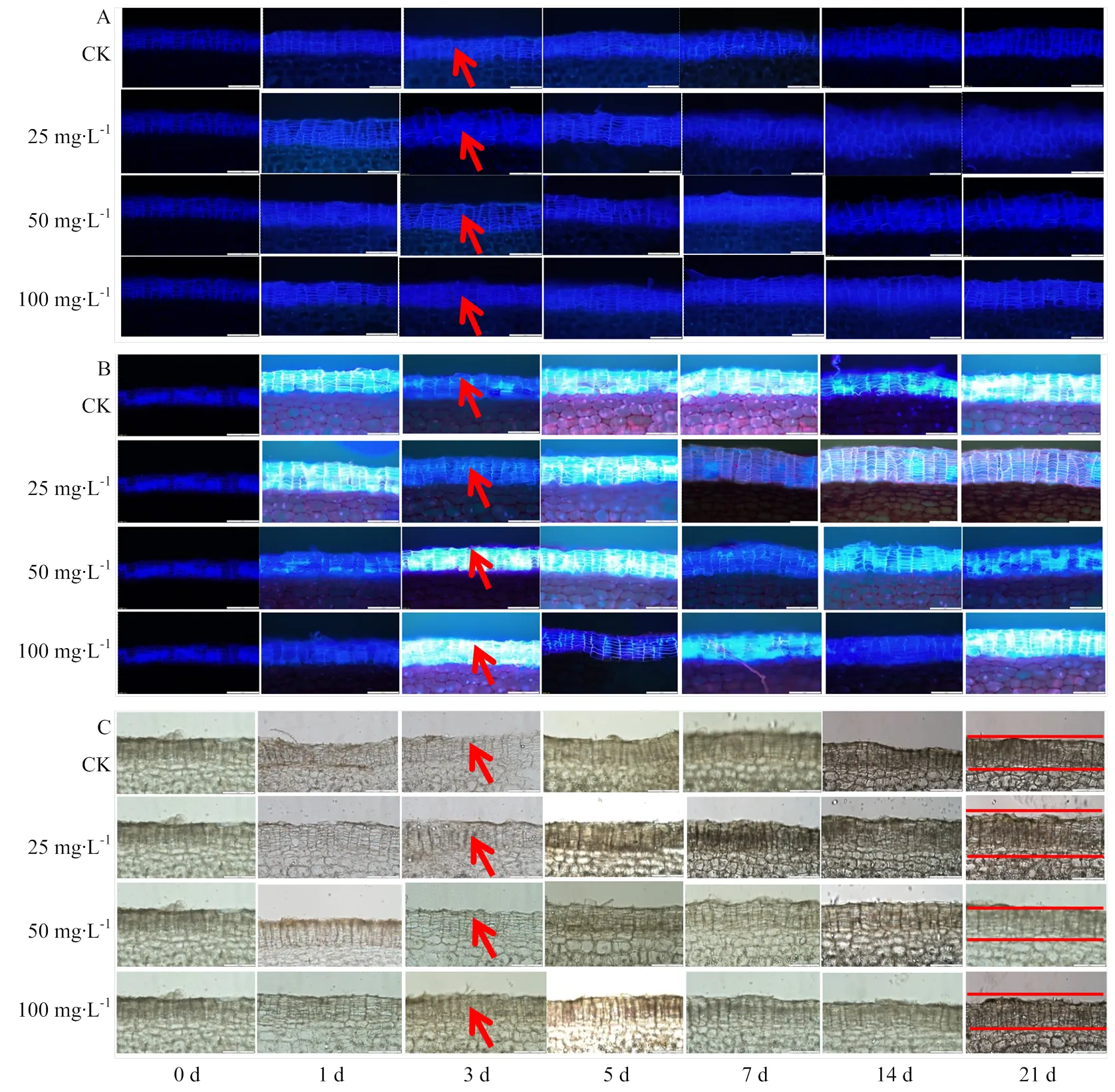
图2 ABA处理对贮藏期间块茎周皮处SPP(A)、SPA(B)和木质素(C)积累的影响(箭头所指为SPP、SPA和木栓化沉积,比例尺:200 μm)
2.3 ABA处理对雾培微型马铃薯块茎周皮组织中木质素含量的影响
贮藏期间,块茎周皮组织中木质素的含量随贮藏时间的延长而持续增加(图4)。ABA处理块茎周皮组织中木质素含量显著高于对照,第21天时,比对照高6.13%(<0.05)。

不同小写字母表示差异显著(P<0.05)

*表示同一贮藏时间不同组别差异显著(P<0.05)。下同
2.4 ABA处理对雾培微型马铃薯块茎周皮组织中总酚类黄酮含量的影响
总酚和类黄酮的积累反映了苯丙烷代谢途径次生代谢物的生物合成。贮藏期间,块茎周皮组织中总酚和类黄酮的含量逐渐积累(图5)。其中ABA处理块茎总酚和类黄酮的积累量显著高于对照。第14天时,总酚含量比对照高13.96%(<0.05)(图5-A),类黄酮含量比对照高20.37%(<0.05)(图5-B)。
2.5 ABA处理对雾培微型马铃薯块茎周皮组织中苯丙烷代谢关键酶的影响
贮藏期间,块茎周皮组织中PAL、4CL、C4H和CAD的活性均逐渐升高(图6)。其中经ABA处理的块茎周皮组织中PAL活性显著高于对照,贮藏第21天时,高于对照79.02%(<0.05)(图6-A)。4CL活性呈先上升后下降的趋势,但始终高于对照,在贮藏第3天时,比对照高4.78%(<0.05)(图6-B)。而C4H和CAD活性随贮藏时间的延长,处理块茎均显著高于对照,在贮藏第21天,C4H活性高于对照12.99%(图6-C)(<0.05),CAD活性比对照高11.54%(图6-D)(<0.05)。
2.6 ABA处理对雾培微型马铃薯块茎周皮组织细胞膜透率和MDA含量的影响
贮藏期间,各处理块茎周皮处的细胞膜透率均呈上升趋势(图7-A),ABA处理块茎的细胞膜透率显著低于对照。第21天时,处理块茎的细胞膜透率低于对照22.13%(<0.05)。各处理块茎周皮处的MDA含量呈逐渐下降的趋势(图7-B),处理显著低于对照。第21天,处理块茎周皮处的MDA含量比对照低11.14%(<0.05)。

图5 ABA处理对贮藏期间块茎周皮处总酚(A)和类黄酮(B)含量的影响

图7 ABA处理对贮藏期间块茎周皮处细胞膜透率(A)和MDA含量(B)的影响
2.7 ABA处理对雾培微型马铃薯块茎周皮组织中的H2O2和含量的影响
H2O2和的积累反映了块茎贮藏期间ROS代谢水平,贮藏期间,块茎周皮组织中H2O2含量随贮藏时间的延长而积累量增加(图8-A),处理块茎显著高于对照,第21天时达到峰值,高于对照67.37%(<0.05)。而块茎周皮组织中含量随贮藏时间的延长,前期迅速升高,中期趋于平稳,在末期又呈下降趋势(图8-B),但贮藏期间ABA处理块茎的含量显著高于对照,第14天时,比对照高7.69%(<0.05)。
2.8 ABA处理对雾培微型马铃薯块茎周皮组织中ROS代谢关键酶活性的影响
贮藏期间,块茎周皮组织中ROS代谢关键酶活性均呈上升状态,其中块茎周皮组织中NOX活性被激活,随贮藏时间的延长,酶活性显著升高(图9-A)。ABA处理显著提高了块茎周皮组织处的NOX活性,21 d时,高于对照47.33%(<0.05)。块茎周皮组织中的SOD活性也随处理时间的延长而逐渐上升(图9-B),第21天,处理SOD活性高于对照8.61%(<0.05)。块茎周皮处CAT活性呈先升高后下降的趋势(图9-C);处理显著高于对照,峰值出现在愈伤第7天,处理高出对照30.43%(<0.05)。贮藏期间,块茎周皮组织中的POD活性随贮藏时间的延长而逐渐升高(图9-D),ABA处理显著提高了POD活性。贮藏第21天,处理块茎的POD活性高于对照14.50%(<0.05)。
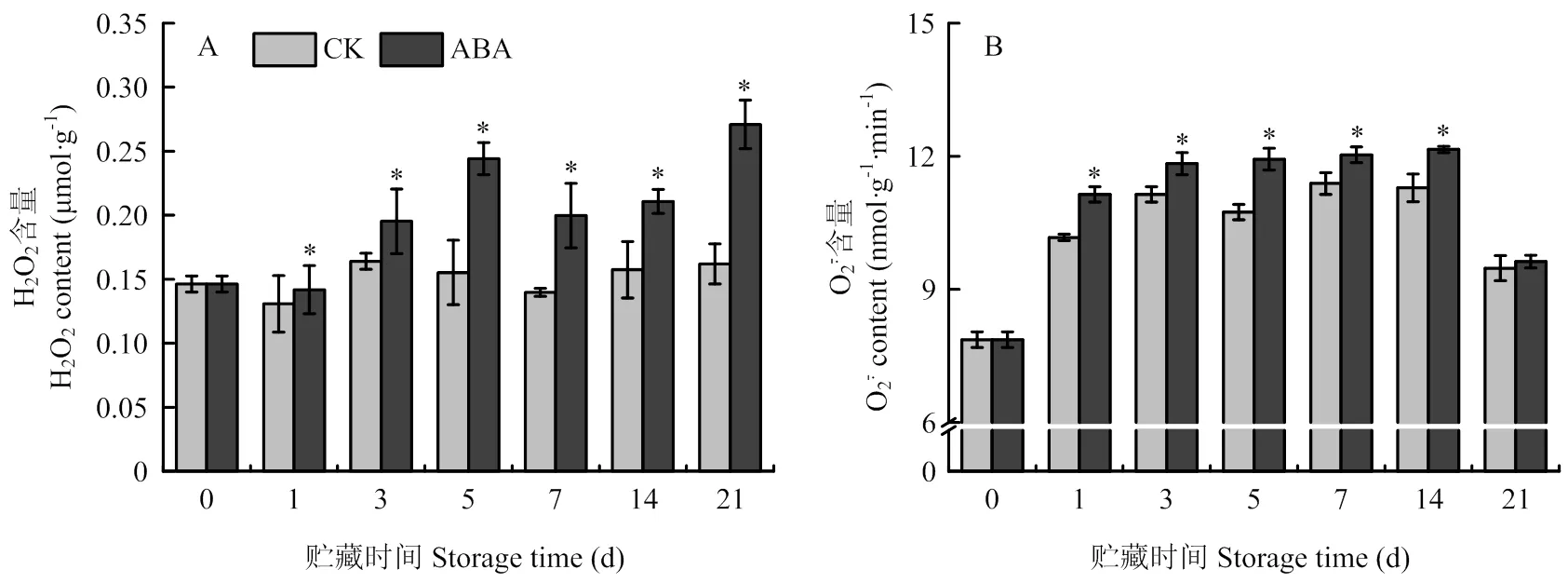
图8 ABA处理对贮藏期间块茎周皮处H2O2(A)和 (B)含量的影响

图9 ABA处理对贮藏期间块茎周皮处NOX(A)、SOD(B)、CAT(C)和POD(D)活性的影响
2.9 ABA处理对雾培微型马铃薯块茎贮藏期间AsA-GSH循环酶活性的影响
APX、MDHAR、DHAR和GR是AsA-GSH循环的关键酶。贮藏期间,块茎周皮组织中APX的活性随贮藏时间的延长先升高后下降再升高(图10-A)。贮藏前期,对照显著高于处理,到贮藏14 d,ABA处理显著提高了块茎周皮组织处APX的活性,处理高于对照44.64%(<0.05)。块茎周皮组织中MDHAR活性在处理期间逐渐上升(图10-B)。除第1天外,处理显著高于对照,第14天达到峰值,高于对照8.99%(<0.05)。期间块茎周皮处DHAR活性逐渐升高(图10-C)。处理均高于对照,在贮藏第14天活性最高,高于对照17.21%(<0.05)。而块茎周皮组织中GR的活性随贮藏时间的延长呈先升高再下降的趋势(图10-D),除第21天外,处理均高于对照。愈伤第5天出现峰值,高于对照54.24%(<0.05)。

图10 ABA处理对贮藏期间块茎周皮处APX(A)、MDHAR(B)、DHAR(C)和GR(D)活性的影响
2.10 ABA处理对雾培微型马铃薯块茎贮藏期间AsA-GSH循环相关物质含量影响
ASA、DHA、GSH和GSSG含量的高低反映组织的氧化还原水平。贮藏期间,块茎周皮组织中ASA的含量随贮藏时间的延长而逐渐积累(图11-A)。ABA处理显著提高了块茎周皮组织处ASA的含量,第14天时,高于对照7.31%(<0.05)。块茎周皮组织中DHA的含量呈现先升高后下降再升高的趋势(图11-B)。除第1天外,对照均高于处理,贮藏第14天时,处理低于对照25.00%(<0.05)。贮藏期间,块茎周皮处GSH含量逐渐升高(图11-C),处理均高于对照,第21天,高于对照21.89%(<0.05)。而块茎周皮组织中GSSG的含量随贮藏时间的延长呈下降的趋势(图11-D),除第7天外,处理显著低于对照;贮藏第21天,处理块茎的GSSG活性低于对照45.76%(<0.05)。

图11 ABA处理对贮藏期间块茎周皮处ASA(A)、DHA(B)、GSH(C)和GSSG(D)含量的影响
3 讨论
3.1 苯丙烷代谢在果蔬采后周皮木栓化过程中的作用
作为植物生长发育过程中重要的“胁迫激素”,ABA对采后果蔬抗逆性的调控具有重要的作用[21]。苯丙烷代谢在果蔬采后愈伤或周皮组织木栓化进程中具有重要作用[10]。总酚和类黄酮作为木栓化过程中一种重要的次生代谢产物,具有专一的抗菌性,在阻止外界病原菌侵染果实的过程中发挥了重要的作用[22-23]。木质素是苯丙烷途径重要的次生代谢产物,结合果蔬组织中的多糖,沉积在伤口周围细胞壁上,使伤口细胞壁的机械强度增加,有效降低了组织失水且防止了真菌病原物的侵染[24]。本研究发现,采后外源ABA处理促进了雾培微型马铃薯块茎贮藏期间周皮组织中总酚、类黄酮以及木质素等次生代谢物的积累,加速了采后块茎伤口周皮木栓化的形成。李雪等[10]研究发现采后外源ABA处理‘陇薯3号’马铃薯块茎,促进了周皮伤口部位细胞中软木脂和木质素的积累,总酚和类黄酮的含量也显著增加,加速了采后块茎的伤口木栓化进程,与本研究结果相似。PAL是苯丙烷代谢的关键酶,催化L-苯丙氨酸生成反式肉桂酸,为形成块茎伤口木栓层的聚酚醛类(SPP)或聚芳香类(SPA)提供了底物,加速了伤口周皮的形成[5]。且SPP和SPA具有专一的抗菌性,SPP可以抵抗细菌类病原菌对块茎的侵染,SPA可以抵抗真菌性病原菌块茎的侵染[25]。KUMAR等[9]研究表明,采后外源ABA处理可以显著提高马铃薯块茎愈伤组织中PAL的酶活性,加速酚类物质和芳香类的生成,促进采后马铃薯块茎伤口周皮木栓化的形成,与本研究结果类似。C4H是参与苯丙烷代谢途径的第一个氧化反应的关键酶,催化反式肉桂酸氧化生成P-香豆酸,为木质素和类黄酮等次生代谢物的合成提供了前体物质[26]。BENVENISTE等[27]研究发现采后菊芋块茎在贮藏期间的C4H活性呈上升趋势,显著高于刚采收的块茎,本研究也得到一致的结论。4CL是苯丙烷代谢最后一步反应的关键酶,催化酚酸单体转化成相应的酚酸–CoA,为木质素合成途径提供底物[28]。在4CL的催化作用下,苯丙烷代谢分别向各次生代谢分支途径转折,生成总酚、类黄酮、木质素等次生代谢物[29]。CAD是木质素合成途径中的限速酶,催化香豆醛等芳香类物质生成相应的醇单体和脂肪酸单体,然后在POD和H2O2的作用下发生氧化铰链聚合反应生成木质素和软木脂[30-31]。研究发现,采后甘薯块茎贮藏过程中,CAD活性显著提高,周皮组织中木质素的含量也显著增加,从而加速了甘薯块茎采后木栓化进程[32]。本研究发现采后使用外源ABA浸泡雾培微型马铃薯块茎,显著提高了块茎中C4H、4CL和CAD活性,加速了采后块茎周皮木栓化进程。
3.2 活性氧代谢在果蔬采后周皮木栓化过程中的作用
活性氧代谢是果蔬采后周皮木栓化形成过程中必不可少的途径,ROS的产生不仅能作为信号分子传递愈伤信号提高相关酶活性,而且参与了伤口周皮中软木脂和木质素的形成,在果蔬采后周皮木栓化期间发挥了重要的作用[33]。采后果蔬木栓化期间体内的ROS主要来源于NOX途径,在NOX途径的作用下将果蔬体内的O2还原为,而存活时间较短,随后被SOD歧化产生为相对稳定的H2O2[34]。随着H2O2的积累,CAT的活性被激活,CAT是果蔬体内清除H2O2的重要酶,在CAT的作用下,果蔬体内多余的H2O2还原成H2O和O2[35]。POD是果蔬损伤细胞发生木栓化加速形成愈伤组织的关键酶,不仅参与了反式肉桂酸前期的催化形成酚单体,而且在H2O2的作用下通过氧化交联的方式,使愈伤组织中生成的酚类单体和芳香类物质聚合生成软木脂和木质素,沉积在块茎周皮组织细胞壁上,加速周皮组织细胞的栓化进程,形成愈伤周皮[36]。张一冉等[13]研究发现采后使用ABA处理李果实后,果实体内活性氧代谢相关酶NOX、SOD、CAT和POD的活性均显著提高,促进了李果实采后周皮伤口愈合。BAJJI等[37]研究报道,采后马铃薯块茎伤口愈合过程中,激活了块茎周皮栓化组织中活性氧代谢,使块茎周皮组织中的H2O2与POD活性提高,加速了块茎周皮栓化组织中SPP的聚合,促进了采后早期马铃薯的栓化进程。陶晓亚等[12]研究发现,采后使用外源ABA处理‘新太阳’番茄果实,提高了番茄果实中POD、SOD和CAT酶活性,清除了果实体内多余的ROS,维持了果实体内活性氧平衡,加速了番茄采后愈伤。本研究发现,采后外源ABA处理激发了雾培微型马铃薯块茎周皮组织中的活性氧代谢,提高了块茎周皮组织中NOX、SOD、CAT和POD的活性,促进了和H2O2合成并有效清除了多余的ROS,使贮藏期间周皮组织中的ROS处于动态平衡,从而有效地促进了雾培微型马铃薯块茎采后周皮木栓化进程,与上述研究结果一致。果蔬采后愈伤期间,细胞膜透率可以反映活性氧对周皮组织细胞膜膜脂氧化的程度,可通过测定细胞膜透率来量化细胞膜的抗氧化程度[38]。ROS积累过多,会激活脂氧合酶和磷脂酶的活性,加快细胞膜膜脂氧化,导致果实体内多不饱和脂肪酸被降解,膜通透性增大[33]。果蔬采后周皮木栓化激活了周皮组织内活性氧代谢,加速果蔬体内ROS的积累,而ROS积累过多导致细胞膜膜脂过氧化,形成MDA等超氧化物,使果蔬体内MDA含量迅速上升。本研究发现,采后外源ABA处理雾培微型马铃薯块茎激活了采后块茎周皮组织中的活性氧途径和抗氧化系统,使周皮组织中的ROS处于动态平衡状态,有效降低了块茎周皮组织中MAD的含量,并且有效保护了周皮组织细胞的细胞膜不受氧化破坏,促进了马铃薯块茎采后的木栓化程度。陶晓亚等[12]研究发现采后外源ABA处理番茄果实降低了愈伤期间果实体内MDA的含量和体内细胞的细胞膜透率,促进了番茄果实愈伤进程,与本研究结果相似。
3.3 AsA-GSH循环相关酶活性对果蔬采后周皮木栓化的影响
APX、DHAR、GR和CAT等都是植物体内主要的抗氧化酶,这些酶活性的升高或下降可以反映植物体内抗氧化水平[39]。当果蔬体内ROS的积累量过多时,激活ASA-GSH循环的防御活性,在APX、DHAR和GR等抗氧化酶的作用下将积累多余的ROS直接氧化生成ASA、DHA、GSH和GSSG等相应的氧化还原底物[40]。在ASA-GSH循环中,由NOX途径产生而积累过多的H2O2在APX的催化作用下生成H2O和MDHA,而生成的MDHA在MDHAR的氧化作用下生成DHA,DHAR又催化DHA转化为AsA,GSH在DHAR作用下转变为GSSG,GSSG在GR和NADPH作用下最终被还原为GSH[41],由此可知果实体内抗氧化酶在ROS的防御系统中具有非常重要的作用。本试验中采后外源ABA处理激活了AsA-GSH循环,提高了块茎周皮组织中APX、MDHAR、DHAR和GR的活性及增加了ASA、DHA、GSH和GSSG等相应的氧化还原底物的含量,参与了采后雾培微型马铃薯块茎木栓化过程中ROS的产生和清除过程,使采后块茎在周皮木栓化过程中的周皮组织中ROS水平处于动态平衡,能有效促进块茎采后周皮形成且保障组织细胞不受伤害。在果蔬采后愈伤过程中或采后周皮木栓化过程中,由于活性氧代谢被激活使果蔬体内抗氧化酶的活性总体都显著提高,但各种抗氧化酶互相之间的变化趋势并不完全一致,这并不影响不同抗氧化酶参与果实体内ROS的调控。本研究发现外源ABA处理后,采后块茎周皮组织中APX和CAT的活性随着贮藏时间的延长总体呈上升状态,虽然这两种酶的变化趋势与H2O2的变化趋势并不完全相同,但是这两种酶都参与了采后块茎周皮木栓化过程中活性氧的清除。而这一变化与段园园等[42]研究采后外源ABA处理锁阳茎切口木栓化及体内抗氧化酶活性变化的结果一致,推测采后雾培微型马铃薯块茎周皮组织木栓化过程中,AsA-GSH循环防御系统的激活发挥了重要的作用。
4 结论
采后25 mg∙L-1外源ABA处理能有效控制采后雾培微型马铃薯块茎的失重,促进块茎周皮组织处软木脂和木质素的积累,并且激活了块茎周皮组织处苯丙烷和活性氧代谢,提高了PAL、4CL、C4H和CAD酶活性;增加了总酚、类黄酮的含量,降低了雾培微型马铃薯块茎采后周皮木栓化组织中细胞膜透率和MDA含量;激活了块茎周皮组织处NOX活性,促进了H2O2和的合成,同时提高了SOD、POD和CAT的活性;激活了块茎体内AsA-GSH循环,清除了周皮组织处过量的ROS,降低了膜脂过氧化,维持了细胞膜的完整性,促进了采后雾培微型马铃薯块茎周皮组织木栓化的进程。
[1] 荐红举, 张梅花, 尚丽娜, 王季春, 胡柏耿, Vadim Khassanov, 吕典秋. 利用WGCNA筛选马铃薯块茎发育候选基因. 作物学报, 2022, 48(7): 1658-1668.
JIAN H J, ZHANG M H, SHANG L N, WANG J C, HU B G, KHASSANOV V, LÜ D Q. Screening candidate genes involved in potato tuber development using WGCNA. Acta Agronomica Sinica, 2022, 48(7): 1658-1668. (in Chinese)
[2] 陈巧玲, 程群, 高剑华, 徐怡, 叶兴枝, 陈火云. 气雾栽培在脱毒马铃薯生产应用中的研究进展. 湖北农业科学, 2019, 58(S2): 58-60.
CHEN Q L, CHENG Q, GAO J H, XU Y, YE X Z, CHEN H Y. Advances in research on aeroponics culture in the production of potato virus-free seed. Hubei Agricultural Sciences, 2019, 58(S2): 58-60. (in Chinese)
[3] 张德银, 廖霏霏, 刘兴贵, 刘晓, 周力. 脱毒马铃薯雾化生产研究进展. 现代农业科技, 2018(20): 60-61, 63.
ZHANG D Y, LIAO F F, LIU X G, LIU X, ZHOU L. Research progress on atomization production of virus-free potato. XianDai NongYe KeJi, 2018(20): 60-61, 63. (in Chinese)
[4] 刘悦善. 浅析原原种“雾培法”生产技术对甘肃省马铃薯种薯产业发展的影响. 种子科技, 2019, 37(16): 121-122.
LIU Y S. Analysis on the influence of the original seed “fog culture” production technology on the development of potato seed potato industry in Gansu Province. Seed Science & Technology, 2019, 37(16): 121-122. (in Chinese)
[5] LULAI E C. Skin-set wound healing, and related defects// Vreugdenhil D. Potato biology and biotechnology: Advances and perspectives. Amsterdam, The Netherlands: Elsevier Limited, 2007: 471-496.
[6] 包改红, 毕阳, 李永才, 吴觉天, 寇宗红, 葛永红, 王毅, 王蒂. 不同愈伤时间对低温贮藏期间马铃薯块茎采后病害及品质的影响. 食品工业科技, 2013, 34(11): 330-334.
BAO G H, BI Y, LI Y C, WU J T, KOU Z H, GE Y H, WANG Y, WANG D. Effect of curing duration on incidence and quality of potato tuber during storage at low temperature. Science and Technology of Food Industry, 2013, 34(11): 330-334. (in Chinese)
[7] LI Y C, BI Y, GE Y H, SUN X J, WANG Y. Antifungal activity of sodium silicate onand its effect on dry rot of potato tubers. Journal of Food Science, 2009, 74(5): 213-218.
[8] 郭文雅, 赵京献, 郭伟珍. 脱落酸(ABA)生物学作用研究进展. 中国农学通报, 2014, 30(21): 205-210.
GUO W Y, ZHAO J X, GUO W Z. Advance of research on biological function of abscisic acid (ABA). Chinese Agricultural Science Bulletin, 2014, 30(21): 205-210. (in Chinese)
[9] KUMAR G N M, LULAI E C, SUTTLE J C, KNOWLES N R. Age-induced loss of wound-healing ability in potato tubers is partly regulated by ABA. Planta, 2010, 232(6): 1433-1445.
[10] 李雪, 吴觉天, 王毅, 姜红, 毕阳, 司敏, 张静荣, 徐洁. 采后ABA处理促进‘陇薯3号’马铃薯块茎愈伤形成. 中国农业科学, 2017, 50(20): 4003-4011. doi: 10.3864/j.issn.0578-1752.2017.20.014.
LI X, WU J T, WANG Y, JIANG H, BI Y, SI M, ZHANG J R, XU J. Postharvest ABA treatment promote wound healing of potato ‘Longshu No.3’ tubers. Scientia Agricultura Sinica, 2017, 50(20): 4003-4011. doi: 10.3864/j.issn.0578-1752.2017.20.014.(in Chinese)
[11] HAN X Y, MAO L C, WEI X P, LU W J. Stimulatory involvement of abscisic acid in wound suberization of postharvest kiwifruit. Scientia Horticulturae, 2017, 224:244-250.
[12] 陶晓亚, 李家寅, 韩雪源, 黄斯, 茅林春. 脱落酸对采后番茄愈伤次生代谢物质合成的影响. 食品工业科技, 2016, 37(16): 330-334.
TAO X Y, LI J Y, HAN X Y, HUANG S, MAO L C. Effect of abscisic acid on secondary metabolite production during wound-healing in postharvest tomato fruit. Science and Technology of Food Industry, 2016, 37(16): 330-334. (in Chinese)
[13] 张一冉, 王雅楠, 杨杨, 韩育梅. 脱落酸与水杨酸处理调节李果实抗冷性及氧化酶活性. 江苏农业学报, 2020, 36(2): 471-476.
ZHANG Y R, WANG Y N, YANG Y, HAN Y M. Regulation of abscisic acid and salicylic acid treatments on chilling resist-ance and oxidase activity of plum fruit. Jiangsu Journal of Agricultural Sciences, 2020, 36(2): 471-476. (in Chinese)
[14] 张志鹏, 谭芸秀, 李宝军, 李永才, 毕阳, 李守强, 王小晶, 张宇, 胡丹. 采后不同温度预贮对雾培微型马铃薯的愈伤效果及其机理. 食品科学, 2021, 43(21): 297-304.
ZHANG Z P, TAN Y X, LI B J, LI Y C, BI Y, LI S Q, WANG X J, ZHANG Y, HU D. Effect and possible mechanism of postharvest pre-storage temperature on wound healing of potato minitubers grown in aeroponic system. Food Science, 2021, 43(21): 297-304. (in Chinese)
[15] VAN OIRSCHOT Q E A, REES D, AKED J, KIHURANI A. Sweet potato cultivars differ in efficiency of wound healing. Postharvest Biology and Technology, 2006, 42(1): 65-74.
[16] JIANG H, WANG B, MA L, ZHENG X Y, GONG D, XUE H L, BI Y, WANG Y, ZHANG Z, PRUSKY D. Benzo-(1,2,3)-thiadiazole-7- carbothioic acid s-methyl ester (BTH) promotes tuber wound healing of potato by elevation of phenylpropanoid metabolism. Postharvest Biology and Technology, 2019, 153: 125-132.
[17] VOO K S, WHETTEN R W, O'MALLEY D M, SEDEROFF R R. 4-coumarate: coenzyme a ligase from loblolly pine xylem. Isolation, characterization, and complementary DNA cloning. Plant Physiology, 1995, 108(1): 85-97.
[18] LAMB C J, RUBERY P H. A spectrophotometric assay for trans- cinnamic acid 4-hydroxylase activity. Analytical Biochemistry, 1975, 68(2): 554-561.
[19] GOFFNER D, JOFFROY I, GRIMA-PETTENATI J, HALPIN C, KNIGHT M E, SCHUCH W, BOUDET A M. Purification and characterization of isoforms of cinnamyl alcohol dehydrogenase from. Planta, 1992, 188(1): 48-53.
[20] Ren Y L, Wang Y F, Bi Y, GE Y H, wang y, fan c f, li d q, DENG H W. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (L.) fruit. European Food Research and Technology, 2012, 234: 963-971.
[21] SOLIDAY C L, DEAN B B, KOLATTUKUDY P E. Suberization: inhibition by washing and stimulation by abscisic acid in potato disks and tissue culture. Plant Physiology, 1978, 61(2): 170-174. doi:10. 1104/pp.61.2.170.
[22] JIMÉNEZ-AGUILAR D M, GRUSAK M A. Minerals, vitamin C, phenolics, flavonoids and antioxidant activity ofleafy vegetables. Journal of Food Composition & Analysis, 2017, 58: 33-39.
[23] REYES L F, CISNEROS-ZEVALLOS L. Wounding stress increases the phenolic content and antioxidant capacity of purple-flesh potatoes (L.). Journal of Agricultural and Food Chemistry, 2003, 51(18): 5296-5300.
[24] KOBAYASHI M, OHURA I, KAWAKITA K, YOKOTA N, FUJIWARA M, SHIMAMOTO K, DOKE N, YOSHIOKA H. Calcium-dependent protein kinases regulate the production of reactive oxygen species by potato NADPH oxidase. The Plant Cell, 2007, 19(3): 1065-1080.
[25] KOLATTUKUDY P E. Biochemistry and function of cutin and suberin. Canadian Journal of Botany, 2011, 62(12): 2918-2933.
[26] CHEN J X, MAO L C, MI H B, LU W J, YING T J, LUO Z S. Involvement of abscisic acid in postharvest water-deficit stress associated with the accumulation of anthocyanins in strawberry fruit. Postharvest Biology and Technology, 2016, 111: 99-105.
[27] BENVENISTE I, SALAUN J P, DURST F. Wounding-induced cinnamic acid hydroxylase in Jerusalem artichoke tuber. Phytochemistry, 1977, 16(1): 69-73.
[28] 赵淑娟, 刘涤, 胡之璧. 植物4-香豆酸:辅酶A连接酶. 植物生理学报, 2006, 42(3): 529-538.
ZHAO S J, LIU D, HU Z B. 4-Coumarate: coenzyme a ligase in plant. Chinese Journal of Plant Physiology, 2006, 42(3): 529-538. (in Chinese)
[29] 范存斐, 毕阳, 王云飞, 任亚琳, 杨志敏, 王毅. 水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响. 中国农业科学, 2012, 45(3): 584-589. doi: 10.3864/j.issn.0578-1752.2012.03.022.
FAN C F, BI Y, WANG Y F, REN Y L, YANG Z M, WANG Y. Effect of salicylic acid dipping on postharvest diseases and phenylpropanoid pathway in muskmelon fruits. Scientia Agricultura Sinica, 2012, 45(3): 584-589. doi: 10.3864/j.issn.0578-1752.2012.03.022.(in Chinese)
[30] 张鲁斌, 谷会, 弓德强, 常金梅. 植物肉桂醇脱氢酶及其基因研究进展. 西北植物学报, 2011, 31(1): 204-211.
ZHANG L B, GU H, GONG D Q, CHANG J M. Research progress of cinnamyl alcohol dehydrogenase and its gene. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(1): 204-211. (in Chinese)
[31] 刘尊英. 绿芦笋(L.)木质化的生理生化基础及其调控技术研究[D]. 北京: 中国农业大学, 2003.
LIU Z Y. Study on physiological and biochemical basis of lignification of asparagus (L.) and its regulation technology [D]. Beijing: China Agricultural University, 2003. (in Chinese)
[32] KIM Y H, BAE J M, HUH G H. Transcriptional regulation of the cinnamyl alcohol dehydrogenase gene from sweet potato in response to plant developmental stage and environmental stress. Plant Cell Reports, 2010, 29(7): 779-791.
[33] JIANG H, WANG Y, LI C J, WANG B, MA L, REN Y Y, BI Y, LI Y C, XUE H L, PRUSKY D. The effect of benzo-(1,2,3)-thiadiazole-7- carbothioic acid S-methyl ester (BTH) treatment on regulation of reactive oxygen species metabolism involved in wound healing of potato tubers during postharvest. Food Chemistry, 2020, 309: 125608.
[34] JAKUBOWSKA D, JANICKA M. The role of brassinosteroids in the regulation of the plasma membrane H(+)-ATPase and NADPH oxidase under cadmium stress. Plant Science: An International Journal of Experimental Plant Biology, 2017, 264: 37-47.
[35] WEI M L, GE Y H, LI C Y, HAN X, QIN S C, CHEN Y R, TANG Q, LI J R. G6PDH regulated NADPH production and reactive oxygen species metabolism to enhance disease resistance against blue mold in apple fruit by acibenzolar-S-methyl. Postharvest Biology and Technology, 2019, 148: 228-235.
[36] BERNARDS M A, SUSAG L M, BEDGAR D L, ANTEROLA A M, LEWIS N G. Induced phenylpropanoid metabolism during suberization and lignification: a comparative analysis. Journal of Plant Physiology, 2000, 157(6): 601-607.
[37] BAJJI M, M′HAMDI M, GASTINY F, DELAPLACE P, FAUCONNIER M L, DU JARDIN P. Catalase inhibition alters suberization and wound healing in potato () tubers. Physiologia Plantarum, 2007, 129(3): 472-483.
[38] WANG C, GAO Y, TAO Y, WU X Z, CUI Z B. Influence of-irradiation on the reactive-oxygen metabolism of blueberry fruit during cold storage. Innovative Food Science and Emerging Technologies, 2017, 41: 397-403.
[39] TIAN S, QIN G, LI B, WANG Q, MENG X H. Effects of salicylic acid on disease resistance and postharvest decay control of fruits. Stewart Postharvest Review, 2007, 3(6): 1-7.
[40] MA Y H, MA F W, ZHANG J K, LI M J, WANG Y H, LIANG D. Effects of high temperature on activities and gene expression of enzymes involved in ascorbate-glutathione cycle in apple leaves. Plant Science, 2008, 175(6): 761-766.
[41] GE Y H, DENG H W, BI Y, LI C Y, LIU Y Y, DONG B Y. Postharvest ASM dipping and DPI pre-treatment regulated reactive oxygen species metabolism in muskmelon (L.) fruit. Postharvest Biology and Technology, 2015, 99: 160-167.
[42] 段园园, 岳鑫, 陈贵林. 脱落酸对锁阳茎切口愈合及抗氧化酶活性的影响. 植物生理学报, 2012, 48(3): 298-302.
DUAN Y Y, YUE X, CHEN G L. Effect of abscisic acid on wound healing and antioxidant enzyme activities ofstem. Plant Physiology Journal, 2012, 48(3): 298-302. (in Chinese)
Effects of Exogenous Abscisic Acid Treatment on Periderm Suberification of Postharvest Mini-Tuber Potato from Aeroponic System and Its Possible Mechanisms

1College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070;2Institute of Agricultural Products Storage and Processing, Gansu Academy of Agricultural Sciences, Lanzhou 730070;3Gansu Seed Station, Lanzhou 730070
【Objective】The aim of this study was to evaluate the effect of exogenous abscisic acid treatment on periderm suberification of postharvest potato mini-tuber from aeroponic system, and to further explore its mechanism.【Method】The original seed potato mini-tubers of Tongshu No. 1, free of artificial damage, were pre-stored at 15℃ (RH86-88%) respectively in dark environment for wound healingafter dipping in exogenous abscisic acid (ABA) for 10 min. The weight loss rate of tuber during wound healing was measured, the accumulation of suberin and cork in pericardium cells was observed, and the phenylpropane and reactive oxygen metabolism in pericardium tissue of potato tuber were also analyzed.【Result】25 mg∙L-1ABA treatment and prestorage at 15℃ significantly reduced weight loss rate of microtuber, accelerated the accumulation of suberin and corkification in perituber tissue.Further studies showed that the key enzyme activities ofphenylpropane metabolism and the content of total phenols, flavonoids and lignin of tuber tissues were significantly increased after ABA treatment, the enzyme activities of phenylalnine ammonia-lyase (PAL), 4-coumarate coenzyme A ligase (4CL), cinnamic acid 4-hydroxylase (C4H) and cinnamyl alcohol dehydrogenase (CAD) were significantly increased by 79.02%, 3.21%, 12.99% and 11.54%, respectively, compared with that of the control 21 days after storage. At the same time, ABA treatment decreased cell membrane permeability and malondialdehyde content, and increasedand H2O2content and enzyme activities of NADPH oxidase (NOX), super oxide dismutase (SOD), catalase (CAT) and peroxidase (POD), the enzyme activities of NOX, SOD, CAT and POD in treated tubers were increased by 47.33%, 8.61%, 27.27% and 14.50%, respectively, 21 days after storage.In addition, ABA treatment also activated antioxidant system AsA-GSH cycle and effectively maintained the intracellular redox balance. 【Conclusion】Postharvest ABA treatment could promote the accumulation of suberin and corkification in perituber tissue by activating the metabolism of phenylpropanoid and reactive oxygen species in periderm tissue, and accelerated the postharvest suberification process of aeroponic cultivated micro-potato tubers.
aeroponic mini-tubers potato; abscisic acid; suberification; phenylpropanoid metabolism;reactive oxygen metabolism

10.3864/j.issn.0578-1752.2023.06.011
2022-05-17;
2022-11-15
甘肃省重点研发计划(GNKJ-2020-2)、甘肃省重大项目(21ZD4NA016)、国家自然科学基金(31860459)、财政部和农业农村部:国家现代农业产业技术体系资助(CARS-09-P26)
张志鹏,Tel:18298335807;E-mail:156467921@qq.com。通信作者李永才,Tel:13639341449;E-mail:lyc@gsau.edu.cn
(责任编辑 赵伶俐)
