发酵乳中植物乳杆菌依赖解旋酶恒温基因扩增检测方法的建立
2023-03-20张雅伦李永波
张雅伦,李永波,张 涛,陈 晨,张 捷,周 巍*,张 岩*
(河北省食品检验研究院,河北省食品安全重点实验室,国家市场监督管理重点实验室(特殊食品监督管理技术),特殊食品安全与健康河北省工程研究中心,河北 石家庄 050071)
发酵乳是以乳及乳制品为原材料,经过灭菌处理,接种特定的微生物发酵而生成的酸性凝乳状制品,通常为保加利亚乳杆菌和嗜热链球菌发酵,因其独特的口感和丰富的营养价值备受人们喜爱,已成为当今乳制品研究的主要方向之一[1-5]。为更好提升发酵乳风味和保健功效,研究人员接种时还添加其他益生菌,如植物乳杆菌、双歧杆菌、链球菌等[6-7]。植物乳杆菌在酸乳发酵过程中可以产生双乙酰、乙酸及其他代谢产物,这些代谢产物一方面加快酸乳生化反应进程,缩短成熟时间,丰富风味,改善质地[8],另一方面还具有有效降低胆固醇、增强免疫力、延缓衰老等多种对人体有益的保健功效[9]。虽然植物乳杆菌的益处较多,但是企业生产的发酵乳因植物乳杆菌污染带来的口味改变、质量下降的情况还是屡见不鲜,也成为了影响品牌的关键因素之一[10-11]。
目前食品微生物检验方面针对食品中植物乳杆菌的快速检测方法较少,国标为乳杆菌属检测,分子生物学检验为较为常见的检验方法[12-13]。国标检验植物乳杆菌需进行后续碳水反应鉴定,且国标的微生物方法需进行培养、纯化、鉴定等步骤,时间较长,易受主观因素影响,无法满足快速检测的需求[14]。分子生物学方法主要为聚合酶链式反应(polymerase chain reaction,PCR)检测,但受非特异性扩增、仪器价格昂贵等因素影响,在基层检验机构不能得到广泛推广使用[15]。依赖解旋酶恒温基因扩增(helicase-dependent isothermal DNA amplification,HDA)检测方法是以PCR为基础的新型恒温基因扩增方法,主要是利用解旋酶在恒温下解开DNA双链,同时DNA单链结合蛋白,再由DNA聚合酶催化合成互补链,不断进行循环扩增反应,最终实现靶序列的指数增长[16]。和其他扩增方法相比,HDA法具有设备简单、特异性强、更加便捷有效等特点[17-20]。
本研究通过HDA法建立一种快速检测发酵乳中植物乳杆菌的方法,通过多种菌株扩增验证方法特异性,通过扩增产物电泳和序列比对分析验证方法稳定性,且本方法不需要昂贵仪器就可以进行实验,便于基层检验机构和生产企业推广使用,满足发酵乳制品快速、高效检验需求。
1 材料与方法
1.1 材料与试剂
发酵乳样品购于当地超市,共计20 个批次,实验用菌株信息见表1。

表1 实验用菌株Table 1 Strains used in the study
脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTPs)、Tris-HAc、腺嘌呤核苷三磷酸(adenine nucleoside triphosphate,ATP)、DNA Marker、正向(反向)引物、细菌基因组DNA提取试剂盒(Ezup柱式) 生工生物工程(上海)股份有限公司;牛血清白蛋白(bovine serum albumin,BSA)、二硫苏糖醇、海藻糖 美国Sigma公司;T4 gp32蛋白、UvrD解旋酶、Bst聚合酶 美国New England Biolabs公司;Reagent D德国Biotecon Diagnostics公司;营养肉汤培养基、乳杆菌培养基、脱脂乳粉培养基、牛肉膏微量元素培养基北京陆桥技术有限责任公司。
1.2 仪器与设备
DK-98-1恒温水浴锅 东方电工仪器厂;BHC-300IIA/B3生物安全检验柜 苏州净化仪器设备有限公司;MS3振荡混匀器 美国IKA公司;HVE-50灭菌器日本Hirayama公司;FiveEasy Plus™ pH计 瑞士Mettler-Toledo公司;NanoDrop 1000核酸测定仪、MIR-25恒温培养箱 美国Thermo公司;3K15冷冻离心机德国Sigma公司;Gel Doc(MP)凝胶成像系统、电泳槽、电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 基因组DNA的提取
吸取100 μL增菌液和400 μL Reagent D至2 mL无菌离心管中,在室温条件下避光静置5 min;在500 W的卤素灯下方15~20 cm处放置离心管,曝光5 min后,8 000 r/min离心5 min,去除上清液;加入100 μL无菌水充分混匀,用细菌提取试剂盒提取DNA,将提取后DNA放置于-20 ℃保存。
1.3.2 植物乳杆菌特异性引物设计
通过分析植物乳杆菌的基因序列,从GenBank数据库中选取保守性强且特异性强的基因序列,最终选定植物乳杆菌scrB基因为靶标序列,通过Primer Premier 6.0软件设计相关引物序列,并通过Oligo 7.37软件进行验证,经实验后获得植物乳杆菌特异性检测引物,如表2所示。
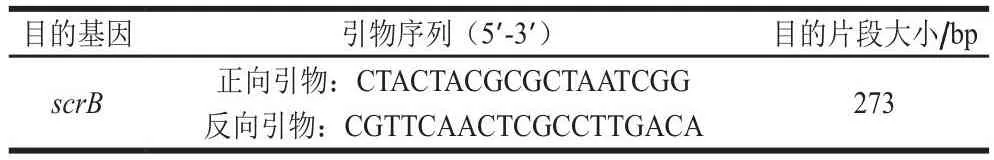
表2 引物序列与目的扩增产物大小Table 2 Sequences of the primers used and size of the PCR products
1.3.3 HDA反应体系优化和建立
为了达到快速、便捷要求,采用HDA一步法反应体系:5 μL 10×Buffer(1 mg/mL BSA、350 mmol/L Tris-HAc、100 mmol/L MgSO4、100 mmol/L二硫苏糖醇)、0.16 μmol/L ATP、10 U Bst聚合酶、0.1 μg UvrD解旋酶、5.0 μg T4 gp32、0.04 μmol/L dNTPs、2 μL模板DNA、25 μmol/L海藻糖,体系引物终浓度为20 pmol/L,使用ddH2O将体系补至50 μL[21]。因UvrD解旋酶、T4 gp32蛋白含量对反应影响较大,对二者含量进行梯度筛选。体系反应条件:在65 ℃金属浴中,恒温条件下反应2 h。
UvrD解旋酶含量的梯度筛选:分别在UvrD解旋酶含量为0.30、0.25、0.20、0.15、0.10、0.05 μg不同梯度条件下进行实验,其他条件一致,通过电泳结果确定反应体系中UvrD解旋酶最优含量。
T4 gp32蛋白含量的梯度筛选:分别在T4 gp32蛋白含量为6.0、5.0、4.0、3.0、2.0、1.0 μg不同梯度条件下进行实验,其他条件一致,通过电泳结果确定反应体系中T4 gp32蛋白最优含量。
HDA结果检测:琼脂糖凝胶含量为2%,电泳条件为恒压100 V、时间45 min,电泳结果通过凝胶成像系统进行分析。
1.3.4 HDA法检测植物乳杆菌的特异性
为验证植物乳杆菌HDA法检测特异性,将表1与植物乳杆菌同源性较高、易造成检测相互影响的菌株经活化培养后,按照1.3.1节方法提取相应菌株的DNA,并通过优化后的HDA反应条件进行检测。
1.3.5 HDA法检测植物乳杆菌的序列比对分析
将植物乳杆菌通过1.3.3节所建立的HDA法扩增后,通过琼脂糖凝胶纯化并收集目的片段,送往生工生物工程(上海)股份有限公司进行序列分析,将得到的序列信息通过NCBI官网进行BLAST比对分析,根据比对结果验证方法稳定性。
1.3.6 HDA法检测植物乳杆菌的检出限
将市售发酵乳样品进行高压灭菌,按照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》方法进行计数和鉴定,验证该批次发酵乳中不含植物乳杆菌,再分别将植物乳杆菌按照不同浓度梯度人工添加到发酵乳中,使其含量维持在2.8×100~2.8×107CFU/g,并通过上述方法进行基因组DNA提取和HDA法检测,得出该方法的检出限。
2 结果与分析
2.1 HDA法反应体系优化结果
由图1~2可知,当UvrD解旋酶含量为0.15 μg、T4 gp32蛋白含量为5.0 μg时,电泳条带清晰、明亮且无扩散现象,表明此时植物乳杆菌HDA法检测效果最好。

图1 不同UvrD解旋酶含量下HDA法测定植物乳杆菌琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of PCR amplified products from genomic DNA of Lactobacillus plantarum with HDA method at different UvrD helicase concentrations
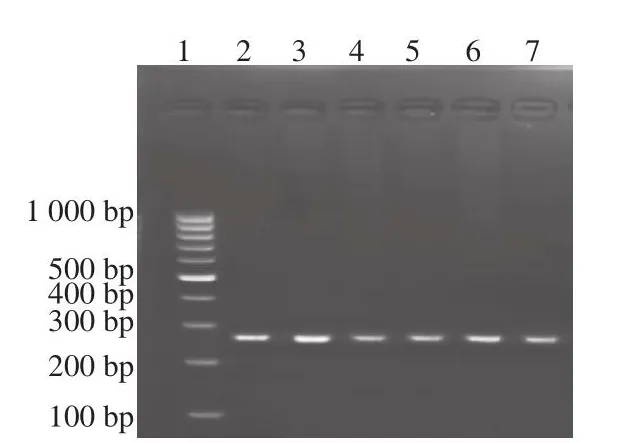
图2 不同T4 gp32蛋白含量下HDA法测定植物乳杆菌琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of PCR amplified products from genomic DNA of Lactobacillus plantarum by the HDA method at different T4 gp32 concentrations
2.2 植物乳杆菌HDA法检测特异性
由图3可知,仅植物乳杆菌有单一的扩增条带产生,大小约为273 bp,与目的片段一致,且其他相近的11 株菌均无扩增现象。由此可以说明,本研究所建立的植物乳杆菌HDA法的特异性良好。

图3 植物乳杆菌HDA法检测特异性琼脂糖凝胶电泳图Fig.3 Electrophoretogram showing the specificity of the HDA method for Lactobacillus plantarum
2.3 HDA法检测植物乳杆菌的序列分析结果
由表3可知,所比对序列与目标序列的同源性均为100%,证明HDA法检测植物乳杆菌扩增产物和目的片段的序列一致,稳定性良好,可以作为快速检验方法。

表3 HDA法检测产物比对结果Table 3 Results of sequence alignment (BLAST) of HDA products
2.4 HDA法检测植物乳杆菌的检出限
由图4可知,发酵乳中植物乳杆菌HDA法检测的检出限为2.8×101CFU/g,该检出限可以满足日常检验需要,为开展现场检测和方法应用推广提供了参考。
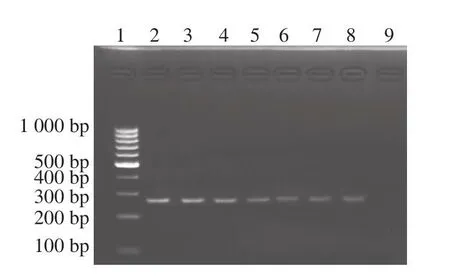
图4 HDA法检测植物乳杆菌灵敏度的琼脂糖凝胶电泳图Fig.4 Electrophoretogram showing the sensitivity of the HDA method for Lactobacillus plantarum
3 讨 论
目前食品检验研究多集中在致病菌方面,针对植物乳杆菌的快速检测方法较少,本研究为植物乳杆检验提供了一种新方式。HDA法比常用的国标方法缩短了检验时间、减少了检验员主观因素影响,能够达到快速、精准的检验;相比其他扩增技术,HDA检验不需要专用设备,反应条件不需太苛刻,基础实验室均能满足,同时还保留了基因扩增的高效和准确性,因采用的聚合酶独特性,不易引起非特异性扩增,具有较高灵敏度[22]。这都保证了HDA技术能够在基层监管部门和生产企业推广使用,符合我国检测技术快速发展趋势,现因HDA技术的独特性已广泛应用于分子生物学领域[23-24],在病毒鉴定[25-27]和微生物鉴定方面多有研究[28-29],应用前景广阔[30]。
本研究通过HDA法,建立了一种快速、高效、应用前景广阔的植物乳杆菌检验方法。以植物乳杆菌scrB基因为靶标序列设计特异性引物,通过实验筛选最佳反应体系,最终确定50 μL反应体系中UvrD解旋酶的添加量为0.15 μg、T4 gp32蛋白添加量为5.0 μg。通过实验验证,本方法特异性强、稳定性高,经测序比对,植物乳杆菌的同源性为100%,检出限低,为2.8×101CFU/g,检测所需时间短,这为解决生产企业的产品因植物乳杆菌污染带来的口味改变、质量下降等问题提供了快速检验渠道,为企业高速发展保驾护航。
