生牛乳中蜂房哈夫尼菌的分离鉴定及其生物学特性
2023-03-20于鲁敏柳志璇殷乙凯赵一璇
于鲁敏,柳志璇,王 攀,殷乙凯,赵一璇
(临沂大学农林科学学院,山东 临沂 276000)
蜂房哈夫尼菌(Hafnia alvei)属于肠杆菌科(Enterobacteriacea)、哈夫尼菌属(Hafniasp.),是典型的革兰氏阴性短杆菌,兼性厌氧型,具有鞭毛,能运动[1-4]。蜂房哈夫尼菌广泛存在于人和动物的肠道、污水、土壤和生牛乳中,是一种机会致病菌,可引起肠道、泌尿系统和呼吸道感染,甚至引发败血症[4-8]。蜂房哈夫尼菌也是一种嗜冷菌,常常造成富含蛋白质的水产品、肉制品、生牛乳及其乳制品在低温冷藏时腐败变质,因此,被认为是一种优势腐败菌,其可通过产生胞外酶、铁载体或形成生物被膜等方式引起食品质量和安全问题[1-2,9-10]。已有报道称,生物被膜是蜂房哈夫尼菌造成食品污染和腐败的一个重要的潜在因素[11]。
生物被膜是细菌细胞产生的胞外多糖、蛋白质或eDNA等胞外基质紧密地黏附在生物或非生物接触物表面的微生物群落,其可随着空气或其他接触物的移动造成细菌的传播和污染[12-15]。在食品加工过程中,一些致病菌和腐败菌能够黏附在食品加工机器或包装材料表面,进而形成生物被膜[11,16]。由于生物被膜很难被清理,从生物被膜解离的细菌细胞会随着后续的食品加工过程进入食品中,进而造成食品污染和腐败[16-19];而这有助于食源性致病菌和腐败菌随着被污染或腐败的食品进入消费者体内,导致其细菌性感染,威胁公共卫生安全[20-22]。
本研究从生牛乳中分离鉴定出1 株蜂房哈夫尼菌,通过研究其耐盐性、耐酸碱、耐药性及生物被膜形成等生物学特性,进而了解其致腐特性或致病性,将有助于解决由蜂房哈夫尼菌引起的食品质量和安全问题。
1 材料与方法
1.1 材料与试剂
无菌采集自山东省临沂市某奶牛养殖场的新鲜乳样,以备细菌分离。
MH肉汤 青岛海博生物有限公司;蛋白胨、酵母浸粉 英国Oxoid公司;NaCl、琼脂粉、细菌基因组DNA提取试剂盒 上海生物工程有限公司;细菌微量鉴定管 杭州滨和微生物试剂有限公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂 南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台 苏州净化设备有限公司;MLS-3781L-PC高压蒸汽灭菌锅 日本Sanyo公司;ZQPW-70恒温振荡培养箱 常州百翔电力设备有限公司;DHP-9082B电热恒温培养箱 合肥达斯卡特生物科技有限公司;H1650-W微量高速离心机 湖南湘仪离心机仪器有限公司;3120000240微量移液器 德国Eppendorf公司。
1.3 方法
1.3.1 培养基的配制
LB液体培养基:蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 5 g/L、pH 7.0、121 ℃高压灭菌15 min;LB固体培养基:蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 5 g/L、琼脂粉20 g/L、pH 7.0、121 ℃高压灭菌15 min;MH液体培养基:MH肉汤粉末21 g/L,121 ℃高压灭菌15 min;MH固体培养基:MH肉汤粉末21 g/L、琼脂粉20 g/L、121 ℃高压灭菌15 min;Swimming培养基:蛋白胨10 g/L、NaCl 5 g/L、琼脂粉3 g/L、121 ℃高压灭菌15 min[11,23]。
1.3.2 细菌的分离培养
取新鲜乳样0.5 mL,置于LB液体培养基中,30 ℃、180 r/min振荡培养16~24 h。用无菌生理盐水将菌液进行梯度稀释,每个浓度梯度取100 μL液体进行平板涂布,30 ℃倒置培养16~24 h,选择合适稀释浓度的平板观察菌落形态,并根据菌落大小、颜色、透明度、边缘等形态学特征对细菌进行分离和纯化[24]。纯化后的菌株(HY-1)置于25%甘油中,-80 ℃保存。
1.3.3 细菌的鉴定
1.3.3.1 染色特性观察
挑取LB固体平板上生长的单菌落进行革兰氏染色,镜检。
1.3.3.2 生理生化鉴定
挑取单菌落接种于细菌微量检定管进行生理生化指标的测定。参照《伯杰氏细菌学鉴定手册》和《常见细菌系统鉴定手册》进行归类判定[25]。
1.3.4 16 S rRNA基因序列分析
采用细菌基因组DNA提取试剂盒提取细菌的DNA,利用细菌16SrRNA基因通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′、1492R:5′-TACGACTTAACCCCAATCGC-3′对细菌DNA的相应序列进行PCR扩增[24]。扩增片段约为1 500 bp。总体系50 μL:2×Phanta®Max Master Mix 25 μL、10 μmol/L正向引物和10 μmol/L反向引物各2.5 μL、ddH2O 17 μL、DNA 3 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,共30 个循环,最后72 ℃终延伸5 min。反应结束后,PCR扩增产物经1%琼脂糖凝胶电泳检验后,送至上海生物工程有限公司测序。将测序结果在NCBI(https://www.ncbi.nlm.nih.gov/)GenBank数据库中进行BLAST分析,并选取同源性较高的核苷酸序列用MEGA7.0以Neighbor-Joining法构建系统进化树[24]。
1.3.5 蜂房哈夫尼菌特性研究
1.3.5.1 培养温度
将过夜培养的蜂房哈夫尼菌HY-1接种到LB液体培养基中,分别置于不同温度条件(4、16、25、30、37 ℃)下静置培养24 h,观察菌株生长情况[21]。然后,用生理盐水将上述不同温度条件下的菌液10 倍连续梯度稀释,稀释度分别为10-1、10-2、10-3、10-4、10-5和10-6,分别吸取10 μL滴加于LB固体平板上,放置5 min,于30 ℃恒温培养箱中培养16 h后进行菌落计数[26]。LB液体培养基为空白对照,实验重复3 次。
1.3.5.2 药敏实验
利用无菌棉签蘸取浓度为108CFU/mL的蜂房哈夫尼菌HY-1涂于MH固体平板,放置5 min后,将34 种药敏纸片紧贴于平板表面,30 ℃培养18 h后观察结果并测量抑菌圈直径[27]。根据美国临床和实验室标准协会抗菌药物敏感性实验标准进行敏感性判定[28-30]。实验重复3 次。
1.3.5.3 耐盐性实验
将过夜培养的蜂房哈夫尼菌HY-1分别接种到不同NaCl质量浓度梯度(0、0.05、0.10、0.20、0.40、0.50、0.70、0.80 g/mL)的LB液体培养基中,于30 ℃振荡培养箱中振荡培养24 h,观察菌株生长情况[3]。然后,用生理盐水将上述不同盐浓度梯度菌液10 倍连续梯度稀释,稀释度分别为10-1、10-2、10-3、10-4、10-5和10-6,分别吸取10 μL滴加于LB固体平板上,放置5 min,于30 ℃恒温培养箱中培养16 h后进行菌落计数。LB液体培养基为空白对照,实验重复3 次。
1.3.5.4 耐酸碱性实验
将过夜培养的蜂房哈夫尼菌HY-1分别接种到不同pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0)的LB液体培养基中,于30 ℃振荡培养箱中振荡培养24 h,观察菌株生长情况。然后,用生理盐水将上述不同pH值菌液10 倍连续梯度稀释,稀释度分别为10-1、10-2、10-3、10-4、10-5和10-6,分别吸取10 μL滴加于LB固体平板上,放置5 min,于30 ℃恒温培养箱中培养16 h后进行菌落计数。LB液体培养基为空白对照,实验重复3 次。
1.3.5.5 泳动性实验
将过夜培养的蜂房哈夫尼菌HY-1用移液枪吸取5 μL滴加到Swimming培养基的中央位置,于超净工作台中静置30 min后,置于30 ℃恒温培养箱中倒置培养48 h,观察结果并测量泳动圈的直径[3]。Swimming培养基为空白对照,实验重复3 次。
1.3.5.6 生物被膜形成实验
利用15 mm×100 mm的玻璃试管进行生物被膜形成实验[12,21,31]。生物被膜的测定方法如下:培养结束后,弃去培养基,用无菌生理盐水洗3 遍,风干。加入无水甲醇固定5 min后,弃掉并风干。加入0.1 g/100 mL的结晶紫染色15 min后,用蒸馏水将未结合的结晶紫洗掉。风干后加入体积分数33%的乙酸溶液充分溶解生物被膜。然后,将生物被膜溶解液转移至96 孔板中,使用酶标仪测定OD490nm。
1)最佳成膜时间的确定。将过夜培养的蜂房哈夫尼菌HY-1接种到LB液体培养基中,于30 ℃恒温培养箱中静置培养72 h,每隔12 h观察生物被膜形成情况并进行测定。LB液体培养基为空白对照,该实验重复3 次。
2)培养温度对生物被膜的影响。将过夜培养的蜂房哈夫尼菌HY-1接种到LB液体培养基中,分别置于不同温度条件(4、16、25、30、37 ℃)下静置培养48 h,进行测定。LB液体培养基为空白对照,该实验重复3 次。
3)不同培养条件对生物被膜的影响。将过夜培养的蜂房哈夫尼菌HY-1分别接种到不同NaCl质量浓度梯度(0、0.05、0.10、0.20、0.40、0.50、0.70、0.80 g/mL)的LB(无钠盐)液体培养基、不同pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0)的LB液体培养基、不同牛乳质量浓度梯度(0、1、2、3、4、5、8 mg/mL)的LB液体培养基中,于30 ℃恒温培养箱中静置培养48 h,进行测定。LB液体培养基为空白对照,该实验重复3 次。
1.4 数据处理
利用MEGA7.0软件绘制HY-1系统进化树。各实验数据以平均值±标准差表示,利用IBM SPSS Statistics 25.0软件进行数据分析,Origin 2018软件进行各实验数据柱形图绘制。
2 结果与分析
2.1 细菌形态学观察
将牛乳进行细菌的分离培养及菌株纯化,在LB固体平板上,菌株HY-1的菌落光滑、为灰白色、半透明、边缘整齐。革兰氏染色结果显示,HY-1为革兰氏阴性菌,菌体呈短杆状,无芽孢(图1)。

图1 HY-1的菌体形态Fig.1 Morphology of HY-1
2.2 生理生化鉴定
由表1可知,通过对菌株HY-1进行生理生化特征检测,结果显示,该分离株能分解利用葡萄糖、木糖、麦芽糖、阿拉伯糖,水解赖氨酸脱羧酶、鸟氨酸脱羧酶,不能利用甘露醇、山梨醇、侧金盏花醇、柠檬酸盐,能还原硝酸盐,靛基质、硫化氢、明胶、V-P实验呈阴性,甲基红实验呈阳性。参照《伯杰氏细菌学鉴定手册》和《常见细菌系统鉴定手册》进行归类判定,初步判断菌株HY-1属于哈夫尼菌属。

表1 HY-1的生理生化特征Table 1 Physiological and biochemical characteristics of HY-1
2.3 16S rRNA序列系统进化树分析
采用通用引物27F/1492R对HY-1的16S rRNA序列进行PCR扩增,经1%琼脂糖凝胶电泳观察,由图2可知,在约1 500 bp处有一条亮且粗的条带,与预期大小一致。
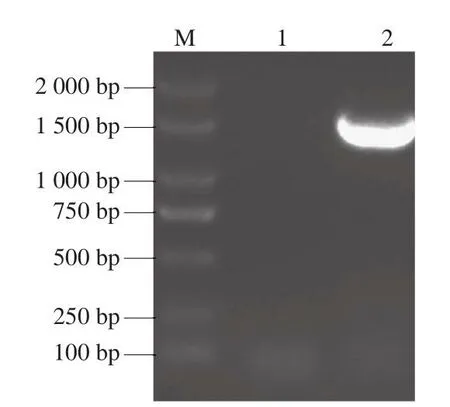
图2 HY-1 16S rRNA PCR扩增产物的琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoregram of PCR amplification product of 16S rRNA gene from HY-1
将PCR扩增产物进行序列测定,对所获得的测序结果在GeneBank数据库进行BLAST分析,并选取与HY-1 16S rRNA基因核苷酸序列同源性较高的8 个肠杆菌科16S rRNA基因核苷酸序列,利用MEGA7.0以Neighbor-Joining法构建系统发育树。由图3可知,菌株HY-1为哈夫尼菌属(Hafniasp.)。

图3 基于16S rRNA核苷酸序列的HY-1的系统进化树Fig.3 Phylogenetic tree of HY-1 based on 16S rRNA gene nucleotide sequence
结合菌株HY-1的形态特征、生理生化特性和16S rRNA基因核苷酸序列相似性,对照《伯杰氏细菌学鉴定手册》和《常见细菌系统鉴定手册》,鉴定本研究筛选的菌株HY-1为哈夫尼菌属(Hafniasp.)的蜂房哈夫尼菌(Hafnia alvei)。
2.4 蜂房哈夫尼菌特性
2.4.1 培养温度
由图4可知,蜂房哈夫尼菌HY-1在4、16、25、30、37 ℃条件下生长的活菌数没有显著差异,说明其生长范围比较广,在低温时仍然能够正常生长。

图4 培养温度对蜂房哈夫尼菌HY-1活菌数的影响Fig.4 Effect of culture temperature on viable count of Hafnia alvei HY-1
2.4.2 药敏实验
由表2可知:蜂房哈夫尼菌HY-1对环丙沙星、阿米卡星、氧氟沙星、左氟沙星、诺氟沙星、大观霉素、卡那霉素、氯霉素、链霉素、哌拉西林、米诺环素、呋喃妥因、多黏菌素B、妥布霉素、庆大霉素、氨苄西林、复方新诺明、氨曲南、头孢西丁、头孢哌酮、头孢吡肟、头孢噻肟、头孢曲松敏感;对四环素、红霉素、青霉素G、头孢他啶、头孢呋辛酯中度敏感;对麦迪霉素、克林霉素、克拉霉素、苯唑西林、头孢噻吩、头孢唑林耐药。

表2 蜂房哈夫尼菌HY-1的药敏实验结果Table 2 Results of drug susceptibility test of Hafnia alvei HY-1
2.4.3 耐盐性
由图5可知,蜂房哈夫尼菌HY-1在NaCl质量浓度为0、0.05、0.10、0.20、0.40、0.50 g/mL时,其活菌数几乎没有变化,但是,当NaCl质量浓度达到0.70 g/mL或0.80 g/mL时,活菌数极显著下降。该结果进一步表明,蜂房哈夫尼菌HY-1的耐盐性为0.50 g/mL。

图5 蜂房哈夫尼菌HY-1的耐盐性Fig.5 Salt resistance of Hafnia alvei HY-1
2.4.4 耐酸碱性
由图6可知,蜂房哈夫尼菌HY-1在pH值为5.0、5.5、6.0、6.5、7.0、7.5、8.0时,其活菌数几乎没有变化。该结果进一步表明,蜂房哈夫尼菌HY-1在pH 5.0~8.0均能生长,其生长情况无差异。

图6 蜂房哈夫尼菌HY-1的耐酸碱性Fig.6 Acid and alkali resistance of Hafnia alvei HY-1
2.4.5 泳动性
由图7可知,蜂房哈夫尼菌HY-1在Swimming培养基表面出现1 个半透明的光晕,其直径约为20 mm,表明接种在培养基表面中央的蜂房哈夫尼菌HY-1可以在培养过程中向四周运动,进而说明蜂房哈夫尼菌HY-1具有泳动性。
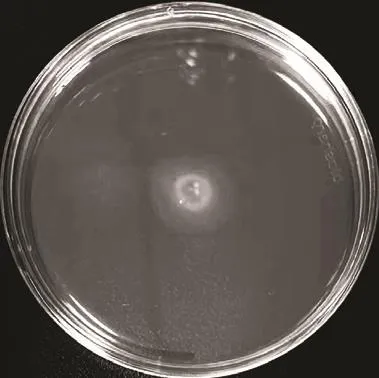
图7 蜂房哈夫尼菌HY-1的泳动性Fig.7 Swimming motility of Hafnia alvei HY-1
2.4.6 生物被膜
由图8可知,利用15 mm×100 mm的玻璃试管染色法测定蜂房哈夫尼菌HY-1的生物被膜形成能力,结果显示,蜂房哈夫尼菌HY-1在48 h时成膜能力最强。

图8 蜂房哈夫尼菌HY-1的最佳成膜时间Fig.8 Biofilm formation ability of Hafnia alvei HY-1
由图9A可知,在4 ℃时,蜂房哈夫尼菌HY-1仍然能够形成较强的生物被膜,而在30、37 ℃条件下,其成膜能力最强。由图9B可知,蜂房哈夫尼菌HY-1在NaCl质量浓度为0.05 g/mL时成膜能力最强,但是当NaCl质量浓度达到0.40 g/mL及以上时,其成膜能力显著下降。由图9C可知,在不同pH值条件下,与培养基正常pH 7.0相比,其他pH值对蜂房哈夫尼菌HY-1的生物被膜形成能力没有显著影响。由图9D可知,脱脂牛乳在1~8 mg/mL质量浓度范围内对蜂房哈夫尼菌HY-1的生物被膜形成能力也没有显著影响。

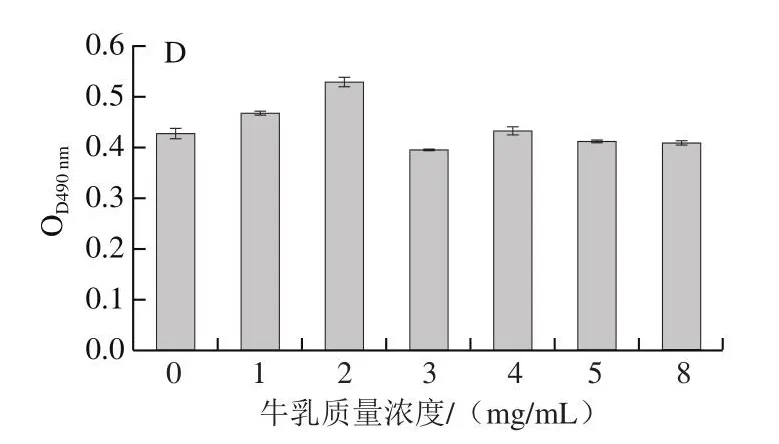
图9 不同培养条件对蜂房哈夫尼菌HY-1生物被膜形成的影响Fig.9 Effect of culture conditions on biofilm formation of Hafnia alvei HY-1
3 讨 论
分离于生牛乳中的蜂房哈夫尼菌HY-1对四环素、红霉素、青霉素G、头孢他啶、头孢呋辛酯中度敏感;对麦迪霉素、克林霉素、克拉霉素、苯唑西林、头孢噻吩、头孢唑林耐药。这些结果表明,蜂房哈夫尼菌HY-1能够抵抗多种抗生素。此外,蜂房哈夫尼菌HY-1既能够在含有0.2~0.5 g/mL NaCl的培养基中存活,也可在pH 5.0~8.0范围内存活,说明其能够在大部分食品或食品原料中正常生长,从而造成食品污染和腐败,最终引发食品质量和安全问题[11,19]。
蜂房哈夫尼菌泳动性实验结果表明,菌株HY-1具有泳动能力。泳动是蜂房哈夫尼菌依靠鞭毛运动和布朗运动实现的,而鞭毛和布朗运动有助于细菌细胞黏附在接触物表面,从而促进生物被膜的形成[3,32]。该蜂房哈夫尼菌HY-1具有形成生物被膜的能力,与Viana等[1]报道结果一致。在4~37 ℃条件下,蜂房哈夫尼菌HY-1仍然能够正常生长繁殖并形成较强的生物被膜,从而造成大部分贮藏食品或食品原料的腐败变质[21]。在本研究中,牛乳对蜂房哈夫尼菌HY-1的生物被膜形成能力没有显著影响,但是当牛乳质量浓度为2 mg/mL时,具有促进蜂房哈夫尼菌HY-1生物被膜形成的潜在能力,进而为蜂房哈夫尼菌的传播和污染提供有效的途径。在弱酸弱碱条件下,蜂房哈夫尼菌HY-1能够正常生长,并且其生物被膜形成能力几乎不受影响。此外,蜂房哈夫尼菌HY-1的耐盐性为0.5 g/mL,该结果与朱耀磊等[3]报道结果一致;但是,当NaCl质量浓度达到0.7 g/mL时,蜂房哈夫尼菌HY-1的活菌数显著下降,并且0.4 g/mL NaCl便显著抑制蜂房哈夫尼菌HY-1生物被膜形成能力,表明可以通过适当提高NaCl质量浓度阻断蜂房哈夫尼菌HY-1的传播和污染。
4 结 论
本研究分离于生牛乳的蜂房哈夫尼菌HY-1能够在低温、弱酸弱碱和高盐条件下正常生长繁殖,且耐受多种抗生素,表明其作为食源性致病菌和腐败菌能够在不良环境中正常传播,从而造成食品污染和腐败,最终引发食品质量和安全问题。因此,该结果为研究和控制由蜂房哈夫尼菌引起的食品质量和安全问题提供了实验基础和理论依据。
