纤维蛋白凝胶管状支架的制备及性能
2023-03-15林展翼刘鹏梅静怡周嘉辉
林展翼 刘鹏 梅静怡 周嘉辉
(1. 华南理工大学 生物科学与工程学院,广东 广州 510006;2. 华南理工大学 医学院,广东 广州 510006;3. 广东省人民医院(广东省医学科学院)心内科,广东 广州 510080;4. 广东省老年医学研究所,广东 广州 510080)
疾病谱的改变及全球人口老龄化造成心血管性疾病逐年攀升,预测到2030 年全球每年将有2 330万人死于该疾病[1]。血管移植是治疗心血管疾病的重要手段,但血管移植物的临床供给不足限制了其应用。目前小口径(直径 ≤ 6 mm)的血管移植物还是以自体血管的获取为主,寻求移植物供给上的突破一直是血管外科界亟待解决的问题。组织工程血管体外培养技术在过去30年间取得了飞速进步,其关键技术集中在种子细胞、支架材料及构建环境的选择这3个方面。目前,相关研究中选择的支架材料主要是可降解的PGA(聚乙醇酸)材料[2],但其酸性降解产物会影响细胞生长,材料降解不完全时将在移植者体内成为异物,这些缺点可能影响组织构建和移植的中远期效果。
近年来,具有高含水量、良好生物相容性和离子传送能力的水凝胶材料得到了广泛应用[3-4],国外已有实验室使用纤维蛋白凝胶作为小口径组织工程血管培养的支架材料[5]。纤维蛋白是一种单体纤维蛋白原的生物聚合物,包含Aα-、Bβ- 和γ- 这3对二硫键连接的多肽链,相对分子质量为3.4×105[6]。凝血酶可以将纤维蛋白原特异性切割为小的纤维蛋白肽,并在钙离子(Ca2+)作用下刺激凝血因子(纤维蛋白稳定因子)转化为凝血因子A(转谷氨酰胺酶),后者催化纤维蛋白肽发生交联,形成纤维蛋白凝胶。纤维蛋白凝胶具有降解产物无毒性[7-8]、生物相容性好等特点[9-11],还具有能促进细胞分泌细胞外基质的优势[12],但形成的凝胶状态不稳定,制备条件及过程要求比较苛刻。有鉴于此,文中针对小口径组织工程血管的构建需求探索一种新型的制备方法,以期为小口径血管的构建提供一种新的技术路径。
1 材料与方法
1.1 主要试剂和仪器
纤维蛋白原、凝血酶、氨基己酸、胰岛素、Pluronic F-127,美国Sigama-Aldrich 公司产品;Dulbecco’s Modified Eagle Medium/F12 培养基,美国Corning公司产品;抗坏血酸,美国Gibco公司产品;Phalloidin-iFluor 594、重组Anti-Vinculin 抗体,英国Abcam 公司产品。UV-2600型紫外可见分光光度计,日本Shimadzu公司产品;MERLIN 型场发射扫描电子显微镜,德国Zeiss 公司产品;Talos F200X 型场发射透射电子显微镜,美国FEI 公司产品;LSM900型激光共聚焦显微镜,德国Zeiss公司产品;DM18 型THUNDER 3D 细胞显微镜,德国Leica 公司产品;Instron 5967 型万能材料试验机,美国英斯特朗公司产品。如无特殊说明,所用试剂均为分析纯。
1.2 纤维蛋白凝胶管状支架的制备
将凝血酶和CaCl2(体积比1∶1)制成混合溶液后冰浴保存,另外用20 mmol/L 的HEPES(4-羟乙基哌嗪乙磺酸)缓冲溶液在37 ℃下配制纤维蛋白原溶液。将纤维蛋白原溶液和混合溶液按4∶1的体积比构建纤维蛋白凝胶,其中凝胶悬浮液的最终含量为纤维蛋白原4 mg/mL、凝血酶0.8 U/mL及CaCl25.0 mmol/L。悬浮液通过吸管的作用混合均匀,混合后注入用5% Pluronic F-127 溶液预处理的模具中,通过可滑动的芯轴和中空圆柱形模具对凝胶支架进行塑形(如图1所示),模具在37 ℃的5% CO2中保持10 min,使纤维蛋白完全凝胶化,最后得长度为3 cm、内径为4 mm、厚度为1 mm的管状凝胶支架材料。由于在负载细胞时凝胶管壁会发生收缩,对凝胶管外径大小的选择,需要根据小口径血管移植物(直径 ≤ 6 mm)的实际尺寸需求进行调整。制得的凝胶由于黏性高,需要用表面活性剂Pluronic F-127[13]对模具进行预处理,防止因凝胶与模具的黏附而破坏支架形状。当使用管状支架负载种子细胞进行培养时,还需要添加一定比例的胰岛素和抗坏血酸,以促进细胞的增殖与细胞外基质的分泌[14]。

图1 纤维蛋白凝胶管状支架的制备Fig.1 Fabrication of fibrin gel tubular scaffold
1.3 负载细胞实验
原代人真皮成纤维细胞购自美国ScienCell 公司。取第2代人成纤维细胞,使用含20% FBS(胎牛血清)的DMEM/F12培养基,在37 ℃、含5% CO2的细胞培养箱中进行培养。细胞生长达到约80%融合状态时以胰蛋白酶消化,超速离心后制成细胞悬液进行下一步实验。
将纤维蛋白原溶液、凝血酶与CaCl2(体积比1∶1)的混合溶液以及每毫升含106个细胞的细胞悬液按4∶1∶1 的体积比混合制成纤维蛋白凝胶悬浮液。混合后注入用5% Pluronic F-127溶液预处理的模具中,模具在37 ℃的5% CO2中保持10 min,使纤维蛋白完全凝胶化。获得凝胶管后,将管状凝胶放入含2 µg/mL 胰岛素、2 mg/mL 氨基己酸、50 µg/mL抗坏血酸的DMEM 培养基的15 cm 培养皿中培养。每周更换培养液3次,每次更换70%培养液。
1.4 分析与表征
1.4.1 凝胶性能表征
设置分光光度计波长为352 nm,测定纤维蛋白凝胶成胶过程的光密度变化,将达到光密度最大值的时间定义为凝胶成胶时间。纤维蛋白凝胶在常温蒸馏水中孵育,选择不同时间点,用滤纸吸附掉凝胶表面水分后在微量天平上测定凝胶的湿重(mt),凝胶吸水率定义为所增加的质量(mt-m0)与初始质量(m0)的比率。将制备好的两组纤维蛋白凝胶转移至培养皿中,一组加入含2 mg/mL的氨基己酸(纤维蛋白酶抑制剂)的PBS溶液,另一组加入等量的不含氨基己酸的PBS溶液,将凝胶放置在37 ℃培养箱中孵育,在不同的时间点取出凝胶计算剩余凝胶体积,将其与凝胶初始体积进行比较,获得凝胶降解速度。
使用万能材料试验机测量纤维蛋白凝胶的杨氏模量。纤维蛋白凝胶在PBS中孵育1 h,用滤纸吸干表面水分,然后装载在两个平板之间进行压缩测试,压缩速度为1.0 mm/min。采用应变范围为0~0.05的应力-应变曲线的线性部分来计算凝胶的杨氏模量。
1.4.2 凝胶微观结构分析
扫描电子显微镜分析:取2.5%戊二醛固定凝胶样品后,依次在梯度乙醇(含量分别为30%、50%、70%、80%和95%)溶液中进行脱水,再使用临界点干燥机进一步干燥脱水凝胶,将其安装在铝垫片上并溅射镀铂,利用场发射扫描电子显微镜进行观察。
透射电子显微镜分析:取2.5%戊二醛固定凝胶样品后,依次在梯度乙醇(含量分别为30%、50%、70%、80%和95%)溶液中脱水,脱水后通过纯丙酮+包埋液对凝胶进行包埋,然后在梯度温度(分别为37、45、60 ℃)下固化。采用超薄切片机对凝胶切片,经过醋酸铀-枸橼酸铅双染色后,利用场发射透射电子显微镜进行观察。
1.4.3 组织学分析
分别在第1天和第4天收集所制备的管状凝胶。部分凝胶使用含4%多聚甲醛的PBS 溶液在冰上进行固定,再经过细胞膜通透步骤后采用PhalloidiniFluor 594抗体在室温下进行染色,最后进行封片、观察。另一部分凝胶在固定、通透处理后,于4 ℃下用重组Anti-Vinculin 抗体稀释液孵育过夜,次日在室温下加入兔抗鼠荧光二抗稀释液孵育,然后进行封片、观察。
选择培养7 d的管状凝胶,放置于含4%多聚甲醛的PBS溶液中固定,再用OCT(最佳切削温度)混合物进行包埋,液氮冷冻后采用HE(苏木精-伊红)染色法进行染色。
1.5 图片处理及统计学方法
使用ImageJ软件对扫描电镜图像进行分析,求出纤维蛋白凝胶的平均纤维直径和孔隙大小。
采用SPSS19.0 统计软件进行数据分析,实验数据以“平均值±标准差”的形式表示。
2 结果与讨论
2.1 纤维蛋白凝胶的性能和结构
2.1.1 凝胶的整体形貌
凝血酶溶液和CaCl2溶液按1∶1 的体积比制成混合溶液,再将纤维蛋白原溶液和混合溶液按4∶1的体积比混合,在37 ℃培养箱中保持10 min后即可使纤维蛋白完全凝胶化。纤维蛋白凝胶混合溶液在成胶前为透明液体(见图2(a)),成胶时为半透明状混合物(见图2(b)),成胶后纤维蛋白凝胶整体外观呈乳白色,外表光滑,结构完整,胶质分布均匀(见图2(c))。

图2 纤维蛋白凝胶的成胶过程Fig.2 Gelation process of fibrin gel
纤维蛋白凝胶的前体物质由蛋白质组成,因此其制备过程中对温度和pH 值的控制尤为关键。本研究中采用HEPES 缓冲溶液作为材料体系的溶剂,有效地控制了凝胶的pH 值;同时,37 ℃的成胶温度既可维持纤维蛋白原的蛋白构象,也保证了体系的成胶。
2.1.2 凝胶的成胶时间
在成胶过程中,纤维蛋白凝胶的浊度随着时间的延长而显著增加(如图2 所示),可测得光密度(OD 值)上升到最大时的平均时间为(172.0±4.7) s(如图3所示)。此时成胶过程结束,该时间点即为纤维蛋白凝胶的成胶时间。
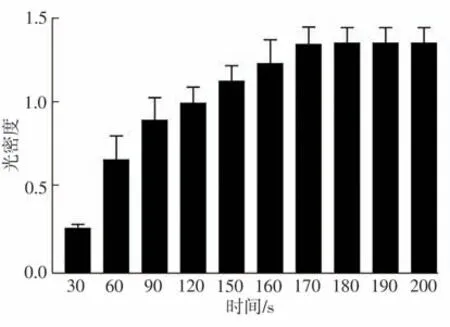
图3 纤维蛋白凝胶的成胶时间Fig.3 Clotting time of fibrin gel
在整个凝胶制备过程中,仅用不到3 min 的时间即可获得外表光滑、厚度均匀的水凝胶,而较短的成胶时间将显著影响凝胶的结构,获得的凝胶更加致密,产生更多的凝胶纤维结构[15]。
2.1.3 凝胶的吸水性能
随着凝胶在蒸馏水中培养时间的延长,其吸水量也逐渐增加(如图4所示)。从开始到培养12 h,吸水速度相对较快;培养12~24 h期间,吸水速度逐步放缓;培养24~72 h时,凝胶的吸水量已经基本达到饱和,此时凝胶内外溶液交换处于动态平衡,纤维蛋白凝胶最终的吸水率为34.50%±1.87%。
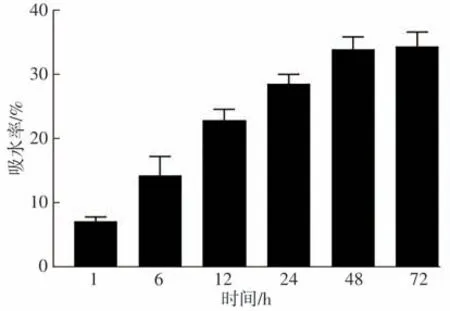
图4 纤维蛋白凝胶的吸水率Fig.4 Water absorption of fibrin gel
短时间内获得的含有较多纤维结构的纤维蛋白凝胶具有更强的抗收缩能力[15]。随着凝胶在蒸馏水中培养时间的延长,凝胶也可以稳定保持较好的吸水率,这有利于凝胶内部与外界环境进行稳定的物质交换,满足负载种子细胞后细胞生长所需的环境条件[16]。
2.1.4 凝胶的降解时间
当凝胶静置在PBS中自然降解时,从开始到第1天凝胶体积减小了40%,凝胶整体形状不再完整。凝胶降解速度从第3 天到第7 天逐步减慢,直至第7 天时完全降解;而当凝胶静置在含2 mg/mL ACA(氨基己酸)的PBS 溶液中时,凝胶在7 d 内的体积下降比例不足20%,整体形状可以维持更长的时间(如图5所示)。
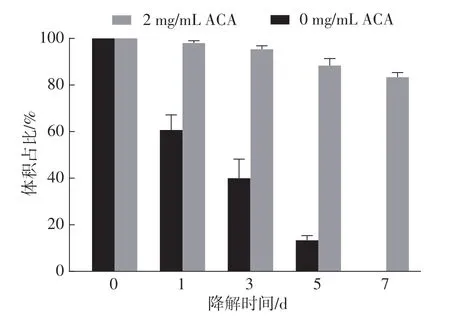
图5 纤维蛋白凝胶的自然降解与ACA介导的降解Fig.5 Natural degradation and ACA-mediated degradation of fibrin gel
普通条件下制得的凝胶存在快速降解现象,因为凝胶在自然状态下很容易被溶液中的纤维蛋白酶分解,并不适合作为生物支架用于细胞长时间培养。因此,为了满足小口径组织工程血管培养的支架材料要求,需要在保存液中额外添加2 mg/mL 的氨基己酸,通过抑制纤维蛋白酶来调控凝胶的降解时间。
2.1.5 凝胶的力学性能
凝胶成胶后,利用万能材料试验机对纤维蛋白凝胶进行力学性能测试,测得凝胶的杨氏模量为(2 624±295) Pa。
天然纤维蛋白凝胶成胶后柔软且易降解。已有研究表明,获得的纤维蛋白凝胶在杨氏模量仅为570 Pa时也可直接作为负载细胞的支架[17],但是凝胶短时间内就会丧失力学性能并完全降解。而在小口径组织工程血管移植物构建的初始阶段(1 至2周),力学性能需要由支架材料来提供,支架降解时间过快会导致这一阶段管状支架结构缺乏稳定性,此时就需要通过添加氨基己酸或采用其他改性方式来抑制纤维蛋白酶的降解作用,从而维持纤维蛋白凝胶支架的初始力学性能。
2.1.6 凝胶的微观结构
扫描电镜结果显示,纤维蛋白凝胶的纤维网络紧凑,呈致密的多孔结构,纤维与纤维之间交联密切。运用ImageJ 软件计算得凝胶平均纤维直径为(0.41±0.03) µm,平均孔隙大小为(47.87±9.60) µm2(如图6所示)。
对用于负载细胞培养的水凝胶来说,营养的自由交换是极其重要的。由图6可知,纤维蛋白凝胶的纤维网络精细且疏松多孔,纤维横纵交错排列。这种结构有利于营养物质及代谢物质的输送和排放,是促进细胞生长的理想结构。交错排列的凝胶纤维可以提供人成纤维细胞附着位点,同时也为细胞的伸展与迁移提供了空间[18]。
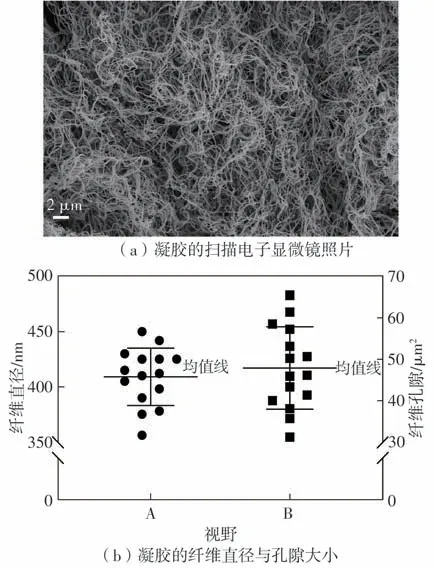
图6 纤维蛋白凝胶的扫描电镜图及纤维直径、孔隙大小Fig.6 Scanning electron microscope result of fibrin gel and fiber diameter as well as pore size
2.2 细胞相容性
2.2.1 负载人成纤维细胞的纤维蛋白凝胶管状支架的组织学分析
通过HE 染色法对负载人成纤维细胞的纤维蛋白凝胶管状支架切片进行染色,可见获得的纤维蛋白凝胶管状支架被酸性伊红染液染成红色,染色结果显示凝胶厚度较均匀(如图7所示),细胞在凝胶中结构完整、分布均匀且密度高。

图7 凝胶-细胞混合物的HE染色结果Fig.7 HE staining result of gel-cell mixture
由图7可知,人成纤维细胞在纤维蛋白凝胶中的生长状况良好,凝胶内部提供的环境条件适合细胞的生长与增殖。
2.2.2 不同培养时间点人成纤维细胞微观结构的变化
人成纤维细胞负载在纤维蛋白凝胶中进行培养后,扫描电镜结果显示:细胞在6 h 就发生分裂,并与纤维蛋白网形成联系(见图8(a));12 h时细胞代谢活性增强,透射电镜清晰显示负载在凝胶内的人成纤维细胞有较多的细胞核和线粒体结构(见图8(b));1 d时人成纤维细胞在凝胶内逐渐伸展开,荧光显微镜下见大部分细胞伸出突触(图8(c)),细胞呈现梭形形态;4 d时细胞开始变得致密,荧光显微镜下见细胞与细胞之间开始形成黏附,细胞形态饱满、活性高,形状变为纺锤形(见图8(d))。
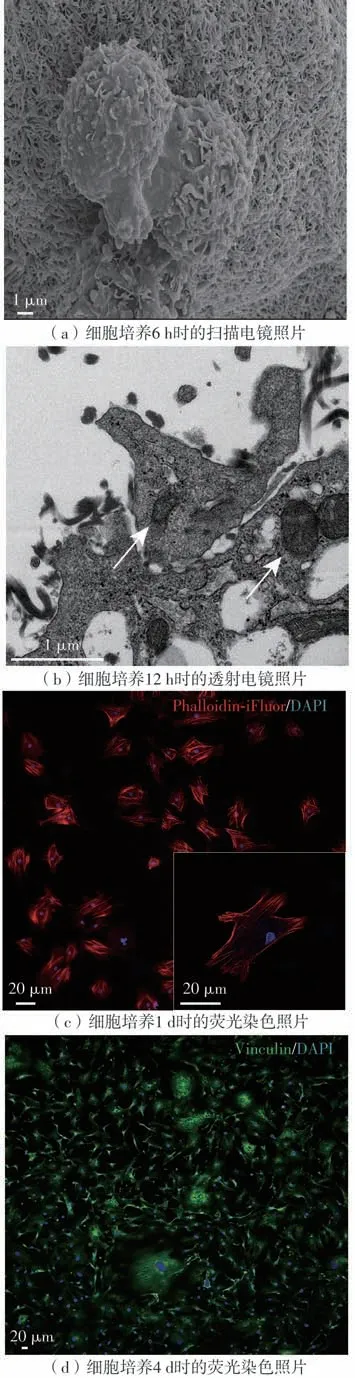
图8 人成纤维细胞在不同时间点的微观结构变化Fig.8 Microstructural changes of human fibroblasts at different time points
仅仅在6 h 内,细胞与凝胶的纤维就交联在一起,说明成纤维细胞与纤维蛋白凝胶的纤维束相容性较好,短时间内就能感知并适应凝胶空间网络结构,并开始融入其中。培养12 h时细胞在凝胶内的代谢变得旺盛,说明凝胶疏松多孔的结构和较高的含水量可为细胞提供合适的生长环境以及物质交换的场所。一般情况下,细胞在适宜环境下新陈代谢会更加旺盛,细胞与细胞之间的联系也会更加密切,这种适宜的环境有利于细胞分泌细胞外基质。培养1 d 后,细胞形态由最初零散的梭形转变为更利于生长与分泌的纺锤形,Vinculin 染色结果显示细胞与细胞之间形成了局部的紧密联系。以上结果表明,成纤维细胞在凝胶内的生长状况良好,能够完全适应这一多孔隙支架材料环境。
3 结语
文中在严格控制温度和pH 值等条件、并保证纤维蛋白原和凝血酶与CaCl2溶液体积比不变的情况下,采用管状模具在短时间内获得了外表光滑、厚度均匀的纤维蛋白凝胶管状支架。该支架材料表面疏松、多孔,满足内外营养自由交换的条件,力学性能稳定,可满足负载细胞进行细胞培养的需求。通过分析该支架对人成纤维细胞生长的影响发现,该支架材料为细胞提供了良好的生长和增殖环境,在培养过程中细胞形态完整,分布均匀,生长状况较好;免疫荧光实验也证实,文中方法制备得到的纤维蛋白凝胶管状支架具有良好的细胞相容性,有望用作小口径组织工程血管移植物培养的支架材料。后续研究中,将探讨纤维蛋白凝胶管状支架作为细胞长期培养载体的稳定性,并尝试用生物反应器与纤维蛋白凝胶管状支架结合来获取具有一定力学性能的小口径组织工程血管。纤维蛋白凝胶支架也可运用在各种仿生材料和人造组织的制造中,具有广阔的应用前景。
