胶体金免疫层析法同时检测果蔬中四种农药残留
2023-03-12沈晓玲陈青舟夏武强张少恩
叶 茂,沈晓玲, ,陈青舟,夏武强,张 敏,张少恩
(1.杭州南开日新生物技术有限公司,浙江杭州 311258;2.象山县水产品质量检测中心,浙江宁波 315700;3.郑州市农产品质量检测流通中心,河南郑州 450000)
农药是现代农业的重要生产资料,对保障果蔬等农产品优质、高产具有不可或缺的作用。毒死蜱、氟虫腈、克百威和多菌灵作为高效、广谱性杀虫或杀菌剂被广泛用于水果、蔬菜的病虫害防治。然而,近年来随着农药长期大量的施用,农药残留及污染问题日益严重,已严重危害人类的健康[1−2],成为全球关注的一项重要食品安全指标。因此,加强农药残留检测,尤其是农药多残留检测是十分必要的。农药最大残留限量(maximum residue limit,MRL)是食品农药残留评价与监管的重要依据[3],中国、欧盟、日本等许多国际组织和国家均出台了相应的农药最大残留限量标准[4−6],其中GB 2763-2019对果蔬中毒死蜱、氟虫腈、克百威、多菌灵的MRL规定如表1所示。
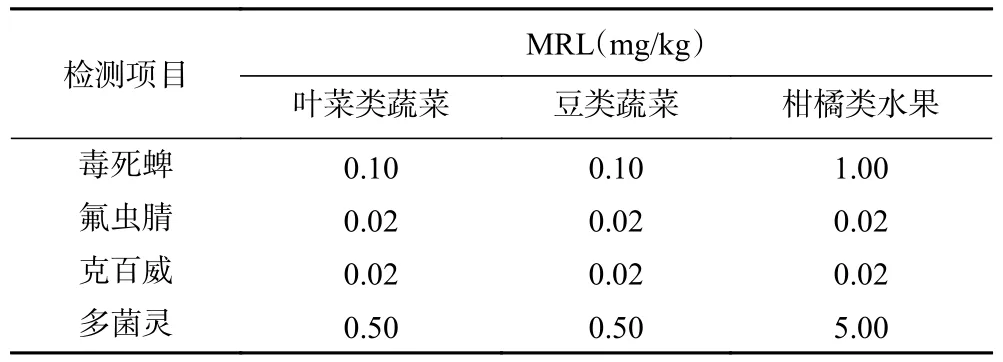
表1 毒死蜱、氟虫腈、克百威、多菌灵的MRL(部分)Table 1 MRL of chlorpyrifos, fipronil, carbofuran and carbendazim (a part)
随着科技的不断发展,快捷、灵敏、能进行多组分分析成为检测农药残留的必备条件[7]。目前,农药多残留检测方法主要有高效液相色谱法(high performance liquid chromatography,HPLC)[8−9]、气相色谱串联质谱法(gas chromatography-mass spectrometer,GC-MS)[10−11]、及液相色谱串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)[12−14]等。尽管这些方法具有较高的灵敏度和特异性,但所需仪器复杂昂贵、操作繁琐费时、检测费用高,较难应用于基层实验室的大批量样本检测[15]。为此,研究开发快速、灵敏、准确、简便的农药多残留快速检测技术,对保护生态环境,保障人类健康有着重要意义。胶体金免疫层析法具有操作方便,检测时间短,不需要复杂仪器判定,定性准确,裸眼即可观察结果等优点,是目前应用最广的快速检测方法[16]。在农药多残留组分检测方面,可采用“宽谱”特异性抗体方式,即通过“共性”半抗原设计或“多簇”人工抗原设计制备宽谱抗体[17],如Liang等[18]采用3种具有共性结构半抗原免疫动物,获得能够同时识别马拉硫磷等8种有机磷类农药的多克隆抗体,但由于抗体特异性不强,不能确定具体的农药品种。另一种方式是通过使用多种特异性抗体进行农药多残留免疫分析,即在试纸条的硝酸纤维素膜上划多条检测线,Guo等[19]通过在试纸条硝酸纤维素膜上划两条检测线可同时检测水中三唑磷和克百威两种农药残留,Wang等[20]运用胶体金三线卡对大普通白菜和土壤样本中吡虫啉、甲基毒死蜱、水胺硫磷进行检测。
毒死蜱、氟虫腈、克百威和多菌灵是果蔬中比较常见的农药残留抽检不合格项目,目前还未有同时检测这四种农药残留的胶体金免疫层析快速检测方法的相关报道。本试验通过优化样品前处理和胶体金免疫层析检测条件,构建了4个抗原−抗体组合的农药多残留检测的免疫胶体金四线卡,只需对待测样本进行一次前处理就可以在一条试剂卡上同时检测毒死蜱、氟虫腈、克百威、多菌灵四种农药,对指导生产环节合理使用农药、市场监督、农药残留超标的快速检测等工作,具有重要的现实意义。
1 材料与方法
1.1 材料与仪器
硝酸纤维素膜、样品垫、金标结合垫、吸水垫 美国Millipore公司;毒死蜱、氟虫腈、克百威、多菌灵、甲基毒死蜱、丁硫克百威、杀螟硫磷、吡虫啉、对硫磷、异丙威标准品 中国医药(集团)上海化学试剂公司;氯金酸(HAuCl4·4H2O)、柠檬酸三钠、羊抗鼠IgG 美国Sigma公司;毒死蜱单克隆抗体、氟虫腈单克隆抗体、克百威单克隆抗体、多菌灵单克隆抗体、包被抗原 杭州南开日新生物技术有限公司自制;普通白菜、菜豆、柑橘 杭州市某农贸市场。
MYP11-2恒温磁力搅拌器 上海梅颖浦仪仪表制造有限公司;紫外-可见分光光度计 美国赛默飞世尔科技公司;Bio Jet XYZ3000型点膜机、CM4000型试纸条切割机 美国BioDot公司;Avanti J-26XP高速冷冻离心机 美国Beckman公司;DHG-9023A型恒温鼓风干燥箱 上海精宏实业设备有限公司;Agilent 6890N-59731气相色谱质谱联用仪、Agilent 1260-6460高效液相色谱质谱联用仪 美国Agilent公司;NK-S101I胶体金读数仪 杭州南开日新生物技术有限公司。
1.2 实验方法
1.2.1 胶体金免疫层析四线卡制备
1.2.1.1 胶体金溶液制备 采用柠檬酸三钠还原法[21]制备胶体金溶液。将100 mL 0.01%的氯金酸溶液置于磁力搅拌器上加热至沸腾后,加入1 mL 0.1%柠檬酸三钠水溶液,继续搅拌煮沸15 min,溶液最终呈透亮的红色,冷却至室温后,用双蒸水定容至100 mL,4 ℃保存备用。在可见光范围内(400~600 nm)用紫外分光光度仪测定溶液的吸收峰波长和吸光度值[22]。
1.2.1.2 最适标记抗体浓度 采用盐沉淀法和吸光度法进行胶体金标记单克隆抗体最适标记量优化[23]。用0.01 mol/L的PB缓冲液(pH7.4)分别将毒死蜱、氟虫腈、克百威、多菌灵单克隆抗体配制成0.5 mg/mL溶液,15000 r/min 4 ℃离心30 min,去除溶液中的蛋白聚合物。以毒死蜱单克隆抗体为例,取5支小试管,分别加入1 mL胶体金溶液和0.8、1.6、2.4、3.2、4.0、5.0 μg/mL的抗体进行标记。室温孵育5 min,测定OD525,向每个小试管中加入1 mL 10% NaCl溶液,5 min后观察各管溶液颜色变化并测定OD525。计算两次OD525差值,并以此差值作为纵坐标,抗体浓度作为横坐标,绘制吸光度差值与相应的抗体浓度的关系曲线,选择曲线平滑临界点的抗体浓度作为最适标记浓度[24]。
1.2.1.3 T线包被浓度优化 C线羊抗鼠IgG包被浓度采用常规浓度0.2 mg/mL,T线上分别包被毒死蜱、氟虫腈、克百威、多菌灵人工包被原,依次形成的T1、T2、T3、T4线,抗原浓度分别设置0.95、0.80、0.65、0.50、0.35 mg/mL五个浓度,抗体以最适标记量进行标记,分别滴加PBS(0.01 mol/L)缓冲液和0.2 mg/L毒死蜱、0.04 mg/L氟虫腈、0.04 mg/L克百威、0.1 mg/L多菌灵标准品混合溶液进行检测,观察显色并使用胶体金读数仪读数。读数判定原则:T/C比值˂1.0(T线比C线淡或几乎看不见)为阳性;T/C比值≥1.0(T线比C线深或一样深)为阴性;若未出现任何色带或C线未出现,则此试剂卡已失效、过期或操作不当,需另做一次测试。
抑制率(Inhibition rate)[25]的计算公式:
式中:I表示抑制率;Sb表示PBS缓冲液的T/C值;St表示混合标准品的T/C值。
1.2.1.4 四线卡组装 将制备好的毒死蜱、氟虫腈、克百威、多菌灵的金标单克隆抗体溶液稀释到最佳标记量后等体积混匀,按照喷量3.0 μL/cm,混合包被在四线卡金标垫区域。将处理后的毒死蜱、氟虫腈、克百威、多菌灵人工包被原和羊抗鼠IgG依次通过点膜仪喷于硝酸纤维素膜上,形成间隔4 mm的T1、T2、T3、T4和C线,37 ℃烘箱干燥8 h。依次将样品垫、金标结合垫、硝酸纤维素膜和吸水垫粘贴于PVC底板上,制成胶体金免疫层析四线卡(图1)。
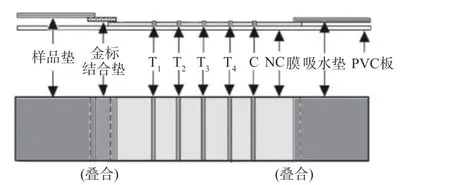
图1 胶体金免疫层析四线卡结构示意图Fig.1 Structure diagram of immune colloidal gold four lines card
1.2.2 样品前处理条件选择 本试验所用蔬菜和水果样品均购自本地农贸市场。普通白菜、菜豆和柑橘每批均购3 kg以上,所有样品分别取其可食用部分,称取5.0 g样品,剪成1 cm2左右的碎片/块后,放入均质机中搅碎,待用。
1.2.2.1 提取溶剂的选择 毒死蜱和克百威属微溶农药,多菌灵和氟虫腈为难溶农药,在样品前处理时采用有机溶剂进行提取,可使农药完全溶解,有利于增加其抑制抗原抗体反应的程度。选择甲醇、乙腈、乙酸乙酯和丙酮四种常用有机溶剂对比提取效果。分别取匀浆后阴性和添标果蔬样品2.0 g,其中阳性添标样品中毒死蜱、氟虫腈、克百威和多菌灵添加浓度分别为0.1、0.02、0.02、0.05 mg/L,分别加入5.0 mL提取溶剂,振荡5 min,室温下4000 r/min离心1 min,取上清液120 μL用于检测。每个样品重复三次,用四线卡进行检测,观察显色并使用胶体金读数仪采集T/C值。
1.2.2.2 提取时间的选择 分别取匀浆后阴性和相同添标的阳性果蔬样品,各加入5.0 mL乙腈,分别振荡3、5、7、10 min。室温下4000 r/min离心1 min,取上清液120 μL用于检测。每个样品重复三次,用四线卡进行检测,观察显色并使用胶体金读数仪采集T/C值。
1.2.3 检出限 通过在阴性样本中分别添加毒死蜱、氟虫腈、克百威、多菌灵标准品的形式,配制毒死蜱标准品浓度为0、0.025、0.05、0.075、0.1、0.2、0.5、1 mg/kg;氟虫腈和克百威标准品浓度均为0、0.005、0.01、0.015、0.02、0.05、0.1、0.2 mg/kg;多菌灵标准品浓度为0、0.01、0.015、0.03、0.05、0.1、0.2、0.5 mg/kg。以优化后的检测条件进行测定,记录显色结果。
1.2.4 特异性 首先,为了避免毒死蜱、氟虫腈、克百威和多菌灵四种免疫试剂之间的交叉反应,对其抗原与单抗的交叉反应分别进行研究评价;其次,选择甲基毒死蜱、丁硫克百威、杀螟硫磷、吡虫啉、对硫磷、异丙威6种农药进行特异性试验。
1.2.5 稳定性 本研究采用37 ℃加速试验判定四线卡的稳定性。取3个不同批次的四线卡置于37 ℃恒温箱中放置8周,分别于每周的第1 d随机抽取四线卡,分别准备阴性样本和阳性添标样本各5个,观察显色并使用胶体金读数仪采集T/C值,按T/C值平均数进行统计。
1.2.6 与仪器方法比较 用本研究制备的四线卡和仪器方法分别检测60份果蔬样品,其中包括添标检测试验和盲样检测试验。添标试验样品制备,用乙腈分别将毒死蜱、氟虫腈、克百威、多菌灵标准品进行稀释,将4种农药混合标样分别添加于普通白菜、菜豆、柑橘空白样品(经质谱仪检测,毒死蜱等4种农药的初始残留量均小于仪器检测限)中。盲样均购自本地农贸市场。
四线卡检测法:称取果蔬样品2.0 g,加入5.0 mL乙腈,振荡提取5 min,室温下4000 r/min离心1 min,取上清液120 μL用于检测。
仪器检测:普通白菜、菜豆、柑橘中毒死蜱等4种农药残留的前处理与检测方法参照行业标准NY/T761-2008[26],其中毒死蜱和氟虫腈采用GCMS[26−27]检测,克百威和多菌灵采用LC-MS/MS[26,28]检测。
1.3 数据处理
本研究所有实验均重复3次,数据结果以平均值±标准差表示,采用Microsoft Excel 2016进行数据处理和作图。
2 结果与分析
2.1 胶体金溶液的紫外扫描图谱
制备的胶体金溶液,肉眼观察呈均一透亮的红色。胶体金溶液在400~600 nm范围内的紫外-可见分光光度计扫描得到吸收光谱图,如图2。由图2可见,该胶体金的最大吸收波长为525 nm,主峰宽度较小,说明胶体金颗粒分布均匀。参考文献[29],胶体金粒径与其吸收光谱有一定关系,计算公式为:
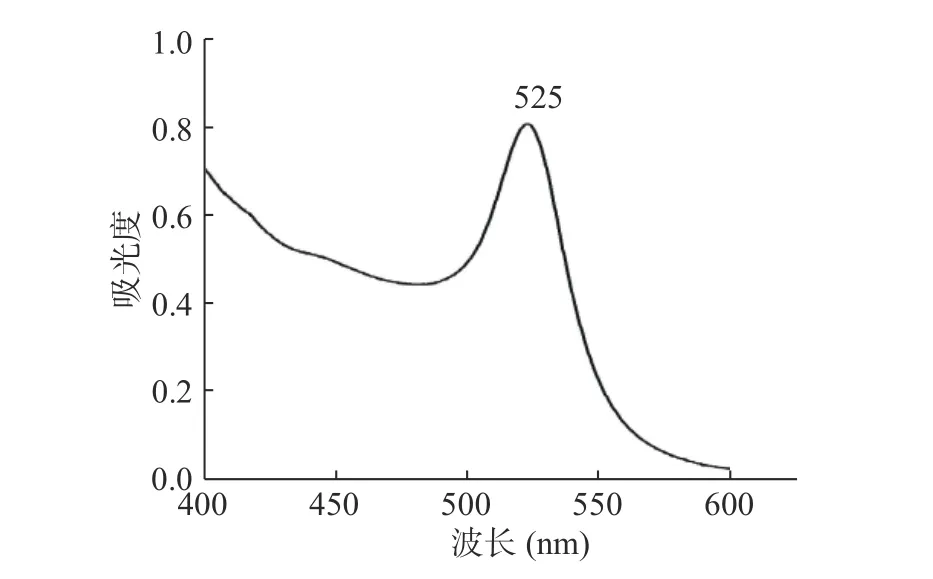
图2 胶体金紫外-可见分光光度计扫描图Fig.2 Determination of colloidal gold by spectrophotometry
式中:λmax表示最大吸收波长,nm;φ表示胶体金粒径大小,nm。
根据此公式计算该胶体金的粒径大小约为24 nm,符合胶体金层析法要求,适合用于标记抗体。
2.2 胶体金免疫层析四线卡制备参数优化
2.2.1 最适标记抗体浓度 用盐析实验并通过测定OD525计算差值来绘制吸光度差值与相应的单克隆抗体浓度的关系曲线(如图3所示)。从图3可以看出,随着抗体浓度的增加,紫外吸收的减少值在下降,当氟虫腈单克隆抗体浓度增加至2.4 μg/mL,毒死蜱单克隆抗体、克百威单克隆抗体和多菌灵单克隆抗体浓度增加至3.2 μg/mL时,出现拐点,曲线接近平滑。基于免疫竞争性反应原理,当吸光度差值趋于平滑时,抗体用量越少,在反应时检测线上包被的抗原与待测物质的竞争越激烈,有利于提高四线卡检测灵敏度。当抗体浓度高于该值时,可能会导致灵敏度降低;反之,如果浓度低于拐点值,会导致检测范围变窄[30],因此选择曲线最开始与x轴相对平行的点即为单克隆抗体的最适标记量。因此,毒死蜱、氟虫腈、克百威、多菌灵四种单克隆抗体的最适浓度分别为3.2、2.4、3.2、3.2 μg/mL。
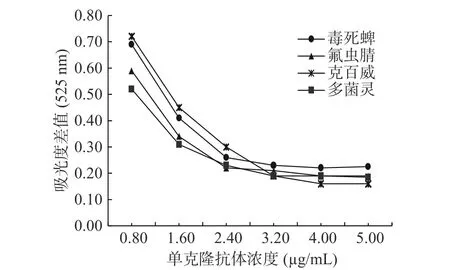
图3 吸光度值与相应的单克隆抗体浓度的关系曲线图Fig.3 Curve of the relationship between the absorbance value and the corresponding monoclonal antibody concentration
2.2.2 检测线包被浓度优化 选择阴性时T线和C线显色明显且T/C值≈1.0,阳性抑制率较高的检测线浓度。从图4中可以看出,随着检测线上包被原浓度的下降,裸眼观察阴性四线卡检测线颜色逐渐下降,胶体金读数仪测定结果显示,阴性的T/C 值逐渐减小,抑制率呈先上升然后下降的趋势。检测线包被浓度分别为毒死蜱0.65 mg/mL、氟虫腈0.80 mg/mL、克百威0.65 mg/mL、多菌灵0.5 mg/mL时,阴性T/C值接近1.0,抑制率相对较高,且裸眼观察阴性四线卡检测线颜色较明显。
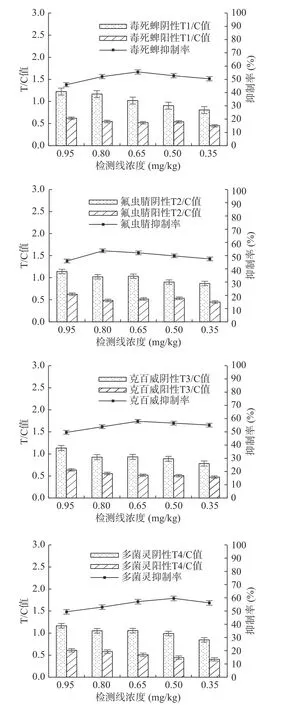
图4 检测线包被浓度优化Fig.4 Optimization of coating concentration of detection line
2.3 样品前处理条件的确定
2.3.1 提取溶剂 分别用甲醇、乙腈、丙酮和乙酸乙酯作为提取剂对样本进行前处理,样本回收率结果见图5。从图5可以看出,对于毒死蜱、氟虫腈和克百威三个检测参数来说,甲醇、丙酮和乙酸乙酯提取的样本液基质干扰较大,T线显色较浅,相比较乙腈提取的样本液基质干扰较小,对阴性样品进行检测时,T线和C线均显色明显,样本添加回收率高于75%;对于多菌灵检测参数来说,丙酮和乙酸乙酯提取的样本液基质干扰较大,T线显色较浅,相比较甲醇和乙腈提取的样本液基质干扰较小,对阴性样品进行检测时,T线和C线均显色明显,样本添加回收率均高于75%;综合而言,乙腈提取效果相对较好,与Desmet等[31]采用的QuEChERS法提取试剂一致。
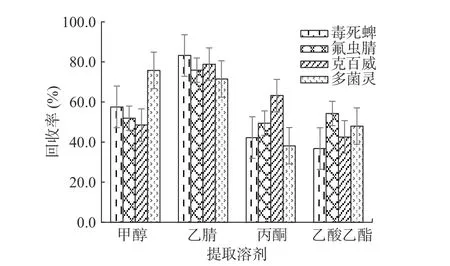
图5 样品前处理提取剂的选择Fig.5 Selection of extraction solvent for sample pretreatment
2.3.2 提取时间 使用乙腈作为提取剂,对比分别振荡3,5,7,10 min的提取效果,结果见图6。由图6可知,当提取时间为3 min时,毒死蜱、氟虫腈和克百威的样品回收率在60%左右,多菌灵的样品回收率在50%左右,当提取时间延长至5 min时,毒死蜱的样品回收率可达80%,其余三种农药的样品回收率在70%左右。随着提取时间的延长样品回收率偏差较小,为保证样品的提取效果和控制提取时间适用于快速检测的特点,选择提取时间为5 min。
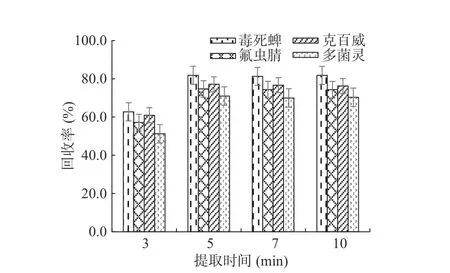
图6 样品前处理提取时间的选择Fig.6 Selection of extraction time for sample pretreatment
2.3.3 样品前处理条件的确定 取待测样品可食用部分,剪成1 cm2左右的碎片/块,放入均质机中搅碎,称取2.0 g匀浆样品于50 mL离心管中,加入5.0 mL乙腈,混匀振荡5 min,室温下4000 r/min离心1 min,取上清液120 μL,即为待测液。
2.4 胶体金免疫层析四线卡的性能评价
2.4.1 检出限 在优化后的条件下进行测试,样品加样量为120 μL,观察试剂板颜色变化,试剂板均在3 min内显示结果,符合检测要求。灵敏度检测结果如图7所示,随着四种农药浓度的降低,检测线颜色越来越深,当T线颜色和C线颜色一致时,检测结果为阴性,四种农药的检出限分别为毒死蜱0.1 mg/kg、氟虫腈0.02 mg/kg、克百威0.02 mg/kg、多菌灵0.05mg/kg。

图7 四线卡检出限测定Fig.7 Determination of detection limit of quadruple reagent plate
2.4.2 特异性 使用PBS缓冲液将毒死蜱、氟虫腈、克百威、多菌灵、甲基毒死蜱、丁硫克百威、杀螟硫磷、吡虫啉、对硫磷和异丙威标准品分别进行稀释,用四线卡进行检测。以甲基毒死蜱为例,使用PBS缓冲液将甲基毒死蜱标准品稀释成浓度为0.1、1.0、10.0 mg/kg,分别添加到经国家标准确认为阴性的普通白菜样品中,设置3个重复,按照2.3.3步骤进行样品前处理,将待测液滴加到四线卡样品垫上,观察显色结果。当显色结果为阳性时,参考文献[25],计算交叉反应率。
式中:S:交叉反应率;y:药物检出限浓度,mg/kg;Z:结构类似物检出时的浓度,mg/kg。
结果见表2,丁硫克百威对克百威的交叉反应率为20%,对检测结果有干扰;异丙威对克百威的交叉反应率为2%,甲基毒死蜱对毒死蜱的交叉反应率为1%,均小于5%,参考文献[32],若交叉反应率低于10%时,可忽略其影响;氟虫腈和多菌灵的检测结果均为阴性。
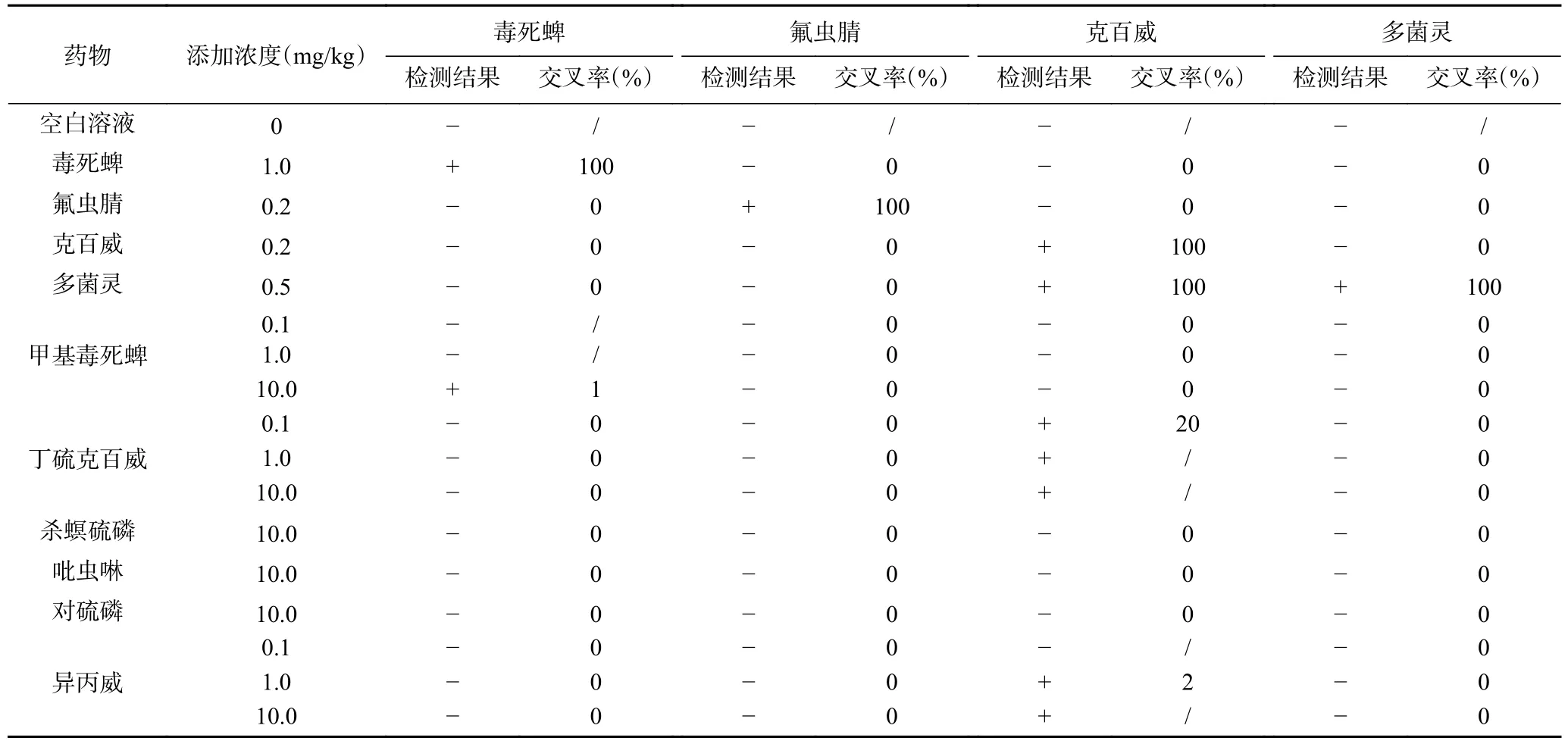
表2 交叉反应率Table 2 Detection of cross-reactivity
2.4.3 稳定性 四线卡在37 ℃条件下保存8周,稳定性试验结果如图8所示,试剂卡检测读数随着时间的延长并没有发生明显变化,肉眼观察显色均匀。根据37 ℃条件下1 d相当于室温下1周计算,四线卡在室温下至少可以保存12个月[21],在保存期内稳定性良好。
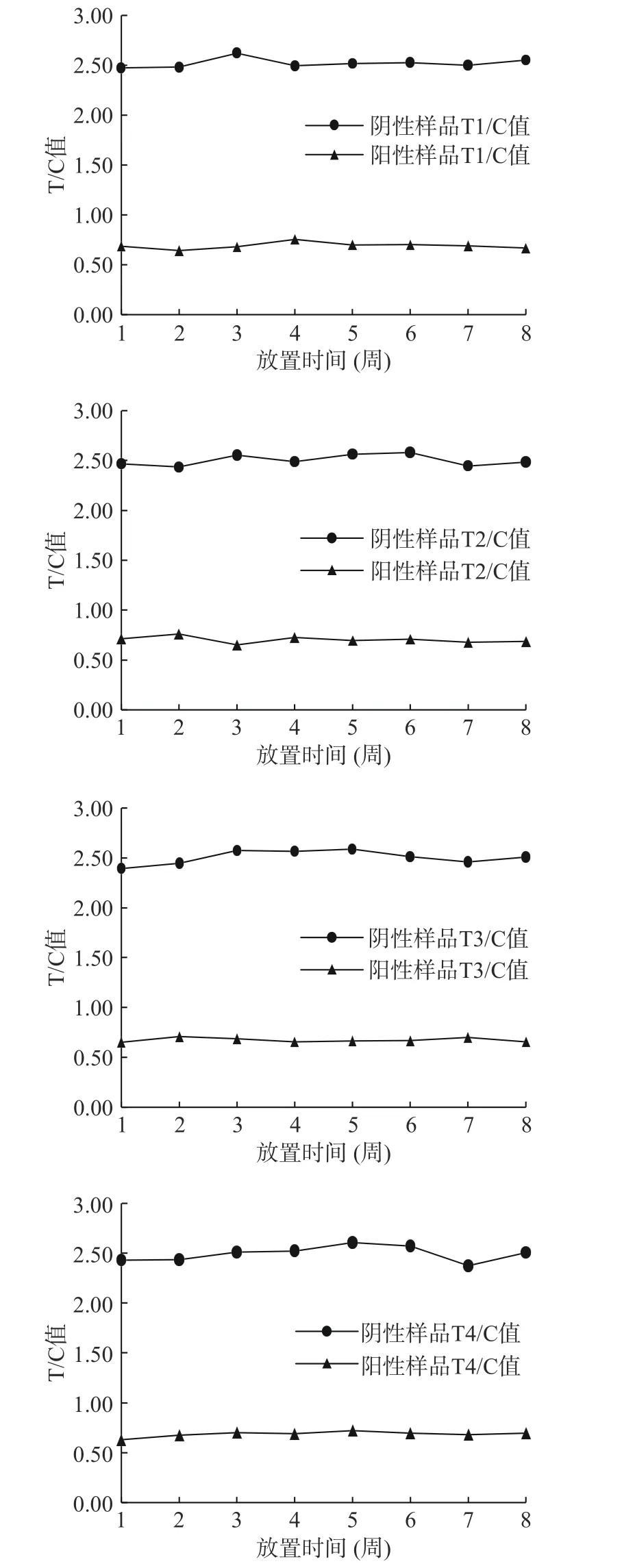
图8 四线卡稳定性测定Fig.8 Stability determination of four lines card
2.4.4 与仪器方法比较 分别采用四线卡和仪器方法(GC-MS或LC-MS/MS)检测普通白菜、菜豆、柑橘样品中毒死蜱等4种农药残留。添标试验结果如表3所示,四线卡和仪器方法对阴性样本和阳性添标样品的检测结果一致。盲样试验结果如表4所示,四线卡检测结果未出现假阳性和假阴性,与仪器法的符合率达100%。结果表明,四线卡与仪器方法的检测结果一致,适用于果蔬样品中毒死蜱、氟虫腈、克百威和多菌灵农药残留的检测。
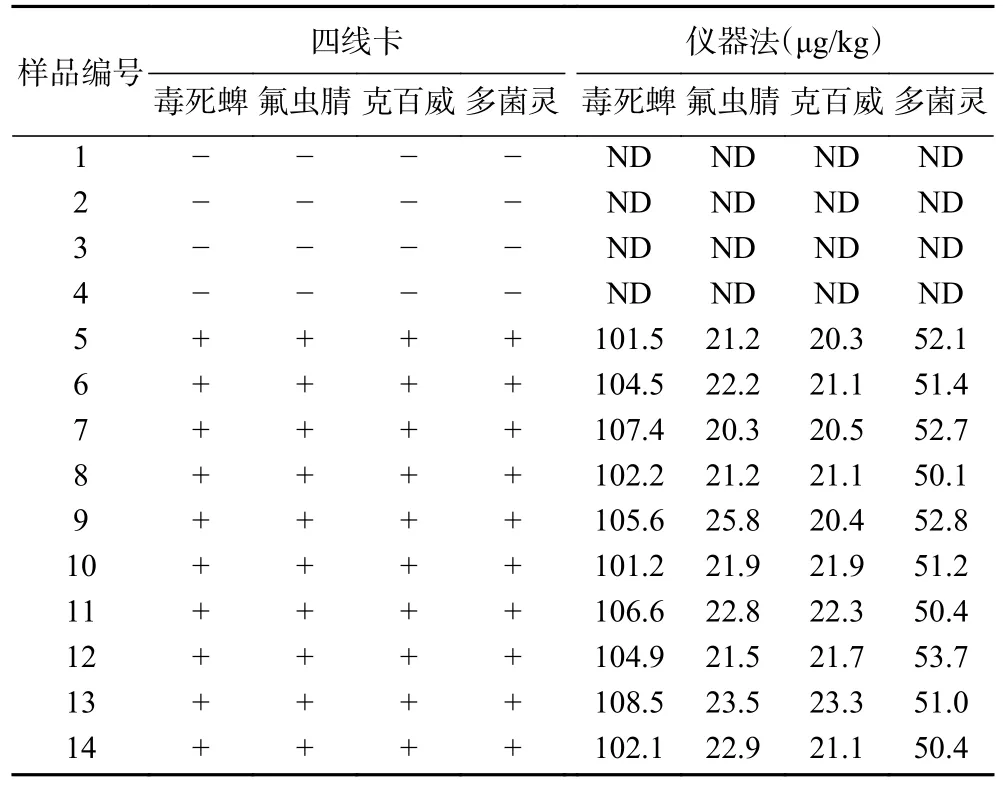
表3 四线卡与仪器法添标检测结果比对Table 3 Comparison of standard addition test results of four lines card and instrumental method
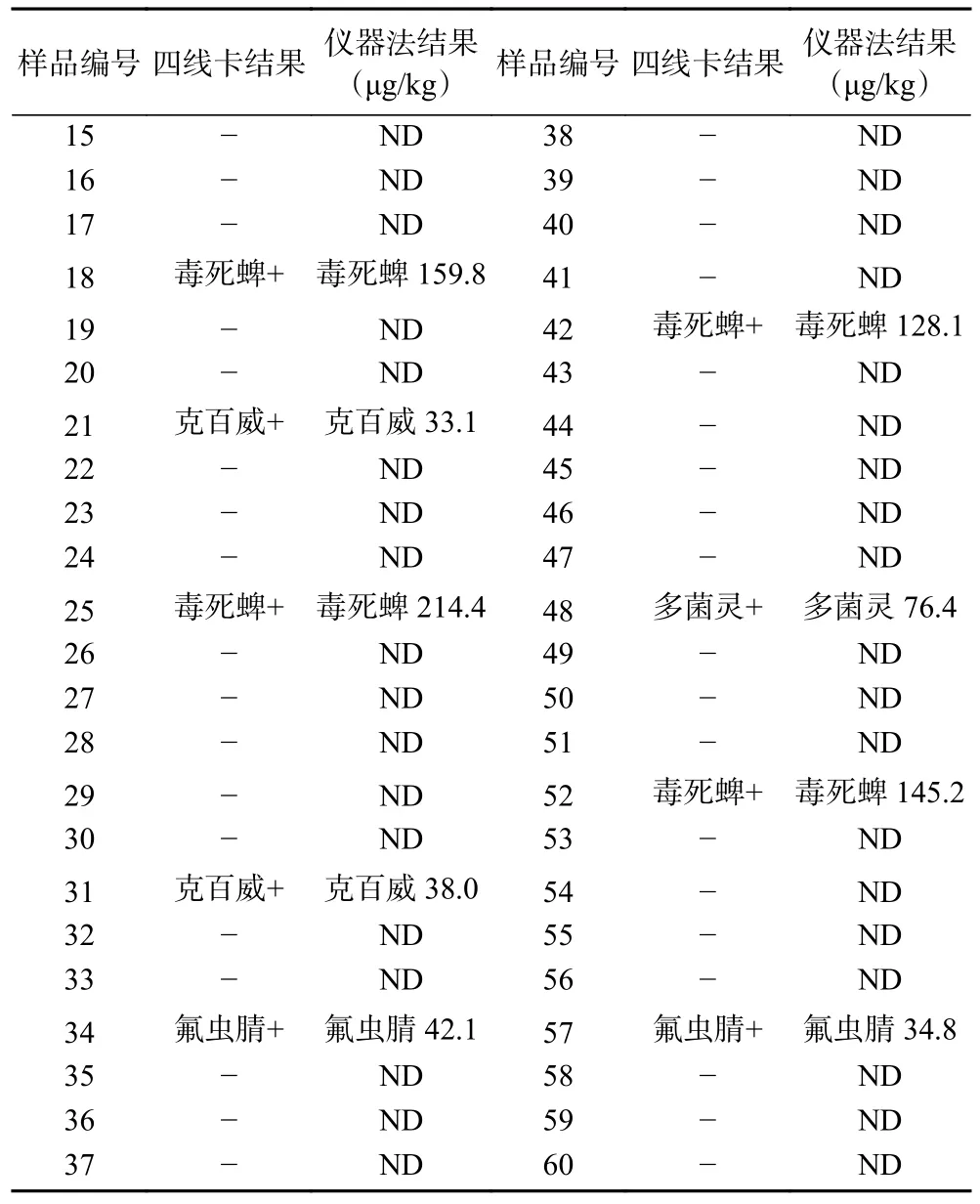
表4 四线卡与仪器法盲样检测结果比对Table 4 Comparison of blind sample test results of four lines card and instrumental method
3 结 论
本研究采用胶体金免疫层析法,构建了4个抗原-抗体组合的农药多残留检测的免疫胶体金四线卡,用于水果和蔬菜中毒死蜱、氟虫腈、克百威、多菌灵等农药残留的快速检测。鉴于样品前处理时需要同时提取四种农药成分,经优化后选用乙腈作为提取溶剂,提取时间为5 min,提取结果满意,整个检测过程约15 min。在优化后的条件下对四线卡进行性能评价,毒死蜱的检出限为0.1 mg/kg、氟虫腈为0.02 mg/kg、克百威为0.02 mg/kg、多菌灵为0.05 mg/kg。在特异性方面,除了丁硫克百威对克百威的交叉反应率为20%,对检测结果有影响,其余药物的交叉反应率均小于5%,不影响检测结果,所以,当克百威检测结果为阳性时,需要考虑到待测样品中丁硫克百威的含量情况。在保存期内稳定性良好,且实际样品的检测结果与仪器法结果一致。本研究制备的胶体金免疫层析四线卡操作简单,可同时检测四个农药指标,通量高,成本低,且大大降低了检测时间,为果蔬的农药残留快速检测工作提供有利保障。
