藜麦酸浆中淀粉絮凝菌的分离鉴定及在藜麦蛋白提取中的应用
2023-03-12石学梅李婉萌
石学梅,李婉萌,林 剑
(烟台大学生命科学学院,山东烟台 264000)
藜麦中蛋白质含量可达到11%~19%,高于传统作物水稻和玉米,可作为一种能够提供高蛋白质和低热量的主食替代品[1],亦可代替大豆蛋白应用于食品加工[2]。目前,藜麦蛋白的提取方法包括:盐溶法[3]、湿法研磨[4]、有机溶剂提取法[5]、碱溶酸沉法[5]、反胶束萃取技术[6]、膜分离法[3]和酶解法[7]等,其中用于提取藜麦蛋白最为广泛的方法是碱溶酸沉法,但这些方法普遍存在高耗能、高废水等缺点。
酸浆法是指利用酸浆中的微生物提取淀粉的一种方法,在植物淀粉提取、粉丝生产方面已有广泛的应用,其分离淀粉的主要机理是依靠酸浆中微生物对淀粉的凝聚作用及金属离子与有机酸对淀粉的沉降作用[8],在生产中酸浆可取代其他化学试剂,作为一种良好的天然絮凝剂,从而减少生产过程对环境的污染,降低生产能耗。在酸浆法沉降其他植物源淀粉的应用实例基础上,利用酸浆法沉降藜麦淀粉[9−11],进而分离提取出藜麦蛋白的可行性较高。
酸浆是植物淀粉乳在微生物自然发酵过程中形成的一种有微酸气味的乳白色或淡黄色液体,在淀粉生产过程中可以加快淀粉的沉降速度,促进淀粉与蛋白质、纤维等杂质的快速分离[5,12],在生产中酸浆可作为一种良好的天然微生物絮凝剂。大量的研究表明,酸浆中对淀粉的沉淀作用主要与微生物活性和酸浆pH有关。卢光莹等[13]、郑玮等[14]研究证明酸浆中起主要作用的微生物是乳酸乳球菌,且其对淀粉的沉降能力受到某些阳离子的影响[15];吴企禾[16]、季子非[17]等研究证明野生酵母菌也能结合并沉淀甘薯淀粉,将乳酸链球菌和酵母菌混合作用于沉降甘薯淀粉,效果比使用单一菌株更佳。目前,我国在酸浆法分离淀粉方面已有许多成功的经验,利用酸浆法生产甘薯淀粉的技术在我国的河北、四川、山东、河南等地使用广泛[18],但酸浆是自然发酵产物,其生产的过程易受微生物种类、原料、气候、操作方法等外界因素的影响[19−20],在无法实现一切条件稳定可控的情况下,利用酸浆法大规模生产品质稳定的产品难以实现,因此研究酸浆中的微生物类群对有效提升酸浆法的生产效率起关键性作用。
本研究用平板分离法,以淀粉絮凝率和产乳酸量为指标,从自然发酵的藜麦酸浆中分离筛选出四株乳酸细菌,根据其形态学特征、生理生化实验以及16S rDNA基因序列分析对筛选出的菌株进行鉴定,并应用于藜麦蛋白的提取,以藜麦蛋白提取率为指标,对其在藜麦蛋白中的提取特性进行分析,为浆法提取藜麦蛋白的深入研究奠定基础。
1 材料与方法
1.1 材料与仪器
甘薯酸浆水 烟台麦特尔生物科技有限公司提供;藜麦 山引2号,原产地南美,烟台大学作物分子育种&基因组学实验室提供;蛋白胨、牛肉膏、葡萄糖、氯化钠、盐酸、氢氧化钠、无水乙醇、过氧化氢国药集团化学试剂有限公司;酵母粉 安琪酵母股份有限公司;乳酸、谷氨酸-葡萄糖标准液 济南延和生物科技有限公司;琼脂粉、硫酸镁、硫酸锰、柠檬酸氢二铵、无水碳酸钙 天津光复科技发展有限公司;磷酸氢二钾 天津市科密欧化学有限公司;细菌DNA提取试剂盒 天根生化科技有限公司;2×Taq Plus Master Mix 诺唯赞生物科技股份有限公司。
FA1004N电子分析天平 奥豪斯国际贸易有限公司;FJ300-SH高速分散均质机 上海标本模型厂;SW-CJ-1FD双人单面洁净工作台 苏洁净化设备有限公司;SPX-250B-Z生化培养箱 上海森信有限公司;WYS-100C生物显微镜 尼康映像仪器有限公司;ALLegre台式高速离心机 美国贝克曼公司;TU-1810超微量分光光度计 北京普析通用仪器有限公司;C1000凝胶成像仪 美国Bio-Rad;T100PCR仪 美国Biometra;B1-BP PowerPac Basic电泳仪美国Invitrogen;SBA-40E生物传感分析仪器 济南延和生物科技有限公司。
1.2 实验方法
1.2.1 自然发酵藜麦酸浆的制备工艺 麦籽粒反复洗涤、45 ℃烘干→粉碎至100目→以料液比1:20 g/mL比例加去离子水→均质形成藜麦粉乳→加入10%(v/v)的初始酸浆→双层纱布过滤,弃上清→沉淀加去离子水调整醪液浓度为10%(v/v)→静置沉淀20~26 h→过滤,弃沉淀→藜麦酸浆[21]
1.2.2 菌株的分离筛选 取藜麦酸浆样1 mL,使用0.9%的无菌生理盐水对其进行10倍梯度稀释,取10−4、10−5、10−6稀释度的酸浆水各100 μL,分别注入灭菌后的MRS碳酸钙固体培养基中摇匀,待培养基凝固后,倒置于37 ℃恒温培养箱中培养48 h。菌落形成后,观察平板上形成的菌落状态,在无菌环境下,挑取产生钙溶解圈的单菌落划线接种到MRS固体培养基平板上,37 ℃培养48 h,反复划线纯化3代以上。根据菌落形态的差异最终挑选出16株菌株,将其转接于MRS斜面培养基中培养至长出菌落。将初步筛选出的菌株在MRS液体培养基中活化后,使用无菌生理盐水将菌悬液浓度调至1×109CFU/mL,然后按照1%的接种量接入灭菌后的MRS液体培养基中,在37 ℃厌氧条件下培养24 h得到纯菌发酵液,以上操作做两组平行样品分别用于菌体产酸能力的测定和菌体对藜麦淀粉沉淀能力的测定,以发酵液中乳酸产量和淀粉絮凝率[22]为指标,筛选出产乳酸能力强,淀粉絮凝率高的优良菌株。
1.2.3 纯菌发酵液中乳酸含量的测定 使用生物传感分析仪测定纯菌发酵液中的乳酸含量。取5 mL纯菌发酵液,使用0.2 mm水系滤膜过滤后,取10 μL过滤后的发酵液测定乳酸含量。
1.2.4 藜麦淀粉絮凝率的检测方法 在25 mL量筒中加入体积为20 mL,浓度为5%(v/v)的藜麦醪液,再加入2 mL空白液体培养基,使用玻璃棒快速搅拌均匀后,静置沉淀30 min,取量筒18 mL处的溶液,在600 nm处测定吸光值记为A;保持其他条件不变的情况下,将加入2 mL空白液体培养基改为加入2 mL纯菌发酵液,并在600 nm处测定吸光值记为B,絮凝率计算公式为[21,23]:
式中:A表示空白液体培养基下的淀粉絮凝率,%;B表示纯菌发酵液下的淀粉絮凝率,%。
1.2.5 菌株的鉴定
1.2.5.1 菌株的形态学观察 将筛选出的优良菌株接种于MRS固体培养基中,37 ℃培养1~2 d,观察菌落的生长情况,包括:溶钙圈、菌落的形态、质地、边缘情况、色泽、大小、透明度等特征,挑取单菌落进行革兰氏染色镜检。
1.2.5.2 菌株的生理生化鉴定 参照《伯杰细菌鉴定手册》对筛选出的纯菌株进行过氧化氢酶实验、运动性实验、H2S生成实验、硝酸盐还原实验、明胶液化实验、吲哚实验、精氨酸产氨实验、葡萄糖产气实验和糖发酵实验。
1.2.5.3 菌株的分子生物学鉴定 将菌株接种于MRS液体培养基中培养,使用天根细菌基因组DNA提取试剂盒提取菌体DNA,并进行1.0%琼脂糖凝胶电泳检测;以提取的DNA为模板,采用细菌通用引物(正向引物27F:5'-AGAGTTTGATCCTGG CTCAG-3',反向引物1492R:5'-GGTTACCTTGTTA CGACTT-3')进行PCR扩增。PCR扩增程序:95 ℃预变性5 min;94 ℃变性30 s;57 ℃退火30 s;72 ℃延伸2 min,循环30次;72 ℃修复延伸10 min,产物经1%琼脂糖凝胶电泳检测后送至上海生工生物有限公司测序。将测序结果与GenBank数据库中的已知菌株进行BLAST比对,并利用MEGA 11.0软件构建系统发育树。
1.2.6 菌株QSL12在藜麦蛋白分离提取中的应用
1.2.6.1 接种量对藜麦蛋白分离提取的影响 菌株活化后,取2 mL菌液再次接种至MRS液体培养基,37 ℃扩大培养12 h,使用无菌生理盐水将菌悬液浓度调至1×109CFU/mL备用。确定初次沉淀醪液浓度50 g/L,初次沉淀时间30 min,二次沉淀醪液浓度120 g/L、二次沉淀时间20 h,发酵温度26 ℃条件下[24],分别按照6%、7%、8%、9%、10%(v/v)的比例加入菌悬液制备酸浆,将其用于藜麦淀粉与蛋白的分离,以蛋白质提取率为指标,探究不同的接种量对藜麦蛋白提取的影响。
1.2.6.2 发酵温度对藜麦蛋白分离提取的影响 确定初次沉淀醪液浓度50 g/L,初次沉淀时间30 min,接种量7%(v/v),二次沉淀醪液浓度120 g/L、二次沉淀时间20 h条件下,分别在18、22、26、30、34 ℃进行发酵制备酸浆,将其用于藜麦淀粉与蛋白的分离,以蛋白质提取率为指标,探究不同的发酵温度对藜麦蛋白提取的影响[25]。
1.2.7 指标测定 淀粉含量测定:参照国标GB 5009.9-2016《食品安全国家标准食品中淀粉的测定》[26];蛋白质含量测定:参照国标GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》[27],蛋白质提取率计算公式如下:
1.3 数据处理
每组实验平行3次,使用Excel和SPSS22.0对数据进行分析处理,数值以平均值±标准差的方式表示[28−29],使用Origin2021进行作图分析。
2 结果与分析
2.1 菌株的分离筛选
按照1.2.2所述实验方法,将16株菌株的菌液按1%的接种量转接至MRS液体培养基,培养24 h后测定发酵液中乳酸产量,结果如图1所示。
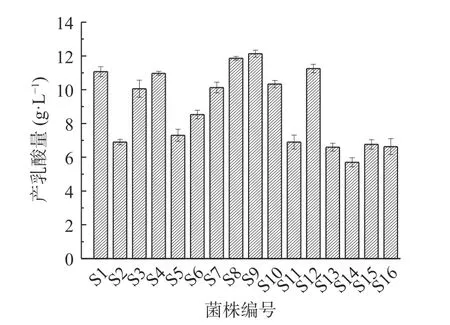
图1 发酵液产乳酸量Fig.1 Fermentation solution lactic acid production
由图1可以看出,发酵液所有菌株均有乳酸生成,其中QSL8菌株和QSL9菌株产酸能力最强,其乳酸产量分别可以达到11.86±0.12和12.13±0.21 g/L。
按照1.2.4实验方法,得出16株菌株的藜麦淀粉絮凝率如图2所示。
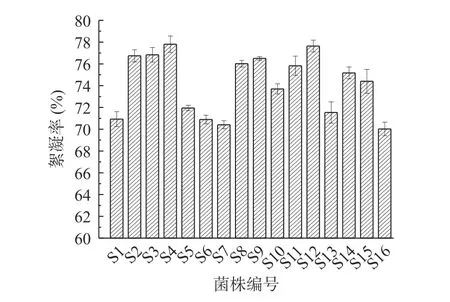
图2 S1~S16菌株对藜麦淀粉沉淀能力比较Fig.2 Comparison of the ability of S1~S16 strains to precipitate quinoa starch
由图2可知,所有菌株对藜麦淀粉均有沉降能力,其中菌株QSL4和QSL12对藜麦淀粉的絮凝率最高,分别达到77.81%±0.75%和77.64%±0.94%。部分纯菌发酵液沉降藜麦淀粉的过程如图3所示。由图3可知,在较短的时间里,纯菌发酵液对藜麦淀粉有明显的沉降效果,且菌株QSL4对藜麦淀粉的沉降速度略高于菌株QSL12。

图3 菌株QSL4和QSL12的纯菌发酵液沉淀淀粉的过程Fig.3 Starch precipitation process of sterile fermentation liquid of strains QSL4 and QSL12
综合产酸能力和藜麦淀粉絮凝率两个指标,最后筛选出QSL4、QSL8、QSL9、QSL12四株优良菌株进行鉴定。
2.2 菌株的鉴定
2.2.1 菌株的形态特征 四株菌株在MRS-CaCO3固体培养基上的菌落形态如图4所示,细胞形态如图5所示。
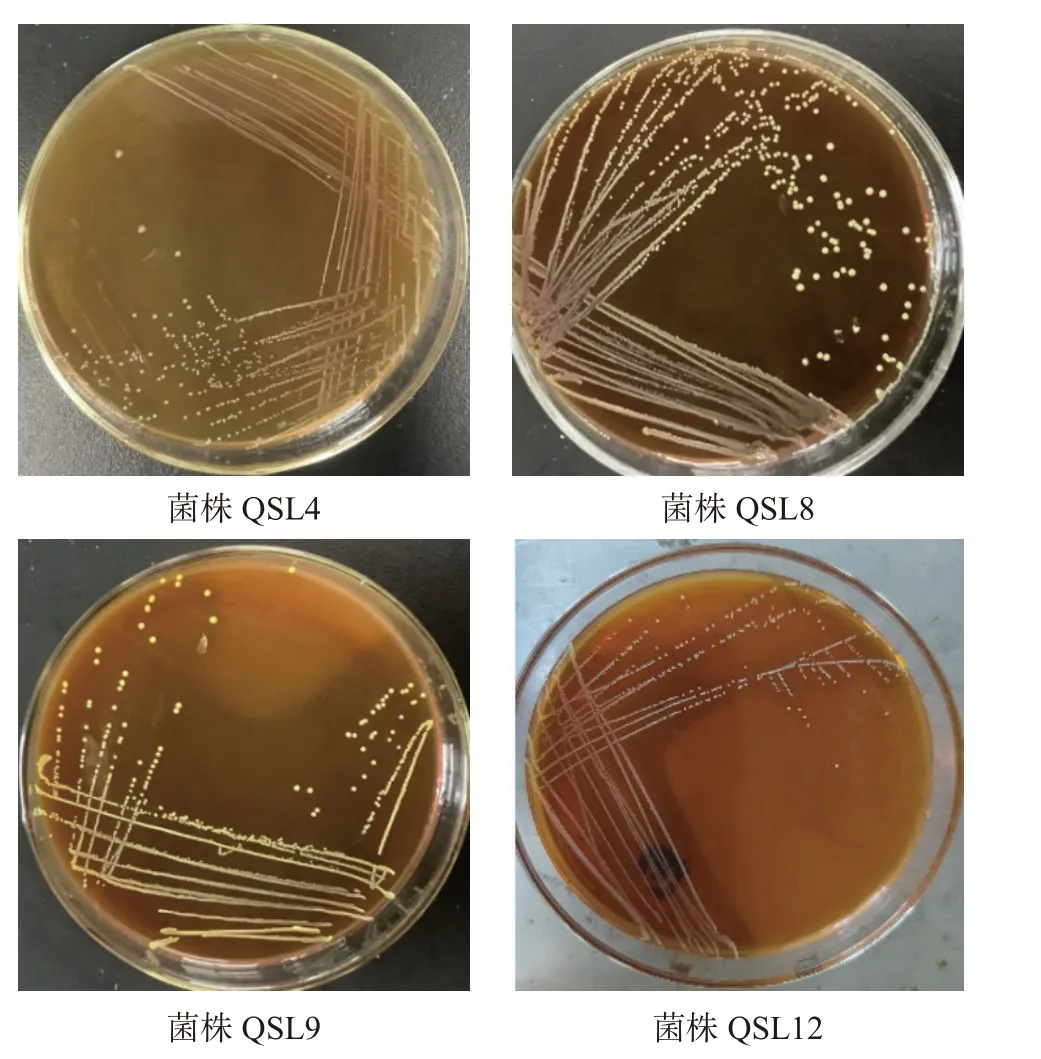
图4 菌株的菌落形态Fig.4 Colony morphology of the strain
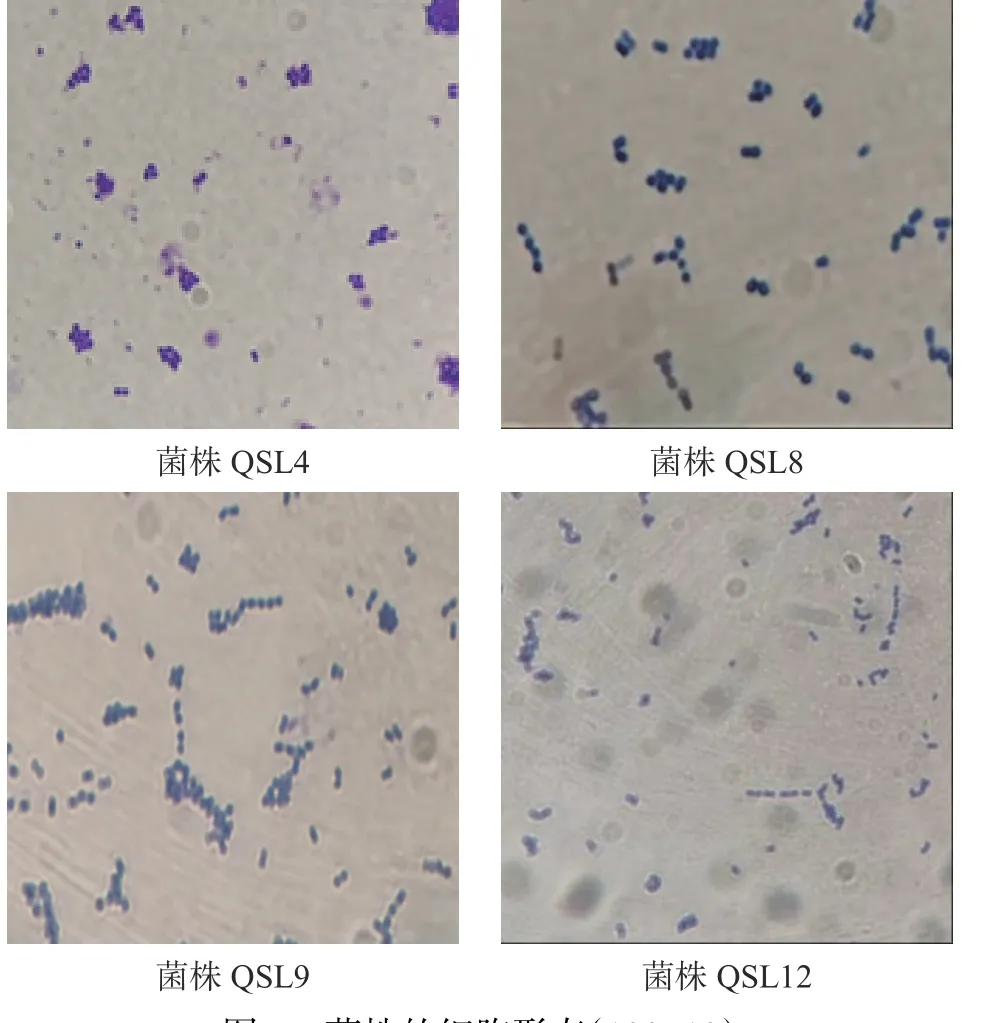
图5 菌株的细胞形态(100×10)Fig.5 Cell morphology of strain (100×10)
由图4~图5可知,菌落形态均为中央隆起、边缘整齐、表面光滑、乳黄色或乳白色,大小约0.3~1.5 mm之间,经革兰氏染色后,均为革兰氏阳性菌,在显微镜下菌体呈球状或短杆状。详细菌株特征结果见表1。

表1 菌株特征Table 1 Strain characteristics
2.2.2 菌株生理生化鉴定 参照《伯杰细菌鉴定手册》,对四株菌株进行生理生化实验,结果见表2,初步判断四株菌株为肠球菌属(Enterococcus)。
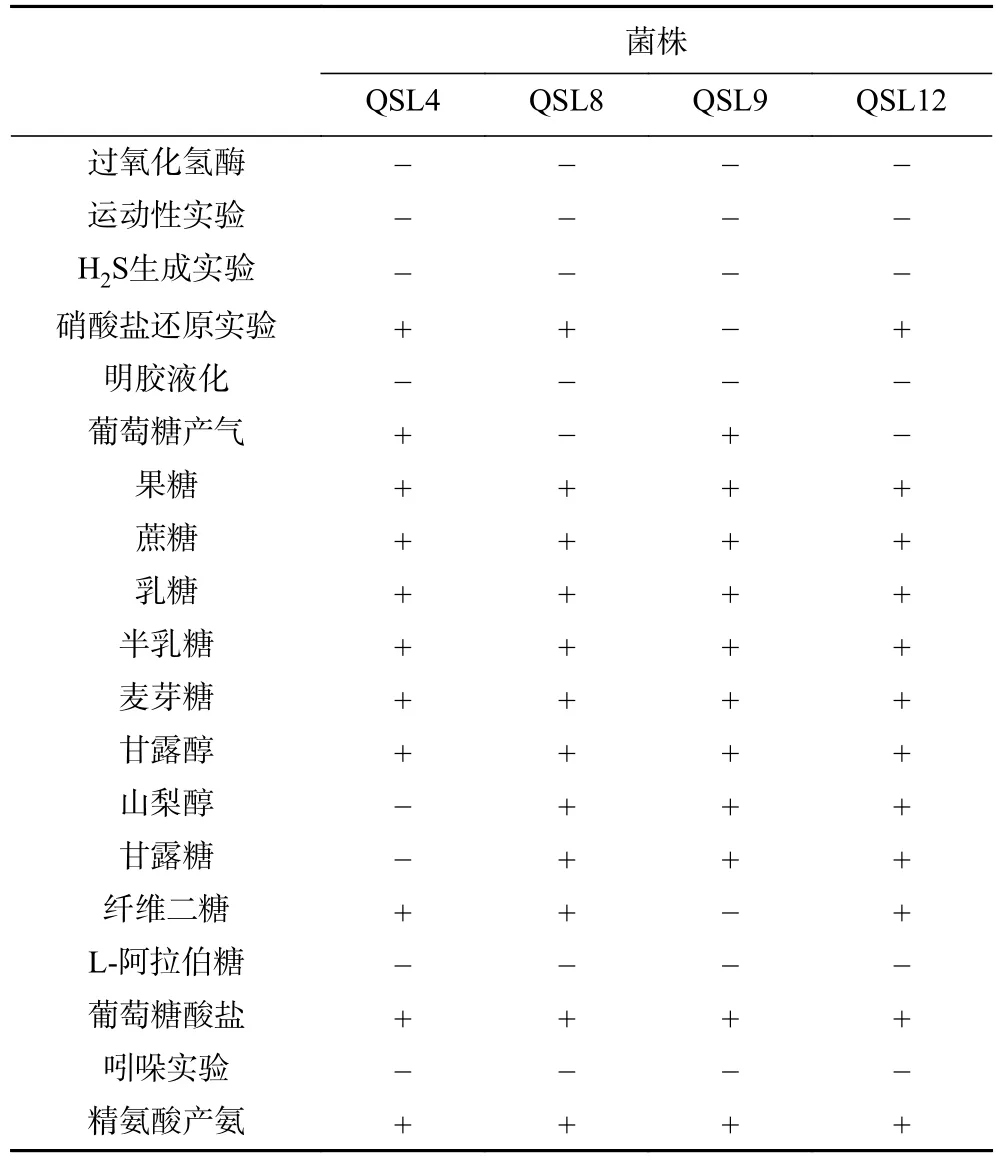
表2 四株菌株的生理生化实验结果Table 2 Physiological and biochemical characterization of four strains
2.2.3 菌株分子生物学鉴定
2.2.3.1 菌株DNA的提取及16S rDNA序列扩增参照细菌DNA提取试剂盒说明书提取基因组DNA,产物进行1%琼脂糖凝胶电泳检测。分别以提取的四株菌的DNA为模板,利用通用引物27F和1492R进行PCR扩增,得到的PCR产物进行1%琼脂糖凝胶电泳,结果如图6所示,PCR产物条带分子量均在1500 bp左右,且条带明亮无明显拖尾。
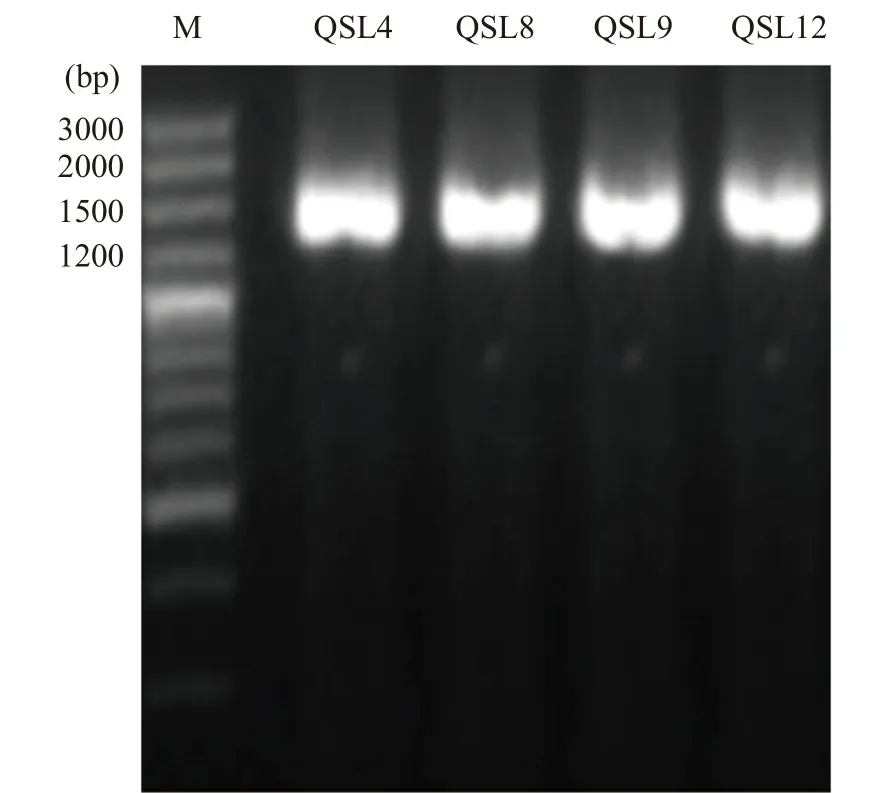
图6 四株菌株的16S rDNA PCR电泳图Fig.6 Electrophoresis of the PCR amplification of 16S rDNA gene of the four strains
2.2.3.2 菌株16S rDNA序列分析及系统发育树的构建 测序结果表明,QSL4的16S rDNA序列共2689 bp,QSL8的16S rDNA序列共2366 bp,QSL9的16S rDNA序列共2444 bp,QSL12的16S rDNA序列共2547 bp。将碱基序列与NCBI数据库中已知碱基序列进行BLAST比对,部分比对结果见表3。

表3 菌株的同源相似性分析Table 3 Homology similarity analysis of strains
结果表明:四株菌的同源性均可达到98%以上,可以判定其属于同种。结合菌株形态学特征、生理生化实验结果以及16S rDNA序列比对可以判定菌株SQL4为屎肠球菌(Enterococcus Faecium)、SQL8为耐久肠球菌(Enterococcus durans)、SQL9为蒙氏肠球菌(Enterococcus mundtii)、SQL12为乳肠球菌(Enterococcus lactis)。根据同源性比对结果,利用MEGA 11.0软件构建系统发育树,结果如图7所示。

图7 四株菌株的系统进化树Fig.7 Phylogenetic tree of four strains
2.2.4 分离菌株在藜麦蛋白分离提取中的应用
2.2.4.1 接种量对藜麦蛋白分离提取的影响 按照1.2.6.1所述方法,探究不同接种量对藜麦蛋白提取的影响,结果如图8所示。
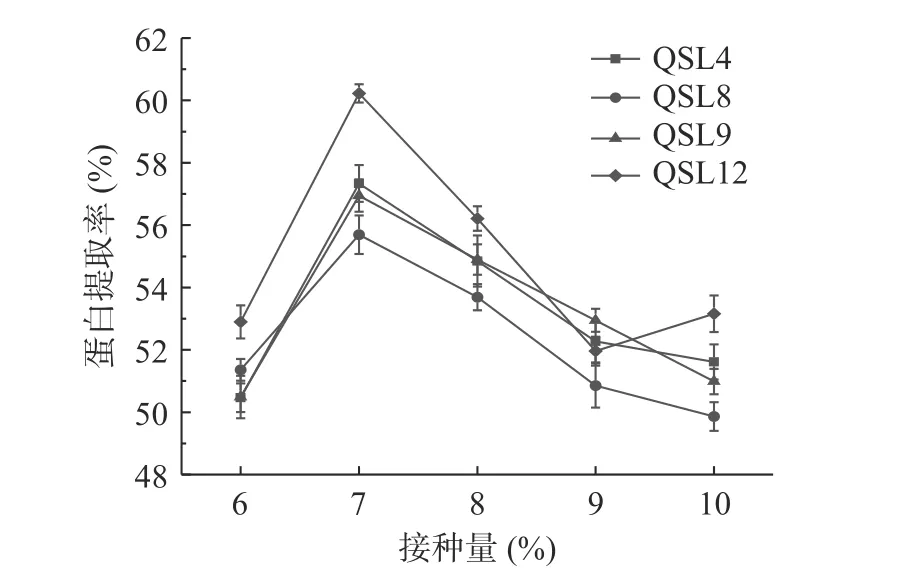
图8 接种量对蛋白提取率的影响Fig.8 Effect of inoculated volume on protein extraction rate
由图8可知,当接种量在6%~7%范围内时,蛋白质提取率随接种量增加而提高,接种量为7%时,菌株QSL12的蛋白质提取率最大,达到60.23%,接种量较低时,微生物生长速度慢,增加接种量可以缩短微生物生长延滞期,提高蛋白质提取率,但当接种量高于7%时,随着接种量的持续增加,蛋白质提取率逐渐降低,结合混合液中的pH(图9),推测可能是因为随着接种量的增加,酸浆pH过低而影响藜麦蛋白的溶解度[25]。因此,提取藜麦蛋白的最适接种量为7%。

图9 接种量对pH的影响Fig.9 Effect of inoculated volume on pH
2.2.4.2 温度对藜麦蛋白分离提取的影响 按照1.2.6.2所述方法,探究不同温度对藜麦蛋白提取的影响,结果如图10所示。
由图10可知,在一定条件下,当温度为18~26 ℃时,蛋白质提取率随温度的升高而增加,特别是菌株QSL12,当温度为26 ℃时,蛋白质提取率达到最大值62.39%,这是由于随着温度的升高,蛋白质的分子构象会发生微变,有利于蛋白质分子间的相互作用;随后随着温度不断升高,蛋白质提取率显著降低,酸浆发酵的过程也是菌株生长代谢的过程,一方面温度会影响菌体生长及菌体细胞中各种酶的活性,进而影响菌体功能,另一方面温度过高会造成部分蛋白质变性[30]。因此,提取藜麦蛋白的最适温度为26 ℃。

图10 温度对蛋白提取率的影响Fig.10 Effect of temperature on the quality of sour liquid
3 讨论与结论
藜麦中的蛋白含量高于其它传统作物,且氨基酸组成比例均衡,含有8种必需氨基酸,尤其富含优质植物蛋白所需的组氨酸和赖氨酸,具有抗衰老、抗氧化[31]、降低胆固醇[32]等生物学功能,藜麦蛋白作为一种优质植物蛋白,对人体健康有着关键作用[2,33],但其新型产品的开发有待加强。酸浆法作为一种应用广泛的传统分离方法,巧妙地利用微生物的絮凝作用分离物质,比其他分离提取方法污染小且耗能低,但一直以来,我国在工业化生产中对酸浆法的应用始终局限于豆类、薯类淀粉以及粉丝的生产[22,34],并且无法实现大规模生产品质稳定的产品。
本研究从自然发酵的藜麦酸浆中分离筛选出4株对藜麦淀粉有较高絮凝活性的产乳酸细菌,根据形态学特征、生理生化实验以及16S rDNA序列比对分析对其进行鉴定,并构建系统发育树。结果表明:菌株QSL4为屎肠球菌(Enterococcus faecium)、QSL8为耐久肠球菌(Enterococcus durans)、QSL9为蒙氏肠球菌(Enterococcus mundtii)、QSL12为乳肠球菌(Enterococcus lactis)。选取菌株QSL12应用于藜麦蛋白的提取中,通过单因素实验,对其在藜麦蛋白中的提取特性进行分析,结果表明:当接种量为7%,发酵温度为26 ℃时,菌株QSL12对藜麦蛋白的提取效果最好,可以达到60.23%和62.39%,均高于碱提酸沉法52.13%。研究结果为酸浆法提取藜麦蛋白的深入研究奠定基础。且研究分离出的乳肠球菌属于乳酸菌中的肠球菌属,目前,肠球菌在干酪发酵剂、益生菌、微生态制剂的开发方面有着十分重要的探究价值[35−37],肠球菌的研究为制备标准化酸浆,实现酸浆法提取植物蛋白的工业化生产具有重要意义,进一步拓展了酸浆法的应用领域。
