发酵香肠乳酸菌筛选及其对产品品质的影响
2023-03-12赵银峰周春燕宁家文吉莉莉
赵银峰,黄 倩,周春燕,宁家文,王 蜀,聂 庆,吉莉莉
(成都大学食品与生物工程学院,肉类加工四川省重点实验室,四川成都 610106)
香肠是我国传统肉制品,具有独特的色泽和风味,受到广大消费者的青睐。随着生活水平日益提高,消费者对香肠的品质、营养及安全性等要求也越来越高,而生产条件、原料质量、微生物等是直接的影响因素。微生物对发酵香肠品质及安全性的影响,已成为了研究的热点。葡萄球菌属、乳杆菌属、片球菌属及乳球菌属等是中式香肠的核心微生物,其中乳杆菌属中许多优良的菌株因具有抑制腐败菌和致病性微生物生长、抗氧化活性等生物功能,以及对蛋白质、脂质及氨基酸的释放明显促进作用,已经被广泛应用到中式香肠的生产中[1−3]。乳酸杆菌在发酵香肠中能通过代谢活动产生大量有机酸,如柠檬酸、苹果酸、乳酸等,对风味的形成有重要意义[4]。最近已有研究表明植物乳杆菌具有潜在提升发酵食品感官属性的特点,但对四川香肠的理化特性、抗氧化性以及特征风味物质影响尚不清楚。而香肠的制作对季节、环境等因素有一定的要求,而原料来源的不同也会影响研究的客观性。采用更简单的模型作为前期菌株筛选方式,能快捷有效地探究微生物对香肠风味及品质的影响,对香肠现代化生产的发展有重要意义并提供一定理论基础。
本文通过研究四株乳酸菌在香肠模型中的主要风味物质变化,筛选出一株对香肠风味有明显提升作用的乳酸菌M-25,并经16S rDNA鉴定为植物乳杆菌。为探究植物乳杆菌M-25对香肠理化特性及风味物质影响,在发酵期间分别检测了对照组和植物乳杆菌发酵香肠的理化、抗氧化以及风味物质的动态变化。应用有监督的偏最小二乘模型分析,进一步明确了植物乳杆菌M-25在香肠中的特征风味物质及影响。本文通过香肠模型对优良乳酸菌的筛选及应用,将有助于改善香肠产品品质和风味特性。
1 材料与方法
1.1 材料与仪器
新鲜猪肉(里脊)及背膘 高金食品有限公司,24 h排酸后,冷链运输至实验室;猪肠衣 苏州梦点商务有限公司;食盐 中盐东兴盐化股份有限公司;成熟四川香肠 来源于肉类加工四川省重点实验室;三氯乙酸、硫代巴比妥酸、乙二胺四乙酸二钠、硫代巴比妥酸、亚硝酸钠 分析纯,成都市科隆化学品有限公司;2,4,6-三甲基吡啶 色谱纯,美国西格玛奥德里奇(上海)贸易有限公司;MRS肉汤培养基(主要包括蛋白胨10.0 g/L、葡萄糖20.0 g/L、乙酸钠5.0 g/L、牛肉粉5.0 g/L、酵母粉4.0 g/L等成分) 北京奥博星生物技术有限公司;葡萄糖、葡萄糖酸内酯 上海源叶生物科技有限公司。
HD-3A智能水分活度测量仪 无锡华科有限公司;Testo 205插入式pH计 德国仪表(深圳)有限公司;LC98IAAA氨基酸分析仪 北京温分分析仪器公司;5977A-7890B气相色谱-质谱联用仪(含PAL3自动进样器) 美国安捷伦公司;CR-400色差仪 柯尼卡美能达有限公司;BFJX-500智能调控风干发酵装置 浙江嘉兴艾博公司。
1.2 实验方法
1.2.1 菌株分离纯化 取成熟四川香肠10 g,经稀释涂布于MRS固体培养基,培养在37 ℃恒温培养箱中,48 h后挑取单个菌落划线于固体培养基。待长出单个菌落进行革兰氏染色并在显微镜下观察细菌形态。挑取镜检下细菌形态相同的菌落,于37 ℃,160 r/min的摇床中充分振荡培养,画线于MRS斜面培养基,放置于4 ℃冰箱以待备用。选取命名为M-2,M-3,M-11,M-25的四株乳酸菌作为本次研究对象。
1.2.2 菌株活化 将M-2、M-3、M-11、M-25四株菌接种于MRS肉汤培养基活化,并保留菌液备用。
1.2.3 香肠模型制备 肌原纤维蛋白提取:将除去脂肪、结缔组织的新鲜猪里脊切块,用0.1 mol/L Tris-HCL,20 mmol/L EDTA,在pH7.0的条件下,于搅拌机中均质匀浆(1:4,w/v)。在4 ℃,10000 r/min下离心10 min,除去上清液,并重复2次。将沉淀(肌原纤维蛋白)置于−20 ℃保存直至使用。
缓冲液制备(g/L):以NaCl(30)、葡萄糖(10)、亚硝酸钠(0.15)和类似鲜猪肉中氨基酸含量的溶液混匀制备,溶液用0.22 μm的无菌滤膜过滤灭菌。
参照Almeida等[5]制作低钠香肠模型的方法略作修改。每200 mL制备好的缓冲液与肌原纤维蛋白(70 g)、30 g糜状的猪背膘(8000 r/min,0.5 min,重复3次)用搅拌机混合均匀。以106CFU/g接种量将M-2、M-3、M-11、M-25活化菌液分别接种至模型中,未接种菌液的模型体系为空白对照组CL,最后加入2 ml 56 mmol/L的葡萄糖酸内酯使得模型凝胶化。四组模型置于12 ℃恒温箱中发酵16 d,在第16 d采集样品进行GC-MS分析,筛选出对模型风味物质影响最明显的菌株作进一步研究。
1.2.4 筛选菌株的鉴定 利用通用引物7F(5'-CAG AGTTTGATCCTGGCT-3')和1540R(5'-AGGAGGT GATCCAGCCGCA-3'),以细菌基因组为模板,扩增16S rDNA,纯化测序,并将测序提交至NCBI的GenBank数据库,使用BLAST程序与已有菌株的16S rDNA序列进行相似性比较,确定该菌株的分类地位。
1.2.5 香肠制备 参考Tang等[6]香肠的制作方法,略作修改。香肠以猪廋肉和背膘(7:3),2.5%食盐制备。实验组(LP)中添加浓度为106CFU/g的菌液,对照组(CL)添加等体积的生理盐水,混合均匀,灌入天然肠衣,香肠用棉线扎为约15 cm/节。将灌装好的香肠悬挂于智能调控风干发酵箱中,在温度12~15 ℃,相对湿度70%~75%条件下风干3 d,取出并真空包装,置于15~18 ℃室温中储藏至14 d。
1.2.6 pH的测定 采用插入式pH计直接检测香肠的pH。
1.2.7 Aw的测定 将切碎后的香肠肉样置于样品皿中均匀铺开,样品高度约为样品皿的2/3,置于水分活度仪中自动检测。
1.2.8 菌落总数的测定 参照GB/T 4789.2-2016《食品卫生微生物学检验:菌落总数测定》,用稀释平板计数法测定细菌总数[7]。
1.2.9 色差的测定 色差仪在使用前先用白板进行矫正,将除去肠衣的香肠切碎,压成薄片后测定其亮度值(L*)、红度值(a*)、黄度值(b*)。
1.2.10 POV值的测定 按照GB 5009.227-2016《食品安全国家标准 食品中过氧化值的测定》中滴定法进行测定[8]。
1.2.11 TBARS值的测定 参照GB 5009.181-2016《食品安全国家标准 食品中丙二醛的测定》的分光光度法进行测定[9]。
1.2.12 挥发性风味物质的测定 香肠模型及香肠挥发性化合物的检测在张旭等[10]方法基础上略作修改。
前处理条件:取3 g粉碎后的肉样(凝胶模型)于20 mL顶空瓶中,加入1 μL 2 μg/μL的2,4,6-三甲基吡啶标准溶液,密封后于−20 ℃备用。设置CLC自动进样器参数条件:加热箱温度35 ℃,加热时间30 min,样品抽取时间30 min,解析时间5 min。
GC条件:压力32.0 kPa;载气为He气,流速1.0 mL/min,不分流进样;进样口温度250 ℃;升温程序:初始温度为40 ℃,保持2 min,然后以6 ℃/min升至100 ℃,保持2 min,再以4 ℃/min升至160 ℃,继续保持3 min,再以6 ℃/min升至200 ℃,最后以10 ℃/min升至220 ℃,不保持。
MS条件:电子电离源(EI);电子能量70 eV;检测器电压350 V;离子源温度230 ℃,四级杆温度150 ℃;质量扫描范围:40~500(m/z)。在GC-MS专用分析软件上进行操作,将化合物数据于NIST 14.L谱库中进行检索匹配,匹配度为80%。
1.3 数据处理
每项试验均重复三次,以平均值±标准差表示试验结果。Microsoft Excel 2016用来计算各指标的平均值±标准偏差,采用SPSS 26.0软件中的单因素方差分析,多重Tukey test进行显著性分析,差异显著表示为(P<0.05),Origin 2021绘制香肠理化特性的变化,而无监督的主成分分析(PCA)和有监督的偏最小二乘模型(PLS-DA)通过SIMCA(14.1)绘制,并以重要投影变量值和Student’s test(VIP>1,P<0.05)筛选特征风味物质。
2 结果与分析
2.1 风味菌筛选
4株菌在模型中孵育16d后风味物质浓度如表1所示。5组模型中共检出37种挥发性化合物,与CT相比,除M-2外,接种M-3、M-11、M-25均明显提升了香肠风味物质含量。对五组模型风味物质进行主成分分析可知(图1),五组模型明显的被区分为CT、M-2和M-3;M-11;M-25三类,且M-25在PCA1、PCA2正半轴上,对主成分贡献最大,其次为M-11,说明M-11和M-25与对照组风味差异明显,对香肠的风味有明显提升作用。而M-2、M-3和对照组聚集,说明接种M-2、M-3对香肠风味影响较小。在香肠中醛类、醇类、酮类和酯类往往伴随着低阈值和高含量,是香肠的特征风味物质[11]。此外,由表1可知,接种M-2的香肠中,醇类、酮类、酯类含量显著低于对照组,仅酸类物质升高。在接种M-3的香肠中,醇类、酮类和酯类含量明显升高,但对酸类和醚类无影响。而接种M-11和M-25香肠的醇类、酮类、酸类、酯类和醚类等主要风味物质含量均明显升高,且M-25(8045.63 μg/kg)的主要风味物质含量明显高于M-11(7691.37 μg/kg),说明M-25对香肠风味物质提升最大。因此,M-25被筛选为风味发酵剂。
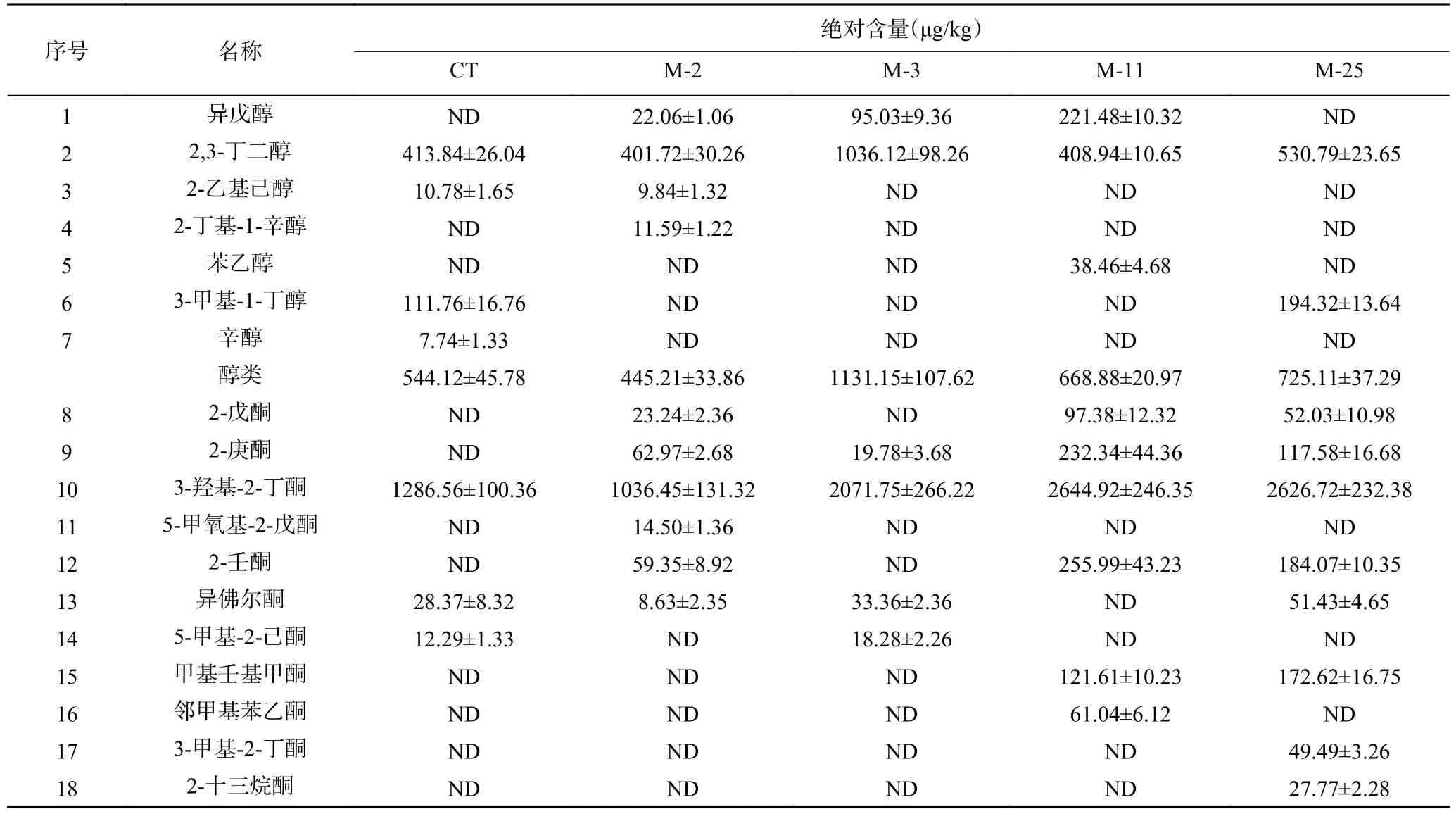
表1 16 d模型中风味化合物含量Table 1 Flavor compounds in the 16 d model
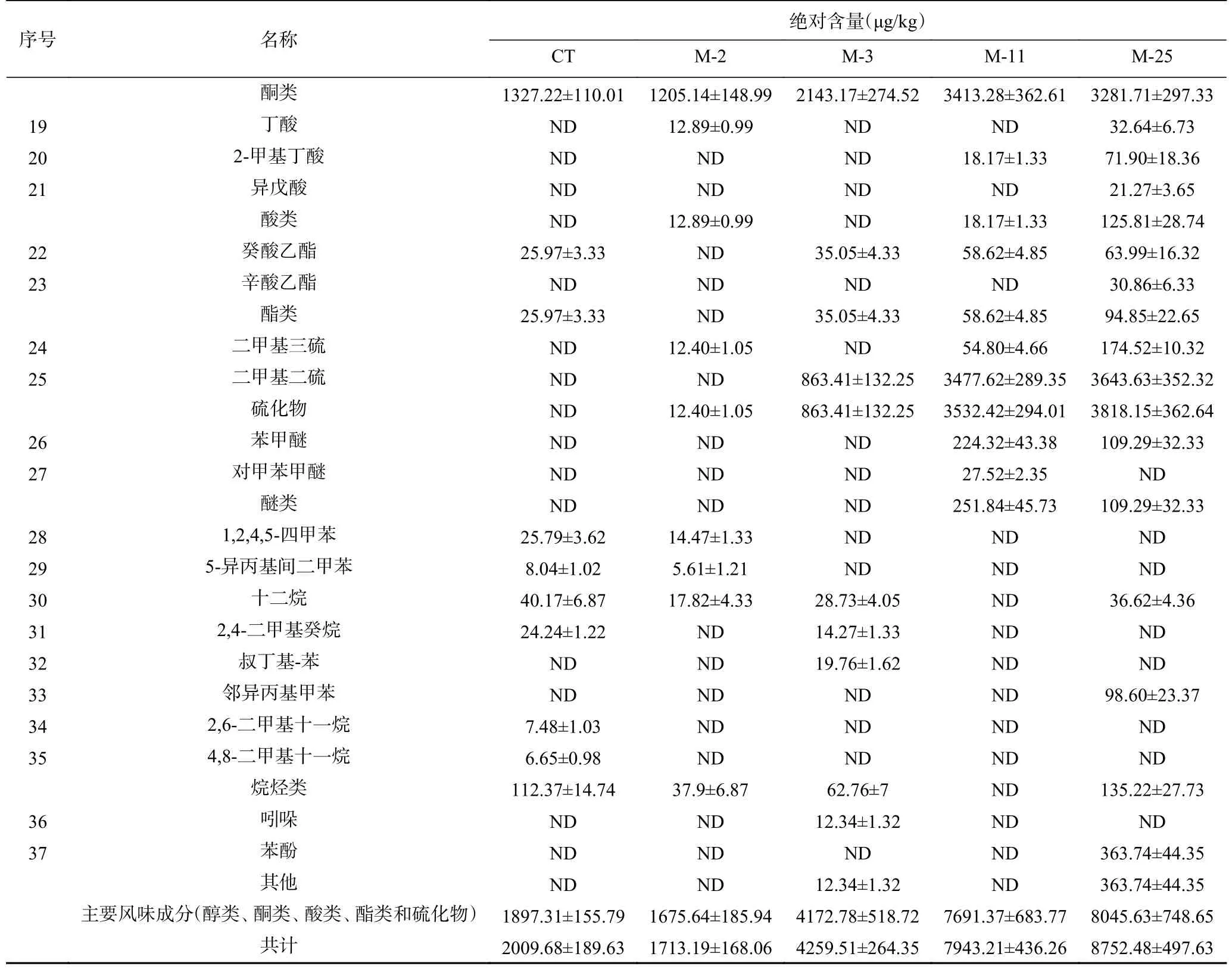
续表 1
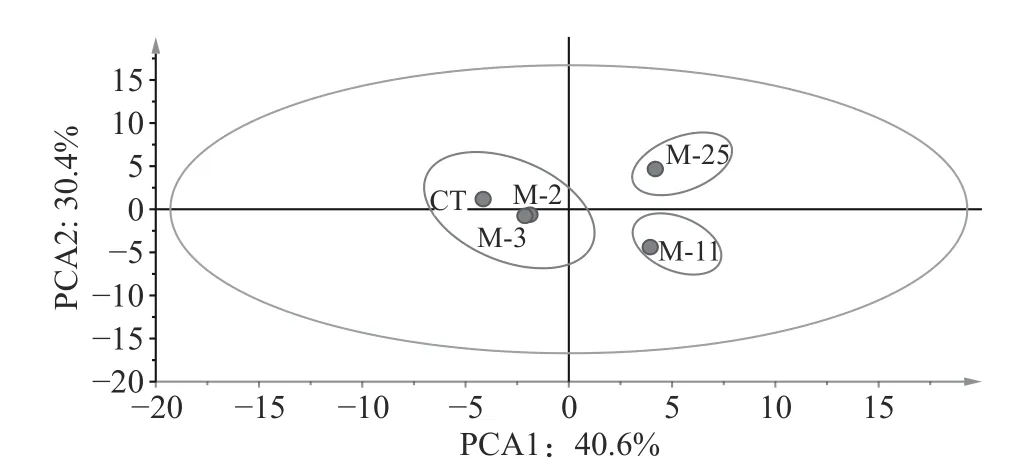
图1 第16 d模型中风味物质的主成分分析Fig.1 Principal component analysis of flavor substances in model 16 d
2.2 菌株鉴定
M-25菌株16S rDNA扩增电泳图如图2所示,序列长度约为1500 bp。通过测定,M-25菌株的序列为1476 bp。将此序列输入NCBI中,在BLAST上对比(表2)可知,M-25菌株16S rDNA的序列与NCBI的GenBank数据库中植物乳杆菌(Lactobacillus plantarum)多种属的序列相似度达到100%,表明M-25为植物乳杆菌。

表2 M-25菌株16S rDNA相似性分析Table 2 16S rDNA similarity analysis of M-25 strain
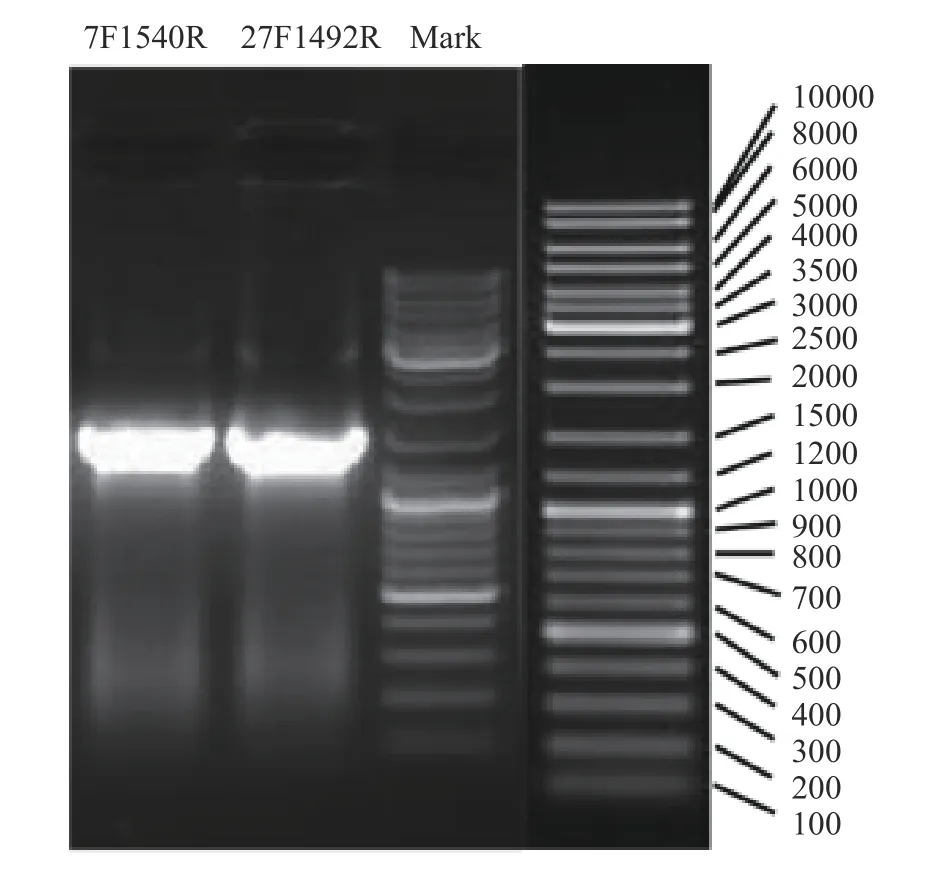
图2 M-25菌株16S rDNA扩增电泳图Fig.2 Electrophoresis of 16S rDNA amplification of M-25 strain
2.3 香肠pH的变化
如图3所示,LP为接种M-25的香肠,CL为空白对照组。两组香肠pH均先降低,后上升。冷风处理3 d后,LP组香肠pH达到最低,且显著低于CL组(P<0.05),因为乳酸菌能通过代谢碳水化合物并产生乳酸等有机酸,使香肠pH在早期快速降低,不利于腐败微生物的生长;7 d后pH缓慢上升,与Ren等[11]和Cavalheiro等[12]的结果类似,在香肠成熟后期,均发现pH缓慢上升。可能是因为蛋白水解以及肽和氨基酸的产生对有机酸有一定的缓冲作用[13]。
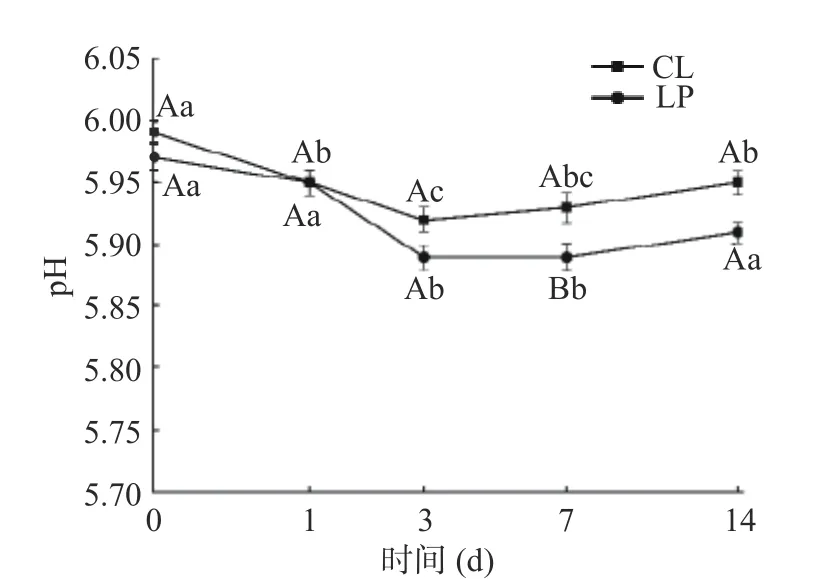
图3 香肠pH的变化Fig.3 Change of sausage pH
2.4 香肠Aw值的变化
香肠Aw随时间的变化如图4。Aw均呈显著降低的趋势(P<0.05)。从第0 d到第14 d,CL组和LP组的Aw明显降低,且LP组较CL组更低(P<0.05)。香肠在前期处于低温风干状态,香肠内部水分迅速向外部迁移,同时表面水分快速的蒸发,使得Aw迅速降低[14]。此外,pH在此阶段的快速降低促进了酸诱导的蛋白变性和凝胶化,蛋白持水能力降低,加快水分流失,使香肠Aw降低[15]。Sun等[16]研究表明,相对更低的pH和Aw值能有效地抑制产生物胺及亚硝胺等不良微生物的生长繁殖,说明接种植物乳杆菌M-25能提高香肠的品质和安全性。
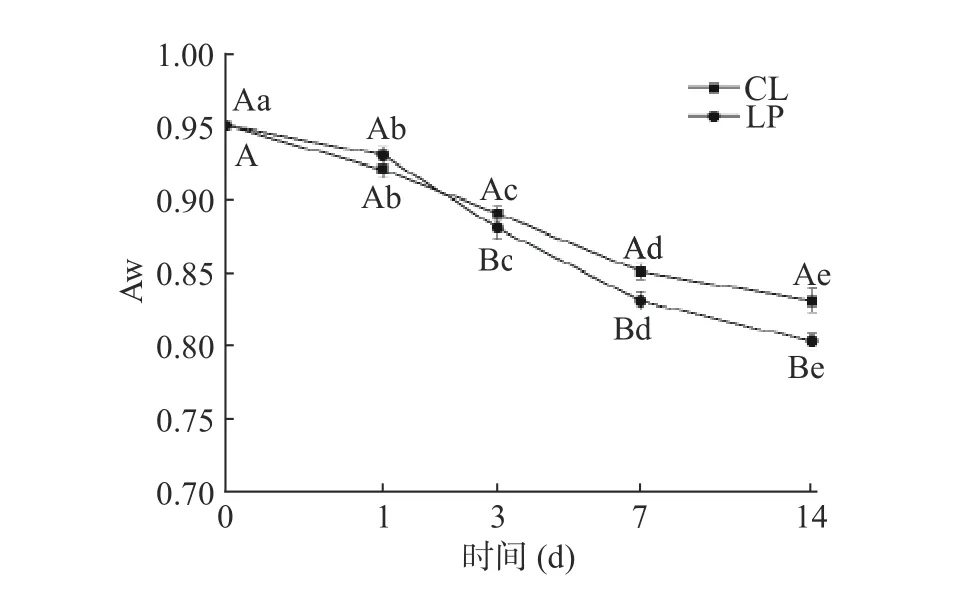
图4 香肠Aw的变化Fig.4 Change of sausage Aw
2.5 香肠色差的变化
香肠颜色的形成和稳定性涉及到微生物、酶活性以及化学反应等,pH、氧化还原电位、温度和湿度等是影响这些反应的关键因素[17]。如表3,香肠的色度随时间发生显著变化(P<0.05)。随着发酵的进行,由于香肠中的水分逐渐流失,L*值也随之降低,这与Gimeno等[18]的研究结果一致。在两组香肠中,a*值也呈现随时间下降的趋势,但Hu等[19−20]研究中乳酸菌和葡萄球菌能显著提升a*值,文中结果与之相反。与本文为探究植物乳杆菌M-25对香肠理化特性改善作用,从而未添加亚硝酸盐相关,使得肌红蛋白不能与之结合,无法提升香肠的红度色泽。与CL组相比,LP组在L*值、b*值和a*值上均无显著差异(P>0.05),表明M-25对香肠的色泽无明显影响。
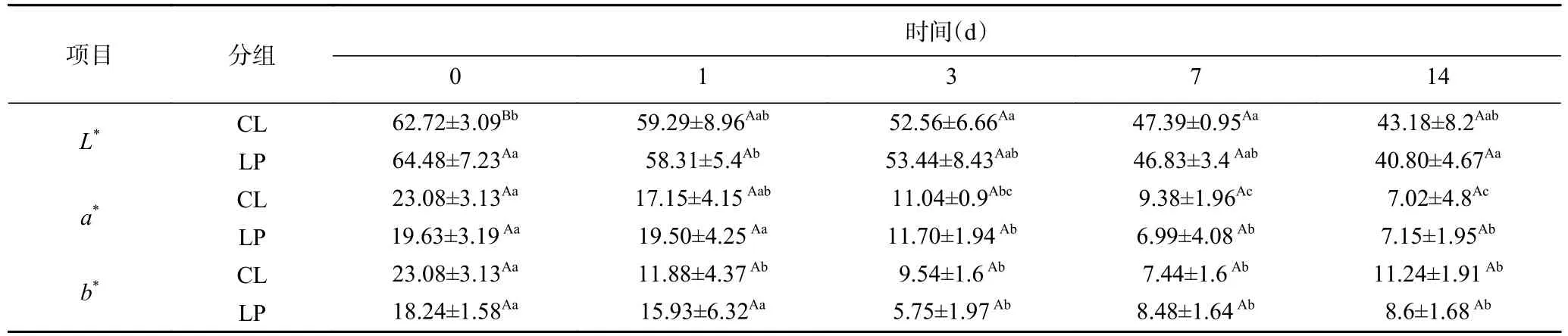
表3 香肠色度的变化Table 3 Change of sausage coloration
2.6 香肠POV的变化
过氧化值是反映脂肪初级氧化的指标,能表征氢过氧化物的含量[21]。据图5可知,随发酵时间增加,CL组和LP组香肠POV值显著升高(P<0.05),说明香肠的脂质氧化程度也随时间的推移而不断加剧,与曹辰辰等[22]研究结果一致。而在发酵1~14 d过程中,LP组中的POV值显著低于CL组(P<0.05),说明M-25对香肠中氢过氧化物的生产或代谢有明显的作用,在番茄汁[23]和哈尔滨干香肠[24]等食品中都体现了其抗氧化特性,还能有效防止食品的过度氧化而产生不良气味[25]。

图5 香肠POV值的变化Fig.5 Change of sausage POV
2.7 香肠TBARS的变化
TBARS值是肉制品脂质氧化酸败程度的重要指标,是肉制品储藏期间品质好坏的评判标准之一[26]。从图6可知,香肠的TBARS值受时间和植物乳杆菌的影响显著(P<0.05),且与POV值变化趋势相同,与张建友等[27]研究结果相似。TBARS值从开始的0.16~0.19 mg/kg,升高到0.54~0.78 mg/kg(P<0.05),同时脂肪氧化程度也随之加深,可能是多不饱和脂肪酸氧化和持续脱水导致的[28]。LP组TBARS值在3 d后就稳定在0.52±0.2 mg/kg,并显著低于持续上升的CL组(P<0.05)。POV与TBARS值呈显著正相关,分别反映脂肪初级和次级的氧化程度[29],而氧化酸败会产生异味等来降低香肠品质[30]。因此,根据POV和TBARS值在两组香肠中动态变化,接种M-25能有效抑制香肠的初级和次级脂肪氧化,能有效提高香肠品质。
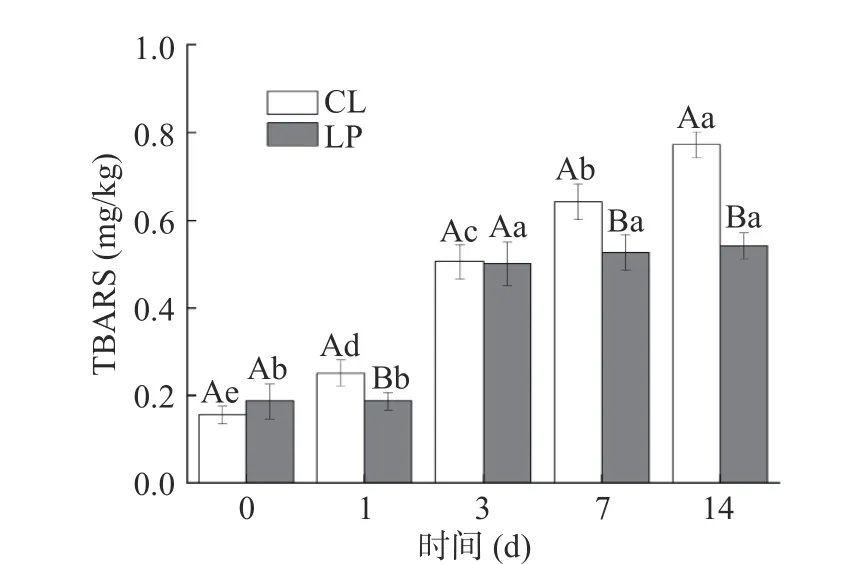
图6 香肠TBARS值的变化Fig.6 Change of sausage TBARS
2.8 香肠挥发性风味物质的变化
风味是肉制品感官评价的重要因素,决定消费者对肉制品的第一感官印象和接受程度。采用顶空固相微萃取-气相色谱-质谱联用仪(SPME-GC-MS)检测香肠中的挥发性风味物质。如表4所示,在香肠制作过程中共检出41种挥发性化合物,CL组和LP组中各检出32和40种,包括8种醇类、10种醛类、4种酮类、6种烷烃类、7种酯类、4种酸类、1种呋喃和吡嗪类化合物。而LP组(8081.91 mg/kg)总风味物质的含量明显高与CL(5578.21 mg/kg)。与CL相比,接种M-25对香肠醇类提升38.11%,对酮类和酯类化合物分别提升22.36和24.37倍,而杨滔等[31]在植物乳杆菌发酵的香肠中发现,仅对酸类物质提升了2.25倍。在植物乳杆菌发酵的猕猴桃中[32],对酮类和酯类物质分别提升32.11%和29.12%,效果远远低于M-25。与本文相同的是,3-羟基-2丁酮在发酵猕猴桃中同样有较大提升。M-25对香肠风味有显著提升,且在醇类、酮类和酯类提升效果显著。
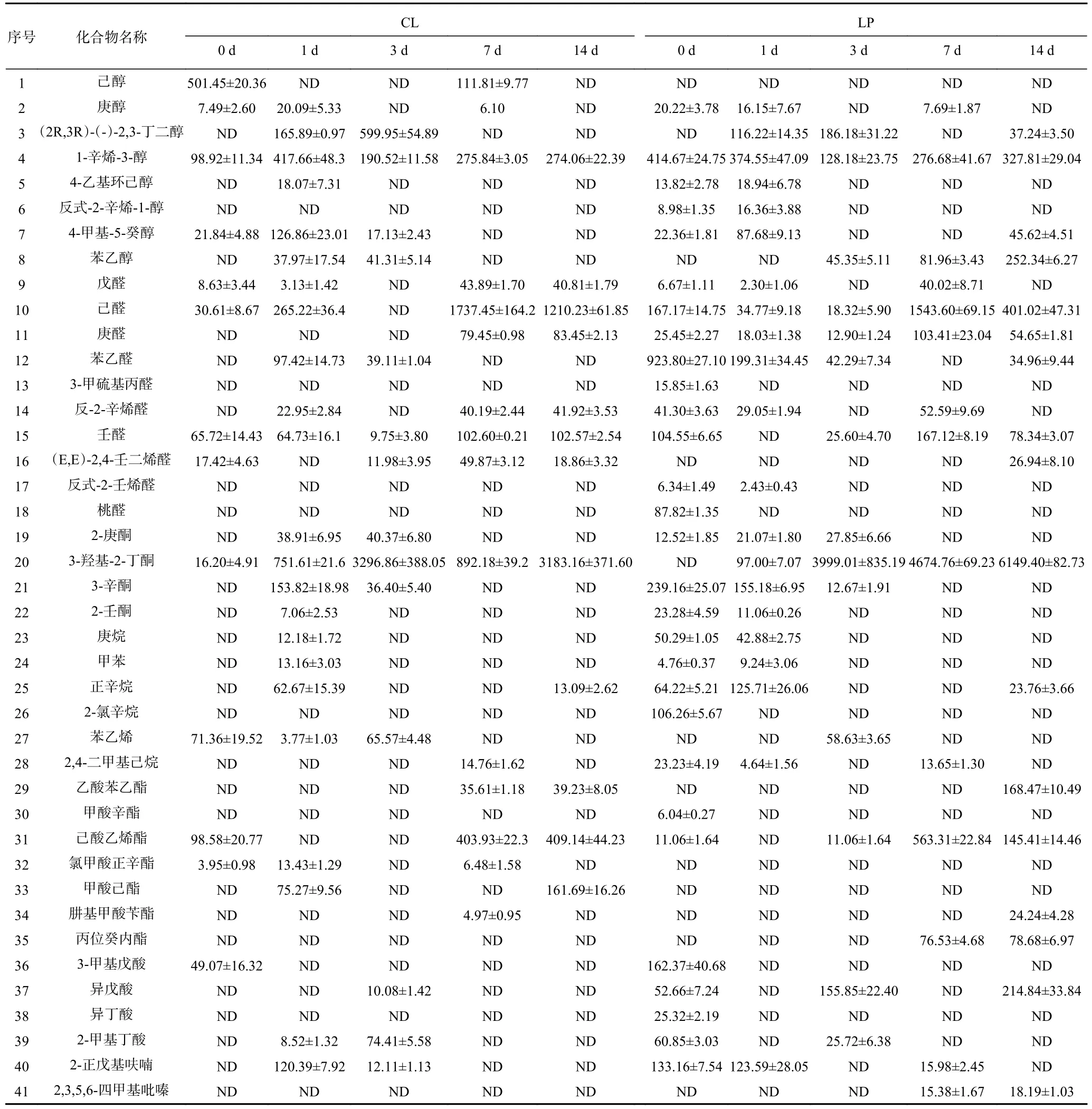
表4 香肠中风味物质绝对含量(μg/kg)Table 4 Absolute content of flavor substances in sausages (μg/kg)
2.9 不同处理香肠中的特征性风味物质
为反映植物乳杆菌M-25对香肠特征风味物质的影响,通过一种有监督的识别方法(PLS-DA)来进一步筛选特征性风味物质,近年来越来越多的应用到食品中挥发性与非挥发性代谢物的差异代谢物筛选[33−34]。如图7所示,模型解释率Rx2、Ry2和模型预测能力Q2值分别为0.49、0.916和0.596,且Ry2和Q2均大于0.5,说明模型稳定可靠。CL组香肠聚集95%置信区间的左下方,LP组香肠聚集在右上方,说明该植物乳杆菌M-25对香肠的风味物质有显著的影响。
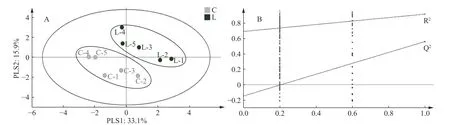
图7 香肠关键风味物质的PLS-DA模型(A)及200次置换检验(B)Fig.7 PLS-DA model for key flavor substances of sausages (A) and 200 substitution test (B)
PLS-DA模型经过200次置换检验进行验证,得到的R2、Q2均大于其原始值,说明模型未发生过拟合,证明了模型的有效性[35]。为确定植物乳杆菌对香肠的特征风味影响,以VIP>1,P<0.05筛选出5种特征风味成分,以VIP值由大到小分别为异戊酸、3-羟基-2-丁酮、苯乙醇、苯乙醛、甲酸己酯,异戊酸、3-羟基-2-丁酮、苯乙醇、苯乙醛为LP特征风味物质。
异戊酸能赋予水果、奶酪香等风味感官特性,主要来源于微生物作用下的亮氨酸分解代谢,Thierry等[36]添加乳酸杆菌在瑞士奶酪中,发现异戊酸的含量为最高,与本文结果一致,说明植物乳杆菌有助于香肠中异戊酸的形成。3-羟基-2丁酮具有令人愉悦的奶油香味,在第14 d时LP组(6149.40 mg/kg)显著高于CL组(3183.16 mg/kg)(P<0.05),可能是植物乳杆菌前期产生大量柠檬酸等有机酸,通过柠檬酸代谢转化为3-羟基-2丁酮[37],从而使含量明显升高。苯乙醇具有柔和、愉快而持久的玫瑰香气,是乳酸菌发酵的萨拉米香肠中特征风味物质[38]。苯乙醇仅在LP香肠中检出,植物乳杆菌具有肌浆蛋白和肌原纤维蛋白降解的特性,促进苯丙氨酸等游离氨基酸的生成,经苯丙氨酸代谢从而使苯乙醇含量升高[39−40]。与CL组相比,LP中更高的苯乙醛可能是在植物乳杆菌代谢活动下,更高活性的氨基转移酶、苯丙酮酸脱羧酶,促进苯丙氨酸向苯乙醛转化[41]。但苯乙醛在发酵过程中是逐渐降低的,在脱氢酶作用下转化成苯乙酯类物质[42],与表2中乙酸苯乙酯含量逐渐升高一致,Ribeiro等[43]在发酵咖啡豆中也观察到相似现象。而甲酸己酯仅在CL组中检出,植物乳杆菌M-25表现出较强的抗氧化活性,较强地抑制了脂肪酸代谢过程中相应酶活性,阻碍己醇和己醛的形成,从而导致未检出甲酸己酯[44−45]。
3 结论
根据香肠模型发酵16 d风味成分分析,添加M-25香肠中的醇类、醛类、酮类和酯类等主要风味物质含量最高且对主成分贡献最大,表明它对风味贡献的潜力最大,且经鉴定M-25为植物乳杆菌。将其接种至香肠中作进一步研究发现,植物乳杆菌M-25能显著(P<0.05)降低香肠pH和Aw,缓解POV和TBARS值升高,抑制脂质的初级和次级氧化,能有效提升香肠品质,维持色泽。植物乳杆菌M-25对香肠醇类、酮类和酯类物质有显著(P<0.05)的提升作用。应用有监督的PLS-DA模型共鉴定出5种特征风味,特别是对异戊酸、3-羟基-2-丁酮、苯乙醇和苯乙醛含量有显著(P<0.05)的提升。但单独的乳酸菌对香肠综合品质的提升有限,不能很好的适用于工业生产。因此,可筛选其他种属的优良微生物,与植物乳杆菌M-25复配从而对香肠品质有更全面的提升及适合香肠的工业生产。
