基于NLRP3炎症小体研究C1q/肿瘤坏死因子相关蛋白6对病毒性心肌炎细胞损伤的保护作用
2023-03-11阴睿媛许亚静
阴睿媛, 王 蓓, 许亚静, 董 夏
(1.陕西省西安市西北妇女儿童医院心脏中心, 陕西 西安 710000 2.陕西省西安市中医医院, 陕西 西安 710000)
病毒性心肌炎是由嗜心肌病毒感染心脏引起的,严重者会发展成扩张型心肌病和心力衰竭,严重威胁生命健康[1]。柯萨奇病毒B3(Coxsackie B3 virus,CBV3)是引起病毒性心肌炎的最常见病毒,其感染心肌细胞后激活炎症反应和细胞凋亡,引起心肌组织损伤[2]。目前,对病毒性心肌炎的临床治疗,还缺乏有效地手段。病毒性心肌炎的进展涉及多种基因的异常表达和调控,靶向特定基因来干预心肌炎的进展和减轻心肌炎引起的组织损伤,是目前研究的一个热点,有望为病毒性心肌炎的临床治疗带来曙光[3]。因此,探寻对病毒性心肌炎有调控作用的新基因及其作用机制,有望为新型基因治疗方法的研发提供可参考的靶标分子和理论基础。炎症小体是一种蛋白质复合体,其在组织损伤、细菌和病毒感染等多种病理条件下被激活,参与调控多种疾病的进展过程。由Nod样受体家族包含pyrin结构域3(NOD-like receptor family pyrin domain-containing 3,NLRP3)蛋白组成的NLRP3炎症小体是目前研究比较广泛的一种炎症小体[4]。NLRP3炎症小体由NLRP3蛋白,凋亡相关斑点样蛋白(Apoptosis-associated speck-like protein containing a CARD,ASC)和含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase-1,Caspase-1)组成[5]。激活NLRP3炎症小体可对白介素-1β(interleukin-1β,IL-1β)和白介素-18(interleukin-18,IL-18)的前体蛋白进行切割加工,产生有活性的IL-1β和IL-18,从而促进炎症反应和细胞死亡[6]。NLRP3炎症小体的激活和病毒性心肌炎密切相关。抑制NLRP3炎症小体的激活可以有效减轻CBV3诱导的心肌炎[7]。NLRP3炎症小体的激活受多种上游信号分子的调控,探寻对该炎症小体具有重要调控作用的新分子,对于开发病毒性心肌炎的治疗方法,具有十分重要的意义。补体C1q /肿瘤坏死因子相关蛋白6 (C1q/tumor necrosis factor-related protein 6,CTRP6) 是脂肪因子超家族的一员,和脂联素结构相似,具有广泛的组织表达模式,特别在心脏和脂肪组织中高表达。CTRP6具有多种生物功能,可调控细胞分化、纤维化、炎症反应和组织损伤等生物学过程,在多种疾病中发挥关键作用。有趣的是CTRP6还具有心肌保护作用[8]。岂止为止,关于CTRP6是否对病毒性心肌炎引起的心肌损伤具有保护作用,尚不明确。本项目通过CBV3感染心肌细胞建立病毒性心肌炎的体外模型,来研究CTRP6对病毒性心肌炎细胞损伤的调控作用和其潜在的分子作用机制。
1 材料与方法
1.1材料与试剂:人心肌细胞AC-16购自北京北纳生物公司;CBV3病毒株购自美国典型培养物保藏中心ATCC;DMEM培养基和胎牛血清购自武汉Procell生命科技有限公司;RNA提取试剂Trizol和TUNEL试剂盒购自上海碧云天生物科技有限公司;cDNA合成试剂盒和FastSYBR Mixture购自江苏康为世纪生物科技股份有限公司;蛋白提取试剂盒、蛋白浓度测定试剂盒和TransIntro EL转染试剂购自北京全式金生物科技有限公司;CK-MB试剂盒购自南京建成生物工程研究所有限公司;cTn-I试剂盒购自上海艾博抗贸易有限公司;AdipoR1 siRNA由上海吉玛制药技术有限公司设计和合成;IL-1β、TNF-α和IL-18 ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司;兔抗人CTRP6抗体、α-actin抗体、Bcl2抗体、Bax抗体、NLRP3抗体、ASC抗体和HRP标记的山羊抗兔二抗购自武汉三鹰生物技术有限公司。
1.2方 法
1.2.1心肌细胞培养:将AC-16心肌细胞接种于含10%的胎牛血清的DMEM培养基中,置于5% CO2的培养箱中37℃生长。每2~3d更换培养液,待细胞密度达80%~90%时,用0.25%胰蛋白酶消化,按1∶2的比例传代。
1.2.2CBV3感染心肌细胞模型的建立:CBV3感染Hela细胞进行繁殖和扩增。根据Reed-Muench法计算50%组织感染率(50% tissue culture infective doses,TCID50)。将心肌细胞接种到6孔板中,过夜培养。第2天,加入100μ的100 TCID50,细胞置于37℃、5% CO2的培养箱中培养2h。然后,去除CBV3病毒液,添加正常培养液,置于37℃、5% CO2的培养箱中继续培养48h,收集细胞进行后续检测实验。
1.2.3RT-qPCR检测mRNA表达:收集细胞,去除培养基,用PBS洗涤,加入Trizol充分裂解细胞,按试剂盒步骤抽提细胞总RNA。以RNA为模板,采用SuperRT cDNA 合成试剂盒进行逆转录反应,合成cDNA。以cDNA为模板,加入FastSYBR Mixture和引物,采用实时荧光定量PCR仪器进行扩增。热循环程序为:预变性95℃,20s;40个循环(变性95℃,3 s;退火/延伸60℃,30s)。以α-actin为内参基因,采用2-△△Ct公式计算靶基因的相对表达水平。
1.2.4Western blotting检测蛋白表达:收集细胞,去除培养基,用PBS洗涤,加入蛋白提取缓冲液和蛋白酶抑制剂,充分裂解细胞。离心,收集上清液,采用蛋白浓度测定试剂盒测量蛋白浓度。将蛋白样品和上样缓冲液混合,沸水煮沸10min使蛋白变性。配置浓缩胶和分离胶,按每孔30μg进行上样,进行SDS-PAGE电泳。采用半干法转模,转模完成后,将膜放入5%脱脂奶粉中,室温封闭1h。将膜放入到一抗抗体的稀释液中,4℃摇床过夜孵育。一抗孵育结束后,TBST洗膜,加入到二抗的稀释液中,室温孵育1h。二抗孵育完成后,TBST洗膜。配置ECL发光液,将发光液均匀涂抹膜上,孵育2min,将膜放入成像仪中,进行成像和拍照。
1.2.5细胞转染:根据CTRP6的cDNA序列,设计带酶切位点的引物,进行常规PCR扩增。产物回收、酶切和纯化后,插入到pcDNA3.1载体,转化受态细胞。挑选阳性克隆,进行测序鉴定,测序正确的单克隆进行后续实验。当细胞融合度达到80%左右时,采用TransIntro EL转染试剂,将pcDNA3.1-CTRP6或PCNDA3.1空载体转染至心肌细胞中。将0.8μg质粒和50μL Opti-MEM培养基混合;加入1.6μL转染试剂,轻柔混合,室温孵育15min。然后,将上述混合物加入到细胞中,于37℃、5% CO2的培养箱中培养6h;更换培养基,继续培养48h。
1.2.6CK-MB活性测定:细胞处理后,离心收集培养基上清,取40μL上清液加入到比色皿中。然后,加入800μL试剂R1和400μL试剂R2,混匀,37℃孵育2min。采用紫外分光光度计测定340nm波长的吸光度值,计算CK-MB活性。
1.2.7cTn-I浓度测定:细胞处理后,离心收集培养基上清,加入到96孔培养板中(50μL/孔)。然后,每孔加入50μL混合抗体,封闭细胞培养板,室温摇床孵育1h。洗涤并彻底干燥细胞培养孔,每孔加入100μL TMB溶液,室温摇床孵育10min后,每孔加入100μL终止反应液,室温摇床孵育1min。采用酶标仪测定450nm波长的吸光度值,计算cTn-I浓度。
1.2.8TUNEL法检测细胞凋亡:细胞处理后,去除培养基,加入4%多聚甲醛固定细胞。PBS洗涤细胞,加入含0.3% Triton X-100的PBS,透化细胞。PBS洗涤细胞,每孔加入50μL TUNEL检测液,于37℃避光孵育60min。去除反应液,PBS洗涤细胞,加入DAPI溶液,室温避光孵育10min。抗荧光淬灭封片液封片后,采用荧光显微镜观察和拍照。
1.2.9ELISA检测炎症因子浓度:细胞处理后,离心收集培养基上清,加入到酶标板中(100μL/孔)。酶标板覆膜,于37℃孵育90min。去除孔内液体,每孔加入生物素抗体工作液100μL,于37℃孵育60min。去除孔内液体,每孔加入洗涤液350μL,浸泡1min,重复洗板3次。加入酶结合物工作液100μL,于37℃孵育30min。重复洗板5次,每孔加TMB溶液90μL,于37℃避光孵育15min。每孔加终止液50μL,终止反应。立即用酶标仪测定450nm波长的吸光度值,计算炎症因子浓度。
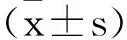
2 结 果
2.1CBV3感染对CTRP6在心肌细胞中的表达水平的影响:RT-qPCR结果表明,CBV3感染后心肌细胞中CTRP6的mRNA表达量降低,与正常组细胞相比,差异有统计学意义(P<0.01,见图1A)。Western blotting结果显示,CBV3感染后心肌细胞中CTRP6的蛋白表达量降低,与正常组细胞相比,差异有统计学意义(P<0.01,见图1B和C)。

图1 CBV3感染对CTRP6在心肌细胞中的表达水平的影响注:A为RT-qPCR检测CTRP6的mRNA表达水平;B为Western blotting检测CTRP6的蛋白表达水平;C为CTRP6蛋白定量图。与正常组比较,**P<0.01
2.2转染CTRP6表达质粒对CTRP6表达水平的影响:与CBV3+空载体组相比,转染CTRP6表达载体可提高CBV3感染的心肌细胞中的CTRP6的mRNA和蛋白表达水平,差异有统计学意义(P<0.01,见图2)。

图2 转染CTRP6表达质粒对CTRP6在CBV3感染的心肌细胞中的表达水平的影响注:A为RT-qPCR检测CTRP6的mRNA表达水平;B为Western blotting检测CTRP6的蛋白表达水平;C为CTRP6蛋白定量图。与正常组比较,**P<0.01;与CBV3+空载体组比较,&&P<0.01
2.3CTRP6过表达对CBV3感染诱导的心肌细胞损伤的影响:与正常组相比,CBV3感染上调心肌损伤标志物CK-MB和cTn-I的活性水平,差异有统计学意义(P<0.01),见表1。与CBV3+空载体组相比,过表达CTRP6可降低CBV3感染的心肌细胞中CK-MB和cTn-I的活性水平,差异有统计学意义(P<0.01),见表1。
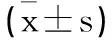
表1 CTRP6过表达对CBV3感染诱导的心肌细胞损伤的影响
2.4CTRP6过表达对CBV3诱导的心肌细胞凋亡的影响:与正常组相比,CBV3感染组Bax蛋白水平上调,而Bcl2蛋白水平下调,差异有统计学意义(P<0.01,见图3)。在CBV3感染的心肌细胞中过表达CTRP6可下调Bax蛋白水平,而上调Bcl2蛋白水平,差异有统计学意义(P<0.01,见图3)。TUNEL实验结果显示,与正常组相比,CBV3感染组心肌细胞凋亡比例增加,差异有统计学意义(P<0.01,见图4)。与CBV3+空载组相比,过表达CTRP6可减少CBV3诱导的心肌细胞凋亡,差异有统计学意义(P<0.01,见图4)。

图3 Western blotting检测CTRP6过表达对CBV3感染的心肌细胞中Bax和Bcl2表达的影响注:与正常组比较,**P<0.01;与CBV3+空载体组比较,&&P<0.01

图4 TUNEL检测CTRP6过表达对CBV3感染诱导的心肌细胞凋亡的影响注:与正常组比较,**P<0.01;与CBV3+空载体组比较,&&P<0.01
2.5CTRP6过表达对CBV3诱导的炎症因子释放的影响:LISA实验结果显示,与正常组相比,CBV3感染增加炎症因子IL-1β,TNF-α和IL-18在心肌细胞中的释放量,差异有统计学意义(P<0.01,见表2)。与CBV3+空载组相比,过表达CTRP6可以减少CBV3感染诱导的IL-1β,TNF-α和IL-18炎症因子的释放,差异有统计学意义(P<0.01),见表2。
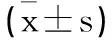
表2 CTRP6过表达对CBV3诱导的炎症因子释放的影响
2.6CTRP6过表达对CBV3诱导的NLRP3炎症小体激活的影响:与正常组相比,CBV3感染可上调NLRP3、ASC和Caspase-1的蛋白表达量,差异有统计学意义(P<0.01,见图5),表明NLRP3炎症小体活性升高。与CBV3+空载组相比,过表达CTRP6可以降低CBV3感染诱导的NLRP3、ASC和Caspase-1的蛋白表达上调,与CBV3+空载体组相比,差异有统计学意义(P<0.01,见图5),表明NLRP3炎症小体的活性降低。

图5 Western blotting检测CTRP6过表达对CBV3诱导的NLRP3炎症小体激活的影响注:与正常组比较,**P<0.01;与CBV3+空载体组比较,&&P<0.01
2.7AdipoR1敲除对CTRP6介导的心肌保护作用的影响:与CBV3+CTRP6载体+control siRNA组相比,CBV3+CTRP6载体+AdipoR1 siRNA组AdipoR1表达水平减少,而NLRP3、ASC和Caspase-1的蛋白表达水平增加,差异有统计学意义(P<0.01,见图6)。另外,敲除AdipoR1也阻断了CTRP6过表达对CBV3诱导的心肌细胞损伤和炎症因子的释放)的抑制效应,差异有统计学意义(P<0.01),见表3、表4。
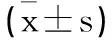
表3 AdipoR1敲除对CTRP6调控的CBV3诱导的心肌细胞损伤的影响
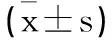
表4 AdipoR1敲除对CTRP6调控的CBV3诱导的炎症因子释放的影响

图6 Western blotting检测AdipoR1敲除对CTRP6调控的CBV3诱导的NLRP3炎症小体激活的影响注:与正常组比较,**P<0.01;与CBV3+空载体组比较,&&P<0.01;与CBV3+CTRP6载体+ control siRNA组比较,@@P<0.01
3 讨 论
CBV3感染心肌细胞会导致大量基因异常表达和调控,促进炎症和心肌细胞损伤的发展。探寻CBV3感染心肌细胞中异常表达的新基因,研究其对心肌炎细胞损伤的调控作用,是目前研究热点,有望为病毒性心肌炎的基因治疗提供可参考的靶标分子和理论基础。CBV3感染心肌细胞是研究病毒性心肌炎疾病的一个常用细胞模型。CBV3感染会引起炎症反应和细胞凋亡,从而造成心肌细胞损伤,导致心肌功能障碍。本项目通过建立CBV3感染心肌细胞模型,检测CTRP6对CBV3感染引起的炎症、细胞凋亡和损伤的作用,初步探讨CTRP6在病毒性心肌炎疾病中可能的调控作用。
CTRP6具有心脏保护作用。在小鼠心肌中特异性过表达CTRP6可减轻阿霉素诱导的心脏毒性和心肌细胞凋亡,改善心脏功能[8]。关于CTRP6是否在病毒性心肌炎细胞损伤中发挥心肌保护作用,目前还没有相关研究。因此,本研究探讨了CTRP6对CBV3诱导的心肌炎细胞损伤的调控作用。结果发现,在心肌细胞中过表达CTRP6可显著下调CBV3感染引起的炎症、心肌细胞凋亡和损伤。本项目研究结果进一步明确了CTRP6的心脏保护作用,拓展了其对病毒性心肌炎细胞损伤的保护效应。
CTRP6对NLRP3炎症小体的活化具有抑制作用[9]。NLRP3炎症小体的激活和病毒性心肌炎密切相关。本研究结果发现CBV3感染的心肌细胞中NLRP3,ASC和Caspase-1的蛋白水平显著上调,表明CBV3感染激活了NLRP3炎症小体。过表达CTRP6可显著下调CBV3感染的心肌细胞中NLRP3、ASC和Caspase-1的表达水平,表明CTRP6对NLRP3炎症小体具有抑制作用。本研究进一步证明了CTRP6对NLRP3炎症小体的抑制性调控作用。因此,CTRP6调控的NLRP3炎症小体通路在病毒性心肌炎的进展过程中可能具有十分重要的作用。
CTRP6和脂联素结构相似,主要通过脂联素受体AdipoR1发挥作用[10]。据报道,AdipoR1可以抑制NLRP3炎症小体的激活[11]。为了研究CTRP6是否通过AdipoR1抑制病毒性心肌炎中NLRP3炎症小体的激活,本研究采用siRNA沉默技术敲除了AdipoR1在心肌细胞中的表达,然后检测抑制AdipoR1是否会阻断CTRP6对NLRP3炎症小体的抑制作用。研究结果发现,敲除AdipoR1显著阻断了CTRP6对CBV3诱导的NLRP3炎症小体激活的抑制作用。另外,进一步实验结果表明,敲除AdipoR1也可逆转CTRP6对CBV3诱导的炎症和心肌细胞损伤的抑制作用。因此,本项目研究结果表明CTRP6通过AdipoR1调控NLRP3炎症小体,从而抑制CBV3感染诱导的心肌炎细胞损伤。综上所述,本研究表明CTRP6通过作用于AdipoR1抑制NLRP3炎症小体的激活来减轻CBV3感染诱导的心肌炎细胞损伤,为了解病毒性心肌炎的发生和进展提供了一个新的分子作用机制。鉴于CTRP6的心脏保护作用,CTRP6可作为病毒性心肌炎基因治疗的一个潜在靶基因。但是,本研究结果主要是通过体外CBV3感染心肌细胞模型得到的,存在一定的局限性。因此,关于CTRP6在病毒性心肌炎中的明确作用,需要通过动物模型体内实验,进一步的研究和验证。
