蛹虫草对LPS诱导的小鼠氧化应激的保护作用
2023-03-10王佳妮于凯雯徐方旭王升厚
王佳妮,于凯雯,徐方旭,王升厚,王 泽*
(1.沈阳师范大学生命科学学院,辽宁沈阳 110034;2.沈阳师范大学实验教学中心,辽宁沈阳 110034)
氧化应激(oxidative stress,OS)这一概念最早由衰老研究权威Sohal教授在1985年提出。正常情况下,生物体处于氧化与抗氧化的动态平衡状态,受到有害刺激时,体内的活性氧自由基(reactive oxygen species, ROS)或活性氮自由基(reactive nitrogen species, RNS)会大量产生和蓄积,进而对生物大分子活性、细胞结构产生严重的破坏[1],引起复杂的生理或病理损伤过程,如糖尿病、高血压、肝病、癌症等[2-4]。近年来,人工合成的抗氧化剂因其安全隐患备受争议,如过量使用会引起致畸、癌变以及一些慢性疾病等危害,从天然生物资源中寻找有效的抗氧化物质用于维持人体及动物健康成为新的研究焦点[5]。
蛹虫草[Cordycepsmilitaris(L.ex Fr.) Link.]分类学上属麦角菌科、虫草属,是我国传统的食药两用真菌。研究显示,蛹虫草具有丰富的、非营养素类的抗氧化活性成分,其体外抗氧化活性得到了较为广泛的解读[6-8]。其中,超氧化物歧化酶(superoxide dismutase,SOD)是抗氧化酶系的重要组成成员,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用,蛹虫草含有真核生物超氧化物歧化酶全部种类的同工酶Cu-SOD、Zn-SOD、Mn-SOD和 Fe-SOD[9],且具有热稳定性高、酶活不受pH影响等优势[10]。此外,蛹虫草黄色素对1,2-二苯代苦味肼基自由基(DPPH·)、羟基自由基(·OH)和超氧阴离子自由基(O2-·)具有很好的清除效果,其黄色素YP1、YP2和YP3的抗氧化效果与抗氧化剂VC相当。虫草烯是一种分子量大小为263.115 8m/z的新型蛹虫草黄色素,2 mg/mL虫草烯的DPPH自由基清除活性与VC接近,可以提高老化HSF细胞的SOD、过氧化氢酶(CAT)活性,并降低丙二醛(MDA)水平[11]。此外,蛹虫草多糖对DPPH自由基和羟自由基亦具有显著的清除能力[12]。因此,该试验利用脂多糖(lipopolysaccharide, LPS)诱导小鼠急性氧化损伤,评价日常服用蛹虫草对机体氧化应激损伤的保护作用,为蛹虫草作为天然抗氧化类功能性食品的应用潜质提供理论支持。
1 材料与方法
1.1 试验材料
1.1.1试材。SPF级KM小鼠,雌雄各半,体重18~20 g,于室温(24±2)℃、湿度(55±5)%,自然光照条件下饲养,小鼠及维持鼠粮均购自辽宁长生生物技术有限公司。蛹虫草子实体由沈阳师范大学功能性蛹虫草省重点实验室栽培提供,60 ℃烘干至恒重,粉碎机粉碎,过80目筛网,-20 ℃储存备用。灌胃前以蒸馏水配制成工作液使用。
1.1.2试剂。脂多糖(Sigma)、过氧化氢测试盒(分光光度法)、总抗氧化能力测试盒(ABTS法)、丙二醛测试盒(TBA法)、过氧化氢酶测试盒(ABTS法),均购自北京鼎国昌盛生物技术有限公司。
1.1.3主要仪器。电子天平(上海精密仪器有限公司);台式低温离心机(上海湘怡离心机仪器有限公司);-80 ℃超低温冰箱(日本SANYO公司);酶标仪(北京普天新桥技术有限公司)。
1.2 试验方法
1.2.1LPS氧化应激损伤模型的确立。KM小鼠随机分为模型组和空白组,模型组腹腔注射0.5 mL/只LPS水溶液诱导氧化应激损伤,分别为6 mg/kg LPS组、8 mg/kg LPS组、10 mg/kg LPS组(n=5),空白组注射同等剂量无菌水。记录小鼠被毛、精神、运动和粪便情况,LPS注射前和注射24 h后小鼠体重记为W1和W2, LPS注射24 h后脱颈处死解剖,称取小鼠肝脏、肾脏、脾脏、胸腺重量,分别计算脏器指数和失重率(QW),计算方法如下:
脏器指数=脏器重量(mg)/体重(g)×100%
QW=[W1(g)-W2(g)]/W1(g) ×100%
式中,f spk为复合地基承载力特征值,kPa;λ为单桩承载力发挥系数;m为面积置换率;R a为单桩承载力特征值,kN;A p为桩的截面积,m2;β为桩间土承载力发挥系数;f sk为处理后桩间土承载力特征值,kPa,应按静载荷试验确定,无试验资料时可取天然地基承载力特征值。
1.2.2蛹虫草的氧化应激保护作用。
1.2.2.1试验分组及处理。KM小鼠随机分为空白组、对照组和试验组(n=30),基于蛹虫草推荐使用剂量标准0.03 g/kg,根据Meeh-Rubner公式得出小鼠基础使用剂量为0.61 mg/g,试验组以0.5 mL/只蛹虫草水溶液连续灌胃28 d;空白组和对照组灌胃同等剂量蒸馏水;对照组及试验组于最后一次灌胃1 h后,腹腔注射10 mg/kg LPS诱导氧化应激损伤。
1.2.2.2小鼠基础生理状态的观察。每日观察记录各组小鼠精神状态、饮水量及进食量。于LPS注射0、2、4、6、8 h,分别处死各组小鼠(n=6),称取肝脏、肾脏、脾脏、胸腺、全脑重量,PBS缓冲液清洗后,装入EP管,-80 ℃冰箱冻存待用,并计算脏器指数。
1.2.2.3氧化应激指标的定量检测。称取肝脏、肾脏、脑组织0.5 g,加入9 倍体积0.9%的生理盐水,冰上匀浆,4 ℃,12 000 r/min,离心5 min,收集组织液。按照各试剂盒说明书要求进行相关指标的检测,其中,采用考马斯亮蓝蛋白法测定各组织的总蛋白含量,比色法检测各组织总抗氧化能力(T-AOC)、过氧化氢(H2O2)含量,检测波长为405 nm。硫代巴比妥酸法测定各组织的MDA含量,检测波长为532 nm。紫外法测定各组织的CAT活性,检测波长为405 nm。各检测组均为3复孔。
2 结果与分析
2.1 LPS诱导的小鼠氧化应激损伤LPS注射2 h后,各浓度组小鼠均出现不同程度的腹泻情况,同时伴有扎堆、精神萎靡、嗜睡、呆卧懒动及竖毛现象,其中10 mg/kg LPS组异常状况最为严重,至LPS注射后7 h恢复正常(图1)。与对照组相比,10 mg/kg LPS引起小鼠肝脏指数明显升高(P<0.05)(表1),各试验组之间失重率(QW)差异不明显(P>0.05)(表2)。
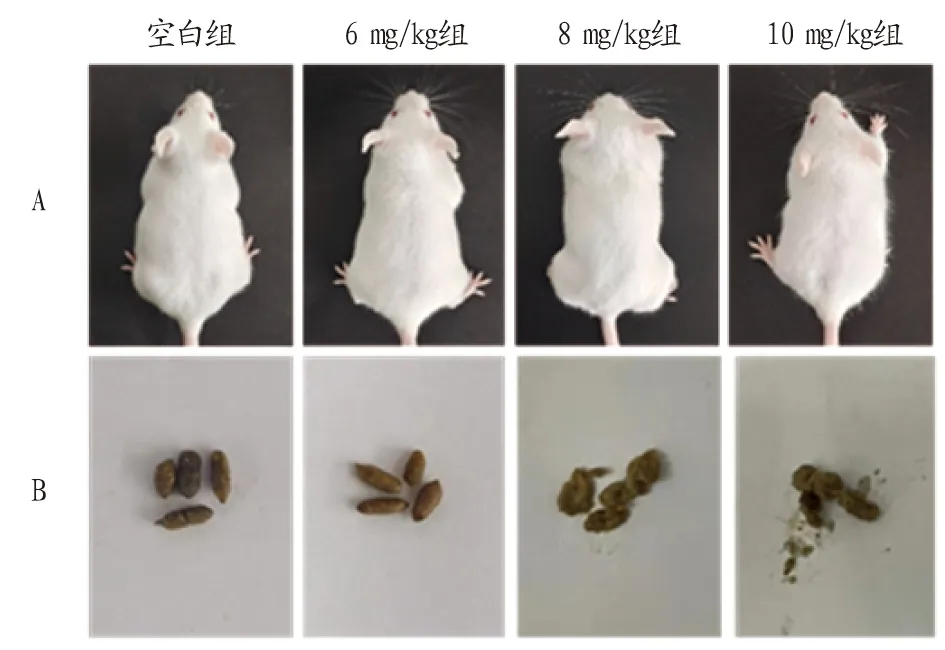
注:A.小鼠被毛情况;B.小鼠粪便改变。Note:A.Mouse hair condition;B.Change of mouse feces.图1 LPS腹腔注射对小鼠基础生理状态的影响Fig.1 Effect of LPS abdominal injection on basic physiological status of mice
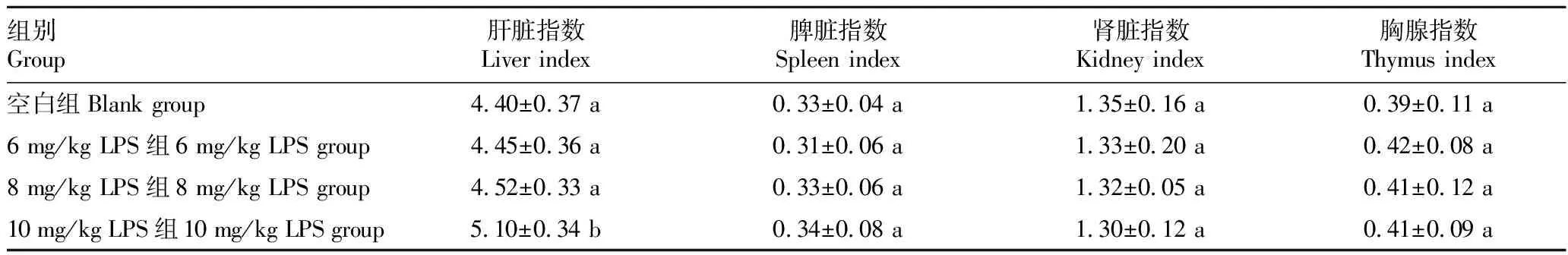
表1 LPS腹腔注射对小鼠脏器指数的影响Table 1 Effect of LPS abdominal injection on mouse organ index 单位:%
2.2 蛹虫草的抗氧化应激作用
2.2.1蛹虫草对小鼠基础生理状态的影响。蛹虫草灌胃28 d 未对各组小鼠精神、形态、行为、摄食饮水产生明显影响(图2)。LPS注射后8 h内,空白组精神、行为、活动量正常,对照组于LPS注射2 h后出现精神低迷、活动量下降等现象,试验组相应异常现象明显强于对照组。从表3可以看出,LPS注射后2~8 h,对照组小鼠肝脏指数出现持续性增大的趋势,且明显高于试验组(P<0.05),至8 h,试验组肝脏指数接近空白组水平(P>0.05);其他脏器指数各组间无明显差异(P>0.05)。

表2 LPS腹腔注射对小鼠失重率的影响Table 2 Effect of LPS abdominal injection on the loss weight rate of mice
2.2.2蛹虫草对小鼠抗氧化能力的影响。从表4~5可以看出,LPS注射后2~6 h,对照组和试验组小鼠肝脏、肾脏及脑组织T-AOC指数、CAT活性均检测到不同程度的降低情况,且对照组降低幅度更大。至试验结束(8 h),试验组小鼠各组织的T-AOC指数、CAT活性均已接近空白组水平(P>0.05),但对照组T-AOC指数、CAT活性仍处于较低水平(P<0.05)。
2.2.3蛹虫草对小鼠各组织H2O2和MDA含量的影响。从表6~7可以看出,LPS注射后2~6 h,与空白组相比,对照组小鼠肝脏、肾脏及脑组织中的H2O2和MDA含量均明显升高(P<0.05),LPS注射未引起对照组和试验组脑组织MDA含量的显著性变化(P>0.05)。试验组肝脏、肾脏H2O2与MDA含量升高趋势均较为平缓,且2~6 h均显著低于对照组(P<0.05)。至试验结束(8 h),对照组和试验组各组织的MDA含量已无明显差异(P>0.05)。
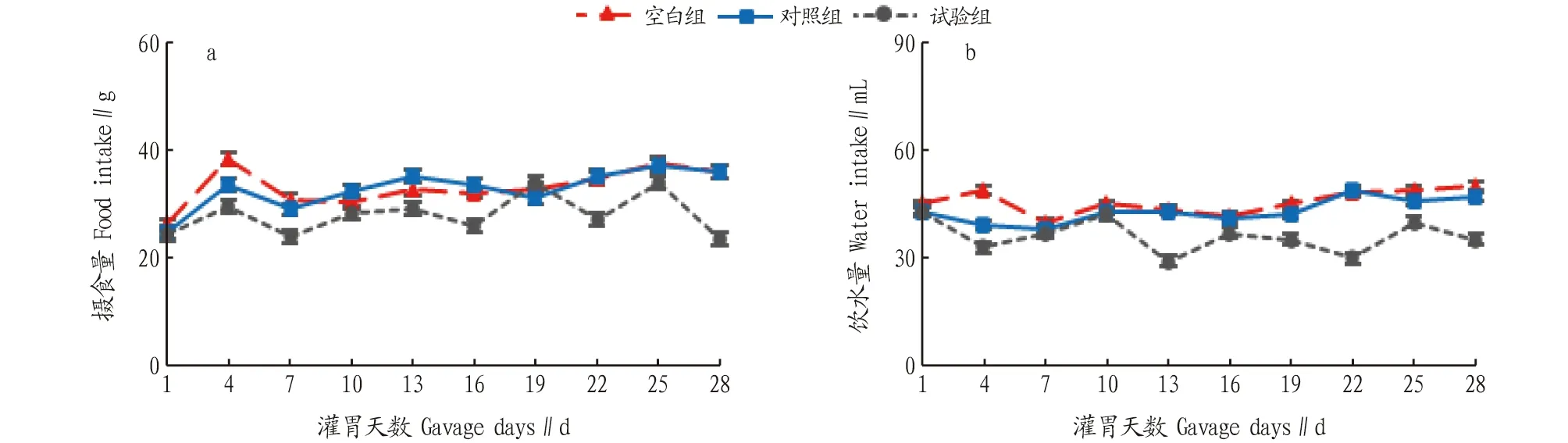
图2 各组小鼠日摄食量(a)和饮水量(b)变化情况Fig.2 Changes of daily food intake (a) and water intake (b) of mice in each group
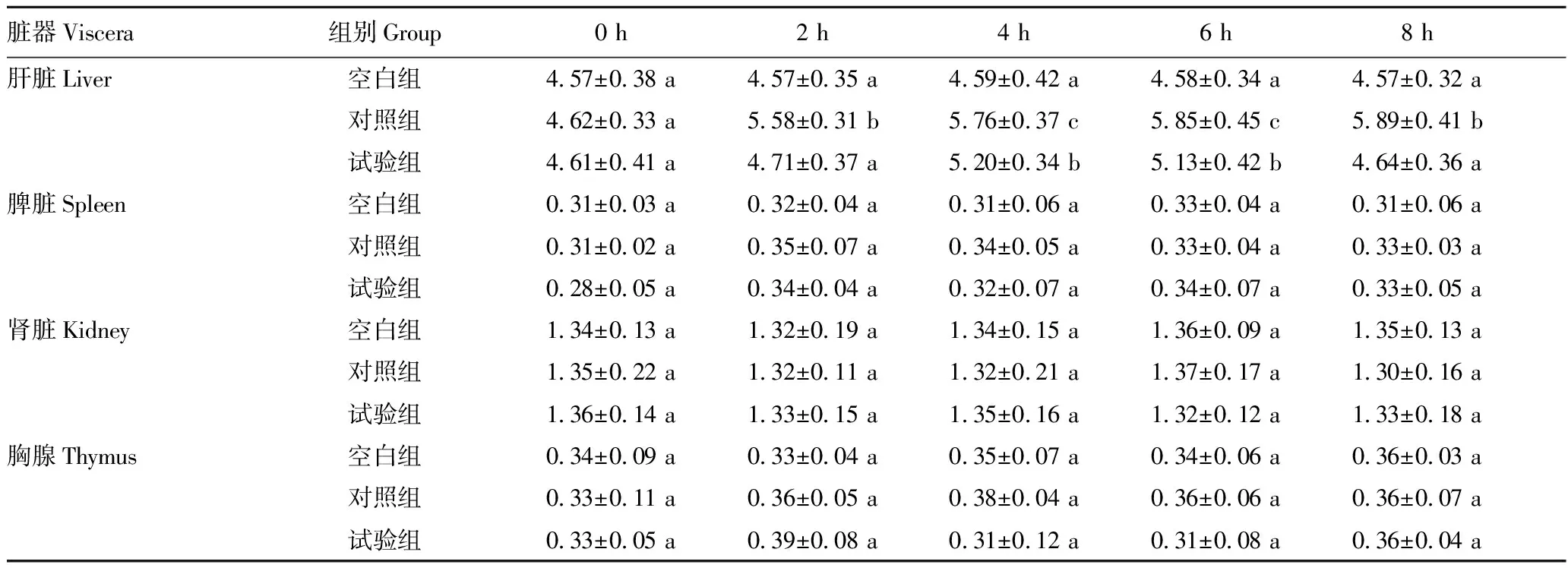
表3 LPS注射对各组小鼠脏器指数的影响Table 3 Effect of LPS injection on the visceral index of mice in each group 单位:%
3 讨论
氧化应激是由自由基在体内产生的一种损伤,衰老和心脏病、阿尔兹海默症等疾病的发生均与体内过激的氧化应激有关[13]。LPS是革兰氏阴性细菌重要的内毒素,高剂量LPS会引起机体短暂的氧化应激反应,以胃肠应激症状较为明显,经常被作为动物氧化应激反应的外部评价指标[14]。该试验采用6、8、10 mg/kg 3个浓度的LPS腹腔注射,以确定LPS诱导小鼠氧化应激损伤的最佳剂量。研究结果显示,6~10 mg/kg的LPS注射剂量均能成功诱导小鼠出现腹泻、精神萎靡、活动量减少以及竖毛等症状,与穆盛田等[15]的研究结果相一致,但10 mg/kg LPS组小鼠腹泻最为严重,活动量减少及竖毛现象直至7 h后逐渐恢复正常,同时,该组小鼠肝脏指数升高明显(P<0.05)。因此,该试验采用10 mg/kg的LPS注射剂量构建小鼠氧化应激损伤。
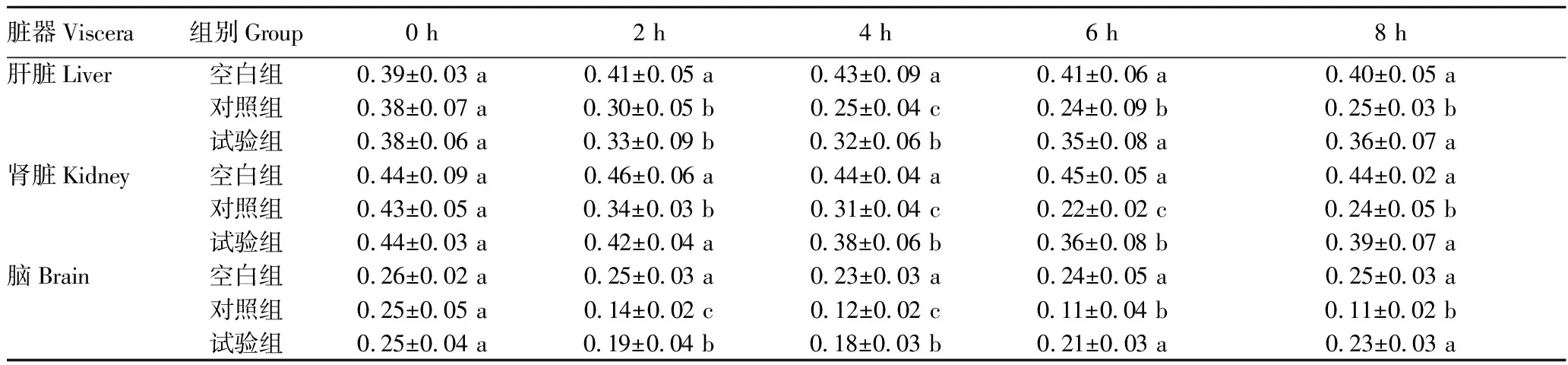
表4 LPS注射对各组小鼠T-AOC指数的影响Table 4 Effect of LPS injection on T-AOC index of each group of mice 单位:U/mg
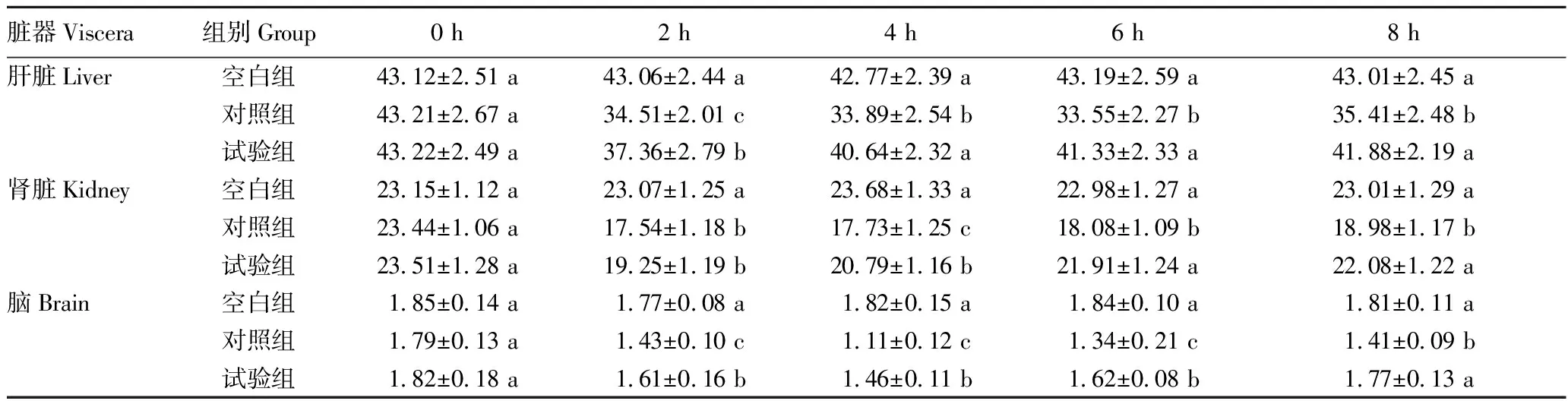
表5 LPS注射对各组小鼠CAT活性的影响Table 5 Effect of LPS injection on CAT activity of each group of mice 单位:U/mg
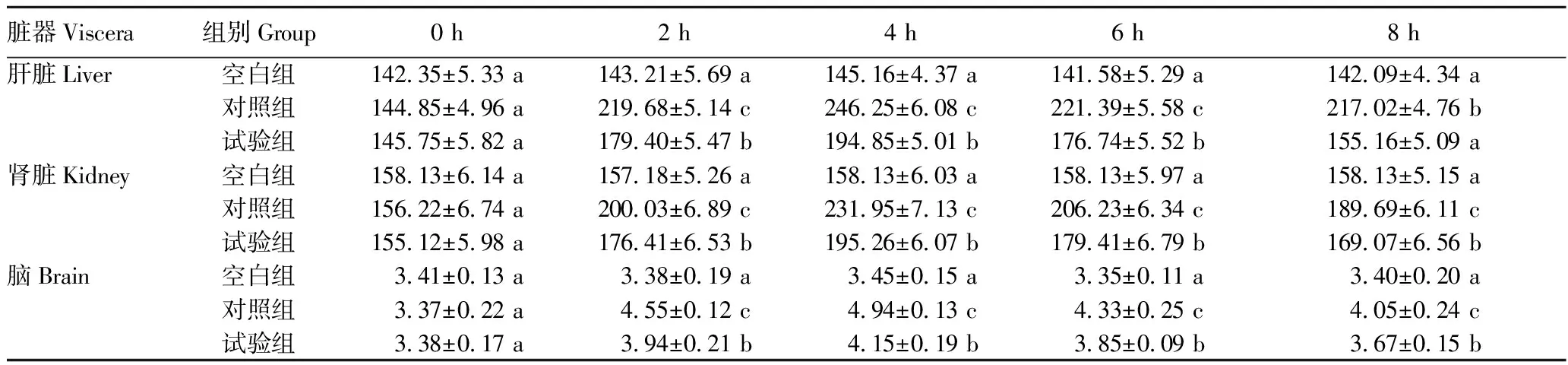
表6 LPS注射对各组小鼠H2O2含量的影响Table 6 Effect of LPS injection on H2O2 content of each group of mice 单位:mmol/g
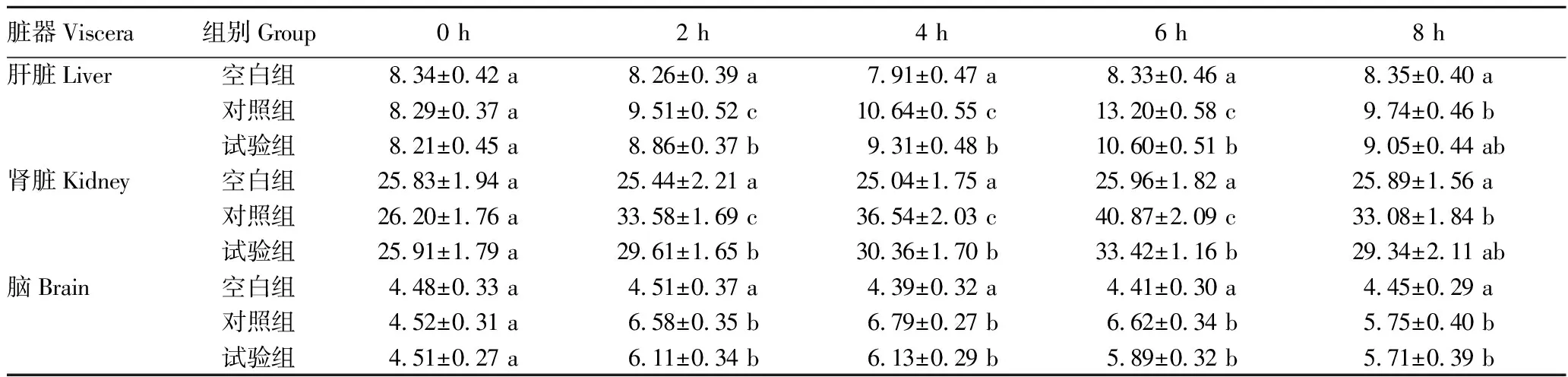
表7 LPS注射对各组小鼠MDA含量的影响Table 7 Effect of LPS injection on MDA content of each group of mice 单位:nmol/mg
蛹虫草作为一种药用真菌,含有丰富的抗氧化生物活性成分,由此该试验通过检测小鼠主要器官组织中氧化应激因子的含量和活力,探究蛹虫草的体内抗氧化应激保护作用。在注射LPS后2~8 h,对照组小鼠肝脏指数增大明显(P<0.05),这与杨毅等[16]的研究结果一致,同时,试验组肝脏指数显著低于对照组(P<0.05)。CAT是机体典型的抗氧化酶,可拮抗机体产生过量的H2O2,T-AOC指数显示了机体的总抗氧化酶活力,抗氧化物系统功能状态,其含量与细胞抗氧化能力呈正相关。由试验结果可以看出,LPS注射后4~6 h,试验组各组织的T-AOC指数、CAT活性均高于对照组(P<0.05),至试验结束(8 h),试验组T-AOC指数、CAT活性已恢复至空白组水平,但对照组T-AOC指数、CAT活性仍显著低于其他两组(P<0.05)。说明日常服用蛹虫草能够强化机体应对急性氧化应激刺激的能力,有助于机体抗氧化系统功能状态的恢复,对肝脏的保护作用最为明显。
MDA是膜脂过氧化的终产物之一,MDA含量能间接考察细胞受到胁迫严重程度,是反映机体抗氧化潜在能力的重要参数[17]。H2O2由ROS转化而来,组织中H2O2含量升高可直接对各器官组织造成伤害[18]。LPS注射引起对照组肝脏、肾脏、脑组织中的MDA和H2O2含量明显增加,说明小鼠肝脏和肾脏是应对LPS氧化应激较为敏感的器官。阮佼[19]的研究结果证实,LPS可导致小鼠肝脏、肾脏、脑、肺、空肠等组织中MDA含量增高,CAT、SOD等抗氧化酶活性降低。张明亮等[20]研究表明,蛹虫草的黄色素成分具有很好地清除自由基活性的作用。该研究发现,LPS注射后2~6 h,试验组各组织中的MDA和H2O2含量上升趋势较为平缓,说明日常服用蛹虫草可以增强机体对MDA和H2O2的清除能力,缩短机体自由基系统恢复平衡的时间,避免机体遭受更为严重的氧化应激攻击。
氧化应激反应是生物体内遭遇外部不良物质刺激最常见的应答方式,过激的氧化应激反应则会造成机体意想不到的氧化损伤。该试验以小鼠LPS氧化应激模型评价了蛹虫草的体内抗氧化损伤能力,研究结果显示,短时间服用蛹虫草可以增强机体的抗氧化平衡状态,该试验为蛹虫草抗氧化活性的研究和应用提供了新的科学依据。
