水稻光温敏不育系gy157S的叶色表型鉴定与候选基因分析
2023-03-09陈能刚张宏伟郝留根王珍珍易崇粉韩丽珍杨占烈
谢 英 陈能刚 张宏伟 郝留根 王珍珍 易崇粉 韩丽珍 杨占烈,*
(1贵州大学生命科学学院/农业生物工程研究院,山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025;2贵州省农作物品种资源研究所,贵州 贵阳 550006;3贵州省水稻研究所,贵州 贵阳 550006)
水稻(Oryza sativaL.)杂交种纯度是杂交水稻生产的重点[1]。带叶色标记性状的植株具有明显的颜色表型,很容易被识别并去除,较分子标记辅助育种成本低、效率高。因此,可将具有良好农艺性状的黄化、白条纹、白化转绿等表型的叶色突变体作为改良材料,把叶色标记性状运用到水稻杂交育种当中,以提高杂交水稻种子纯度[2-3]。此外,水稻叶色突变体是研究水稻光合作用、叶绿素合成与降解及其生长发育调控机制的重要材料[4]。发掘更多的水稻叶色突变体,并开展相关基因克隆和功能分析,有助于阐明水稻叶色变异和光合作用的分子机制。迄今为止,被克隆的水稻叶色基因已经超过120个,其中大部分是隐性核基因,有小部分是显性核基因或细胞质基因[5-6]。这些基因突变分别导致水稻叶色呈现出黄化、白化、持绿、条纹、斑马、紫色、黄化转绿、白化转绿等表型,并且大多数突变体伴随着叶绿素含量减少、叶绿体发育异常[7]。由于这些变化与叶绿素合成[8-9]与降解[10]、类胡萝卜素合成[11]、叶绿体结构与功能[12]、叶绿体发育[13]、光合作用与光形态发生[14]、细胞程序性死亡[15]等生物学过程密切相关,导致许多叶色突变体光合速率下降,甚至严重影响作物的产量和存活率[16]。然而,随着生物技术的发展和叶色变异研究的深入,部分叶色突变体具有较高光合效率和较强的耐受光抑制能力,从而使水稻产量提高,如突变体ygl1[17]。也有一些叶色基因在粳稻或籼稻的不同遗传背景下,叶片的颜色有所不同[18]或对水稻产量和光合作用发挥着截然不同的作用[19]。前人研究发现,在水稻中一些叶色基因与抗病性有关,对水稻分子育种有很大应用价值,如在易感纹枯病粳稻品种9522中,抑制OsNYC3基因的表达能大幅增加该品种对纹枯病的抗病性,并且对水稻产量和主要的农艺性状基本没有影响[20];而水稻黄叶突变体lc7基因编码铁氧还蛋白依赖性谷氨酸合酶1 不仅可以调节氮同化和叶绿体发育,还在广谱白叶枯病抗性中发挥重要作用[21]。此外,滞绿突变体由于整个生长周期叶片表型都为绿色,叶绿素含量增高,可以作为优质的稻草提供给畜牧业[22]。水稻叶色变化和光合作用的调控机制极其复杂,虽然近年来鉴定与克隆得到许多水稻叶色变异的基因,但仍然需要鉴定更多的涉及叶色突变和光合作用的功能基因[6]。除此之外,将叶色突变体应用到杂交水稻生产当中的难度仍较大。因此,本研究将由自然突变获得的黄绿叶突变性状导入水稻两系不育系中,创制出携带黄绿叶标记新的两系不育系gy157S,结合叶色表型观察和叶绿素含量测定、透射电镜观察、遗传分析、基因定位和候选基因遴选、DNA 测序验证、实时荧光定量PCR(quantitative real-time PCR,qRTPCR)分析等研究,以期为探明目标基因对水稻叶色的调控机制和生产应用潜力提供理论基础。
1 材料与方法
1.1 试验材料
水稻黄绿叶光温敏不育系gy157S(系谱来源:C815S///C815S/黄绿叶突变体//紫2B,贵州省农作物品种资源研究所),是由黄绿叶自然突变体(软红米/粤泰B//品资5B/中9B 的F3代群体中发现的黄绿叶自然突变株)与C815S(湖南农业大学)杂交获得的F1代,然后与籼稻紫2B(贵州省水稻研究所)杂交获得复交F1代,从中选择黄绿叶单株与光温敏不育系C815S 杂交,再经多年多代系统选育而成。本研究以gy157S来源亲本之一的光温敏不育系C815S 作为试验对照材料(近似品种);籼稻R1638(贵州省农作物品种资源研究所)为定位群体的亲本。
1.2 苗期叶色表型观察
将gy157S与亲本C815S种子在35 ℃条件下催芽3 d后,将发芽的种子分别播种于20和30 ℃的光照培养箱(12 h 光照/12 h 黑暗)中培育,每隔48 h 观察1 次幼苗的生长情况,记录叶片的表型变化。
1.3 叶片光合色素含量的测定
分别选取20 和30 ℃条件下生长20 d 的亲本C815S和gy157S的全展叶,洗净用滤纸晾干,然后称取剪去中脉的新鲜叶片约0.2 g,剪碎放入10 mL 的离心管中,加入无水乙醇后放置于4 ℃冰箱中黑暗下浸提48 h,在浸提期间多次手动摇晃,以保证溶剂和叶片的充分接触,直至叶片由绿色变为白色。将浸泡后的提取液移入25 mL 容量瓶中,以无水乙醇定容以及调零。使用722N型分光光度计(上海菁华科技仪器有限公司)测量665、649 和470 nm 下的吸光值,重复测定3 次。然后参考Lichtenthaler[23]的方法,计算单位质量叶绿素a(chlorophyll a,Chl a),叶绿素b(chlorophyll b,Chl b)和类胡萝卜素(carotenoid,Caro)含量。
1.4 叶片叶肉细胞超微结构观察
叶片取样方法与1.3 相同,然后将叶片沿叶脉方向剪成面积约1 mm2的正方形,尽量减小牵拉、挫伤与挤压等机械损伤,参照张天雨等[24]的方法进行制片染色,在hitachi HT7700 透射电子显微镜(日立高新技术公司,日本)下观察并采集图像。
1.5 遗传分析与群体构建
利用gy157S 与R1638 进行正反杂交,按常规种植加代收获的F1代和F2代种子,作为遗传研究和基因定位的群体。
1.6 DNA的提取和PCR扩增
水稻新鲜叶片DNA 使用十二烷基硫酸钠(sodium dodecyl sulfate,SDS)法提取,分别提取C815S、gy157S、gy157S与R1638杂交F2绿叶混池和黄绿叶混池及F2黄绿叶群体的DAN 用于基因定位。PCR 体系共10 μL:Taq酶5 μL、DNA 模板1 μL、ddH2O 2 μL、上下游引物各1 μL。反应程序:94 ℃预变性2 min;94 ℃变性30 s,55~60 ℃(退火温度根据引物差异稍有改动)退火30 s,72 ℃ 延伸45 s,30 个循环;72 ℃终延伸2 min,此反应产物用于分子标记定位。
1.7 DNA文库构建、测序和数据处理及分析
采用高通量测序技术与集团分离分析法相结合(bulked segregant analysis sequencing,BSA-seq)的方法,分别从gy157S/R1638的F2群体中选取30 株叶片为正常绿色的单株和30 株叶片呈现黄绿叶的单株提取总DNA,分别等量混合成正常绿叶基因池和黄绿叶突变基因池,gy157S 和R1638 分别取10 株提取总DNA,待检验合格后送北京诺禾致源科技股份有限公司进行测序。以籼稻品种R498的基因组序列为参考基因组,对所有混池进行二代测序,亲本池测序深度为10×,混池的测序深度为20×。参照Takagi等[25]和程凤等[26]的方法,计算出两个子代样本的相对于参考基因组的单核苷酸多态性(single nucleotide polymorphism,SNP)频率(SNP-index)和插入缺失(insertion/deletion,InDel)频率,计算两个极端混池样本之间的ΔSNP-index 和ΔInDel-index:
ΔSNP-index=SNP-index(黄绿叶混池,yellow-green leaf mixing pool,YP)-SNPindex(绿叶混池,green leaf mixing pool,GP)
ΔInDel-index=InDel-index(黄绿叶混池,YP)-InDelindex(绿叶混池,GP)
选取95%和99%置信水平作为筛选的阈值,统计阈值内SNP 位点的ΔSNP-index 和ΔInDel-index 平均值绘制染色体分布图。
1.8 基因定位
为了进一步验证BSA-seq分析结果和缩小候选区间范围,利用籼稻9311 和粳稻日本晴基因组间的差异,选上述染色体区段上均匀分布的简单重要序列(simple sequence repeats,SSR)标记,由成都擎科梓熙生物技术有限公司合成。对亲本R1638 和gy157S 进行多态性标记筛选,筛选到的多态性标记用于连锁分析,找到两个池间有多态的标记,用于基因定位,初步确定突变基因的位置。所用SSR 标记序列下载至Gramene数据库(http://www.gramene.org)(表1)。

表1 与目标基因连锁的SSR引物序列Table 1 SSR primer sequences linked to the target gene
1.9 总RNA 提取与qRT-PCR
选取20 ℃条件下生长20 d的亲本C815S和gy157S幼苗叶片相同部位提取总RNA,对候选相关基因、光合色素合成相关基因的表达水平进行qRT-PCR 分析。候选基因分别为OsR498G0306815500.01、OsR498G03 06965500.01、OsR498G0306729500.01、OsR498G03069 57400.01。叶绿素合成基因分别为CHLH、OsPORA、YGL1、GSA-AT、HEMA1、OsCAO2、OsYLC2、OsDVR、OsCHLM。总RNA 的提取和qRT-PCR 分析参照鄢小青等[27]的方法,所有qRT-PCR 引物由成都擎科梓熙生物技术有限公司合成(表2)。

表2 qRT-PCR引物序列Table 2 qRT-PCR primer sequences
2 结果与分析
2.1 黄绿叶光温敏核不育系gy157S 在不同温度下苗期表型观察与光合色素含量变化
为了探讨gy157S的黄绿叶表型是否受温度的影响,本研究以C815S为对照材料开展了不同温度的处理试验。结果显示,在20和30 ℃处理条件下,播种后20 d,对照材料C815S的幼苗均呈现正常绿叶表型(图1-A、B);gy157S在20 ℃条件下,幼苗叶色呈现出黄绿表型(图1-A),而在30 ℃条件下,呈现出淡绿色表型(图1-B)。在不同温度下测定C815S 和gy157S 光合色素含量,结果发现,在20 ℃条件下,gy157S植株叶片的总叶绿素、叶绿素a、叶绿素b和类胡萝卜素含量均较对照C815S极显著下降(图1-C),分别降低54.7%、26.34%、76.49%、23.69%;在30 ℃条件下,gy157S 叶片的总叶绿素、叶绿素a、叶绿素b和类胡萝卜素含量也均较C815S 极显著下降(图1-D),分别降低37.85%、33.07%、55.65%、19.59%。上述结果表明,gy157S 的黄绿叶表型与叶片光合色素含量变化有关,且受温度的影响。

图1 不同温度下C815S和gy157S幼苗表型及光合色素含量Fig.1 Phenotype and photosynthetic pigment content of the C815S and gy157S seedings under different temperature conditions
2.2 黄绿叶光温敏核不育系gy157S 叶绿体显微结构观察
为了检测在不同温度条件(20和30 ℃)下gy157S叶绿体的发育情况,采用透射电子显微镜观察在不同温度条件下生长20 d的gy157S和C815S秧苗叶肉细胞超微结构。结果显示,在不同温度条件下对照C815S 的叶肉细胞中叶绿体含量丰富,形态也比较饱满(图2-A、E),类囊体和基质片层结构完整,且规则排列(图2-C、G)。而gy157S在20 ℃条件下,部分叶肉细胞的叶绿体发育畸形,有部分没有叶绿体,淀粉颗粒与同等条件下C815S相比,gy157S的数量更多、体积更小(图2-C、D),并且类囊体和基质片层结构错综复杂地堆叠甚至缺失(图2-D);30 ℃条件下,仍有少部分叶绿体发育异常,但大部分与C815S 相比无明显差异(图2-F、H)。结果表明,gy157S 的叶绿体发育在一定程度上受温度的影响。

图2 不同温度下C815S和gy157S叶绿体超微结构比较Fig.2 Comparison of chloroplast ultrastructure between C815S and gy157S under different temperature conditions
2.3 gy157S黄绿叶标记性状的遗传分析
为了分析gy157S黄绿叶表型的遗传特性,将gy157S与R1638进行正反交,所得F1植株均表现为正常叶色。在正反交F2群体中叶色发生了明显的分离,分别对两个F2代分离群体进行调查,经卡方(χ2)测验,发现正常叶色和黄绿色植株的分离比例均符合3.84)(表3),表明两系不育系gy157S 黄绿叶性状受1对隐性核基因控制,将该基因暂命名为gy157S(t)。

表3 gy157S的遗传分析Table 3 Genetic analysis of gy157S
2.4 BSA重测序分析与基因定位
2.4.1 BSA 重测序分析 通过重测序共获得原始数据38.056 G,过滤后为37.658 G,各样本测序质量高(Q20≥95.88%、Q30≥89.83),GC 含量占比在43.63%~44.14%之间。综上,所有样本的数据量足够,测序质量合格,GC分布正常,符合建库测序要求(表4)。

表4 测序数据质量情况汇总Table 4 Summary of sequencing data quality
基于基因分型的结果,筛选两个亲本间纯合差异的SNP和InDel标记,共挑选出569 146个SNP和167 026个InDel位点。分析计算两个子代在亲本SNP 和InDel 标记位点的△SNP-index 和△InDel-index。分别将△SNP-index和△InDel-index 结果进行1 000 次置换检验,选取95%置信水平作为筛选的阈值(图3-A、B)。为直观反映子代SNP-index 和InDel-index 合并后的All-index 在染色体上的分布情况,对All-index 在染色体上的分布进行作图,计算△All-index。进行1 000次置换检验,选取95%置信水平作为筛选的阈值(图3-C)。结果显示,以1 Mb为窗口,95%置信水平下在3 号染色体定位出17 个符合的区域,主要集中在4 780 001~5 868 000、26 606 001~30 593 000 和31 378 001~32 445 000 位置,总长分别为1.09、3.99 和1.07 Mb 的候选区域内,候选区间初步估计为Chr3:4.78~11.9 Mb和Chr3:26.61~32.45 Mb;以1 Mb为窗口,99%置信水平下在3 号染色体定位出7 个符合的区域,主要集中在26 779 001~30 376 000 bp之间,长度为3.60 Mb,候选区域初步估计为Chr3:6.92~11.43 Mb 和Chr3:26.76~31.15 Mb(表5)。
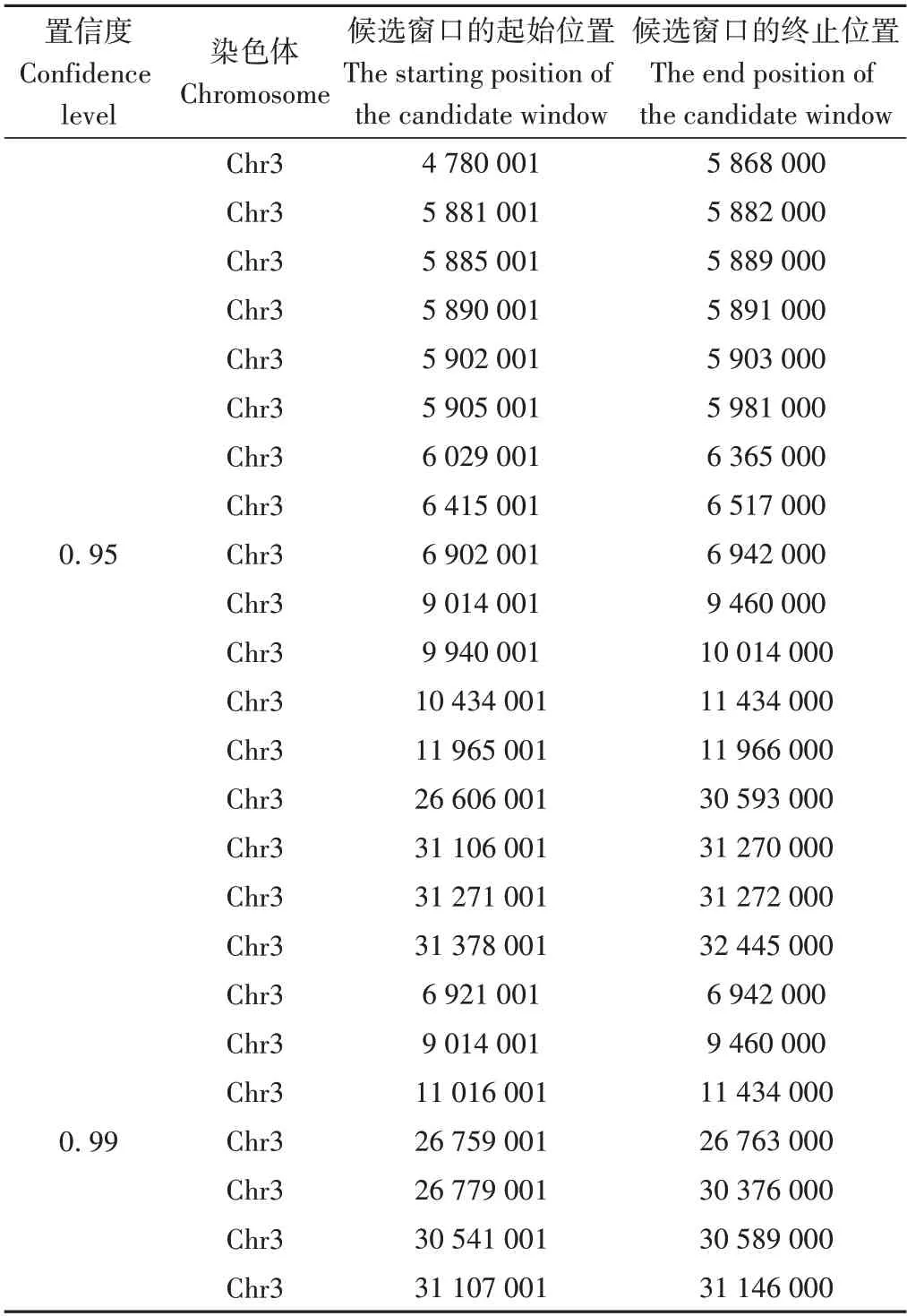
表5 gy157S/R1638 F2群体ΔAll-index候选区域Table 5 Candidate regions of gy157S/R1638 F2 population with ΔAll-index/bp

图3 两个混池之间的差异分布和SSR分子定位Fig.3 Difference distribution between two pools and SSR molecular localization
2.4.2 gy157S 黄绿叶标记基因的定位 利用亲本gy157S 和R1638 间的差异,筛选出多态性好的SSR 引物,然后利用定位群体中的10个正常单株混池和10个黄绿叶单株混池进行遗传连锁分析。结果发现,黄绿叶表型与第3号染色体上的SSR标记RM15824和RM15848连锁。同时对附近的SSR 引物进行多态性筛选,获得多态性标记RM15678、RM15824、RM15848及RM16200。分别对192个F2黄绿叶单株进行分析,初步将黄绿叶基因gy157S(t)定位于分子标记RM15678 与RM15824 之间,遗传距离分别为13.2和4.7 cM,该区间约为2.4 Mb(图3-D),且位于BSA-Seq 置信度为95%候选区域Chr3:26.61~32.45内。
2.4.3 黄绿叶基因gy157S(t)的候选基因预测 对于质量性状的BSA 分析,在候选区间内All-index 为1 且造成基因功能改变的移码突变、提前终止或者非同义突变极有可能是引起表型变异的位点,可将其作为候选基因筛选的重点。根据分子育种信息库(http://mbkbase.org)的基因注释信息和BSA分析结果,第3号染色体26.61~32.45 Mb 区间All-index 为1,且造成基因功能变异位点有4 个,分别位于基因OsR498G03067 29500.01、OsR498G0306815500.01、OsR498G0306957400.01和OsR498G0306965500.01,因此将这4 个基因作为候选基因筛选的重点。OsR498G0306729500.01编码胰蛋白酶半胱氨酸/丝氨酸肽酶结构域,外显子区域存在一个碱基缺失;OsR498G0306815500.01编码铁氧还蛋白OsFdC2,其外显子上存在1 个非同义突变;OsR498G0306957400.01编码腺苷酸环化酶蛋白,其外显子区域发生了非同义突变,OsR498G0306965500.01编码三磷酸肌苷焦磷酸酶,其3'UTR 存在一个碱基缺失(表6)。采用qRT-PCR 技术对gy157S 和C815S中OsR498G0306729500.01、OsR498G0306815500.01、OsR498G0306965500.01和OsR498G0306957400.01表达量进行分析(图4)。结果显示,与C815S 相比,OsR498G0306815500.01的表达量极显著增加,OsR498G0306729500.01和OsR498G0306965500.01的表达量极显著下降,OsR498G0306957400.01的表达量显著下降。利用在线工具https://www.genscript.com/蛋白质亚细胞定位进行预测,显示OsR498G0306815500.01、OsR498G0306957400.01和OsR498G0306965500.01定位于叶绿体,OsR498G0306729500.01位于细胞质(表7)。以上分析结果表明,4个预测基因均有可能是本研究黄绿叶突变体的候选基因。进一步分析发现,以上4 个候选基因中,只有OsR498G0306815500.01位于候选区间RM15678和RM15824内,因此推测该基因可能为候选基因。进一步对OsR498G0306815500.01测序结果显示,该基因第7个外显子上第2 594 bp位由T突变为G,导致酪氨酸(Y)突变为天冬氨酸(D)。

表6 突变位点All-index信息Table 6 All-index information of mutation sites

图4 20 ℃条件下C815S及gy157S叶片中候选基因的表达分析Fig.4 Expression analysis of candidate genes in C815S and gy157S leaves at 20 ℃
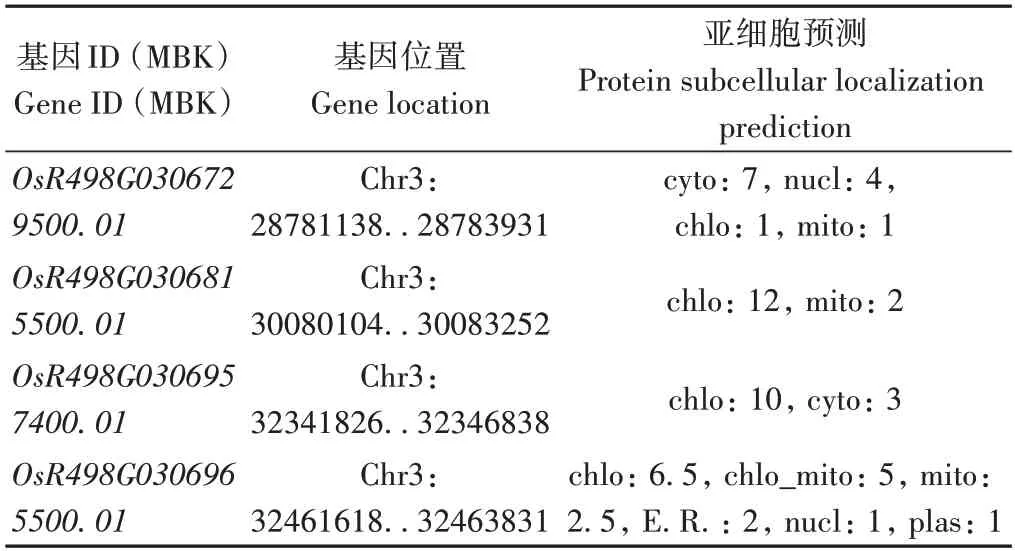
表7 候选基因蛋白质亚细胞定位预测Table 7 Candidate gene protein subcellular localization prediction
2.5 叶绿素合成相关基因的表达分析
由于gy157S植株叶绿素含量较对照C815S显著下降,低温下叶绿体形态结构受损严重,推测gy157S中叶绿素合成相关基因可能会受到影响。qRT-PCR 定量分析结果显示,在20 ℃条件下,与对照材料C815S 相比,叶绿素生物合成相关叶绿素合酶基因(YGL1)、谷氨酰-1-半醛氨基酸转移酶基因(GSA-AT)、尿卟啉原Ⅲ脱羧酶基因(HEMA1)、亚铁血红素加氧酶基因(OsYLC2)、镁原卟啉甲基转移酶基因(OsCHLM)表达量呈显著或极显著上调,而原叶绿素酸酯氧化还原酶A 基因(OsPORA)表达量显著下降,其余几个叶绿素合成基因镁离子螯合酶基因(CHLH)、叶绿素酸酯a氧化酶基因(OsCAO2)、联乙烯还原酶基因(OsDVR)表达量无显著变化(图5)。

图5 20 ℃条件下C815S及gy157S叶片中叶绿素合成相关基因的表达分析Fig.5 Expression analysis of chlorophyll synthesis related genes in C815S and gy157S leaves at 20 ℃
3 讨论
叶绿素的合成和叶绿体的发育在植物光合作用中发挥着至关重要的作用。在水稻叶色突变中,叶绿素合成和叶绿体发育相关基因变异往往会导致叶色发生改变。目前已克隆的参与叶绿素合成途径的叶色基因有OsHemA[28]、CHLH[29]、YGL2[30]、CHLD[31]、OsCAO1[32]、OsDVR[33]、CHLI[34]、FGL[35]、OsCAO2[36]和OsYLC2[37]等;调控叶绿体发育的基因有GRA78[38]、WGL2[39]、WSL6[40]、Z15[41]和RA1[42]等。叶色突变体的表型通常与光合色素含量相关,如ygl80[43]、ys53[44]、ygl11(t)[45]在整个生育期都呈现黄化表型,突变体的光合色素含量均比野生型低,本研究中gy157S的表型变化受光合色素含量影响,在20 ℃条件下表现出黄绿叶表型,在高温30 ℃条件下表现出淡绿叶表型;在不同温度条件下叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均极显著低于对照C815S。叶绿体是植物进行光合作用的主要场所,很多水稻叶色突变体叶绿体发育异常,与类囊体结构和基粒结构是否发生改变有关。如突变体ys53叶绿体没有完整的类囊体和基粒结构,表现出明显的空泡化[44];ye1类囊体层状数量减少、排列不良[46]。本研究中,与C815S相比,gy157S 类囊体和基质片层结构错综复杂地堆叠(图2-D),导致叶绿体发育受到抑制。在水稻中存在一类温敏型叶色突变体,不同温度条件下,该类突变体的叶片颜色和叶绿体发育状态不同,可以利用它们研究水稻的叶绿素合成,叶绿体发育,以及对光温响应的分子机制等。如tcm5突变体的叶片在28 ℃时为黄绿叶表型,叶绿素含量较野生型显著降低,而在20 ℃时叶片颜色和叶绿素含量与野生型无明显差异[47];ygl4在20 ℃条件下比25和30 ℃条件下黄化表型加重且光合色素含量更低[48]。本研究中,gy157S在20 ℃条件下,部分叶肉细胞的叶绿体发育畸形,甚至缺失,淀粉颗粒与对照C815S相比数量更多、体积更小(图2-C、D),并且类囊体和基质片层结构错综复杂地堆叠甚至缺失(图2-D)。在30 ℃条件下,仍有少部分叶绿体发育异常,但大部分与C815S 相比无明显差异(图2-F、H),与叶色变化相一致。因此,推测gy157S 的黄绿叶表型不仅受温度调控,还可能影响叶绿体发育和光合色素的合成。
水稻叶色基因的克隆和功能研究有助于阐明叶色调控的分子机制[49]。本研究利用gy157S 与R1638 进行正反杂交构建F2群体,遗传分析结果表明,gy157S黄绿叶性状受1 对隐性核基因控制(表3)。从F2群体中选择黄绿叶植株和绿叶植株构建极端表型的DNA 混池,采用BSA分析发现,在第3号染色体短臂和长臂上各存在1个明显的ΔSNP指数曲线的峰(图3),这两个区间可能存在控制gy157S 黄绿叶表型的候选基因。而短臂上的测序覆盖度不高,该区间的峰可能是测序覆盖度低引起的假阳性。因此,根据BSA 分析的95%置信度区间,将第3 染色体长臂26.61~32.45 Mb 作为候选基因的重点区间。采用连锁分析,进一步对目标基因进行验证并将其定位于标记RM15678 与RM15824 之间。该区间内只有基因OsR498G0306815500.01的SNP指数为1,且造成基因编码氨基酸的变异。候选基因双亲测序结果显示,OsR498G0306815500.01的第7 外显子上的2 594 bp 处碱基T 突变为G,导致酪氨酸(Y)突变为天冬氨酸(D)。qRT-PCR 结果表明,gy157S 中OsR498G0306815500.01的表达量相比C815S 极显著上调(图4)。因此,推测OsR498G0306815500.01可能是导致黄绿叶两系不育系gy157S 叶色变化的候选基因。OsR498G0306815500.01编码铁氧还蛋白(ferredoxin,Fd)的一种Fd-like 蛋白(FdC)OsFdC2。前人研究发现,FdC 能够与需氧环化酶结合参与叶绿素的合成[50],与psbA 转录[51]以及对青枯菌菌株抗病性[52]等功能有关,到目前为止,FdC蛋白在高等植物中的研究较少,其功能仍有待研究。
水稻中OsFdC2已被克隆,该基因与拟南芥FdC2基因(AT1G32550)有较高相似性[53]。研究表明,OsFdC2可以将光合电子从PSI 传输到其他Fd 依赖性代谢途径参与光合电子传递和碳同化[54]。水稻突变体501ys中OsFdC2编码区第1 447 位(cDNA 的314 位)碱基由C替换为T,导致其DNA序列发生错义突变。与野生型的叶色相比,501ys在整个生育期都表现为黄绿叶,并且叶绿素含量减少,与野生型相比,501ys突变体中的叶绿体更膨胀,叶绿体中颗粒堆减少,且嗜锇颗粒显著增多[53]。ygl18编码OsFdC2的基因LOC_Os03g48 040的5'UTR 发生突变,与野生型相比,黄绿叶突变体ygl18自三叶期起叶片开始变黄,同时伴随着光合速率与叶绿素含量下降[55]。突变体hdy1编码OsFdC2的基因LOC_Os03g48040剪接位点单碱基突变(G→A)导致移码突变,与野生型相比,hdy1表现为抽穗期延迟和黄叶表型,叶肉细胞中叶绿体的数量没有明显差异,但类囊体片层结构异常且含有更少的基质片层[56]。本研究的gy157S 是通过杂交选育的方式,将自然变异的黄绿叶突变性状导入水稻两系不育系中创制出新的携带黄绿叶性状两系不育系。与501ys,gyl18,hdy1不同,gy157S是基因OsFdC2第7外显子上的2 594 bp处发生单碱基突变,导致编码氨基酸发生改变,在大田种植整个生育期都为黄绿色,与501ys表型相似。然而,gy157S在20 ℃条件下表现出黄绿叶表型,叶绿体发育严重受阻,在高温30 ℃条件下表现出淡绿叶表型,叶绿体发育大部分恢复正常,这与OsFdC2相关的其他突变体表型存在差异。综上,推测gy157S(t)对叶绿体发育和叶色的调控可能受温度影响。
下一步将通过基因编辑和功能互补确认gy157S(t)的候选基因,并探索在水稻生长发育途径中的作用,为阐明gy157S(t)基因对叶绿体发育和叶绿素合成的分子调控机制奠定基础。
4 结论
光温敏核不育系gy157S的黄绿叶表型受温度的影响,在20 ℃条件下,呈现黄绿叶表型,叶片中光合色素含量极显著降低,叶绿体发育缺陷。在30 ℃条件下,gy157S幼苗呈现淡绿叶表型,叶片光合色素含量呈现极显著降低,但叶绿体发育大部分恢复正常。gy157S的黄绿叶表型由1 对隐性核基因控制,BSA 分析和连锁分析结果将其定位于第3号染色体标记RM15678和RM15824之间,候选区间的基因功能分析、双亲测序和qRT-PCR结果表明,OsFdC2可能是gy157S 黄绿叶表型的候选基因。
