黄精酒制前后多糖单糖组成及抗氧化活性对比研究❋
2023-03-07鲁文洁陈井太宋志前万晓莹彭诗涛刘振丽宁张弛
鲁文洁,陈井太,宋志前,万晓莹,彭诗涛,刘振丽,宁张弛△,王 淳△
(1.中国中医科学院中医基础理论研究所,北京 100700;2.北京四方中药饮片有限公司,北京 100072;3.上海林清轩生物科技有限公司,上海 201600)
蒸法是中药传统炮制中常用的关键技术之一,能增加一些中药的免疫活性,如黄精、何首乌、五味子、牛膝等[1-4],而多糖类成分是这些中药表现免疫调节作用的共性有效成分之一[5,6]。由于多糖的结构极其复杂,解析其结构就要先分析其单糖组成[7]。高效液相色谱(High Performance Liquid Chromatography,HPLC)法联合不同检测器是目前最常用的单糖组成分析方法。根据所用检测器的不同,可分为衍生化后测定和直接测定两种情况。一是联用二级管阵列检测器(Diode Array Detector,DAD)或荧光检测器(Fluorescence Detector,FLD)时,需对多糖水解液进行衍生化后方能测定。1-苯基3-甲基-5吡唑啉酮(3-Methyl-1-phenyl-2-pyrazolin-5-one,PMP)是常用的单糖衍生化试剂。二是联用蒸发光散射检测器(Evaporative Light Scattering Detector,ELSD)或示差折光检测器(Refractive Index Detector,RID)等时,可不进行衍生化处理直接测定单糖[8]。
本文从黄精多糖的单糖组成入手,通过对比HPLC-ELSD、HPLC-RID和PMP-HPLC-DAD 3种分析方法的检测效果,确定黄精多糖单糖组成的测定方法。并进一步考察黄精酒制前后多糖的单糖组成变化,为明确酒制对黄精多糖初级结构的影响提供依据。同时还对酒制前后黄精多糖的抗氧化活性进行测定,为临床用药提供依据。
1 材料
1.1 药物与试剂
果糖(货号:100231-201807,纯度≥99.6%)、岩藻糖(货号:112014-201902,≥99.6%)、半乳糖(货号:100226-201807,≥95.9%)、D-无水葡萄糖(货号:110833-200904,100%)和鼠李糖(货号:11683-201502,100%)对照品购自中国食品药品检定研究院;D-甘露糖(货号:C16J8H28561,纯度≥98%)、L(+)-阿拉伯糖(货号:20179462701,纯度≥98%)对照品购自上海源叶生物科技有限公司;三氟乙酸(货号:20190527)购自天津市大茂化学试剂厂;磷酸氢二钾(货号:030517)购自北京化学试剂公司;氢氧化钠(货号:20120109)购自北京化工厂;1-苯基3-甲基-5吡唑啉酮(3-Methyl-1-phenyl-2-pyrazolin-5-one,PMP,货号:C11370802)购自上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl,DPPH,货号:STBB0719)购自美国sigma公司;乙腈、甲醇为色谱纯,其他试药为分析纯。
从多花黄精主产地湖南、安徽、贵州、湖北、江西、广东等地购买了11个批次药材,经北京中医药大学中药学院刘春生教授分别鉴定为百合科植物多花黄精Polygonatum cyrtonema Hua,样品信息见表1。

表1 黄精药材品种和来源信息
1.2 主要仪器
1200型高效液相色谱仪(含G-1322A在线真空脱气机,G-1311A高压四元泵,G-1313A标准自动进样器,G-1316A恒温箱,G1315CDAD SL检测器,G-1362A示差折光检测器,Agilent HP化学工作站),美国Agilent公司;2000型蒸发光散射检测器,美国Alltech公司;XWK-Ⅲ型空气发生器,天津市津分分析仪器制造有限公司;UGC-24C型氮吹仪,北京优晟联合科技有限公司。
2 方法与结果
2.1 黄精和酒黄精饮片的制备
按照课题组前期确定的工艺条件分别制备得到黄精和酒黄精饮片[9]。取黄精药材2 kg,洗净,切厚片(2~4 mm),置于鼓风干燥箱中,45 ℃干燥至含水量15%以下,得到黄精饮片。取黄精饮片1 kg,加黄酒200 g,拌匀,闷润过夜至酒吸尽;置蒸锅内隔水加热,炖至16 h,取出,同上干燥处理,得到酒黄精饮片。
2.2 黄精和酒黄精多糖的制备
取黄精和酒黄精饮片约500 g,加10倍量水回流提取2次,每次1 h,滤过,减压浓缩(60 ℃),加水定容至500 mL,缓慢加入乙醇,待含醇量达到90%,4 ℃冷藏过夜,离心,弃上清,用90%乙醇洗涤沉淀3次,冷冻干燥,称重,分别得黄精、酒黄精的粗多糖100.97 g、70.12 g,计算得率分别为20.15%和14.02%。分别取上述黄精和酒黄精的粗多糖,加水制成约1 g·L-1粗多糖溶液,按粗多糖溶液-Sevage试剂(3∶1)加入Sevage试剂[三氯甲烷-正丁醇(4∶1)],剧烈振摇,离心,弃去中间的蛋白层和下层有机层,重复3次,收集上层水液,加乙醇至醇浓度为90%,4 ℃冷藏过夜,离心弃去上清液,沉淀用90%乙醇洗涤3次后,冷冻干燥,得到纯化后多糖,称重,得黄精多糖和酒黄精多糖重量分别为74.21 g、51.76 g,计算得率分别为14.84%和10.35%[9]。
2.3 对照品溶液的制备
取果糖、葡萄糖、阿拉伯糖、岩藻糖、甘露糖、半乳糖和鼠李糖对照品适量,精密称定,分别加蒸馏水制成每1 mL含11.04 mg、5.60 mg、5.19 mg、5.24 mg、5.49 mg、5.38 mg、5.06 mg的单糖储备液。精密吸取各单糖储备液适量,置于10 mL容量瓶中,加蒸馏水稀释至刻度,即得每1 mL含果糖3.31 mg,葡萄糖0.56 mg,阿拉伯糖0.52 mg,岩藻糖0.52 mg,甘露糖0.55 mg,半乳糖0.54 mg,鼠李糖0.51 mg的混合对照品溶液。
2.4 黄精多糖酸水解条件的优化
2.4.1 因素水平表的设计 以水解温度、水解时间、酸浓度作为考察因素,采用L9(34)正交表进行三氟乙酸(Trifluoroacetic Acid,TFA)水解黄精多糖的正交试验设计。以单糖含量为指标,确定黄精多糖的最佳酸水解条件。因素水平见表2。

表2 黄精多糖酸水解正交试验因素水平表
2.4.2 供试品溶液的制备 取编号为PC-6的黄精多糖约10 mg,9份,精密称定,置于10 mL西林瓶中,按正交试验因素表加入不同浓度的TFA溶液2 mL,封盖,在不同温度下反应,水解液用氮气吹干,用2 mL甲醇溶解,氮气吹干,反复3次,直至TFA完全除尽。沉淀加水溶解,并定容至5 mL容量瓶中,即得。每组平行3次。
2.4.3 色谱条件 色谱柱:Agilent Carbohydrate NH2柱(4.6 mm×250 mm,5 μm)。柱温:30 ℃;流动相:乙腈-水(75:25);流速:1 mL/min;ELSD漂移管温度:110 ℃;气体流量:2.5 L/min;增益:8。
2.4.4 测定法 精密吸取混合对照品和样品溶液各5 μL,进样,计算单糖含量。
黄精多糖水解条件优化结果见表3,为避免单糖含量高低影响正交试验结果,采用权重法对4个单糖含量进行归一化处理,以综合评分M为评价指标,对黄精多糖水解条件进行优化,具体公式如下:
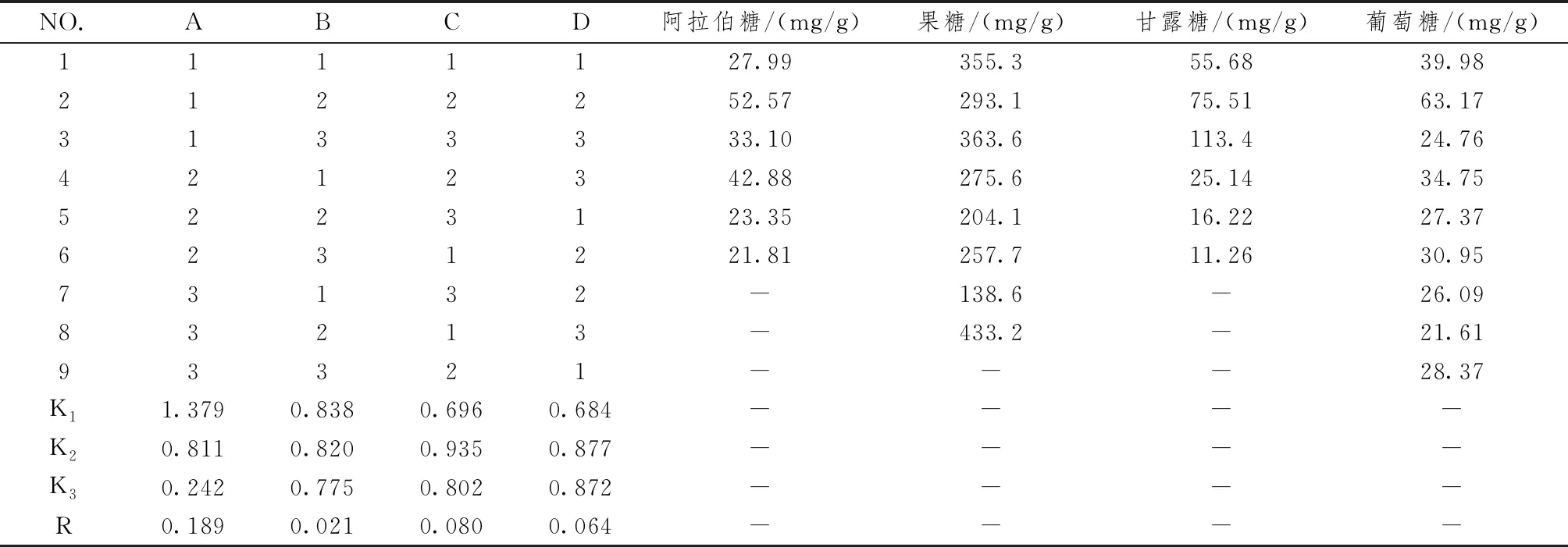
表3 黄精多糖水解正交试验结果
式中A、B、C、D分别为不同酸水解条件阿拉伯糖、果糖、甘露糖和葡萄糖含量。
由表4可以看出,影响黄精多糖酸水解效果的各因素水平作用分别为A>C>B,即水解温度>酸浓度>水解时间,但仅因素A(水解温度)具有显著性意义(P<0.05)。对于各指标,因素A和因素B均以第1水平最佳,因素C以第2水平最佳,结合方差分析和正交试验结果,最终确定黄精多糖的最佳水解条件为A1B1C2,即选取1 mol/L三氟乙酸在60 ℃下水解1 h。

表4 方差分析表
2.5 不同单糖检测方法的对比
对比HPLC-ELSD、HPLC-RID和PMP-HPLC-DAD 3种单糖分析方法的检测效果,确定最佳的单糖含量测定方法。
2.5.1 供试品溶液的制备 分别取编号为PC-6的黄精和酒黄精多糖约10 mg,精密称定,置于10 mL西林瓶中,按最佳水解条件进行水解,水解液采用氮气吹干,加2 mL甲醇溶解,氮气吹干,反复3次,直至TFA完全除尽。沉淀加水溶解,定容至5 mL容量瓶中,即得。
2.5.2 HPLC-ELSD法分析单糖组成
2.5.2.1 色谱条件 同2.4.3项。
2.5.2.2 测定法 精密吸取对照品和供试品溶液各5 μL,进样,测定。结果见图1,黄精和酒黄精多糖中均可检测到阿拉伯糖、果糖、甘露糖和葡萄糖4个单糖成分。

1.鼠李糖;2.岩藻糖;3.阿拉伯糖;4.果糖;5.甘露糖;6.葡萄糖;7.半乳糖
2.5.3 HPLC-RID法分析单糖组成
2.5.3.1 色谱条件 RID检测器温度:40 ℃。其余同2.4.3。
2.5.3.2 测定法 精密吸取对照品和供试品溶液各20 μL,注入液相色谱仪,测定。结果见图2,黄精和酒黄精多糖均仅检测到果糖。
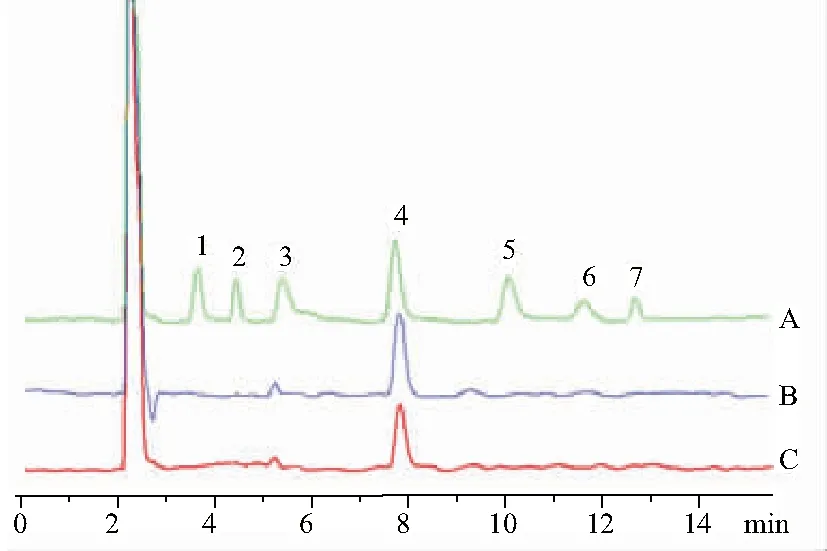
1.鼠李糖;2.岩藻糖;3.阿拉伯糖;4.果糖;5.甘露糖;6.葡萄糖;7.半乳糖
2.5.4 PMP-HPLC-DAD法分析单糖组成
2.5.4.1 色谱条件 色谱柱:Waterssymmetry C18色谱柱(3.0 mm×150 mm,3.5 μm)。柱温:30 ℃;流动相:乙腈-0.05 mol/L磷酸盐缓冲液(pH 6.92)(13:87);流速:0.5 mL/min;DAD检测波长:250 nm。
2.5.4.2 衍生化反应 精密吸取2.3项下混合对照品溶液和2.5.1项下供试品溶液各200 μL,置于试管中,依次加入0.3 mol/L的NaOH溶液和0.5 mol/L的PMP甲醇溶液各500 μL,混合,置于80 ℃下反应1.5 h,冷却至室温,再加入0.3 mol/L的HCl溶液500 μL中和反应液,用2 mL三氯甲烷萃取3次,除去PMP,弃去有机层,水层加水定容至2 mL容量瓶中,即得。
2.5.4.3 测定法 精密吸取衍生化后的对照品和供试品溶液各20 μL,进样,测定。结果见图3,黄精和酒黄精多糖中均只检测到葡萄糖和阿拉伯糖。

1.鼠李糖;2.半乳糖醛酸;3.葡萄糖;4.半乳糖;5.阿拉伯糖;6.岩藻糖
对比3种分析方法,HPLC-ELSD法可检测到阿拉伯糖、果糖、甘露糖和葡萄糖4种单糖;PMP-HPLC-DAD法仅检测到葡萄糖和阿拉伯糖2种单糖;HPLC-RID法仅能检测到果糖。因此,HPLC-ELSD法的检测效果最好,后续实验采用HPLC-ELSD进行含量测定。
2.6 黄精和酒黄精多糖单糖成分的含量测定
采用HPLC-ELSD法建立单糖的含量测定方法,并对比酒制前后黄精中4种单糖含量的变化。
2.6.1 对照品溶液的制备 分别精密吸取阿拉伯糖、果糖、甘露糖、葡萄糖的对照品储备液,置于10 mL容量瓶中,加水稀释至刻度,制成每1 mL含阿拉伯糖、果糖、甘露糖和葡萄糖质量浓度为0.52 mg、3.31 mg、0.55 mg和0.56 mg的混合对照品溶液。
2.6.2 供试品溶液的制备 取各批次黄精和酒黄精多糖约10 mg,精密称定,置于10 mL西林瓶中,按2.5.1项下方法制备供试品溶液,即得。
2.6.3 方法学考察
2.6.3.1 线性关系的考察 分别精密吸取2.2项下的混合对照品储备液,按1、2、4、6、8、10倍比进行稀释,得系列混合对照品溶液,按2.6.1项下的色谱条件进行测定,以峰面积的自然对数(natural logarithm)为纵坐标(Y),相应的质量浓度的自然对数值log C为横坐标(X),绘制标准曲线,计算回归方程与线性范围,求r值。结果如表5所示,各单糖成分相关系数r均达到0.999 2以上,表明4个单糖成分的线性关系良好。

表5 线性关系考察结果
2.6.3.2 精密度试验 精密吸取编号为PC-6黄精多糖供试品溶液5 μL,连续进样6次,按2.6.1项下色谱条件测定。结果表明4个单糖成分的峰面积对数值(log A)的RSD均<1.0%,表明该方法的精密度良好。
2.6.3.3 稳定性试验 精密吸取编号为PC-6黄精多糖供试品溶液5 μL,分别于制备后0、2、4、6、8、24 h测定,结果表明4个单糖成分峰面积对数值(log A)的RSD均<1.0%,表明4个单糖成分在24 h内稳定性良好。
2.6.3.4 重复性试验 取药材编号为PC-6的黄精多糖约10 mg,6份,精密称定,按2.6.2项下方法制备,分别测定并计算4个单糖成分的含量。结果显示,4个单糖成分含量的RSD均<2.0%,表明该方法重现性良好。
2.6.3.5 回收率试验 取已知各单糖含量的PC-6黄精多糖约5 mg,6份,精密称定,分别精密加入果糖、阿拉伯糖、甘露糖和葡萄糖对照品溶液,按2.6.2项下方法制备,分别测定并计算回收率。结果如表6所示,阿拉伯糖的回收率范围为95.83%~102.9%,RSD为2.63%;果糖的回收率范围为95.17%~102.6%,RSD为2.45%;甘露糖的回收率范围为96.36%~104.6%,RSD为3.37%;葡萄糖的收率范围为97.02%~99.70%,RSD为1.10%。4个单糖回收率值的RSD均<5.0%,表明该方法回收率符合标准。

表6 加样回收率考察结果
2.6.4 测定法 精密吸取黄精和酒黄精多糖供试品溶液5 μL,注入液相色谱仪,测定,即得。结果如表7所示,11批黄精多糖的单糖含量范围分别为阿拉伯糖39.59~97.48 mg/g,果糖249.2~570.2 mg/g,甘露糖40.39~98.19 mg/g,葡萄糖54.82~95.43 mg/g;11批酒黄精多糖的单糖含量范围分别为阿拉伯糖0.00~37.18 mg/g,果糖127.6~348.8 mg/g,甘露糖0.00~61.0 mg/g,葡萄糖65.76~106.4 mg/g;果糖在黄精酒制前后均为主要的单糖成分。同黄精相比,同批次酒黄精的果糖、甘露糖、阿拉伯糖的含量均降低,葡萄糖含量有所升高。其中5批酒黄精多糖未检测到阿拉伯糖,7批黄精多糖未检测到甘露糖。

表7 黄精多糖的单糖含量结果(mg/g)
2.6.5 主成分分析 采用Simca-P14.1软件对黄精和酒黄精的单糖含量进行主成分分析法(Principal Components Analysis,PCA)处理,共提取出3个主成分,其累积解释率R2(cum)为0.967,预测能力Q2(cum)为0.783,其中,其中,第一主成分解释了54.9%的变量信息,第二主成分解释了26.8%的变量信息,第三主成分解释了15.0%的变量信息。如图4所示,黄精和酒黄精可明显区分,表明炮制对黄精的单糖含量影响较大。
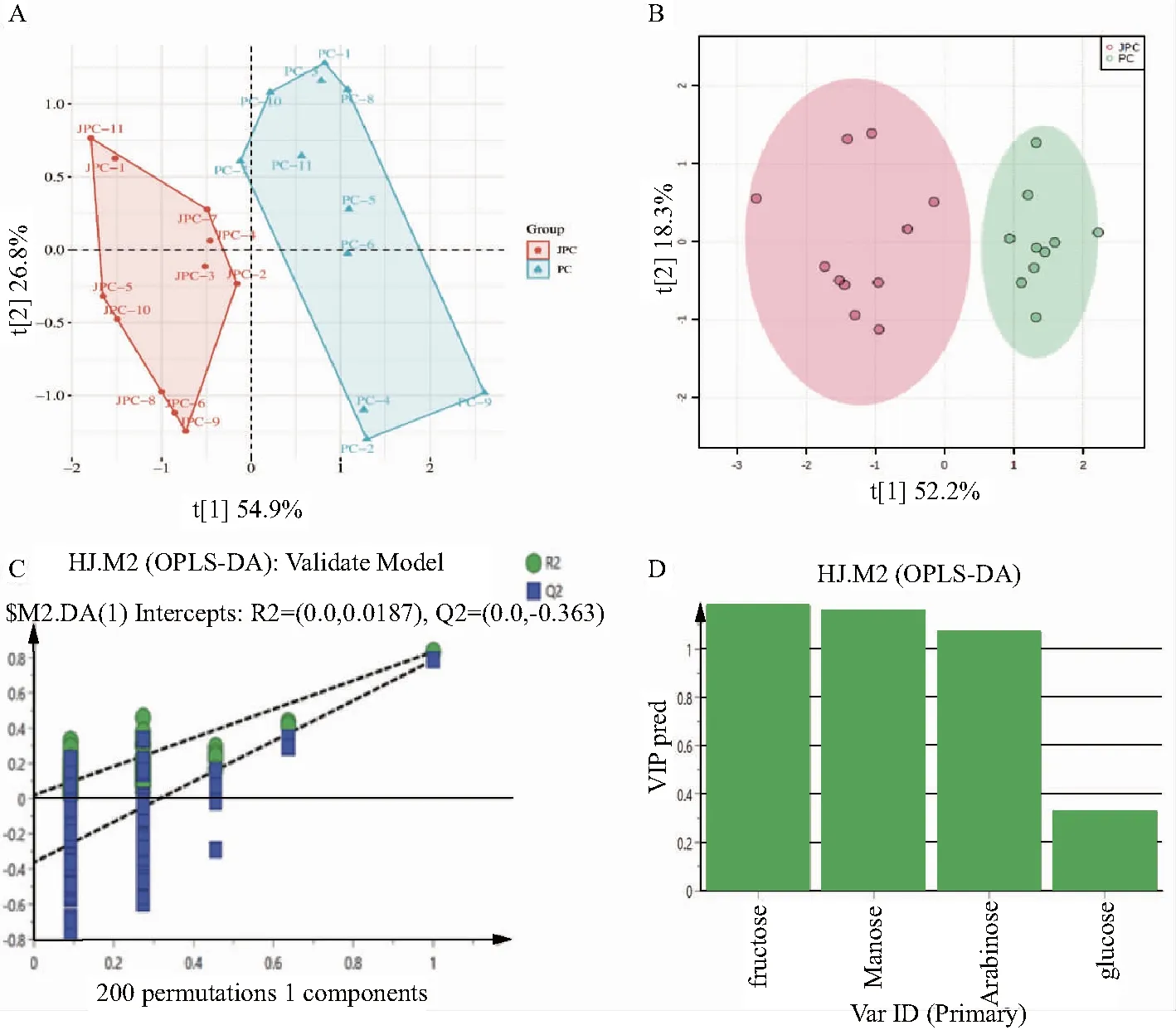
注:A.PCA得分图;B.OPLS-DA得分图;C.置换检验图;D.VIP值图
2.6.6 正交偏最小二乘法判别分析 为进一步考察黄精和酒黄精的差异,在PCA无监督分析的基础上,开展有监督的正交偏最小二乘辨别分析法(Orthogonal Partial Least Squares-Discriminant Analysis,OPLS-DA)分析,并对其进行置换检验,以验证该模型的拟合程度,结果见图4。OPLS-DA得分图显示,其R2X为0.914,R2为0.833,Q2为0.786,提示模型具有较高的可信度以及模型预测能力强。进一步对OPLS-DA模型参数R2和Q2进行了200次的置换验证,结果显示R2Y的截距未超过0.3,Q2Y的截距未超过0.05,表明OPLS-DA模型可靠,可用于下一步的分析。以变量重要性投影(VariableImportance inProjection,VIP)>1为标准筛选差异化合物,结果显示黄精与酒黄精的差异化合物为阿拉伯糖、甘露糖和果糖,经酒制后三者含量均降低。
2.7 黄精酒制前后多糖的抗氧化活性变化
参考文献的方法,用无水乙醇配制0.1 mmol·L-1DPPH溶液,避光保存[10,11]。分别将不同浓度提取物及2 mL DPPH溶液加入同一试管中,摇匀,室温下静置30 min后测定其吸光度A2,同时测定DPPH溶液与2 mL溶剂混合后的吸光度A0,以及提取物与2 mL溶剂混合后的吸光度A1。按照{抑制率=[1-(A2-A0)/A1]×100﹪}计算清除率,清除率越大抗氧化能力越强。
分别取不同浓度的黄精和酒黄精粗多糖,测定DPPH自由基清除率,计算半抑制浓度IC50,结果见图5。
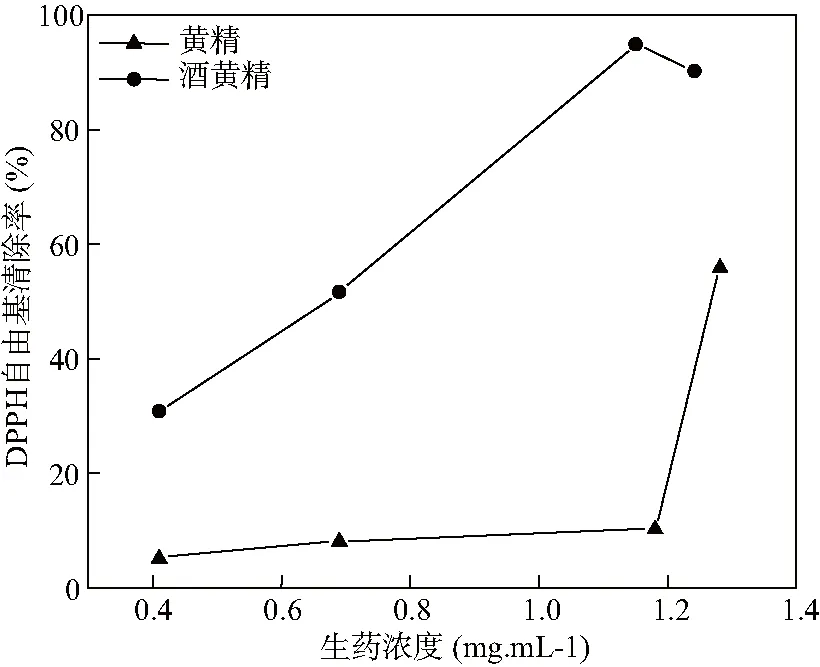
图5 不同浓度多花黄精和酒黄精多糖的DPPH自由基清除率(n=3)
3 讨论
单糖组成分析是研究中药多糖组成、结构、作用及构效关系的基础[12]。目前常用的检测方法是多糖酸水解成单糖,再分析其单糖组成。有研究表明单糖水解反应的速率与其种类相关,且过高的水解温度会产生副产物影响测定结果[13]。因此,优化酸水解条件对于分析多糖的单糖组成是非常重要的。此外,不同的检测器对多糖单糖组成的影响也较大,目前常用的有HPLC-ELSD法、HPLC-RID法和PMP-HPLC-DAD法[14]。PMP-HPLC-DAD法常用于检测酸性、中性和碱性单糖,但需对单糖进行衍生化处理[15]。HPLC-RID法和HPLC-ELSD法可直接用于测定单糖,无须衍生化,但重复性较差[16]。本研究对3种方法进行比较,结果显示,HPLC-ELSD法可测到阿拉伯糖、果糖、甘露糖和葡萄糖;PMP-HPLC-DAD法仅检测到葡萄糖和阿拉伯糖,推测其未测到果糖原因是PMP仅能与醛糖发生衍生反应,未检测到为酮糖的果糖[17];甘露糖的保留时间过短,可能与PMP的色谱峰重叠。HPLC-RID检测法的灵敏度较差,故仅测到含量较高的果糖。因此,HPLC-ELSD法最适合用于检测黄精和酒黄精多糖的单糖组成。此外,本文未检测到文献报道的鼠李糖、半乳糖醛酸、乳糖和岩藻糖[18,19],推测其原因可能与品种有关。
炮制后中药的多糖含量会显著降低,而单糖含量上升[20]。本文对比了黄精和酒黄精的单糖组成和含量,结果显示,酒制前后均是以果糖为主的杂多糖,但酒制后果糖、阿拉伯糖和甘露糖含量下降,且部分酒黄精多糖未检测到阿拉伯糖和甘露糖,葡萄糖含量有所上升。推测在高温高湿的炮制环境中,多糖发生水解,且部分单糖可能发生麦拉德反应,使饮片发生褐变[21],如阿拉伯糖和果糖。此外,DPPH自由基清除结果显示,黄精炮制后IC50值降低,抗氧化活性增强,提示上述黄精酒制前后抗氧化活性的增强可能与单糖组成的变化有关。
