中国大鲵出血症发病原因及致病菌基因组分析
2023-03-03赵彦华张世勇刘洪岩孙梦玲
赵彦华,张世勇,刘洪岩,孙梦玲,薛 晖
(江苏省淡水水产研究所,江苏 南京 210017)
中国大鲵(Andriasdavidianus)在分类学上属于两栖纲(Amphibia)、有尾目(Caudata)、隐鳃鲵科(Cryptobrachidae)、大鲵属(Andrias),因其叫声似婴儿啼哭,民间俗称“娃娃鱼”,是我国现存最大的两栖动物[1]。自1978年我国首次人工繁育中国大鲵以来[2],全国各地陆续开展了中国大鲵的人工繁育和养殖技术的研究,促进了中国大鲵养殖业的快速发展[3]。但随着养殖规模的扩大、种质的退化和养殖环境的恶化,越来越多的疾病给大鲵养殖业造成了严重的经济损失。近几年,在江苏省中国大鲵养殖厂出现一种以表皮出血为主并伴有部分皮肤溃烂的疾病,引起该病的病原尚未确认,临床治疗上存在很大的障碍,因此本试验通过对发病的中国大鲵开展致病原因探究和致病菌的全基因组分析,从而为临床病害防控提供科学的理论依据。
1 材料与方法
1.1 主要试剂 75%消毒酒精,购自青岛海氏海诺英诺消毒科技有限公司;脑心浸出液肉汤(Brain heart infusion,BHI)平板、营养琼脂(Nutrient agar,NA)平板、血琼脂(Blood agar,BA)平板和革兰染色液,均购自广东环凯生物科技有限公司;细菌药敏试剂片,购自杭州滨和微生物试剂有限公司;微量生化发酵管,购自北京陆桥生物技术有限公司;Taq酶、PCR Buffer、DL3 000 DNA Marker和Ezup柱式细菌基因组DNA 抽提试剂盒,均购自生工生物工程(上海)股份有限公司。
1.2 主要仪器 基因扩增仪StepOnePlusTMReal-Time PCR System(5020):德国赛默飞;显微镜(CX23):日本奥林巴斯;分子凝胶成像分析系统(ChemiDoc XRS):美国伯乐;生化培养箱(DHP-9162)、恒温振荡器(THZ-98A):上海一恒科学仪器有限公司。
1.3 材料采集 患病中国大鲵,来自江苏省汤山某大鲵养殖场,平均体长约55 cm,平均体重约1 800 g。健康中国大鲵,来自江苏省镇江市某大鲵养殖场,共30尾,平均体长约8 cm,平均体重约48 g。
1.4 发病原因初步鉴定
1.4.1 患病大鲵临床症状和剖检观察 选取症状明显患病大鲵,观察临床特征,体表是否存在赘生物,随后进行体表消毒,严格按照无菌操作流程打开腹腔,观察腹腔内脏器情况。
1.4.2 病毒感染鉴定 取患病大鲵溃烂处皮肤肌肉、肝脏和肠道组织,加入无菌生理盐水进行研磨,研磨液利用无菌针式过滤器(0.22 μm)进行过滤,将过滤后滤液无菌注射于健康大鲵背部肌肉,共注射4尾,每尾2 mL,暂养于水族箱中观察14 d。
1.4.3 病原菌分离和镜检 无菌接种环轻压发病大鲵肝脏横截面和肠道内壁,划线接种于NA平板,置于28 ℃恒温培养箱,培养48 h后挑取典型菌落进行纯培养,纯培养后细菌接种于BA平板,观察细菌溶血性;选用革兰染色法对纯培养后细菌进行染色,镜检观察细菌形态和染色特征。
1.5 人工感染试验 将健康大鲵于水族箱中适应饲养7 d,水族箱规格为1 100 cm×500 cm×700 cm,水温控制为22 ℃,试验共设置2个试验组和1个对照组,每组4尾。将健康大鲵体表皮肤无菌划伤,在试验组水族箱中加入15 mL含病原菌肉汤培养基,对照组大鲵则放入15 mL无菌肉汤培养基,连续观察14 d,记录各组大鲵感染数。取发病大鲵肝脏和肠道组织进行病原菌的分离和鉴定。
1.6 病原菌生化鉴定 将病原菌接种于微量生化发酵管,以微量发酵管的形式进行生化指标检测。
1.7 16S rDNA序列的扩增和分析
1.7.1 DNA提取和PCR扩增 按照Ezup柱式细菌基因组DNA 抽提试剂盒说明书提取病原菌DNA,并测定其浓度和纯度。以提取的DNA为模板,选用细菌16S rDNA通用引物进行聚合酶链式反应(Polymerase chain reaction,PCR)扩增,PCR反应体系(25.0 μL):10×PCR缓冲液(含Mg2+)2.5 μL、10 mmo/L 4×dNTP 1 μL、10 μmol/L正向和反向引物各0.5 μL、TaqDNA聚合酶(5 U)0.2 μL、DNA模板0.5 μL,加入ddH2O至25.0 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性25 s,55 ℃退火45 s,72 ℃延伸1 min,循环30次;72 ℃延伸10 min。委托生工生物工程(上海)股份有限公司对扩增产物进行纯化和测序。
1.7.2 序列分析和系统发育树构建 测序后,在GenBank数据库中输入测得的病原菌16S rDNA 序列并进行BLAST比对。将病原菌16S rDNA序列通过美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的BLAST检索系统进行序列同源性分析,检索出高同源性的序列使用MEGA 4.0软件,采用邻接法(Neighbor-joining method)构建系统发育树,并进行置信度检测。
1.8 药敏试验 选取9种常用抗菌药,按照纸片扩散法进行试验,将浓度为1×107CFU/mL的病原菌悬液均匀涂布于BHI平板培养基上,加入药敏试纸片,每种药敏试纸片设立2个试验组和2个对照组,28 ℃培养24 h后测量抑菌圈直径,计算2个试验组抑菌圈直径平均值作为结果进行判定,直径≥16 mm判定为敏感(Sensitivity,S),直径介于11~15 mm判定为中介(Intermediary,I),直径≤10 mm判定为耐药(Resistance,R)。
1.9 全基因组分析 利用Illumia测序方法,对病原菌基因组进行测序,获得原始图像数据,经Base Calling转化为序列数据进行基因组组装和测序,进行基因功能注释和预测。利用Trimmomatic软件对原始测序数据进行质量剪切,得到测序数据,最后经过Nanopore三代测序,利用RNAmmer-1.2和tRNAscan-SE 2.0.4软件对基因组中包含的核糖体RNA(Ribosomal RNA,rRNA)和转运RNA(Transfer RNA,tRNA)进行预测,采用R circlize包进行基因组圈图绘制,全面展示基因组的特征。
2 结果
2.1 患病大鲵临床症状和剖检观察 患病大鲵主要临床症状为体表有大量弥散性出血点,头部皮肤较为严重并伴有溃烂,行动迟缓,拒绝进食,剖检后发现其腹腔内肝脏有大量出血点,肠壁充血,脾脏发白。
2.2 病毒感染鉴定 无菌组织匀浆注射于健康大鲵后连续观察14 d,大鲵活动和进食正常,无肉眼可见病害症状出现,排除病毒感染可能性。
2.3 病原菌分离和镜检 从患病大鲵肝脏中分离出1株优势菌株,命名为WG-1。分离菌在营养琼脂平板上呈现出表面光滑、边缘整齐、圆形微凸的乳白色菌落,不溶血(图1)。革兰染色后在显微镜下可见红色呈短链分布的球杆状细菌,无鞭毛和荚膜,为革兰阴性菌。

图1 病原菌在营养琼脂平板(A)和血平板培养基(B)上生长状态
2.4 人工感染试验 人工感染病原菌后,试验组大鲵于试验第8天首次出现感染症状,至第14天试验结束时,2个试验组感染率分别为100%和75%,临床症状与中国大鲵出血症症状相似,体表有出血点,头部溃烂,行动迟缓,对照组大鲵无症状。在2个试验组发病大鲵肝脏和肠道组织中均分离出与病原菌WG-1形态一致的细菌,符合科赫氏法则要求。
2.5 病原菌生化鉴定 生化试验结果显示,病原菌氧化酶试验阴性、V-P试验阴性、吲哚阳性、鸟氨酸脱羧,可分解葡萄糖,不可分解甘露醇、七叶苷、阿拉伯糖和蔗糖。
2.6 PCR扩增、序列分析和系统发育树构建 病原菌16S rDNA扩增后得到1 474 bp的片段(图2)。同源序列的BLAST结果显示,病原菌与AR0057(GenBank登录号:CP027177.1)摩根氏菌属(Morganella)细菌的同源性达99.93%,与分离病原菌相似度最高的8个菌株均同属于摩根氏菌属,表明分离病原菌属于摩根氏菌属。系统发育分析结果显示,病原菌在系统发育树上与分离自海产品的摩氏摩根菌(MorganellamorganiiNR_115750.1)聚为一支(图3)。
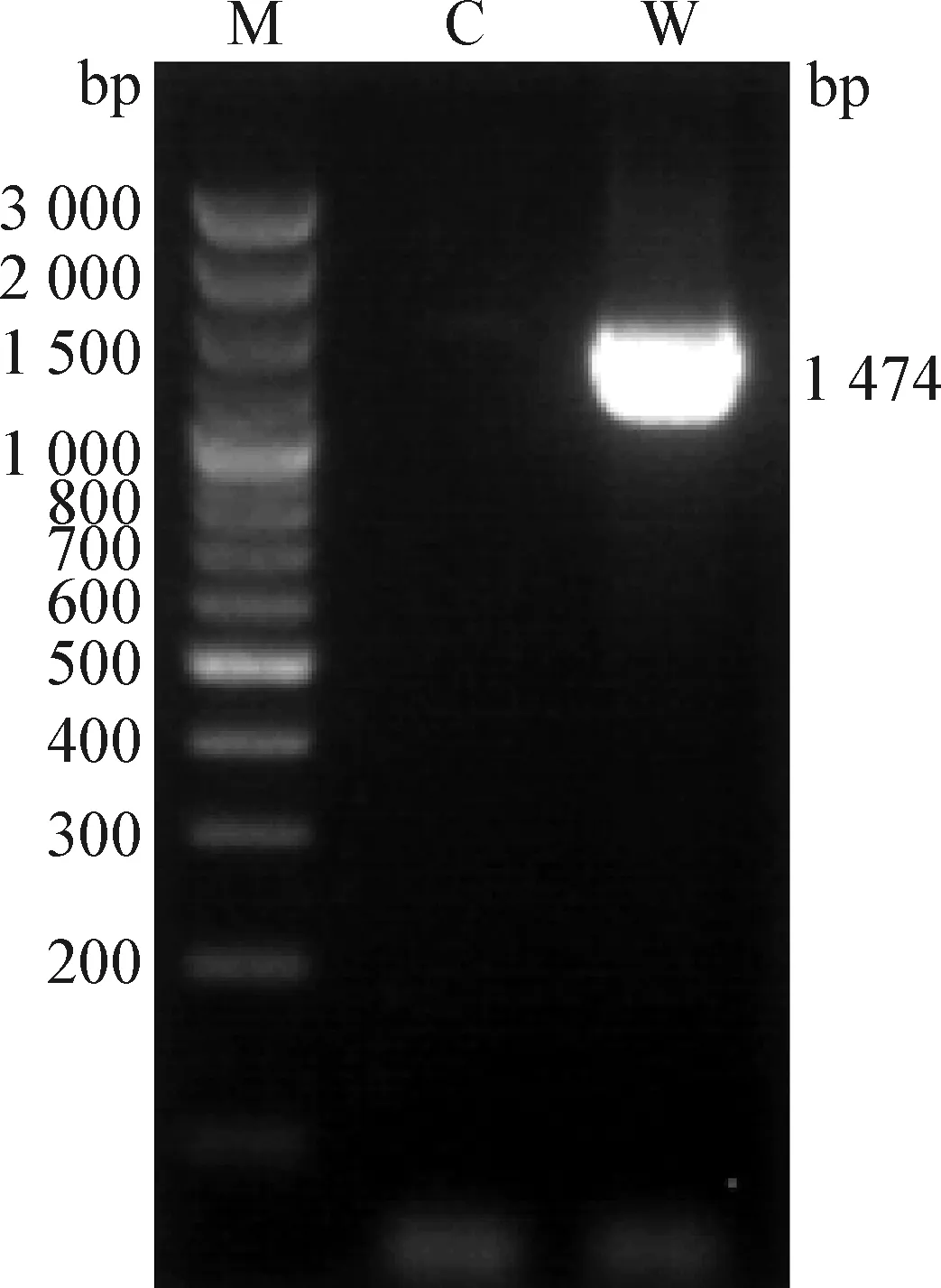
图2 WG-1 16S rDNA基因的PCR扩增

图3 基于16S rDNA基因序列构建的系统发育树
2.7 药敏试验 选择氨曲南等9种抗菌药进行药敏试验,结果显示,病原菌对卡那霉素最敏感,链霉素次之,对羧苄西林、多黏菌素和呋喃妥因有耐药性(表1)。

表1 耐药性分析结果
2.8 全基因组分析
2.8.1 基因组组装与预测 分离病原菌测序结果见表2,基因组有效数据量为2 350.4 Mb,Reads个数为2 790 545个,平均测序读长为1 547 bp,N50长度为2 872 bp。运用ABySS软件对数据进行组装,并运用GapCloser软件对组装结果进行校正,组装结果统计见表3,组装后基因组总长度为3 824 333 bp,G+C含量为51.05%。利用Glimmer 3.02软件对该基因组进行基因预测,预测结果见表4,共得到3 732个编码蛋白的基因,基因总长度为3 342 762 bp,基因平均长度为895 kb,基因的G+C含量为52.4%。

表2 测序数据统计
表3 组装结果统计

表4 基因预测结果统计
2.8.2 非编码RNA统计 结果如表5所示,分离病原菌基因组含有82个tRNA,总长度为6 439 bp,占基因总长度的0.16%;含有22个rRNA,总长度为31 986 bp,占基因总长度的0.83%,其中包括:8个5S rRNA,总长度为920 bp,占基因总长度的0.02%;7个16S rRNA,总长度为10 717 bp,占基因总长度的0.28%;7个23S rRNA,总长度为20 349 bp,占基因总长度的0.53%。
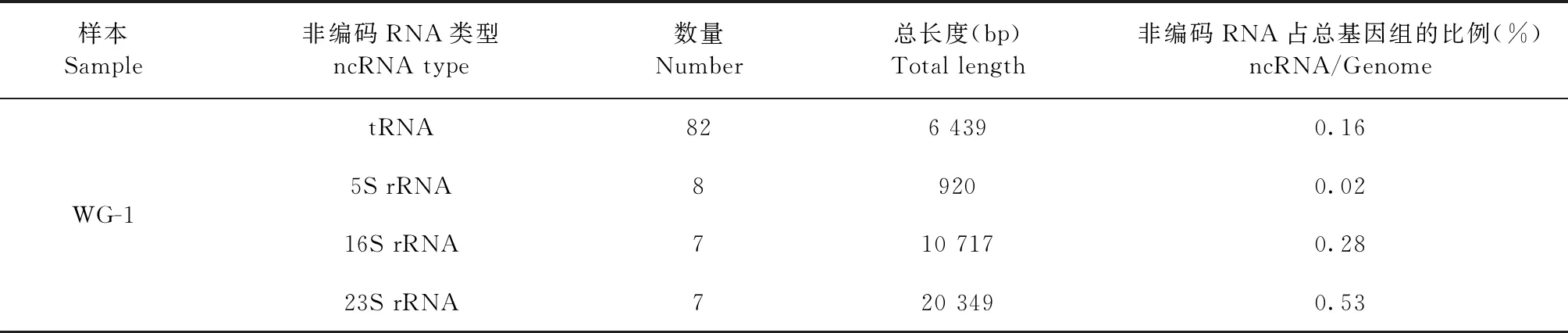
表5 非编码RNA统计
2.8.3 基因功能注释 将预测基因的蛋白序列分别与NR、GO、eggNOG、KEGG、Swiss-Prot、CAZy、CARD数据库进行比对,基因功能分析结果显示,分别有3 664、1 780、2 961、2 328、2 716、66和96个基因在对应的NR、GO、eggNOG、KEGG、Swiss-Prot、CAZy和CARD数据库获得注释。

表6 基因功能注释统计
2.8.4 基因组圈图 结果如图4所示,圈图的最外圈、第2圈、第3圈分别为基因组大小的标识、正链上编码蛋白序列、负链上编码蛋白序列,颜色的不同表示编码序列不同的同源性功能分类;第4圈为rRNA和tRNA;第5圈为G+C含量,该区域G+C含量如高于全基因组平均G+C含量,则用向外的红色显示,峰值的高低与平均G+C含量差值呈正相关;如该区域G+C含量低于全基因组平均G+C含量,则用向内的蓝色表示,峰值的高低与平均G+C含量差值呈正相关;最内圈为G+C skew值,计算公式为G-C/G+C,在生物学意义上,如该值为正值时,正链更倾向于转录编码序列;为负值时,负链更倾向于转录编码序列。
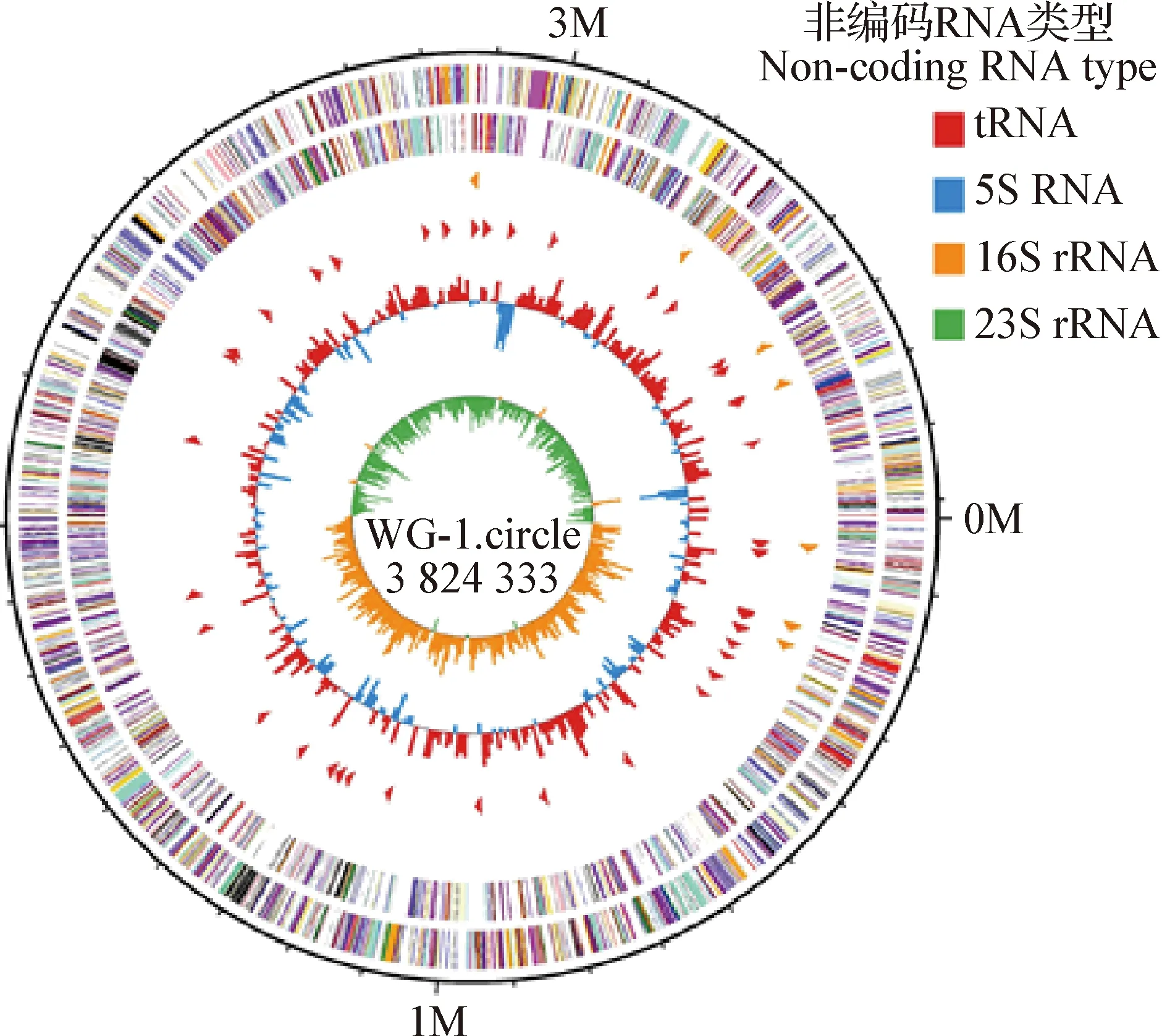
图4 基因组圈图
3 讨论
目前,据研究报道已发现中国大鲵病害有10多种[4],其中临床上较常见的病害为细菌病,感染中国大鲵的细菌多种多样,包括迟钝爱德华菌(Edwardsiellatarda)[5]、恶臭假单胞菌(Pseudomonasputida)[6]、嗜水气单胞菌(Aeromonashydrophila)[7,8]、温和气单胞菌(A.sobria)[9]和杀鲑气单胞菌杀鲑亚种(A.salmonicidasubsp.salmoni-cida)[10]等。1999年,王高学等首次发现了荧光假单胞菌(Pseudomonasfluorescens)感染可导致大鲵患赤皮病,该菌株对链霉素、氯霉素、氟哌酸和庆大霉素高度敏感,临床选用硫酸庆大霉素肌内注射,治疗效果较好[11];2010年,王旭等发现元凶维氏气单胞菌(Aeromonasveronii)感染可导致大鲵腐皮病,药敏试验显示该菌对头孢类抗菌药较敏感[12];2011年,杜宗君等通过对四川人工养殖死亡的大鲵研究发现,荧光假单胞菌(Pseudomonasfluorescens)感染可导致大鲵花斑肝,致病菌对新生霉素、氯霉素和强力霉素较为敏感,推荐采用敏感药物内服或肌内注射进行治疗[13];2012年,高正勇等研究发现,弗氏柠檬酸杆菌(Citrobacterfreundii)可感染大鲵造成死亡,药物敏感性试验显示,该菌株对氨曲南、头孢三嗪、先锋噻肟等9种药物高度敏感,建议根据药敏试验选择最有效的药物进行治疗[14]。
摩氏摩根菌(Morganellamorganii)是肠杆菌科(Enterobacteriaceae)摩根氏菌属(Morganella)的唯一菌种,目前分为2个亚种:摩根亚种和波斯尼亚种[15]。摩氏摩根菌为条件致病菌,能够造成动物肺脏淤血、脓肿,肾脏出血等病变,也可以造成动物体表皮肤或肌肉的溃烂[16]。
本次试验根据分离病原菌药物敏感性试验结果,临床上建议首选卡那霉素进行治疗;同时有文献报道,我国1990年已从进口冷冻海鱼中分离出摩根氏菌[17],结合本试验所得病原菌在系统进化树上与海鲜中分离到的摩氏摩根菌聚为一支这一特点,建议在大鲵日常养殖中关注投喂的海鲜产品的质量,以防造成细菌性疾病大暴发。
