基于离子色谱法测定乳及乳制品中亚硝酸盐含量
2023-03-03张丽芳张淼怡刘宇奇郑百芹周璇谷守国
张丽芳,张淼怡,刘宇奇,郑百芹,周璇,谷守国
1. 唐山市食品药品综合检验检测中心(唐山 063000);2. 河北省农产品质量安全检测工程技术创新中心(唐山 063000);3. 唐山市功能性农产品产业技术研究院(唐山 063000)
乳及乳制品中含有丰富的蛋白质、脂肪、乳糖、维生素和矿物质等营养元素,在日常饮食中占据越来越重要的地位,其质量安全问题也越来越受到关注。亚硝酸盐广泛存在于土壤、地表水、植物和生物系统中。亚硝酸盐与食品中固有的胺类化合物是产生亚硝胺的前体物质,亚硝胺在动物试验中被证实为致癌物。大量摄入亚硝酸盐可诱导高铁血红蛋白血症,导致组织缺氧[1-2]。新生婴儿对亚硝酸盐非常敏感,且乳制品摄入量大。奶牛的养殖环境、饲养用水及饲料中亚硝酸盐含量过高,有可能导致牛乳中的亚硝酸盐含量超标[3]。因此对乳品中亚硝酸盐进行安全监控十分必要[4]。
鉴于亚硝酸盐对人体的危害性,各国制定食品中亚硝酸盐的添加量和残留量相关限量。世界卫生组织食品添加物联合专家委员会规定:亚硝酸盐每日摄取安全容许量为0~0.06 mg/kg[5]。GB 2762—2017《食品安全国家标准 食品中污染物限量》[6]规定:乳及乳制品中生乳的亚硝酸盐(以亚硝酸钠计)不得大于0.4 mg/kg;乳粉及特殊膳食用食品(婴幼儿配方食品、婴幼儿谷类辅助食品、孕妇及乳母营养补充食品等)亚硝酸盐(以亚硝酸钠计)不得大于2 mg/kg。
乳制品中亚硝酸盐的常见检测方法有分光光度法、液相色谱法、气相色谱法、流动注射法、离子色谱法和液相色谱-质谱联用法[7-10]。这些方法存在各自的优缺点,如:分光光度法操作复杂,引入镉污染物,易对环境造成污染;气相色谱法灵敏度不高,不能满足乳制品的限量要求;离子色谱法作为无机阴离子分析技术,具有快速、灵敏、选择性好等优点,但GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》[11]中离子色谱法前处理过程需要过柱,操作复杂,成本高。试验采用离子色谱法测定乳及乳制品中亚硝酸盐含量,通过优化前处理条件和筛选色谱分析参数,旨在建立一种准确、快速、低成本的检测方法,为乳及乳制品中亚硝酸盐的测定研究提供技术支持。
1 材料与方法
1.1 材料与试剂
亚硝酸根标准物质(1 000 μg/mL,北京北方伟业计量技术研究院);乙腈(色谱纯,DiKMA)。
1.2 仪器与设备
883 Basic IC plus离子色谱仪(瑞士万通);PL2002分析天平(瑞士梅特勒-托利多公司);LYNX4000高速低温冷冻离心机(Thermo Scientific);Gd-16高速均质机(新锐科技)。
1.3 方法
1.3.1 样品前处理
1.3.1.1 液态奶和乳饮料
称取20 g样品,精确至0.01 g,至50 mL准确量值的离心管中,加入乙腈定容至50 mL,充分涡旋振荡,静置10 min。样品按10 000 r/min离心10 min。取液体过0.45 μm水相滤膜后上机。
1.3.1.2 奶粉
称取5 g样品,精确至0.01 g,至50 mL准确量值的离心管中,用20 mL水复溶,加入乙腈定容至50 mL,充分涡旋振荡,静置10 min。随后,样品按10 000 r/min离心10 min。取液体过0.45 μm水相滤膜后上机。
1.3.1.3 干酪
称取2.5 g样品,精确至0.01 g,至50 mL准确量值的离心管中,加入20 mL水,加入数粒陶瓷珠,高速匀浆2 min,超声30 min,取出放置至室温,加乙腈定容至50 mL,充分涡旋振荡,静置10 min。随后,样品按10 000 r/min离心10 min。取液体过0.45 μm水相滤膜后上机。
1.3.2 色谱条件
色谱柱Metrosep A Suup7-250/4.0;柱温35 ℃;进样量50 μL;淋洗液流速0.7 mL/min;淋洗液3.6 mmol/L Na2CO3。
1.3.3 标准溶液配制
1.3.3.1 标准储备液
精确量取0.1 mL 1 000 μg/mL的亚硝酸盐标准溶液至10 mL容量瓶中,用水定容至刻度,制备成10 μg/mL标准储备液。
1.3.3.2 标准中间液
精确量取1.0 mL 10 μg/mL标准储备液至10 mL容量瓶中,用水定容至刻度,制备成1 μg/mL的标准中间液。
1.3.3.3 标准曲线
精密吸取0.1,0.2,0.4,0.8,1.0和2.0 mL标准中间液分别至10 mL容量瓶中,用水定容至刻度,制备成0.01,0.02,0.04,0.08,0.10和0.20 μg/mL的标准曲线。
1.3.3.4 基质匹配标准曲线
精密吸取0.1,0.2,0.4,0.8,1.0和2.0 mL标准中间液分别至10 mL容量瓶中,用基质空白提取液定容至刻度,制备成0.01,0.02,0.04,0.08,0.10和0.20 μg/mL的基质标准曲线。
1.3.4 计算公式
试样中亚硝酸盐(以NO2-计)含量按式(1)计算。
式中:X为试样中亚硝酸盐含量,mg/kg;C为试样中实测亚硝酸盐质量浓度,mg/L;V为试样溶液体积,mL;f为稀释倍数;m为试验质量,g。
2 结果与讨论
2.1 前处理方法的选择
2.1.1 样品沉淀剂的选择
乳及乳制品中测定亚硝酸盐去除蛋白和脂肪的沉淀剂种类较多,如乙酸锌+亚铁氰化钾、钨酸钠+硫酸、冰乙酸、冰乙酸+乙腈、三氯乙酸+乙腈、乙醇等。乙酸锌+亚铁氰化钾对于乳制品有很好的蛋白沉淀效果,是液相色谱法和分光光度法常用的沉淀剂,但在离子色谱中这些沉淀试剂会引入大量金属离子,污染色谱柱,降低离子色谱柱效[12-13]。乙酸沉淀法基线相对较平直,同时亚硝酸根不受乙酸根的影响,但在低体积分数时,亚硝酸盐可能受pH影响加速转化,使回收率偏低。
乙醇、乙腈是较为理想的蛋白沉淀剂,试验发现乙醇的沉淀效果比乙腈的沉淀效果差,选择乙腈作为蛋白沉淀剂。有机相与水相的比例会影响蛋白沉淀效果和回收率,比较乙腈与水相的体积比分别为7∶3,6∶4,5∶5,4∶6和3∶7时的沉淀效果和对亚硝酸根回收率的影响,结果见表1。在20 g液态奶或乳制品制备成20 mL液态试样时,加入约30 mL乙腈(V乙腈∶V水=6∶4),蛋白沉淀效果最理想,未出现分层现象,回收率高,确定为蛋白沉淀的最佳条件。试验以乙腈为沉淀剂,沉淀效果与回收率(回收率98.4%)均优于颜琪等[14]以1∶1的乙腈-3%乙酸为蛋白沉淀剂(回收率97.3%)。

表1 蛋白沉淀剂的选择
干酪试样在水中的溶解度低,样品经高速均质后超声提取,亚硝酸盐回收率优于试样加入水后直接超声提取。对超声提取时间进行优化,亚硝酸盐回收率随着超声时间的延长而提高,到30 min后,回收率趋于稳定,因此确定超声时间为30 min。
2.1.2 分离参数的优化
试样经蛋白沉淀后,离心进行分离,以亚硝酸盐的回收率为评价指标,筛选出离心转速与时间,设计因素与水平见表2,所得结果见表3。随着离心转速的提高和时间的延长,蛋白分离效果变好,亚硝酸盐的回收率提高后趋于平稳。结合操作时间综合考虑,选择10 000 r/min、离心时间10 min作为分离参数。

表2 离心转速和时间对亚硝酸盐回收率的影响试验设计

表3 离心转速和时间对亚硝酸盐回收率的影响试验结果
2.1.3 净化参数优化
由于乳制品中的氯离子含量较高,奶粉中氯离子含量一般在800~1 000 mg/L[15]。按照GB 5009.33—2016,氯离子浓度大于100 mg/L时,待测液需要依次通过针头滤器、C18柱、Ag柱和Na柱,去除或降低待测液中氯离子浓度,以降低对亚硝酸盐的影响,但试验结果显示,亚硝酸根离子的回收率并未受到氯离子的影响,所得结果与冯伟科等[16]研究结果一致。试验方法在离心去除蛋白后,上清液直接过滤膜上机,不再用Ag柱、Na柱处理,大幅降低检测成本。
2.2 色谱条件的优化
试验考察Metrosep A Suup4-250/4.0和Metrosep A Suup7-250/4.0色谱柱对亚硝酸盐的分离效果。Suup4色谱柱采用的淋洗液为1.8 mmol/L Na2CO3和1.7 mmol/L NaHCO3,流速1.0 mL/min,亚硝酸根的出峰时间为5.20 min,但奶的基质有干扰峰,通过调节淋洗液和流速并未有所改善。Suup7色谱柱采用3.6 mmol/L Na2CO3为淋洗液,流速0.7 mL/min,亚硝酸根与杂质峰能得到很好分离,出峰时间14.4 min。提高淋洗液的离子浓度或流速,离子的保留时间会缩短,但不利于干扰离子与亚硝酸根的分离,流速的增加也显著增大系统的压力。综合考虑,确定采用Metrosep A Suup7-250/4.0色谱柱,3.6 mmol/L Na2CO3为淋洗液,流速0.7 mL/min,作为试验的色谱条件。标准溶液色谱图和奶粉基质色谱图见图1。

图1 标准溶液(A)和奶粉基(B)质色谱图
2.3 基质效应
基质效应(Matrix effects,ME)是指样品中除分析物以外的组分,在分析过程中对目标物有显著干扰。基质效应影响大时会降低方法的灵敏度,影响方法的准确性,给测定带来误差[17],因此,方法开发和确证过程中需要对基质效应做出评价。按照样品的前处理方法分别制备液态奶、奶粉、干酪的基质空白提取液。分别用基质空白提取液和水配制系列浓度的标准溶液,按照试验方法进行测定。一般认为,基质匹配校正曲线斜率与标准曲线斜率的比值在0.85~1.15之间不存在基质效应[18-19]。试验液态奶、奶粉、干酪的基质效应分别为0.95,0.74和0.68,结果表明液态奶的基质效应较弱,而奶粉和干酪具有较强的抑制作用。分析原因是奶粉和干酪中除了蛋白质、脂肪和碳水化合物外,有多种不同种类的物质,如维生素类、无机盐类、植物油类、添加剂等。因此,液态奶检测采用标准曲线进行校正,奶粉和干酪采用基质匹配的标准曲线进行校正。
2.4 方法学确定
2.4.1 标准曲线、检出限和定量限
选择0.01,0.02,0.04,0.08,0.10和0.20 μg/mL标准工作液,按1.3.2的仪器条件进行测定。以峰面积Y(μs·min)为纵坐标,质量浓度X(μg/mL)为横坐标,做标准曲线,以3倍信噪比确定检出限,以10倍信噪比为定量限。所得线性方程、线性相关系数、检出限和定量限见表4。

表4 标准曲线线性方程、相关系数、检出限和定量限
2.4.2 方法的回收率与精密度
为验证方法的可靠性,采用基质加标法对回收率和精密度进行考察,在液态奶、奶粉和干酪中添加标准溶液,制备成0.5,1.0和2.0 mg/kg这3个质量分数水平,每个添加水平6个平行。在低、中、高3个浓度条件下,回收率在85.4%~101.3%之间,精密度为1.5%~7.1%。试验方法具有良好的回收率和精密度,能够满足检测需求,结果见表5。
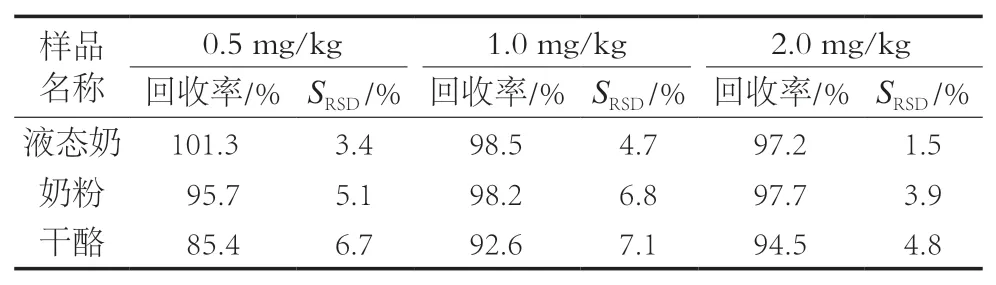
表5 方法的加标回收率及相对标准偏差(n=6)
3 结论
试验方法适用于液态乳、乳粉及干酪乳制品中亚硝酸含量的测定。通过对前处理方法优化、流动相的选择、色谱柱的比较、结果稳定等方面的讨论,确定乳及乳制品中亚硝酸盐分离提取及色谱分析的最佳参数:蛋白沉淀剂采用乙腈,与试样的体积比6∶4,按离心转速10 000 r/min、离心时间10 min分离蛋白,上清液经0.45 μm滤膜过滤,以3.6 mmol/L Na2CO3为淋洗液,流速为0.7 mL/min,进行色谱分析。方法的回收率为85.4%~101.3%,精密度为1.5%~7.1%,满足检测需求。奶粉和干酪样品以基质匹配的标准曲线进行校正,降低基质效应对检测结果的影响。该方法前处理方法简单、成本低、检出限低,优于国标方法,能够满足乳及乳制品中亚硝酸盐的检测要求,可为食品安全监督提供有效的技术支撑。
