断尾对兰州大尾羊生长性能、脂肪沉积分布和屠宰性能的影响
2023-02-27宋淑珍刘俊斌朱才业徐红伟刘立山孔艳龙
宋淑珍,刘俊斌,朱才业,徐红伟,刘立山,孔艳龙
(1.甘肃省农业科学院畜草与绿色农业研究所,兰州 730070; 2.甘肃农业大学动物科学技术学院,兰州 730070;3.西北民族大学生命科学与工程学院,兰州 730030;4.永靖县瑞霖科技养殖有限公司,永靖 731603)
绵羊是最早被驯化家养的畜种之一[1],为人们提供肉、乳、毛、皮等重要的食物和御寒物品,在人类历史进程中具有重要的经济价值。世界上700多个绵羊品种中,将近25%的绵羊属于脂尾型羊[2]。脂尾是绵羊在长期的选择和进化过程中形成的特征,在早期,绵羊尾部脂肪不仅是人们重要的脂类来源食物,也是绵羊抵御极端寒冷气候和营养匮乏等极端生存压力的能量保证,绵羊在夏秋季牧草丰盛时储存大量脂肪供冬春季牧草匮乏时动用以维持机体能量需要[3]。但随着养殖业现代化的推进和人们生活水平的提高,大量脂肪沉积在尾部不仅浪费饲料,降低饲料效率,而且还会降低胴体重量,影响胴体品质[4];此外,人们日常饮食中过量的脂肪摄入会引起一些健康问题,因而对于生产来说绵羊尾部脂肪已经失去了其原来的价值,如何减少尾部脂肪的沉积,提高胴体品质是现代畜牧业的主要目标之一。
兰州大尾羊属于长脂尾型绵羊,具有耐粗饲、生长发育快、肉质鲜嫩等优点,其脂尾肥大,方圆平展,自然下垂至飞节上下,被尾中沟平分为左右对称的两瓣,尾尖外翻,成年羯羊尾脂占胴体重的13.23%[5],大量的脂肪沉积在尾部造成饲料资源的极大浪费,沉积1 kg脂肪所耗饲草料相当于生产2 kg瘦肉所需的饲草料[3],过多的尾部脂肪沉积降低了养羊业的经济效益。此外,脂肪沉积与分布是影响胴体品质的主要因素[6],脂肪沉积在肌间有助于提高肉品质,而沉积在尾部、皮下、腹部等部位则成为“无用脂肪”[7-8],降低胴体质量。对1~3日龄的滩羊羔羊断尾,135日龄左右屠宰时,尾部脂肪显著降低,肌肉剪切力具有减小的趋势,每天增加收益0.36元·只-1[9]。断尾洼地绵羊公羔90日龄屠宰时,尾脂较未断尾组减少了61.22%[10]。目前,保护畜禽种质资源,挖掘特有畜种生产潜力成为畜牧业的研究重点,如何减少脂尾型绵羊尾部脂肪沉积,并改善胴体脂肪沉积分布,使更多的脂肪沉积在肌间具有重要的研究意义。对于脂尾型绵羊减少尾脂沉积的研究主要集中在杂交改良[11]、早期屠宰[10]等方面,对改变脂肪沉积分布以及脂肪因子等涉及内分泌方面的报道较少。本研究探讨断尾对兰州大尾羊生长性能、血清脂肪因子、屠宰性能和脂肪沉积分布等的影响,为通过脂肪沉积部位干预提高绵羊生产效率,改善胴体品质提供数据支持,并为脂尾型绵羊的生产利用提供参考。
1 材料与方法
1.1 试验时间与地点
试验于2021年3月24日—11月28日在永靖县瑞霖养殖有限公司进行,年平均气温9.0 ℃,年平均日照时数2 517.6 h,海拔约2 150.0 m。
1.2 试验动物与试验设计
选择血缘清楚、体重接近的5日龄健康兰州大尾羊羔羊18只,随机分为对照组和试验组,每组9只羔羊,试验组羔羊采用橡皮圈结扎法断尾。试验期两组羊日粮相同,均饲喂全价配合饲料(精粗比为70∶30),自由饮水。每日上、下午各饲喂1次,每隔30 d对各组试验羊只空腹静脉采血、称重。试验期240 d,结束时,每组选择4只羊屠宰取样用于后续试验。
1.3 试验动物饲养管理
试验羔羊随母羊哺乳至2月龄断奶,哺乳期自由哺乳,并通过羔羊补饲槽补饲羔羊补饲料(临洮德华饲料有限公司提供),主要成分为玉米、豆粕、棉籽粕、植物油、奶粉、乳清粉、糖蜜、氨基酸、矿物质元素和微量元素等,营养成分为粗蛋白质≥18.0%,粗纤维≤7.0%,粗灰分≤8.0%,钙0.60%~1.20%,总磷≥0.50%,氯化钠0.30%~1.50%,赖氨酸≥0.80%,并添加6%的苜蓿和6%的燕麦草。羔羊断奶后,转入试验羊舍;转入前1周,对羊舍、羊栏、食槽等进行打扫、消毒。单栏饲养,羊舍温度、光照、通风等饲养环境条件一致。每天上午7:00、下午16:00分2次饲喂,自由饮水。试验日粮根据美国 NRC(2007)肉用绵羊营养需要配制,试验期日粮的组成、营养水平见表1。
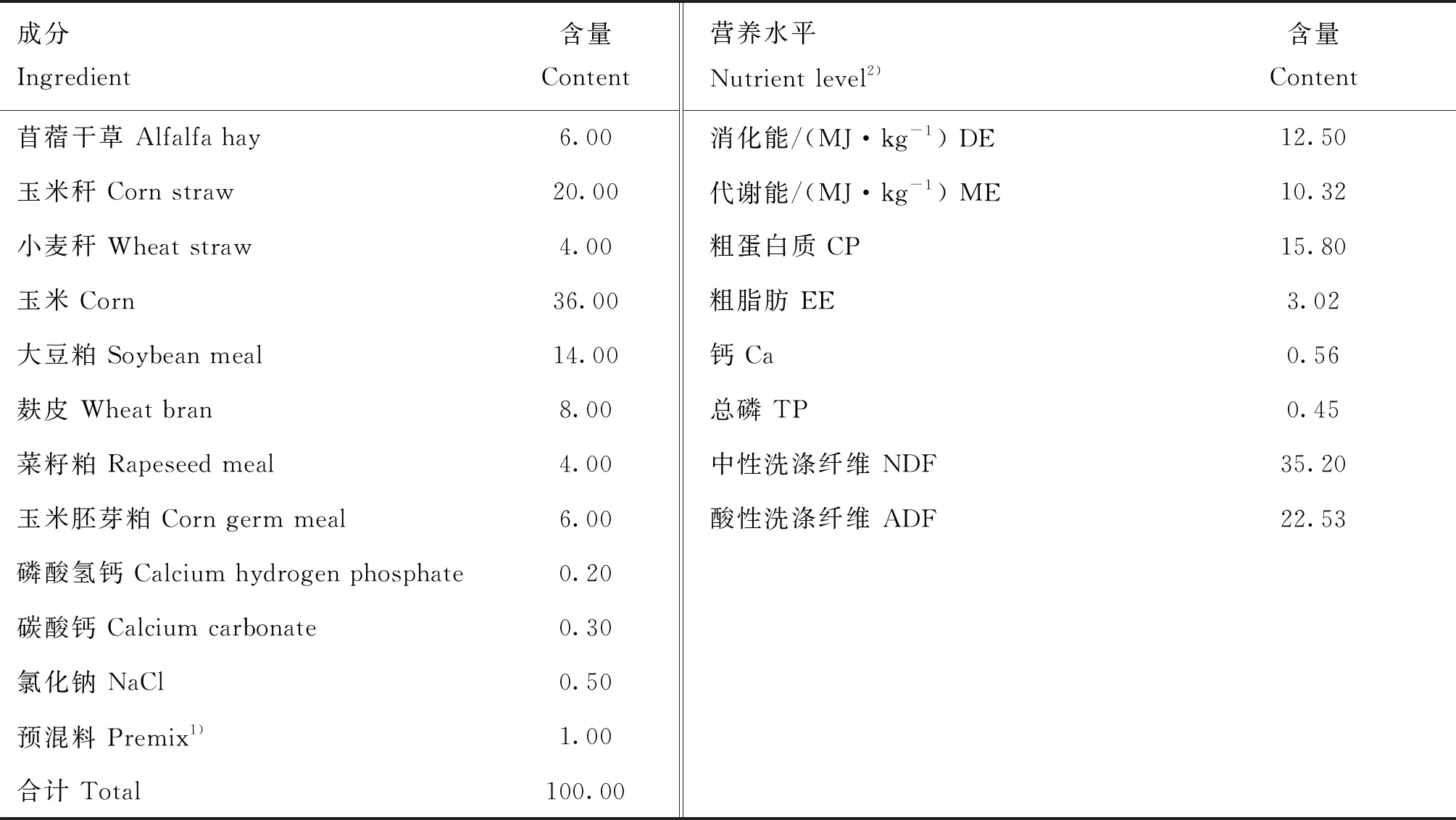
表1 试验日粮组成及营养水平(干物质基础)
1.4 测定指标与方法
1.4.1 生长性能 试验开始前(第0天)、试验期每隔30 d对试验羊进行早晨空腹称重,其中试验开始前和结束时连续2 d空腹称重(取平均值),记录体重数据,并计算每个阶段平均日增重(average daily gain,ADG)=(末重-初重)/间隔天数。
试验期每30 d连续3 d记录投料量、剩料量,并计算平均日采食量(average daily feeding intake,ADFI)、料重比(F/G)。
1.4.2 血清脂肪因子 试验期第0、30、90、120、150、180、210、240、270天早晨7:00在试验羊左静脉进行空腹采血。采血采用未加抗凝剂的5 mL离心管,常温静置30 min后,2 150×g离心10 min,吸取上清液分装于2个1.5 mL EP管中,置于-80 ℃保存。
血清肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin- 6,IL-6)、瘦素(leptin,LEP)、脂联素(adiponectin,ADPN)、抵抗素(resistin,RETN)采用双抗体一步夹心法酶联免疫吸附试验(ELISA)测定,使用由黄石艾恩斯生物科技有限公司提供的羊专用试剂盒,上样50 μL于酶标仪(上海科华,ST-360),读取450 nm的OD值,代入回归方程计算出样品的浓度;血清游离脂肪酸(nonesterified fatty acid,NEFA)采用铜试剂比色法,使用南京建成生物工程研究所游离脂肪酸测试盒;血清甘油三酯(Triglyceride,TG)、葡萄糖(glucose,GLU)分别采用甘油磷酸氧化法、氧化酶法测定,用全自动生化仪(希森美康,BX-3010)测定,使用上海科华生物工程有限公司试剂盒。
1.4.3 屠宰性能和肉品质 屠宰率:试验羊宰前12 h禁食,2 h禁水,空腹称重屠宰后,去头、毛皮、内脏及前肢膝关节和后肢趾关节以下部分,整个躯体(包括肾及其周围脂肪)静置30 min后称胴体重,计算屠宰率=胴体重/宰前活重×100%。
GR值:第12~13肋骨之间距离背中线11 cm处组织厚度,用游标卡尺测定。
眼肌面积:用直尺测定倒数第1与第2肋骨之间脊椎上眼肌的高和宽,计算眼肌面积=眼肌高度×眼肌宽度×0.7。
背膘厚度:第12与第13胸椎结合处的背部皮下脂肪的厚度,用直尺测定。
剪切力:参考《肉嫩度的测定 剪切力测定法》(NYT 1180—2006),取右侧后腿肉一块(≥6×3×3 cm),除去表面脂肪、筋膜,装入塑料薄膜袋中包扎好,放在15~16 ℃条件下24 h,然后置于4 ℃熟化24 h,取出在室温下放置1 h。将热电耦温度计插入肌肉中心部,再包扎好肉样,保持袋口向上,放入功率1 500 W的80 ℃恒温水浴锅中,待肉羊中心温度达到70 ℃为止(约45 min)。取出肉样,置于4 ℃冷却。按与肌纤维呈垂直方向切取厚度为2.5 cm,长宽为5 cm的肉片,再用直径1.27 cm的圆形取样器顺肌纤维方向钻切肉样块,做3个重复,计算平均值。
熟肉率:取右侧后腿肉约100 g,剥去表面脂肪称重,在2 000 W电炉上蒸45 min,室温悬挂冷却30~45 min后称重,3个平行,计算平均值。
采集右侧背最长肌样品,测定pH、肉色、失水率,每个样品做3个平行,取平均值。
1.4.4 脂肪沉积与器官指数 尾巴大小指数:试验羊屠宰去毛皮、四肢后,用软尺量尾长、尾根部宽、尾中部宽(尾巴中间最宽处的宽度)[13]、尾周长(尾巴最宽处一周长度)及尾巴重量,并计算各指标指数。
各部位脂肪沉积:试验羊屠宰去毛皮、四肢后,剥离皮下、尾部、心组织周围、肾组织周围、大网膜、肠系膜、腹部脂肪,用吸水纸吸干水分,进行称重,并计算内脏脂肪和总脂肪以及各部位脂肪指数。内脏脂肪=心组织周围脂肪+肾组织周围脂肪+大网膜脂肪+肠系膜脂肪+腹部脂肪;总脂肪=内脏脂肪+尾部脂肪+皮下脂肪;各部位脂肪指数(%)=该部分脂肪重/宰前活重×100。
1.5 数据处理与统计分析
运用 SPSS 软件(IBM SPSS Statistics 19)中T检验。所有数据以“平均值±标准误(Mean±SE)”表示,显著水平为0.05(P<0.05)。
2 结 果
2.1 断尾对兰州大尾羊生长性能的影响
由图1A可知,兰州大尾羊羔羊断尾后的30 d内,断尾组(T组)羔羊日增重135.93 g,显著低于对照组(C组)的208.15 g(P<0.05);31~60 d内,断尾组日增重168.52 g,数值上低于对照组的174.44 g,但差异不显著(P>0.05);61~90 d、91~120 d内,断尾组日增重分别达到207.03和308.52 g,分别较对照组的180.36和291.85 g提高了14.79%和5.71%,差异不显著(P>0.05);121~150 d内,断尾组日增重223.33 g,稍低于对照组的238.89 g,无显著差异(P>0.05);151~240 d内两组试验羊的日增重在223.12~238.89 g,无显著差异(P>0.05)。由图1B可知,由于断尾对羔羊早期(断尾30 d内)生长影响,断尾组试验羊的体重在断尾后的前3个阶段(断尾90 d内)显著低于未断尾组,但随着断尾后时间的延长,两组试验羊的体重无显著差异(P>0.05)。

数据点上无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),下同
由表2可知,兰州大尾羊羔羊断尾后的料重比在断尾后的61~90 d内,显著小于对照组(P<0.05),其余阶段差异不显著(P>0.05)。断尾组除了0~30 d、121~150 d、181~240 d外,各阶段料重比及平均料重比在数值上小于对照组。

表2 断尾对兰州大尾羊料重比的影响
2.2 断尾对兰州大尾羊血清脂肪因子的影响
断尾后,短期内(0~60 d)兰州大尾羊血清TNF-α较对照组显著升高(P<0.05),61~240 d虽然断尾组血清中浓度一直高于对照组,但差异不显著(图2C,P>0.05)。试验期内,血清GLU(图2A)、LEP(图2E)、RETN(图2F)、ADPN(图2H)断尾组在数值上大于对照组,并且随着试验期的增加,断尾组和对照组之间的差异增大,但差异不显著(P>0.05)。血清TG断尾后0~30 d内断尾组高于对照组,61~210 d内断尾组低于对照组,211~240 d内断尾组高于对照组,但差异不显著(图2B,P>0.05)。血清IL-6断尾后0~30 d内断尾组在数值上高于对照组,但差异不显著(P>0.05),31~240 d内断尾组与对照组变化趋势一致(图2D)。试验期内,血清NEFA在两组间变化趋势一致,两组间无显著差异(图2I,P>0.05)。
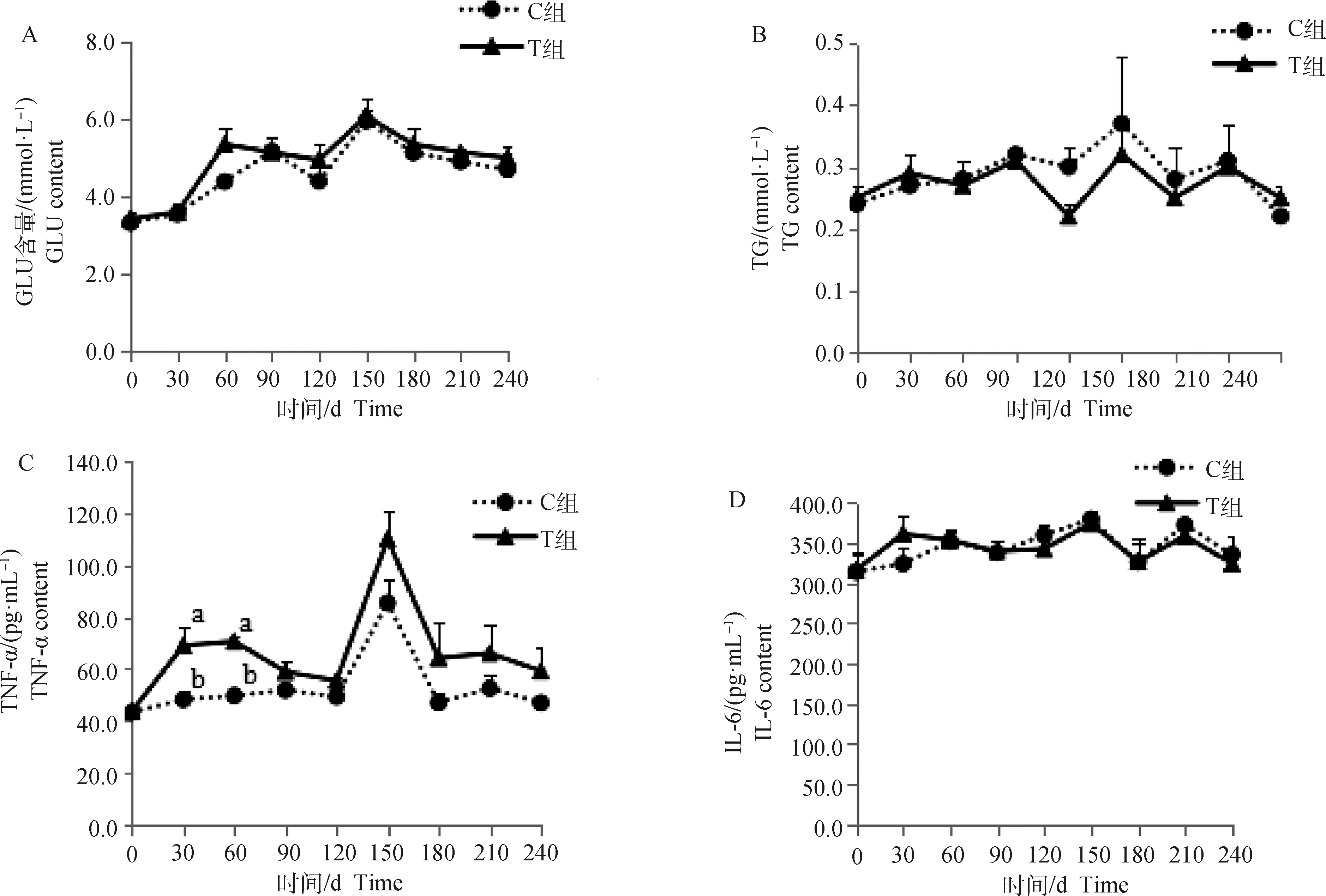
A~I.分别为血清GLU、TG、TNF-α、IL-6、LEP、RETN、ADPN和NEFA含量
2.3 断尾对兰州大尾羊脂肪沉积和器官指数的影响
由表3可见,断尾对兰州大尾羊各部位脂肪沉积有影响。断尾后,兰州大尾羊尾部脂肪指数、总脂肪指数与对照组相比,显著降低(P<0.05),分别降低了74.31%和34.02%。断尾组皮下脂肪指数、肾周脂肪指数、腹部脂肪指数和内脏脂肪指数显著高于对照组(P<0.05),心脏脂肪指数、大网膜脂肪指数和肠系膜脂肪指数两组间无显著差异(P>0.05)。
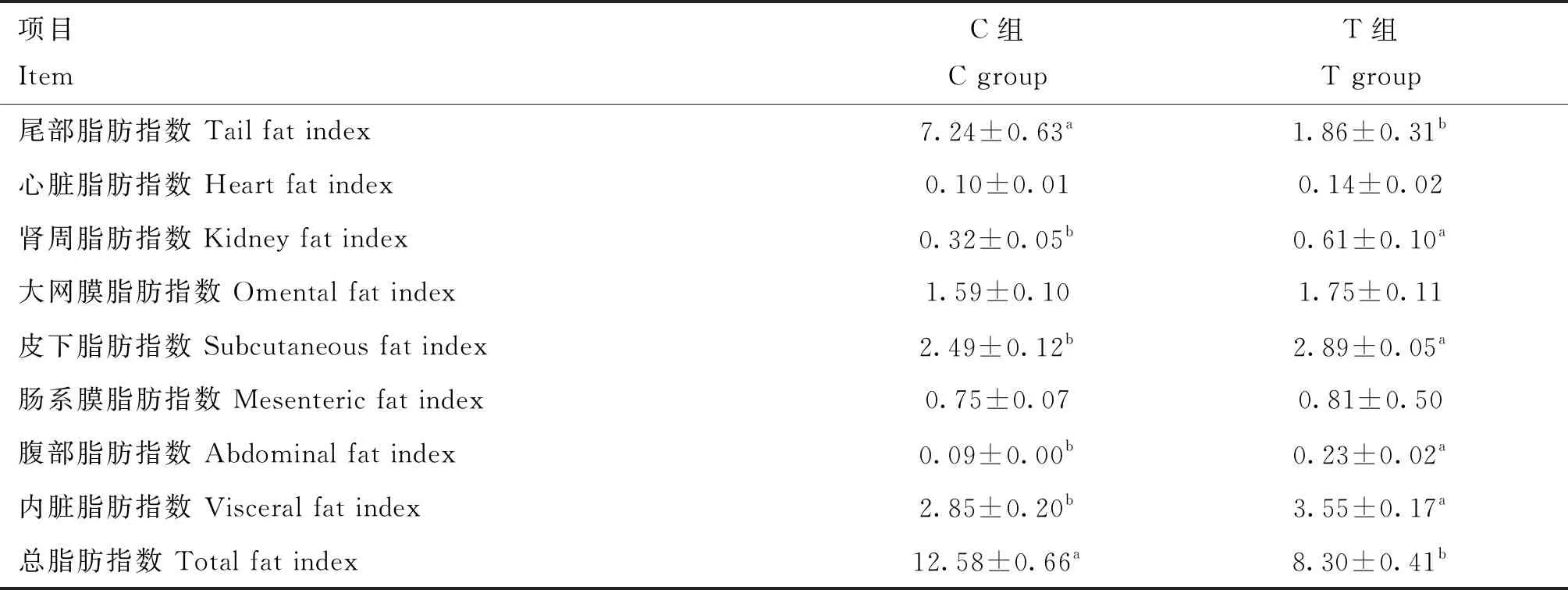
表3 断尾对兰州大尾羊脂肪沉积指数的影响
由表4可见,早期断尾使兰州大尾羊尾长指数、尾中宽指数、尾周长指数和尾重指数显著降低(P<0.05),而对尾根宽指数无显著影响(P>0.05),两组试验兰州大尾羊尾巴大小见图3。断尾后,兰州大尾羊头重指数显著升高(P<0.05),蹄重指数、毛皮重指数两组间无显著差异(P>0.05)。
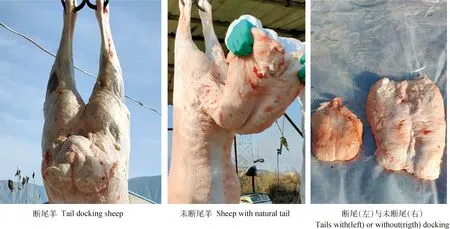
图3 断尾与未断尾的兰州大尾羊尾巴

表4 断尾对兰州大尾羊尾部及器官指数的影响
2.4 断尾对兰州大尾羊屠宰性能和肉品质的影响
断尾组羊的屠宰率显著大于对照组(P<0.05),GR值、背膘厚、眼肌面积差异不显著(P>0.05,表5)。断尾组背最长肌的肉色(亮度、红度、黄度)和pH与对照组无显著差异(P>0.05),断尾组羊背最长肌剪切力显著小于对照组(P<0.05),失水率和蒸煮损失两组间无显著差异(P>0.05,表6)。

表5 断尾对兰州大尾羊屠宰性能的影响
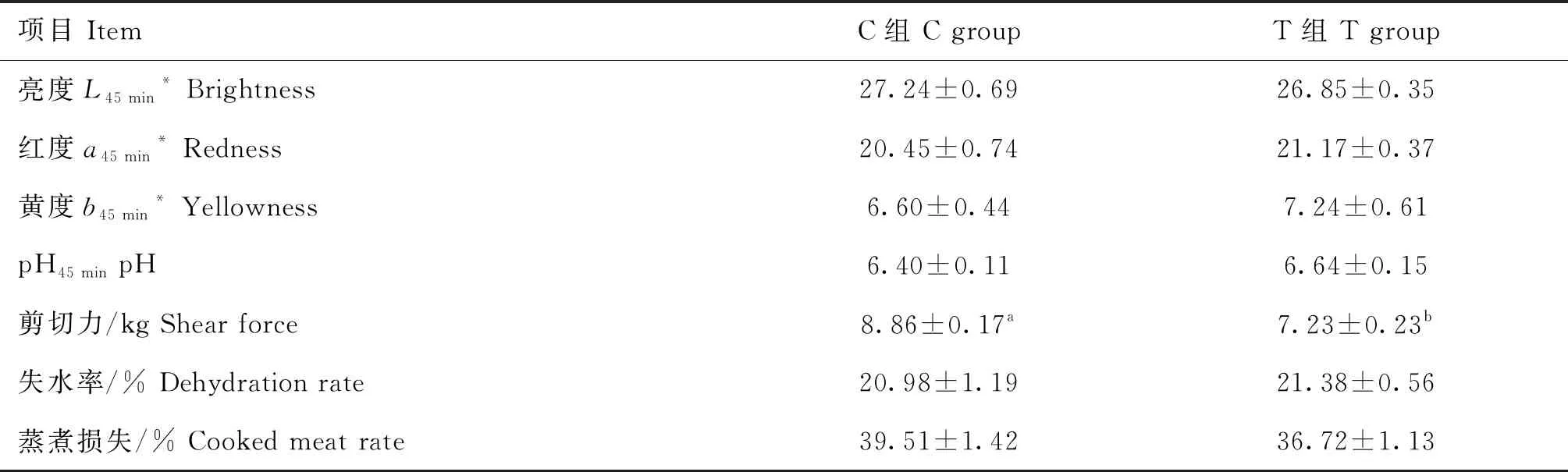
表6 断尾对兰州大尾羊肉品质的影响
3 讨 论
3.1 断尾对兰州大尾羊生长性能、屠宰性能和肉品质的影响
在舍饲条件下,脂尾型绵羊早期断尾不仅利于交配和避免羊粪污染羊毛,而且可以提高屠宰性能和饲料转化率(料重比)。日增重和饲料转化率是衡量家畜生产性能的主要指标,屠宰性能则直接反映家畜产肉能力和肌肉营养沉积分布[14]。而肌肉的颜色、嫩度、pH、失水率、蒸煮损失等是肌肉品质的主要指标[15],其中剪切力是测定肉嫩度的重要指标,pH是肉类酸度的重要指标,一般介于5.8~6.2之间[16]。Wang等[17]将1日龄的脂尾型绵羊断尾,待46日龄断奶后放牧至6月龄屠宰,与未断尾组相比,断尾能极显著地提高日增重、胴体重、屠宰率和背膘厚,显著地提高眼肌面积;同时,显著提高背最长肌的L*值和肌内脂肪含量,降低剪切力。刘政等[18]对2月龄的兰州大尾羊和蒙古羊进行断尾后发现,断尾组的兰州大尾羊和蒙古羊日增重、宰前活重和胴体与未断尾组相比,均有提高的趋势,而采食量有降低的趋势。周瑞等[19]的研究结果表明,断尾脂尾型羊的背膘厚、GR值有增大的趋势,而剪切力、失水率有减小的趋势。Bingöl等[20]对1日龄脂尾型公羔断尾,在其断奶后进行70 d的育肥试验,结果显示,断尾组的日增重、屠宰率显著高于对照组,断尾组的眼肌面积、肌内脂肪含量在数值上增大,但无统计学差异。也有研究结果显示,早期断尾对宰前活重、日增重、屠宰率等无显著影响[21]。
在本试验中,兰州大尾羊羔羊在断尾后的最初30 d内,断尾组日增重显著低于未断尾组,以后31~60 d、61~90 d、91~120 d、121~240 d各阶段两组羊试验羊的日增重无显著差异;断尾组试验羊的体重在断尾后的90 d内显著低于未断尾组,但随着断尾后时间的延长,两组试验羊的体重无显著差异;断尾组料重比在断尾后的61~90 d内,显著小于未断尾组,其余阶段差异不显著。这可能是因为在断尾的最初30 d内,断尾对羔羊造成一定的损伤,由于断尾应激使免疫调节机制被激活,使部分营养物质用于免疫反应,从而降低了其生长性能,从而使日增重较对照组减小,随着断尾损伤的愈合,在61~120 d内断尾羊出现补偿生长,经过补偿生长后两组羊的体重无显著差异。在整个试验期内,断尾羊的料重比在数值上小于未断尾组,这可能是断尾后,尾部沉积脂肪减小,从而使总脂肪沉积也减小,导致饲料转化率升高的原因。
与未断尾组相比,断尾兰州大尾羊的屠宰率显著升高,剪切力显著降低,背膘厚、GR值在数值上增大,这与上述研究结果相似。前人研究认为,脂尾型绵羊尾部脂肪发育较早,羔羊生长发育早期尾部脂肪沉积较快[22],并且尾部脂肪沉积效率高于其他部位脂肪沉积效率[23],具有局部沉积的生物学效应[24]。同时,沉积1 kg脂肪所耗饲草料相当于生产2 kg瘦肉所需的饲草料[3]。本试验中,兰州大尾羊早期断尾人为干预后,使得尾部脂肪代谢通路受损并且部分被阻断,动物摄入的能量更多的用于机体其他部位的生长发育和脂肪沉积,多余能量便较多地沉积到皮下、腹部和肌内等部位,使尾部沉积的脂肪量降低,胴体总脂肪、皮下脂肪以及肌内脂肪含量增加,屠宰率、背膘厚、GR值、嫩度增大,剪切力降低,从而提高了胴体品质和肉品质。
3.2 断尾对兰州大尾羊脂肪沉积分布的影响
动物的脂肪组织分为白色脂肪和棕色脂肪,白色脂肪全身各处都有分布,主要分布于躯干、四肢、皮下、腹部和内脏,线粒体少,主要储存甘油三酯,是机体能量储备中心,同时还分泌多种脂肪因子,脂肪因子在调节机体饱腹感、脂质代谢、胰岛素敏感性方面具有重要的作用[25]。棕色脂肪主要分布在肩胛、颈部和胸腔,富含线粒体,主要参与机体的适应性产热[26-28]。畜体脂肪的沉积分布是影响胴体品质和肉品质的重要因素,过多的脂肪沉积在尾部、皮下、腹部、内脏等部位会降低胴体品质,而脂肪沉积在肌肉间则可以提高肌肉品质,肌内脂肪含量是评价肉品质最主要的质量指标,与肉的嫩度、色泽、多汁性和风味有关[29-32]。王立艳等[9]研究结果表明,滩羊早期断尾后,更多的脂肪沉积在皮下、肌内和肾周,提高了肉的嫩度,改善了肌肉品质。刘政等[18]的研究结果显示,断尾使兰州大尾羊更多的脂肪沉积到了皮下、睾丸、肾周和肠胃周围,且总脂肪重显著降低。Tilki等[21]的研究结果也认为,脂尾型绵羊断尾后,肾周脂肪和肠系膜脂肪沉积也显著提高。Wang等[17]的研究表明,断尾使脂尾型绵羊肌内脂肪极显著升高。
绵羊尾部脂肪沉积是经过长期的自然选择和人工选择,在进化过程中形成的稳定遗传的表型特征,受激素、细胞因子、基因、营养等多因素的调控[22]。研究发现,哺乳动物的脂肪细胞由胚胎期具有多向分化能力的间充质干细胞在成脂因子的诱导下发育而来,其数量在出生时基本恒定,出生后,脂肪的沉积主要靠前脂肪细胞的增大和分化实现[33],因此,从脂肪组织发育的角度看,脂肪细胞的增殖和成脂分化,尤其具有分化潜能的前脂肪细胞的增殖分化在脂肪沉积过程中显得尤为重要[34],脂肪组织中前脂肪细胞在营养、激素等刺激下,不断的进行增殖分化以及成熟脂肪细胞的增大是脂肪沉积的主要原因。在常规的营养和外界环境条件下,脂肪细胞的数量、体积、分化速度以及在尾部、皮下、腹部等部位沉积分布会在一定的范围之内达到平衡和稳态[35]。同时,脂尾型绵羊尾部脂肪沉积较早且幼龄羊尾部沉积脂肪效率更高[22]。本试验对脂肪沉积部位进行人为干预,兰州大尾羊羔羊5日龄断尾处理后,一方面可能是在兰州大尾羊幼龄期,也就是尾部脂肪发育的关键期,断尾使尾部脂肪代谢通路受损并且部分被阻断,使得原本沉积在尾根部的脂肪部分转移到皮下、腹部、内脏等部位,造成尾根部脂肪降低,皮下、腹部、肾周和内脏总脂肪升高;另一方面,断尾使尾部脂肪代谢通路部分被阻断,尾巴减小,尾部沉积的脂肪降低,在相同的饲养管理条件下,多余的能量更多的沉积在皮下、腹部、内脏和肌内等部位,从而改变机体脂肪沉积分布。所以,长脂尾型绵羊早期断尾干预可以作为脂肪沉积部位干预的一种有效手段。
3.3 断尾对兰州大尾羊脂肪因子的影响
脂肪组织不仅是重要的能量储存和代谢器官,也是重要的内分泌器官,其分泌的多种具有生物活性的脂肪因子能够通过自分泌、旁分泌及内分泌的方式介导一系列的信号转导通路,在调节机体能量平衡、脂质代谢、糖代谢等方面具有重要的作用[36-38]。脂肪因子还可通过不同的靶点反馈调节脂肪细胞的发育分化,在脂肪沉积发生过程中促进脂肪细胞增殖分化的脂肪因子分泌水平增加,而抑制分化的脂肪因子下降,促进脂肪的沉积,反之则抑制脂肪细胞的增殖分化[39]。目前发现脂肪细胞能分泌600多种多肽物质[40],包括TNF-α、IL-6、LEP、ADPN、RETN、VEGF等,这些多肽物质共同构成了一个非常复杂的内分泌网络系统[41-43]。TNF-α、IL-6是脂肪细胞和免疫巨噬细胞分泌的炎性脂肪因子,这些因子除了参与免疫反应外,还可以诱发机体局部和全身的脂质沉积炎症反应,参与脂质代谢的调节[41]。LEP、ADPN、RETN都是脂肪细胞分泌的脂肪因子,与脂肪细胞之间存在一系列的反馈调节机制,LEP除了通过下丘脑的摄食中枢抑制能量摄入外,调控能量平衡从而调节脂肪沉积外,还通过抑制前脂肪细胞分化发育和CEB-α和PPAR-γ的表达,减少细胞内甘油三酯的积聚,最终抑制脂肪细胞的生长发育[44]。ADPN和RETN能反馈刺激脂肪细胞的发育分化,从而调节脂质沉积。TG、GLU也可以反映动物体脂代谢情况[16],TG是肌内脂肪含量的主要决定因素[45-46],GLU是机体对糖的吸收、运转和代谢动态平衡状态的反映,也是机体能量代谢水平的体现。
动物在正常生长发育过程中产生的分解代谢物最终会进入到血液里,因而血清相关指标能够反映动物机体新陈代谢的情况[47]。Eicher等[48]研究认为,小母牛血浆中TNF-α在断尾后的0、144 h显著升高。Prunier等[49]研究结果显示,仔猪断尾后,血浆GLU浓度不受影响。本研究结果显示,兰州大尾羊断尾后0~60 d内血清TNF-α浓度较未断尾组显著升高,之后断尾组在数值上一直高于未断尾组。这可能一方面是断尾激活了免疫系统,导致巨噬细胞和淋巴细胞分泌TNF-α,随着断尾损伤时间的延长,断尾造成的炎症反应降低;另一方面,断尾使尾部脂肪代谢通路部分被阻断,导致脂肪细胞分泌的TNF-α诱导前脂肪细胞和脂肪细胞的凋亡。断尾组血清GLU、LEP、RETN、ADPN在数值上大于未断尾组。这可能是在相同饲养管理条件下,通过断尾干预后,断尾组尾部脂肪沉积降低,沉积在机体其他部位的脂肪相对量增加,导致脂肪细胞分泌的脂肪因子增加,从而反馈调节脂肪的沉积。
4 结 论
4.1在本试验条件下,兰州大尾羊早期断尾(5日龄)可使尾长指数、尾中宽指数、尾周长指数和尾重指数显著降低,同时,断尾改变脂肪的沉积分布,断尾后尾部脂肪指数、总脂肪指数显著降低;而皮下脂肪指数、肾周脂肪指数、腹部脂肪指数和内脏脂肪指数显著升高。
4.2断尾可以提高屠宰率和改善肉品质,兰州大尾羊早期断尾后屠宰率显著提高,背最长肌剪切力显著降低。
