硫化氢对心肌成纤维细胞增殖的抑制作用及机制研究 Δ
2023-02-27刘露露秦燕孟国梁顾锦华张琳包小燕南通大学附属妇幼保健院南通市儿童医院药学部江苏南通6007南通大学药学院江苏南通600南通大学附属妇幼保健院南通市儿童医院心电图室江苏南通6007
刘露露 ,秦燕 ,孟国梁 ,顾锦华 ,张琳 包小燕 (.南通大学附属妇幼保健院/南通市儿童医院药学部,江苏 南通 6007;.南通大学药学院,江苏 南通 600;.南通大学附属妇幼保健院/南通市儿童医院心电图室,江苏 南通 6007)
心肌纤维化是一种以心肌成纤维细胞基质蛋白沉积为主要特征的心肌病理改变[1]。当心肌缺血缺氧时,心肌成纤维细胞可过度激活,进而造成心脏损伤[2]。虽然心肌成纤维细胞是心脏中数目最多的细胞,但在研究心脏生理功能和疾病机制过程中,对心肌成纤维细胞研究却相对较少。硫化氢(hydrogen sulfide,H2S)是一种气体信号分子[3],在调节细胞信号传导、抗炎、抗氧化等病理生理学过程中发挥着重要作用[4]。去乙酰化酶3(sirtuin 3,SIRT3)是组蛋白去乙酰化酶Ⅲ的成员之一,可参与感知细胞能量代谢,进而维持氧化还原状态的平衡[5]。H2S是一种具有抗氧化作用的气体分子,SIRT3与线粒体功能和氧化应激密切相关。既往研究证实,H2S可通过增强SIRT3的表达来改善血管紧张素Ⅱ(angiotensinⅡ,Ang Ⅱ)诱导的心肌肥大[6]。由于Ang Ⅱ会诱导心肌纤维化[7],且既往研究发现H2S可以减轻阿霉素诱导的心肌纤维化[8],但是目前尚不清楚SIRT3是否也在H2S抗Ang Ⅱ诱导的心肌纤维化中起关键作用。因此,本研究拟采用硫氢化钠(sodium hydrosulfide,NaHS)作为H2S供体,观察SIRT3在H2S抗Ang Ⅱ诱导的心肌成纤维细胞增殖中的变化,揭示H2S抗心肌纤维化的新靶点,从而为临床防治心肌纤维化相关疾病提供理论依据和实验基础。
1 材料
1.1 主要仪器
本研究所用主要仪器有AE-100型电子天平(美国Millipore公司)、SYNERGY H1型全自动酶标仪(美国BioTek公司)、TCS SP8型激光共聚焦显微镜(德国Leica公司)、Chemidoc Tonch型化学发光显影仪(美国Bio-Rad公司)、MVS-83型压力蒸汽灭菌器(日本Panasonic产业株式会社公司)、5424 R型高速台式离心机(德国Eppendorf公司)等。
1.2 主要药品与试剂
青霉素-链霉素溶液(批号C0222)、胰蛋白酶(批号C0201)、CCK-8试剂盒(批号C0038)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI,批号C1005)、Alexa Fluor 488标记山羊抗兔IgG二抗(批号A0423)和Cy3标记山羊抗兔IgG二抗(批号A0516)均购自上海碧云天生物技术有限公司;DMEM(批号SH30021.01)购自美国Cytiva公司;胎牛血清(批号10099141C)购自美国Gibco公司;NaHS(批号16721-80-5)购自瑞士 Admas公司;Ang Ⅱ(批号 A9525,纯度100%)购自美国Sigma-Aldrich公司;羟脯氨酸测定试剂盒(批号A030-1-1)购自南京建成生物工程研究所有限公司;脂质体2000(批号11668-019)购自美国Invitrogen公司;兔源SIRT3、视神经萎缩蛋白1(optic atrophy protein 1,OPA1)多克隆抗体均购自美国Santa Cruz Biotechnology公司,货号分别为sc-365175、sc-393296;兔源Ⅰ型胶原(collagen Ⅰ,Col Ⅰ)、Ⅲ型胶原(collagen Ⅲ,Col Ⅲ)多克隆抗体均购自武汉博士德生物工程有限公司,货号分别为BA2023、M00788;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phos-phate dehydrogenase,GAPDH)抗体(货号GB12002)购自武汉赛维尔生物科技有限公司;SIRT3干扰RNA(SIRT3 siRNA,批号20180312-1)、阴性对照干扰RNA(negative control siRNA,NC siRNA;批号20180312-2)均购自上海吉玛制药技术有限公司。
1.3 实验动物
1~3 d龄的SD雄性大鼠(体质量为5~8 g)由南通大学实验动物中心提供,使用许可证号为SYXK(苏)2017-0046,生产许可证号为SCXK(苏)2019-0001。所有大鼠饲养于无菌环境中,温度约为27 ℃,相对湿度约为55%,自由饮水、进食。
2 方法
2.1 心肌成纤维细胞的培养
取1~3 d新生SD雄性大鼠心脏,并用胰蛋白酶水浴消化,取出细胞悬液,留取沉淀(即细胞)于细胞培养箱中培养。根据差速离心法分离心肌成纤维细胞。待细胞生长密度达到80%后传代,采用第3代心肌成纤维细胞进行实验。
2.2 心肌成纤维细胞的分组、给药与造模
将心肌成纤维细胞按每孔1 mL(密度为2×105个/mL)接种于6孔板中,待心肌成纤维细胞生长密度约60%时,将含10%胎牛血清的培养液换成含0.5%胎牛血清的培养液饥饿细胞24 h后,将细胞分为空白组、Ang Ⅱ组、Ang Ⅱ+NaHS组、NaHS组,每组6个复孔。Ang Ⅱ+NaHS组以及NaHS组中加入NaHS溶液(50 μmol/L)预处理4 h,Ang Ⅱ组以及Ang Ⅱ+NaHS组加入Ang Ⅱ溶液(100 nmol/L)刺激细胞24 h从而诱导产生心肌成纤维细胞增殖模型,观察NaHS给药后对心肌成纤维细胞增殖的影响。给药剂量按参考相关文献[6]设置。
2.3 心肌成纤维细胞增殖的检测
细胞分组和处理同“2.2”项下,按照CCK-8试剂盒说明书方法进行操作,检测各组细胞的光密度(optical density,OD)值。
2.4 心肌成纤维细胞中羟脯氨酸含量的检测
细胞分组和处理同“2.2”项下,按照羟脯氨酸测定试剂盒说明书方法进行操作,利用试剂盒提供的羟脯氨酸标准品,按公式(羟脯氨酸含量=各组样品吸光度/标准品吸光度×标准品浓度)计算各组心肌成纤维细胞中羟脯氨酸含量。
2.5 心肌成纤维细胞中SIRT3蛋白表达水平的检测
采用Western blot法进行检测。细胞分组和处理同“2.2”项下,用细胞裂解液裂解细胞40 min,提取细胞总蛋白。将转膜盒置于4 ℃环境中260 mA通电90 min,将转好的膜于5%牛奶中封闭2 h,加入SIRT3(稀释比为1∶2 000)及GAPDH(稀释比为1∶5 000)一抗于4 ℃摇床孵育过夜后用TBST洗膜,加入Alexa Fluor 488标记山羊抗兔IgG二抗室温孵育2 h。采用ECL化学发光法曝光,Image J软件分析各条带的灰度值,各条带的灰度值与内参蛋白GAPDH灰度值的比值表示蛋白表达水平。
2.6 转染NC siRNA或SIRT3 siRNA后心肌成纤维细胞中SIRT3蛋白表达水平的检测
采用Western blot法进行检测。取稀释过的脂质体2000分别和NC siRNA或SIRT3 siRNA(稀释比均为1∶1 000)混合,加入到心肌成纤维细胞培养皿中,分为NC siRNA组及SIRT3 siRNA组。待细胞转染4 h后,弃除转染复合物,用0.1 mol/L的磷酸盐缓冲液(PBS)冲洗细胞后更换成含10%胎牛血清的培养液培养48 h后进行检测。每个样本平行检测6次。
2.7 心肌成纤维细胞转染后的分组、给药与造模
心肌成纤维细胞转染NC siRNA或SIRT3 siRNA后,将细胞分为NC siRNA组、NC siRNA+Ang Ⅱ组、NC siRNA+Ang Ⅱ+NaHS组或SIRT3 siRNA组、SIRT3 siRNA+Ang Ⅱ组、SIRT3 siRNA+Ang Ⅱ+NaHS组。NC siRNA+Ang Ⅱ+NaHS 组、SIRT3 siRNA+Ang Ⅱ+NaHS组中加入 NaHS 溶液(50 μmol/L)预处理 4 h,NC siRNA+Ang Ⅱ组、NC siRNA+Ang Ⅱ+NaHS组、SIRT3 siRNA+Ang Ⅱ组、SIRT3 siRNA+Ang Ⅱ+NaHS组中加入Ang Ⅱ溶液(100 nmol/L)刺激细胞24 h从而诱导产生心肌成纤维细胞增殖模型,观察NaHS对心肌成纤维细胞增殖的影响,每组6个复孔。
2.8 心肌成纤维细胞转染后增殖及羟脯氨酸含量的检测
细胞分组和处理同“2.7”项下。按照CCK-8试剂盒、羟脯氨酸测定试剂盒说明书方法进行检测。
2.9 心肌成纤维细胞转染后Col Ⅰ、Col Ⅲ、OPA1蛋白表达水平的检测
采用免疫荧光法进行检测。细胞分组和处理同“2.7”项下,用PBS清洗细胞,固定细胞20 min后弃掉固定液,再用PBS清洗细胞,封闭细胞1 h后弃掉封闭液,加入Col Ⅰ、Col Ⅲ、OPA1一抗(稀释比均为1∶50),4 ℃过夜后用PBS洗涤细胞,按1∶100的稀释比加入Alexa Fluor 488标记山羊抗兔IgG二抗(用于Col Ⅰ)和Cy3标记山羊抗兔IgG二抗(用于Col Ⅲ、OPA1),室温避光放置2 h。用DAPI染细胞核,将载玻片置于荧光显微镜上拍片,用Image J软件测定荧光强度,荧光强弱间接反映Col Ⅰ、Col Ⅲ、OPA1蛋白表达水平。
2.10 统计学分析
3 结果
3.1 H2S对Ang Ⅱ诱导的心肌成纤维细胞增殖和羟脯氨酸含量的影响
与空白组相比,Ang Ⅱ组细胞OD值和羟脯氨酸含量均显著升高(P<0.05);与Ang Ⅱ组相比,Ang Ⅱ+NaHS组细胞OD值和羟脯氨酸含量均显著降低(P<0.05)。实验结果表明,H2S可以显著抑制Ang Ⅱ诱导的心肌成纤维细胞增殖,降低羟脯氨酸含量。结果见图1。
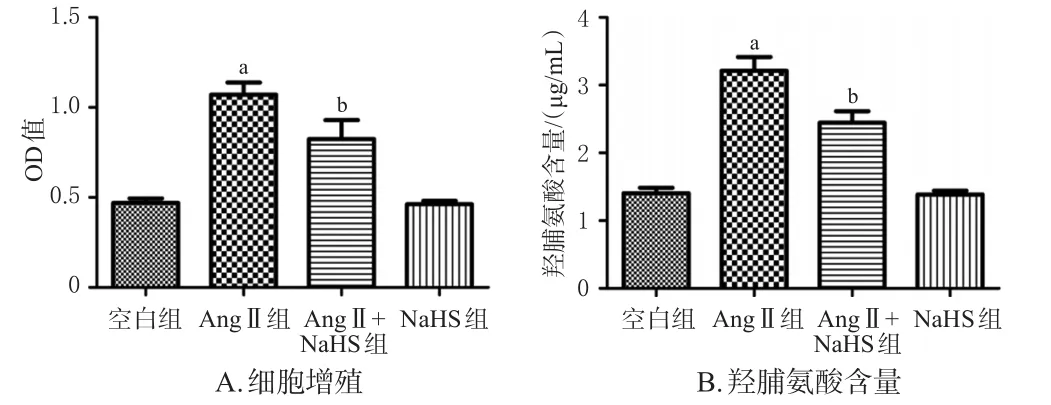
图1 H2S对Ang Ⅱ诱导的心肌成纤维细胞增殖及羟脯氨酸含量的影响(n=6)
3.2 H2S对Ang Ⅱ诱导的心肌成纤维细胞中SIRT3蛋白表达的影响
与空白组相比,Ang Ⅱ组细胞中SIRT3蛋白表达水平显著降低(P<0.05);与Ang Ⅱ组相比,Ang Ⅱ+NaHS组细胞中SIRT3蛋白表达水平显著升高(P<0.05)。实验结果表明,H2S可以显著提高Ang Ⅱ刺激后心肌成纤维细胞中SIRT3蛋白表达。结果见图2。
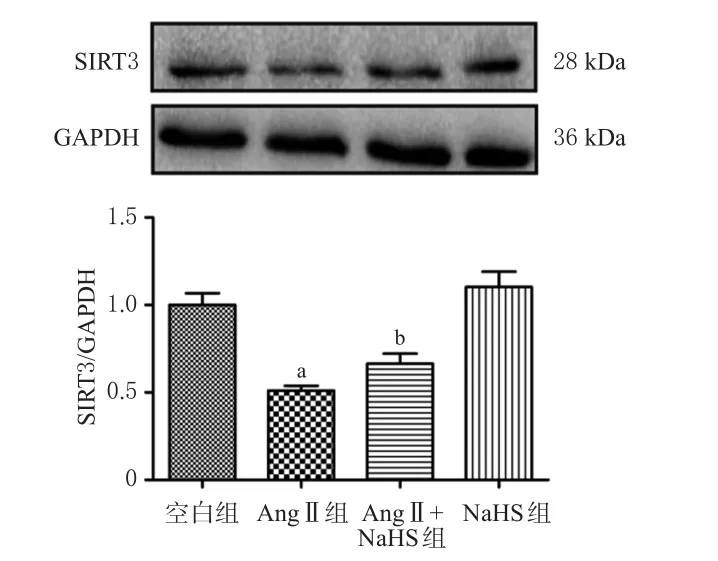
图2 H2S对Ang Ⅱ诱导的心肌成纤维细胞中SIRT3蛋白表达的影响
3.3 转染NC siRNA或SIRT3 siRNA后对心肌成纤维细胞中SIRT3蛋白表达的影响
与NC siRNA组相比,SIRT3 siRNA组细胞中SIRT3蛋白表达水平显著降低(P<0.05)。实验结果表明,用干扰RNA技术成功下调细胞中SIRT3蛋白表达。结果见图3。
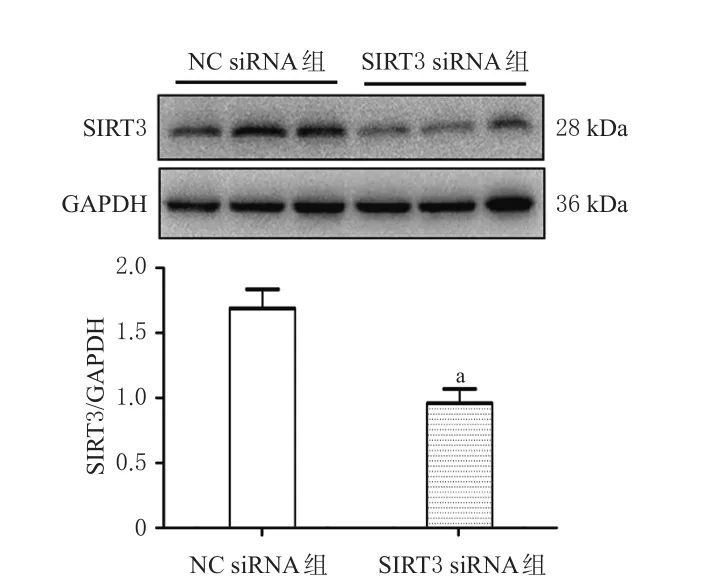
图3 转染NC siRNA或SIRT3 siRNA后的心肌成纤维细胞中SIRT3蛋白表达水平(n=6)
3.4 转染SIRT3对H2S抑制心肌成纤维细胞增殖和降低羟脯氨酸含量的影响
与NC siRNA组相比,NC siRNA+AngⅡ组细胞OD值及羟脯氨酸含量均显著升高(P<0.05);与NC siRNA+AngⅡ组相比,NC siRNA+Ang Ⅱ+NaHS组细胞OD值及羟脯氨酸含量均显著降低(P<0.05)。下调SIRT3表达后,与SIRT3 siRNA组相比,SIRT3 siRNA+Ang Ⅱ组细胞OD值及羟脯氨酸含量均显著升高(P<0.05);与 SIRT3 siRNA+Ang Ⅱ组相比,SIRT3 siRNA+Ang Ⅱ+NaHS组细胞OD值及羟脯氨酸含量均无显著变化(P>0.05)。实验结果表明,H2S依赖SIRT3抑制AngⅡ诱导的心肌成纤维细胞增殖并且依赖SIRT3降低羟脯氨酸含量。结果见图4。
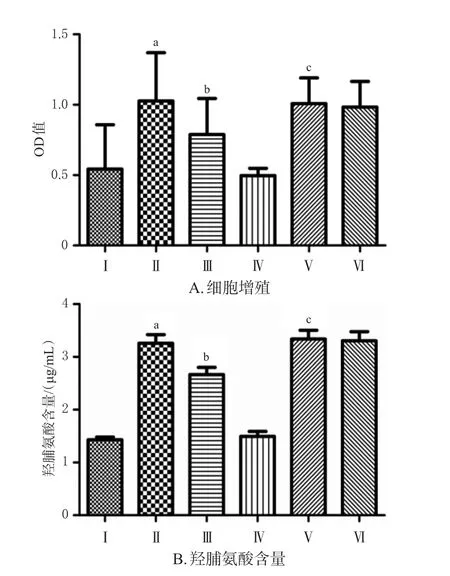
图4 转染SIRT3对H2S抑制心肌成纤维细胞增殖和降低羟脯氨酸含量的影响
3.5 转染SIRT3对H2S抑制心肌成纤维细胞中Col Ⅰ和Col Ⅲ蛋白表达的影响
如图5所示,H2S可显著抑制Ang Ⅱ诱导的心肌成纤维细胞中Col Ⅰ和Col Ⅲ蛋白表达升高;而在下调SIRT3表达之后,H2S对Col Ⅰ、Col Ⅲ表达的抑制作用明显减弱。
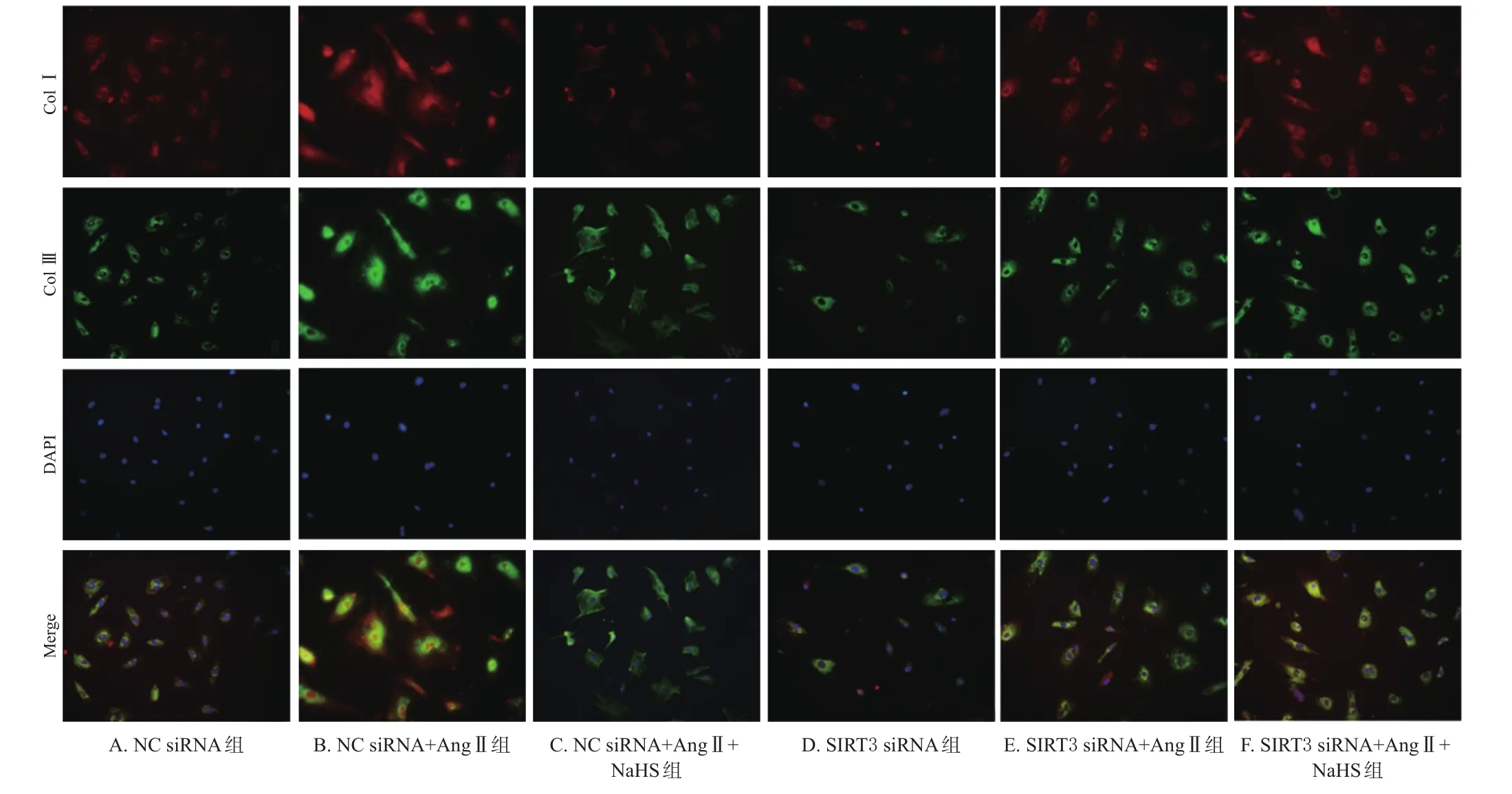
图5 转染SIRT3对H2S抑制心肌成纤维细胞中Col Ⅰ和Col Ⅲ蛋白表达的影响(×200)
3.6 转染SIRT3对H2S逆转心肌成纤维细胞中OPA1蛋白表达的影响
如图6所示,H2S能显著逆转Ang Ⅱ诱导的心肌成纤维细胞中OPA1蛋白表达降低;而下调SIRT3表达之后,H2S的逆转作用被抑制。实验结果表明,H2S对AngⅡ诱导的心肌成纤维细胞中OPA1表达降低的逆转作用依赖于SIRT3。
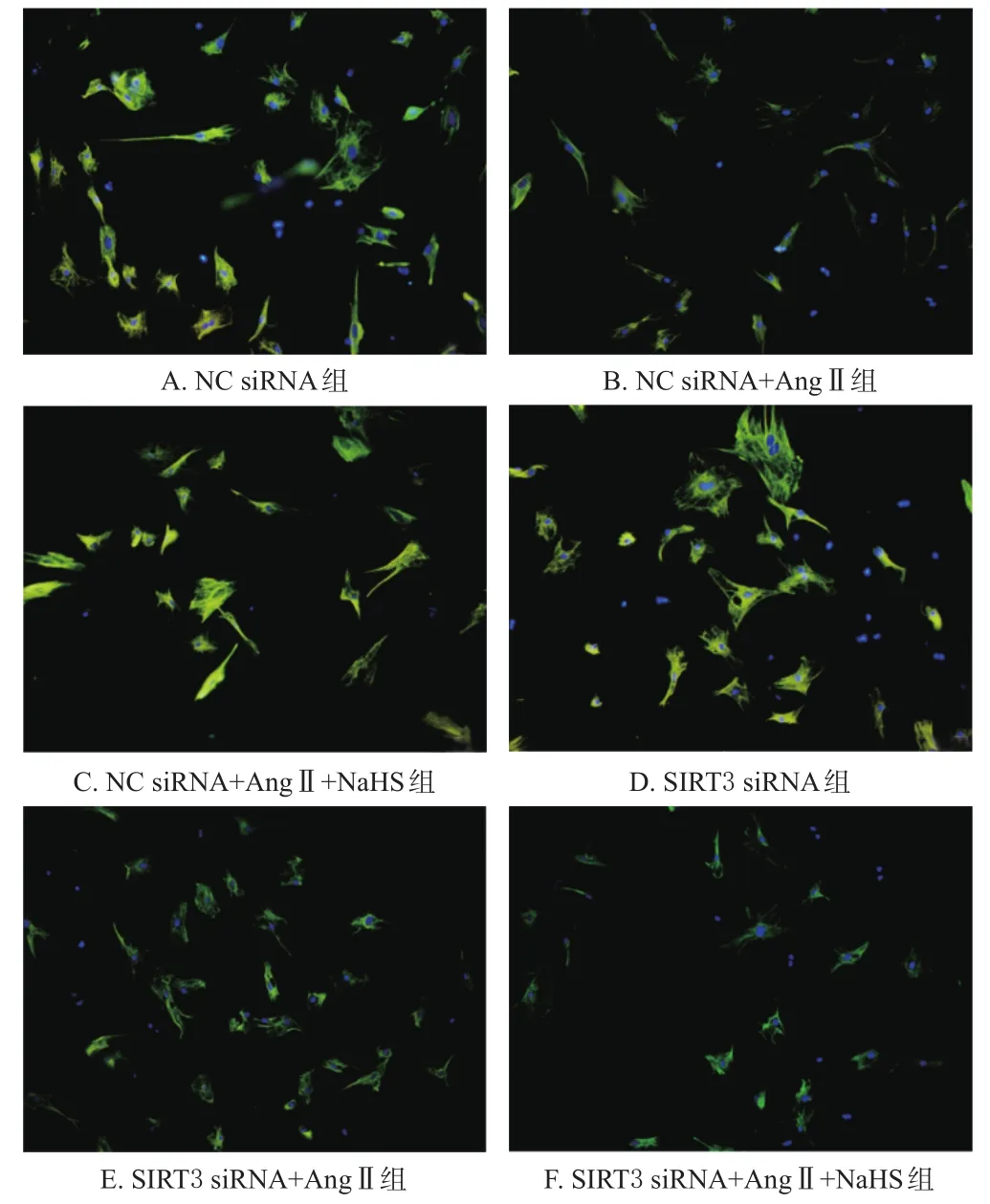
图6 转染SIRT3对H2S增强心肌成纤维细胞中OPA1蛋白表达的免疫荧光图(×200)
4 讨论
心肌纤维化是细胞外基质重塑的病理过程,可明显增加心肌壁僵硬度,恶化心功能,甚至产生心力衰竭以及心源性猝死[9]。心肌纤维化常见于缺血性心脏疾病,包括高血压[10]、心脏瓣膜病[11]、糖尿病心肌病[12]、肥厚型心肌病和特发性扩张型心肌病[13]等。此外,由于心肌梗死的局部区域细胞外基质的改变易导致炎症的产生,因此心肌梗死发生纤维化的情况最为普遍[9]。
长期以来,H2S被认为是一种有毒的气体。然而,目前越来越多的研究发现H2S可参与多种纤维化疾病的发生与发展。有研究证实,内源性和外源性H2S可以延缓肺、肝脏和肾脏等纤维化进展[14]。此外,多种心脏疾病也与H2S的生成紊乱密切相关,如H2S可抑制慢性心力衰竭机体心肌纤维化及心肌凋亡,其具体机制与减少氧化应激有关[15]。最近的研究表明,SIRT3可以通过调节靶蛋白的乙酰化水平,改善线粒体功能,延长机体寿命[16];相反,缺乏SIRT3后OPA1减少,心脏损伤加重,机体寿命显著缩短[17]。值得注意的是,H2S对多种细胞具有保护作用[18]。本实验以NaHS作为H2S的供体,探讨H2S对Ang Ⅱ诱导的心肌成纤维细胞中SIRT3蛋白表达的影响。
本实验通过CCK-8检测心肌成纤维细胞增殖发现,H2S可以显著抑制Ang Ⅱ诱导的心肌成纤维细胞增殖。羟脯氨酸是胶原蛋白特有的氨基酸,占氨基酸总量的13%,因此根据羟脯氨酸含量可以明确胶原水平,而成纤维细胞是产生胶原的主要细胞之一,测定羟脯氨酸的含量可间接反映成纤维细胞增殖情况[19]。通过检测心肌成纤维细胞羟脯氨酸含量发现,H2S可以显著抑制Ang Ⅱ诱导的心肌成纤维细胞羟脯氨酸的生成;通过Western blot法检测SIRT3蛋白表达发现,H2S可以显著增强Ang Ⅱ刺激后心肌成纤维细胞中SIRT3蛋白表达。下调SIRT3表达后,H2S不能抑制Ang Ⅱ诱导的心肌成纤维细胞增殖及羟脯氨酸的生成。胶原的生成与心肌纤维化密切相关,SIRT3缺乏会加重Ang Ⅱ诱导的小鼠心肌成纤维细胞间质纤维化[20]。研究发现,木犀草素通过调节SIRT3/ROS/MAPK信号通路从而抑制胶原表达以达到减少皮肤老化的效果[21],线粒体融合相关蛋白OPA1通过促进线粒体吞噬来保护心肌成纤维细胞[22]。通过免疫荧光检测心肌成纤维细胞Col I、Col Ⅲ、OPA1发现,H2S可以显著降低Ang Ⅱ诱导的心肌成纤维细胞的胶原生成,增强心肌成纤维细胞的OPA1表达。下调SIRT3表达后,H2S降低Col I及Col Ⅲ表达、增强OPA1表达的作用明显减弱。上述结果表明,H2S可通过上调SIRT3表达,进而调节线粒体融合相关蛋白OPA1的表达,改变线粒体的结构和功能,减轻Ang Ⅱ刺激下氧化应激,最终抑制心肌成纤维细胞增殖。
综上所述,H2S依赖增加SIRT3表达来抑制Ang Ⅱ诱导的心肌成纤维细胞增殖。
