水稻恶苗病病菌鉴定及其对化学药剂的敏感性分析
2023-02-26李广胜李月娇孙淑琴李岩朱祥茂杨秀荣冯学良
李广胜 李月娇 孙淑琴 李岩 朱祥茂 杨秀荣 冯学良

摘要:为进一步明确天津地区水稻恶苗病发病特点及引发该种病害的病原菌,同时摸清水稻恶苗病病原菌对目前生产上常用化学药剂的抗药性,以对天津地区水稻恶苗病的发生特点及化学药剂防治提出解决方案和优化措施。通过采集天津市不同地区不同栽培管理条件下水稻发病植株,依据发病植株的田间症状表现,并通过病原菌分离观察菌株形态特征和构建系统发育树等分子生物学鉴定方法,明确该病是由藤仓镰刀菌(Fusarium fujikuro)引起的水稻恶苗病;通过对苯醚甲环唑、丙硫菌唑、多菌灵、福美双、咯菌腈、咪鲜胺、氰烯菌酯、肟菌酯、戊唑醇等9种常用化学杀菌剂的敏感性测定,结果表明该病原菌对生产上使用频率最高的氰烯菌酯、咯菌腈和咪鲜胺3种药剂均产生了严重的抗药性,其抗性倍数分别为730.16、107.27、326.73,而且8个不同来源菌株的抗药性地域差异较大,根据其EC50可分成3、2、3、3、3、2、3、3、2个聚类组。结果表明,藤仓镰刀菌是天津地区水稻恶苗病的主要侵染病原菌,由于抗药性较严重近1~2年内应当停止使用氰烯菌酯、咪鲜胺、咯菌腈等3种杀菌剂,其他类型杀菌剂也应交替、轮换使用,避免连续、单一用药,以降低水稻恶苗病给水稻生产造成的损失。
关键词:水稻恶苗病;藤仓镰刀菌(Fusarium fujikuro);抗药性;抗性倍数;聚类分析
中图分类号:S435.111.4+4 文献标志码:A
文章编号:1002-1302(2023)24-0114-09
水稻恶苗病别称徒长病,其主要传播侵染途径为种子带菌传播,使用化学药剂对种子进行处理是最有效的方式[1]。近年来由于菌株的抗药性问题造成该病普遍发生,其主要田间症状表现为带病种子播种后不发芽或不能出土,苗期发病时表现为感病植株比正常植株细、高,可造成水稻减产3.0%~95.4%,甚至绝收[2]。在水稻恶苗病的药剂防治过程中,最初多菌灵作为主要药剂由于长期单一使用,造成了抗药性,导致防治效果降低[3-5]。咪鲜胺作为多菌灵的代替药剂在大规模推广使用一段时间后经相关学者研究发现该化学药剂也存在一定的抗性风险,2012年氰烯菌酯由于较好的防效在生产中得到了推广,在经过一段时间的推广使用后,有研究指出该病原菌的肌球蛋白突变可能导致对氰烯菌酯抗性的增加,并且能够产生多个抗性生理小种,从而降低其防效[6-10]。
2022年7—8月天津市水稻种植区恶苗病发生严重,有些地块病穴率为48%~74%,病株率为10.80%~22.40%,严重地块造成10%~30%的产量损失,而且症状有多种表现,发病时期也是参差不齐,严重威胁着天津市水稻的生产,针对以上情况,本试验开展病株采集、病原菌分离纯化、病原菌鉴定及其对化学药剂的敏感性测定,以便分析发病原因并寻找解决对策。
1 材料与方法
1.1 试验材料
水稻恶苗病病株采自天津市宁河区的杨泗村(菌株编号2201)、东棘坨镇(菌株编号2202)、苗庄村(菌株编号2203);津南区的西小站(菌株编号2204)、南辛房村(菌株编号2205);宝坻区的大钟庄(菌株编号2206)、小辛码头(菌株编号2207)、王卜庄(菌株编号2208)等8个不同栽培管理条件下水稻种植田,分离获得8個菌株。
1.2 供试药剂
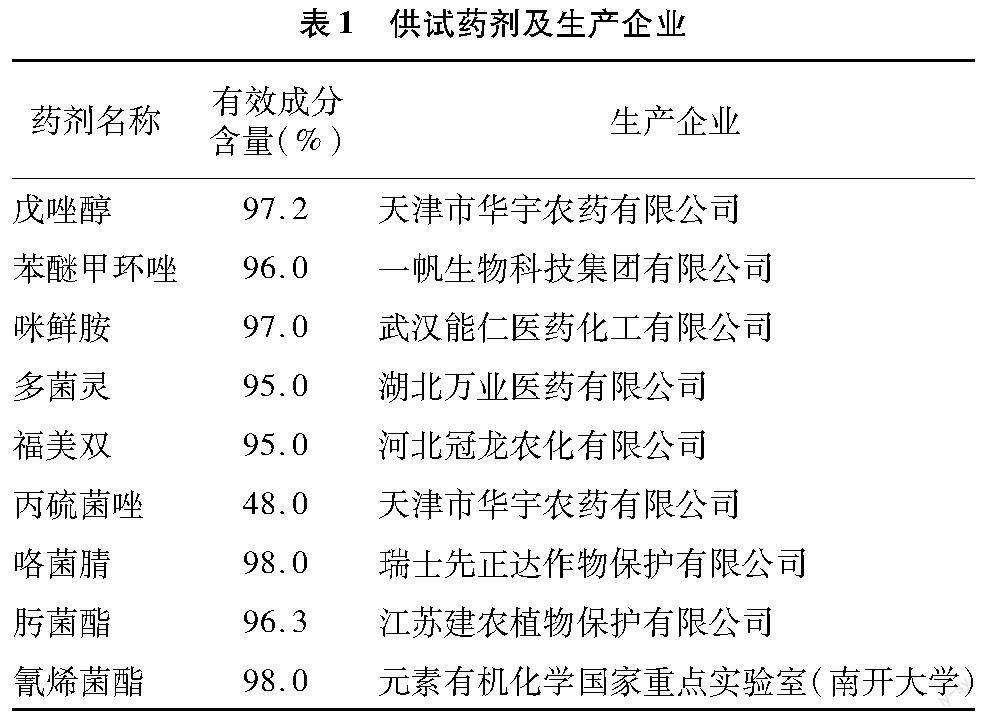
供试药剂详见表1。
1.3 试验方法
1.3.1 样品采集
2022年7—8月在天津宁河、宝坻、津南等水稻种植区采集水稻恶苗病发病植株样品,观察并记录植株整体发病状态及程度,将发病植株放入采样袋,并按照不同采样地点依次进行编号,当天带回天津市农业科学院植物保护研究所植物病害实验室进行病原菌分离。
1.3.2 病原菌分离
病原菌的分离采取组织分离法,首先用灭菌后的蒸馏水清洗采集的植株,水分擦干将准备分离的组织剪成4 mm×4 mm的小块,采用5%次氯酸钠溶液进行浸泡处理10 min,再用灭菌后的蒸馏水进行冲洗,吸干水分后于每个PSA培养基平板中放置5块,每个样品重复分离3次,于25 ℃环境中使其自然生长约1周。待组织块周围长出大小形态一致的菌丝后,挑取菌落边缘菌丝体对病原菌进行纯化培养,将分离的供试菌株单株分别转移到PSA培养基平板上,在25 ℃环境中继续培养7 d并观察菌落大小和正反面颜色以及小型分生孢子形态特点,并根据镰刀菌的形态特征进行菌株形态学鉴定[11]。
1.3.3 分子鉴定与系统发育树构建
将不同来源的菌株在培养基上培养7 d,刮取少量菌丝,采用北京索莱宝科技有限公司的真菌基因组DNA提取试剂盒对基因组进行提取,并用天根生化科技(北京)有限公司的2×Taq PCR Mix进行PCR扩增。采用通用引物EF1-728F(5′-CATCGAGAAGTTCGAGAAGG-3′)和TEF1LLErev(5′-AACTTGCAGGCAATGTGG-3′)扩增目标片段[12];扩增体系:模板DNA 2 μL,引物(10 μmol/L)各1 μL,2×Taq PCR Mix 25 μL,使用ddH2O将体系加到50 μL。扩增程序:94 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s(循环35次),72 ℃保持5 min。随后将PCR产物进行1.0%琼脂糖凝胶电泳,挑选目标条带PCR产物进行测序,测序结果在NCBI基因库进行BLAST比对,确定病原菌的种类。此外,自GenBank下载藤仓镰刀菌[Fusarium fujikuroi NRRL 5338(MN193860.1)、F. fujikuroi IMI 58289(HC036627.1)]、尖孢镰刀菌[F.oxysporum NM16 (MT565405.1)、F.oxysporum CBS:130302 (MT011000.1)]、新知镰刀菌[F.andiyazi CBS:119857 (MT011007.1)、F.andiyaz NRRL 31727 (MN193854.1)]等标准参照菌株TEF1-α序列,以木贼镰刀菌[F.equiseti KF1017 (JF966252.1)、F.equiseti MOS879(MN193854.1)]和禾谷镰刀菌[F.graminearum 23-4 (MH572242.1)、F.graminearum N6-1 (MH572241.1)]为外群,采用软件MEGA 5.05进行Clustal W比对,以邻近相接法(neighbor-joining,NJ)构建系统发育树[13]。
1.3.4 室内毒力测定
采用生长速率法评价恶苗病菌株对供试杀菌剂的敏感性。将所用药剂原药称取0.2 g纯品,加入二甲基亚砜和吐温80,其体积分别为1 mL和10 μL进行溶解。将原药按比例稀释成10、1、0.1、0.01、0.001 μg/mL等浓度,将1 mL药液与9 mL灭菌后40 ℃左右的PDA培养基在培养皿中进行充分混匀,每个浓度重复3次,以无菌水作为对照。将不同来源的病菌菌饼分别移入不同浓度的带毒培养基中,25 ℃环境下培养96 h,并测定菌落直径。计算出各药剂对水稻恶苗病病菌菌丝生长抑制的回归方程、抑制中浓度(EC50),比较供试药剂对靶标病原菌的毒力大小,并依据EC50进行系统聚类分析。
1.3.5 抗药性数据统计分析 抗性倍数的计算:RR=T/S。式中:RR表示测试种群的抗性倍数;T表示测试种群的EC50;S表示敏感品系的EC50。
抗药性水平的分级标准见表2。
1.3.6 不同地域菌株差异聚类数据统计
使用DPS 7.05软件计算EC50,进行系统聚类分析,比较不同地方菌株对几种化学药剂的敏感性。
2 结果与分析
2.1 水稻恶苗病样品的采集
2022年7月29日、8月3日,于水稻孕穗期、抽穗期在天津市宁河区杨泗村、东棘坨镇、苗庄村;津南区的西小站、南辛房村;宝坻区的大钟庄、小辛码头、王卜庄等8个不同栽培管理条件下采集水稻种植田恶苗病病株,分离获得8个菌株,编号分别为2201、2202、2203、2204、2205、2206、2207和2208。通过田间调查发现,发病早的植株节间明显伸长,叶片变黄且分蘖少,有倒生根,植株甚至干枯死亡,叶鞘上有粉色或白色霉层;发病晚的,有些植株没有明显增高,但叶片发黄、茎秆上有褐色条斑,叶片批张度大,植株下部茎节有倒生须根(图1)。
2.2 形态學鉴定
从发病植株上分离获得的纯化菌株,菌落正面为粉白色,背面黄色,小型分生孢子卵形或扁椭圆形,无色单孢,大小为4~5 μm(图2、图3)。根据菌落形态及分生孢子特征可确实其病原菌为镰刀菌的一种。
2.3 分子鉴定及系统发育分析
从分离出的8株供试镰刀菌DNA中扩增出约1 200 bp TEF1-α片段,不同菌株间扩增出的片段长度没有明显差异(图4)。将PCR产物纯化及测序,并将测序结果提交至GenBank进行BLAST比对分析得出,分离出的8株供试菌株均为藤仓镰刀菌(F. fujikuroi)。基于以上8株供试菌株以及GenBank中8株标准参照菌株的TEF1-α序列,并以木贼镰刀菌[F.equiseti KF1017 (JF966252.1)、F.equiseti MOS879 (MN193854.1)]和禾谷镰刀菌[F.graminearum 23-4 (MH572242.1)、F.graminearum N6-1 (MH572241.1)]为外群,进行系统发育分析。8株供试镰刀菌的TEF1-α序列与藤仓镰刀菌[F. fujikuroi NRRL 5338(MN193860.1)、F. fujikuroi IMI 58289 (HC036627.1)]的序列聚在一起且亲缘关系置信度为100%,其中菌株2201~2205、2208汇聚为一个子分支,2206和2207汇聚为一个子分支(图5)。
2.4 水稻恶苗病病菌对9种化学药剂的敏感性测定
水稻恶苗病病菌对9种化学药剂的敏感性测定结果见表3。敏感性从大到小依次为苯醚甲环唑、戊唑醇、咪鲜胺、多菌灵、咯菌腈、丙硫菌唑、肟菌酯、福美双、氰烯菌酯。但所测试的9种常用化学药剂中,水稻恶苗病病菌对氰烯菌酯、咪鲜胺和咯菌腈的抗药性水平表现较为明显,平均抗性倍数从高到低依次为730.16、326.73、107.27,为高抗水平。对戊唑醇和丙硫菌唑的抗性倍数分别为13.26、10.37,属于中等抗性水平;对苯醚甲环唑、多菌灵的抗性倍数低于10,为低抗性水平;肟菌酯用于防治水稻恶苗病的效果不是很好,报道很少。
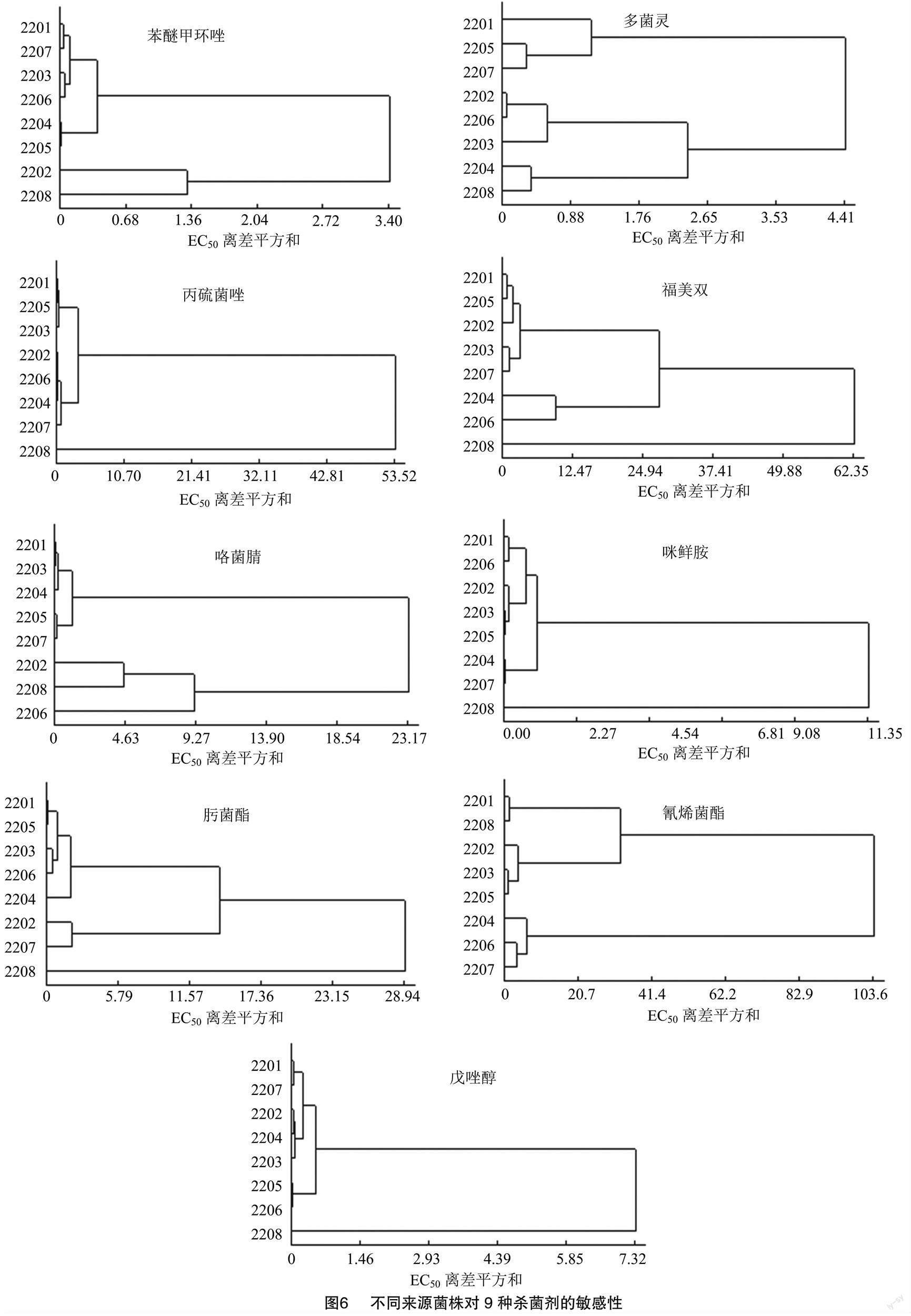
2.5 不同地理来源菌株对9种杀菌剂敏感性水平的系统聚类分析
由图6可知,不同地区病原菌对苯醚甲环唑的敏感性可分为3个组别,其中2201、2207、2203、2206、2204、2205组成第1个聚类组,2202组成第2个聚类组,2208组成第3个聚类组。3个聚类组中菌株数分别占供试菌株数的75.0%、12.5%、12.5%,其中多数菌株分布在第1个聚类组中,表明不同来源的水稻恶苗病病菌对苯醚甲环唑的敏感性相似。
不同地区病原菌对丙硫菌唑的敏感性可分为2个组别,其中2201、2205、2203、2202、2206、2204、2207组成第1个聚类组,2208组成第2个聚类组,2个聚类组中菌株数分别占供试菌株数的87.5%和12.5%,其中多数菌株分布在第1个聚类组中,表明不同来源的水稻恶苗病病菌对丙硫菌唑的敏感性相似。
不同地区病原菌对多菌灵的敏感性可分为3个组别,其中2201、2205、2207组成第1个聚类组,2202、2206、2203组成第2个聚类组,2204、2208组成第3个聚类组,3个聚类组中菌株数分别占供试菌株数的37.5%、37.5%、25.0%,供试菌株在3个聚类组中分布较均匀,表明不同来源的水稻恶苗病病菌对多菌灵的敏感性差距较大。
不同地区病原菌对福美双的敏感性可分为3个组别,其中2201、2205、2202、2203和2207组成第1个聚类组,2204、2206组成第2个聚类组,2208组成第3个聚类组。3个聚类组中菌株数分别占供试菌株数的62.5%、25.0%、12.5%,供试菌株多分布于第1个聚类组中,表明不同来源的水稻恶苗病病菌对福美双的敏感性相似。
不同地区病原菌对咯菌腈的敏感性可分为3个组别,其中2201、2203、2204、2205、2207组成第1个聚类组,2202、2208组成第2个聚类组,2206组成第3个聚类组。3个聚类组中菌株数分别占供试菌株数的62.5%、25.0%、12.5%,供试菌株多分布于第1个聚类组中,表明不同来源的水稻恶苗病病菌对咯菌腈的敏感性相似。
不同地区病原菌对咪鲜胺的敏感性可分为2个组别,其中2201、2206、2202、2203、2205、2204、2207组成第1个聚类组,2208组成第2个聚类组,2个聚类组中菌株数分别占供试菌株数的87.5%、12.5%,供试菌株较集中分布于第1个聚类组中,表明不同来源的水稻恶苗病病菌对咪鲜胺的敏感性相似。
不同地区病原菌对氰烯菌酯的敏感性可分为3个组别,其中2201、2208组成第1个聚类组,2202、2203、2205组成第2个聚类组,2204、2206、2207组成第3个聚类组,3个聚类组中菌株数分别占供试菌株数的25.0%、37.5%、37.5%供试菌株在3个聚类组中均有相当数量分布,表明不同来源的水稻恶苗病病菌对氰烯菌酯的敏感性差距较大。
不同地区病原菌对肟菌酯的敏感性可分为3个组别,其中2201、2205、2203、2206、2204组成第1个聚类组,2202、2207组成第2个聚类组,2208组成第3个聚类组,3个聚类组中菌株数分别占供试菌株数的62.5%、25.0%、12.5%,供试菌株主要集中在第1个聚类组中,表明不同来源的水稻恶苗病病菌对肟菌酯的敏感性相似。
不同地区病原菌对戊唑醇的敏感性可分为2个组别,其中2201、2207、2202、2204、2203、2005、2006组成第1个聚类组,2208组成第2个聚类组,2个聚类组中菌株数分别占供试菌株数的87.5%、12.5%,供试菌株主要集中在第1个聚类组中,表明不同来源的水稻恶苗病病菌对戊唑醇的敏感性相似。
3 结论与讨论
水稻恶苗病能够导致植株徒长、死亡,产量和品质降低,因此该病害一直是水稻生产上重点关注的对象[14-15]。调查发现,发病早的植株节间明显伸长,叶片变黄,下部茎节逆生不定须根,分蘖少或不分蘖,植株干枯死亡,叶鞘上有粉色或白色霉层;发病晚的,有些植株没有明显增高,但叶片发黄、茎秆上有褐色条斑,叶片批张度大,植株下部茎节有倒生须根。有的植株虽然看上去生长正常,没有表现症状,但下部茎节有倒生须根,已有菌丝潜伏,该水稻植株收获的种子也携带了病原菌,发病植株携带的孢子进行传播引起再侵染,往往谷粒无明显发病症状,但种子内部已携带病原菌,这与人们所认知的田间症状差异较大。
水稻恶苗病作为一种重要的水稻种传病害,对于其致病菌国内外学者进行了大量研究,认为水稻恶苗病病原菌为藤仓赤霉复合种内的3种镰刀菌,分别为藤仓镰刀菌、层出镰刀菌、拟轮枝镰刀菌,其中藤仓镰刀菌为致病的优势种群[16-18],本研究结果与之一致。目前对于病原菌进行鉴定往往需要十分准确的方法,传统的形态学方法存在很大的不确定性,容易造成误判,因此只能作为鉴定的初步参考[11]。而借助于分子鉴定和系统发育树的鉴定方式已广泛应用于植物病原菌,目前对于镰刀菌属的鉴定使用最多的是基于TEF1-α序列特征的分子鉴定及系统发育分析[19]。本研究借助于 TEF1-α 序列分析,结合形态学与生物学特征将8种不同地区采集的水稻恶苗病病原菌进行的精确鉴定,并且通过构建系统发育树将其分为2个不同分支,8株供试菌株均为藤仓镰刀菌(F. fujikuroi)。
针对近年来水稻生产上出现的抗药性问题,特别是水稻恶苗病病菌产生的抗药性,合理选择药剂和定期更换药剂是科学防治的关键[20-21]。 近几年,生产上多数采用氰烯菌酯、咯菌腈、咪鲜胺等药剂进行水稻种子处理[22-23],其在使用初期防效较好因此受到了大面积推广,但随着长时间不断地单一用药,有研究结果对此发出了预警,提示水稻恶苗病对氰烯菌酯和咯菌腈存在一定的抗性风险,在水稻生产中应當给予足够的重视[10]。肟菌酯作为一种甲氧基丙烯酸酯类杀菌剂,其在生产上应用较少,因此其抗性倍数尚不明确。本研究结果表明,天津地区水稻恶苗病病菌对以上3种药剂产生了严重的抗药性,3种化学药剂的抗性倍数分别为730.16、107.27、326.73,其中对氰烯菌酯的抗药性最高,致使种子上存在的水稻恶苗病病菌没有被有效控制;又由于2022年天津地区的特殊气候条件,移栽后遇上连续高温,同时农户于水稻分蘖期进行烤田(当土温在30~35 ℃,利于该病发生),致使该病严重发生并进行多次侵染循环。另外,通过不同地区供试菌株对化学药剂的敏感性分析,9种药剂苯醚甲环唑、丙硫菌唑、多菌灵、福美双、咯菌腈、咪鲜胺、氰烯菌酯、肟菌酯、戊唑醇对水稻恶苗病病菌菌株的EC50由低到高分别可分成3、2、3、3、3、2、3、3、2个聚类组,水稻恶苗病病菌对多菌灵、氰烯菌酯的敏感性地区性差异较大,而对其他试验药剂的敏感性地区性差异较小。此种差异的存在可能是由于不同水稻品种自身原因产生的,也可能与不同的水稻田间管理、气候条件与施药方式有关,另外在水稻生产上育种家没有针对恶苗病进行品种筛选,因此造成该病在天津地区大面积发生。
针对天津地区水稻恶苗病发病特点及对几种化学药剂的敏感性分析提出以下几点建议:(1)选用优良抗病品种,避免使用易感病品种。(2)对田间发现的发病植株及时进行清理。(3)播种前进行种子带菌率检测及每年进行病原菌抗药性监测,进行预测预报。(4)化学药剂使用方面,近1~2年内停止使用氰烯菌酯、咪鲜胺、咯菌腈,建议使用戊唑醇、苯醚甲环唑、丙硫菌唑、多菌灵、福美双等化学药剂,交替、轮换使用,避免连续、单一用药,或者用四霉素、乙蒜素这类植物杀菌剂,进行种子处理或药剂喷施,注意轮换使用,以降低水稻恶苗病对水稻生产造成的损失。
参考文献:
[1]张春云,卢 毅,张 桥,等. 不同药剂·方法和时间浸种对水稻恶苗病的防治效果[J]. 安徽农业科学,2014,42(9):2590-2592.
[2]季芝娟,曾宇翔,梁 燕,等. 水稻恶苗病抗性研究进展[J]. 中国水稻科学,2021,35(1):1-10.
[3]何富刚,颜范悦,辛万民,等. 水稻恶苗病菌抗药性的产生及防除[J]. 辽宁农业科学,1994(3):12-14.
[4]陈夕军,卢国新,童蕴慧,等. 水稻恶苗病菌对三种浸种剂的抗性及抗药菌株的竞争力[J]. 植物保护学报,2007,34(4):425-430.
[5]许 媛,肖 婷,褚姝频,等. 江苏省句容市葡萄炭疽病菌多样性及对苯并咪唑类杀菌剂的抗药性分析[J]. 南京农业大学学报,2022,45(1):78-85.
[6]刘永锋,陈志谊,周保华,等. 江苏省部分稻区恶苗病菌对水稻浸种剂的抗药性检测[J]. 江苏农业学报,2002,18(3):190-192.
[7]周华飞,杨红福,陈宏州,等. 江苏镇江地区水稻恶苗病菌分离鉴定与对咪鲜胺的抗性分析[J]. 西南农业学报,2019,32(2):337-341.
[8]陈尤嘉. 氰烯菌酯浸种对水稻恶苗病的防效及安全性调查[J]. 中国植保导刊,2014,34(7):79-81.
[9]徐 瑶. 水稻恶苗病菌对咪鲜胺敏感性分析与药剂防治研究[D]. 大庆:黑龙江八一农垦大学,2015.
[10]Hou Y P,Qu X P,Mao X W,et al. Resistance mechanism of Fusarium fujikuroi to phenamacril in the field[J]. Pest Management Science,2018,74(3):607-616.
[11]陈宏州,杨红福,姚克兵,等. 水稻恶苗病病原菌鉴定及室内药剂毒力测定[J]. 植物保护学报,2018,45(6):1356-1366.
[12]张广志,张新建,陈 泉,等. 哈茨木霉复合种内3个中国新记录种的分离和鉴定[J]. 山东科学,2015,28(6):43-46,51.
[13]Kumar S,Stecher G,Li M,et al. MEGA X:molecular evolutionary genetics analysis across computing platforms[J]. Molecular Biology and Evolution,2018,35(6):1547-1549.
[14]Singh R,Kumar P,Laha G S. Present status of bakanae of rice caused by Fusarium fujikuroi Nirenberg[J]. Indian Phytopathology,2019,72(4):587-597.
[15]Hossain K S,Mia M,Bashar M A. Management of bakanae disease of rice[J]. Bangladesh Journal of Botany,2018,44(2):277-283.
[16]Wulff E G,Srensen J L,Lübeck M,et al. Fusarium spp. associated with rice bakanae:ecology,genetic diversity,pathogenicity and toxigenicity[J]. Environmental Microbiology,2010,12(3):649-657.
[17]Singh R,Sunder S,Kumar P,et al. Study of bakanae disease of rice in Haryana[J]. Plant Disease Research,2018,33(1):15-22.
[18]李風顺,乔俊卿,张荣胜,等. 防治水稻恶苗病拮抗细菌的筛选、鉴定和评价[J]. 江苏农业学报,2022,38(4):907-914.
[19]陈子豪. 藤仓镰孢菌对多菌灵抗药性分子机制及检测方法研究[D]. 南京:南京农业大学,2014:17-32.
[20]陈宏州,杨红福,饶鸣帅,等. 水稻恶苗病防治药剂效果评价[J]. 中国农学通报,2018,34(33):140-146. [HJ2mm]
[21]Choi H W,Lee Y H,Hong S K et al. Monitoring for the resistance to prochloraz of Fusarium species causing bakanae disease in Korea[J]. The Korean Journal of Mycology,2015,43(2):112-117.
[22]刘禹含,邹佳营,何 博,等. 吉林省水稻恶苗病菌对咯菌腈的敏感性及抗药性风险评估[J/OL]. 吉林农业大学学报,(2020-09-16)[2023-01-03]. DOI:10.13327/j.jjlau.2020.5228.
[23]徐 瑶,李 鹏,刘洪亮,等. 水稻恶苗病菌对咪鲜胺的敏感性及生物学特性的研究[J]. 黑龙江八一农垦大学学报,2016,28(3):12-16,55.
