肿瘤相关巨噬细胞在结直肠癌发展及治疗和预后中的作用
2023-02-24王文锐杨清玲陈昌杰
魏 可,王文锐,杨清玲,陈昌杰
结直肠癌(Colorectal cancer,CRC)是一种进行性癌症,其增殖、迁移和转移过程十分复杂,涉及诸多因素和信号通路,死亡率居高不下。肿瘤微环境(tumor microenvironment,TME)是由各种细胞以及其分泌的蛋白质、细胞因子、趋化因子和外泌体等组成的独特体系[1]。TME中的巨噬细胞即为肿瘤相关巨噬细胞(tumor-associated macrophage,TAMs),是TME最主要的免疫细胞。越来越多研究发现,TAMs具有肿瘤促进作用,然而其在CRC中的作用及其机制尚不完全清楚,因此,我们有必要就TAMs的来源、表型极化及其在CRC TME中的作用及其机制进行综述,探讨针对TAMs的相关免疫治疗CRC的策略,总结不同亚型的TAMs对CRC的预后评估价值,从而为临床治疗CRC提供新思路。
1 TAMs
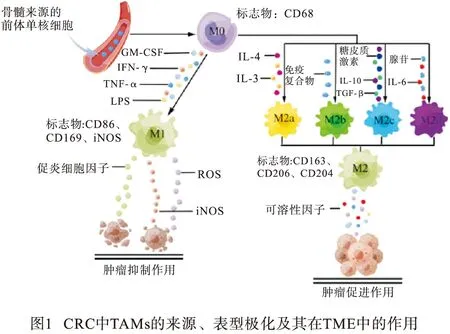
TAMs是高度异质性巨噬细胞,其表型和功能具有可塑性。在肿瘤中,巨噬细胞主要起源于骨髓前体细胞分化的单核细胞(M0型TAMs)。单核细胞迁移出血管后可诱导为M1型TAMs(由经典途径激活)和M2型TAMs(由替代途径激活)[2]。通常,使用不同的标志物来鉴定CRC中的TAMs,包括最常见的泛TAMs标志物CD68;M1型TAMs标志物,如一氧化氮合酶(inducible nitric oxide synthase,iNOS)、CD86和CD169;M2型TAMs标志物,如CD163、CD206和CD204。作为TME的一员,TAMs的生物活性会受到TME中不同化学物质的影响。TME中的干扰素-γ(interferon-γ,IFN-γ)、脂多糖(lipopolysaccharide,LPS)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)等可诱导M1型TAMs活化[3-4]。活化的M1型TAMs分泌iNOS、活性氧(reactive oxygen species,ROS)和促炎细胞因子如白细胞介素(interleukin,IL)-6、 IL-12、TNF-α[5-8]等,使M1型TAMs能够杀死病原体并引发抗肿瘤免疫反应。然而,TME中的某些物质也可诱导 M2型TAMs活化,根据不同的活化物质,可将M2型TAMs进一步分为四种不同的亚型,即M2a(由IL-4、IL-13诱导)、M2b(由免疫复合物诱导)、M2c[由IL-10、转化生长因子β (transforming growth factor β,TGF-β)和糖皮质激素诱导]和M2d(由IL-6和腺苷诱导)[9]。活化的M2型TAMs可分泌可溶性因子,如IL-6、TGF-β1、血管内皮生长因子(vascular endothelial growth factor,VEGF)、精氨酸酶1、C-C基序趋化因子(C-C motif chemokine,CCL)22、趋化因子(chemokine,CXCL)12和CXCL13等发挥肿瘤促进作用[10-15],具体分泌的可溶性因子及促肿瘤结果见表1。事实上,巨噬细胞的极化状态是非常复杂的,有的巨噬细胞同时具有M1和M2的特征。但在CRC TME中的TAMs主要表现为M2型,通过促进CRC血管生成、转移、改变CRC耐药性和促进CRC免疫逃逸等发挥促肿瘤作用。CRC中TAMs的来源、表型极化及其在TME中的作用见图1。

表1 TAMs分泌的可溶性因子及其各种促肿瘤结果
2 TAMs在CRC中的促进作用
TAMs作为TME中最主要的免疫细胞之一,在CRC发生和发展扮演了关键性角色,下文将通过介绍TAMs促进血管生成、转移、改变CRC耐药性和促进CRC免疫逃逸等抗肿瘤免疫反应的作用,来探讨TAMs参与CRC发生发展的机制。
2.1 TAMs促进CRC血管生成 癌症的生长和转移依赖于血管生成,其为癌细胞供应氧和营养。有研究[16]表明,在CRC细胞周围TAMs浸润的密度与新生血管程度呈正相关。肿瘤血管的生成往往是由肿瘤缺氧所引起的,此时TAMs被招募到缺氧区,TAMs分泌的诸多细胞因子,如VEGF、IL-1、IL-8、TNF-α和基质金属蛋白酶 (matrix metalloproteinases,MMPs),这些细胞因子通过对缺氧信号做出反应,从而促进CRC中的内皮细胞产生新血管[17-18]。TAMs分泌的具有促进血管生成的MMPs,主要是MMP-2和MMP-9,通过降解细胞外基质(extracellular matrix,ECM)和基底膜,使包括VEGF在内的促血管生成因子诱发内皮细胞产生迁移并启动血管生成。此外,高表达血管生成素受体TIE2的TAMs,可使TAMs聚集在肿瘤血管周围,从而使血管生成的活性增强[19]。由此可见,TAMs参与肿瘤的血管生成,并发挥重要的促进作用。
2.2 TAMs促进CRC转移 肿瘤细胞的侵袭和远处转移是肿瘤病人死亡的主要原因。TAMs对CRC转移的促进作用可体现在以下两方面。一方面是TAMs分泌蛋白质、细胞因子、趋化因子和外泌体等直接促进CRC转移。如极化的M2型TAMs通过分泌CXCL13和VEGF来诱导前转移生态位形成并促进CRC肝转移[10,15]。另一方面,上皮-间充质转化(epithelial-mesenchymal transition,EMT)和ECM重塑是促进肿瘤转移的重要影响因素,TAMs通过影响EMT和ECM间接促进CRC转移。如TAMs 分泌的TGF-β1和IL-6诱导CRC细胞的EMT,促进CRC转移[13-14];研究者进一步探究发现TAMs分泌的IL-6通过激活JAK2 / STAT3途径诱导EMT的形成,这不仅增强CRC细胞的迁移和侵袭能力,也会促使CRC细胞分泌CCL2,促进TAMs募集,在CRC细胞与TAMs相互作用之间形成正反馈回路[20]。可见,TAMs所释放的因子能引起CRC细胞EMT,并因而促进CRC侵袭。ECM已成为了肿瘤细胞转移的重要支架和屏障,其降解能力已成为了癌症转化研究中的重点。此外,TAMs产生的蛋白水解酶,如MMPs、组织蛋白酶和丝氨酸蛋白酶,这些酶可介导ECM的降解和重塑从而促进肿瘤细胞的迁移。TAMs分泌的MMP-9可降解ECM蛋白,最终增强CRC细胞的侵袭能力[21]。可见,TAMs在促进CRC转移方面发挥着至关重要的作用。
2.3 TAMs改变CRC耐药性 TAMs的浸润程度与CRC病人的化学耐药性相关。首先,TAMs可通过分泌某些物质调节CRC细胞耐药性。例如,在某些刺激下TAMs产生的腐胺,可拮抗化疗药物5-氟尿嘧啶对CRC细胞的杀伤作用[22]。其次,TAMs可通过调节某些信号通路改变CRC耐药性。如M2型TAMs分泌的CCL22可活化PI3K/AKT通路降低5-氟尿嘧啶对CRC细胞迁移和侵袭的抑制作用[11]。最后,有证据显示CRC的耐药性与肿瘤血管生成相关。有研究[23]称TAMs分泌的VEGF可促进CRC血管生成,然而新形成的肿瘤血管通透性大,导致对化疗药物的传递效果差,从而增强了CRC细胞的耐药性。此外,有研究发现TAMs可通过调节免疫微环境参与肿瘤耐药,且其可通过与肿瘤干细胞相互作用参与肿瘤耐药。如在TME中IL-33可诱导表达IL-33受体的TAMs积累和分化,并且这些TAMs产生TGF-β,进而促进肿瘤干细胞侵袭和耐药[24]。由此可见,TAMs在CRC细胞耐药中发挥着关键作用,TAMs可作为CRC治疗的靶点,增加癌细胞对其化疗药物的敏感度,以提高CRC的治愈率。
2.4 TAMs促进CRC免疫逃逸 越来越多研究表明,TAMs通过各种机制直接或间接地使T细胞失活参与肿瘤免疫逃逸过程。TAMs的初始作用是通过呈递肿瘤抗原,产生某些因子激活T细胞从而发挥CRC抑制作用。然而,受TME的影响TAMs可释放的某些物质间接抑制T细胞的抗肿瘤作用。如TAMs释放的精氨酸酶1可抑制CD8 T细胞毒性[12];作为细胞之间的通讯媒介,有研究[25]发现M2型TAMs衍生的外泌体,其包含的miR-155-5p通过促进肿瘤细胞中IL-6的表达,从而抑制T细胞免疫应答。此外,在TAMs表面高度表达的程序性死亡受体1(programmed cell death protein -1,PD-1)和细胞毒性T淋巴细胞相关蛋白4,通过与T细胞上的PD-1和CD80/CD86结合直接抑制T细胞对癌细胞的杀伤作用,最终引起癌细胞免疫逃逸。已有研究[26-27]发现TAMs分泌的TGF-β和前列腺素E2通过抑制T细胞活性和增强程序性死亡受体-配体1(programmed cell death protein-ligand 1,PD-L1)的表达介导TME中CRC的免疫逃逸。并且,在TAMs表面表达的同源免疫检查点配体:含V结构域免疫球蛋白的 T细胞活化抑制因子,通过减少T细胞增殖活性促进肿瘤免疫逃逸[28]。简而言之,TAMs通过分泌抗炎细胞因子和外泌体以及表达相关配体和同源免疫检查点配体促进CRC免疫逃逸。
3 针对TAMs的相关免疫治疗策略
基于TAMs在CRC抗肿瘤免疫过程中发挥的作用,现阶段的研究热点越来越倾向于针对TAMs的相关免疫治疗策略,这些治疗策略大致可分为:抑制TAMs的募集和极化、重极化TAMs和免疫治疗中靶向TAMs。
3.1 抑制TAMs的募集和极化 在TME中促使TAMs的募集和极化的因素很多。首先,TAMs来源于循环单核细胞,其主要依赖于CCL2-CCR2信号传导轴从骨髓迁移并招募到TME。因此,可通过使用CCL-2抗体、CCR2拮抗剂或某些物质阻断或干扰CCL2-CCR2信号传导轴来减少肿瘤原发部位和转移部位TAMs的数量,从而抑制肿瘤进展。如CCR2拮抗剂CCX872通过阻断CCL2-CCR2轴,有效减少TME中TAMs数量[29]。其次,集落刺激因子-1(colony stimulating factor 1,CSF-1)及其相关受体(colony stimulating factor 1 receptor,CSF-1R)形成的CSF1-CSF1R信号轴以及CXCL12-CXCR4信号轴参与TAMs的募集。如通过建立小鼠模型发现在肿瘤小鼠体内使用CSF-1抑制剂可使TAMs极化为抗肿瘤表型,并且CSF-1R的缺失会导致小鼠体内几乎所有的TAMs被消耗,从而发挥抗肿瘤作用[30-31]。除此之外,体内体外的某些物质可通过调节TAMs的极化抑制CRC细胞迁移[32-34]。如从甜瓜花梗中提取葫芦素B与STAT3结合阻止JAK2和STAT3磷酸化,阻断JAK2 / STAT3信号传导来抑制M2型TAMs的极化,从而减弱CRC细胞增殖和迁移能力[33]。由此可见,可通过多种途径抑制TAMs的募集和极化从而达到CRC治疗效果。
3.2 重极化TAMs TME中的TAMs主要是M2型,具有很强的促肿瘤作用。由于TAMs的可塑性,许多研究者就有了对TAMs进行再塑的想法,即将TAMs从具有促肿瘤作用的M2型重新极化为具有肿瘤杀伤作用的M1型。由于TME的复杂性,其中存在重极化TAMs的多种物质,包括蛋白质、细胞因子、趋化因子和外泌体等,均可作为临床治疗的潜在靶点。如肿瘤细胞衍生的外泌体miR-130和miR-33通过将TAMs从M2型转变为M1型来减缓肿瘤的进展[35]。另外,在TME中许多信号通路的激活在M2型TAMs极化中扮演了关键角色,因此以这些信号通路作为靶点使M2型TAMs重极化成为治疗的可能。如ZHAO等[36]研究发现,西妥昔单抗激活的NF-κB和STAT3通路可降低IL-6的表达,从而使TAMs从M2型重新极化为M1型。除此之外,近些年纳米复合物在靶向TAMs的治疗中也有一些进展。HAN等[37]研究发现,一种靶向M2型TAMs的纳米复合物可有效逆转TAMs表型,并活化T细胞重塑肿瘤微环境,抑制肿瘤细胞活性。由此可见,通过重极化TAMs对CRC进行治疗有很大的潜力。
3.3 免疫治疗中靶向TAMs 在CRC的抗肿瘤疗法中,免疫疗法已经是相当广泛而有效的手段,主要有免疫检查点抑制剂、过继细胞疗法和自体肿瘤疫苗[38]。首先,免疫检查点抑制剂,通常包括PD-1和PD-L1抗体,其通过干扰T细胞与肿瘤细胞或抗原的提呈细胞上相应的配体,如PD-1/PD-L1结合从而产生肿瘤抑制作用。如有研究者[39]通过建立小鼠模型发现,CD30L通过抑制TAMs表达PD-L1,从而促进CD30效应T细胞介导的抗肿瘤免疫应答,抑制CRC的进展。在针对TAMs的CRC疗法中PD-1/PD-L1免疫治疗常采用联合治疗。如多种受体酪氨酸激酶抑制剂福瑞替尼和抗PD-1的抗体联合治疗,不仅增加了T细胞的浸润,而且降低了TAMs的比例,也阻止TAMs向M2型TAMs的极化,最终重塑了TME,促进抗肿瘤免疫[40]。其次,对于过继细胞疗法,已经验证了肿瘤定向抗间皮素嵌合抗原受体T细胞和M2型TAMs抑制剂组合的抗肿瘤效率,并且正在研究基于其特异性标志物(如CD40)的TAMs相关过继细胞治疗[41]。最后,还有研究者在稳定表达卵清蛋白肽的细胞模型中发现,卵清蛋白肽疫苗可降低CRC组织中TAMs的密度,从而限制肿瘤的生长,而血管内皮生长因子C及其受体(VEGFC/VEGFR3)通路使中和抗体的补充可进一步抑制 M2型TAMs对 CRC 组织的趋化性,防止CRC免疫逃逸[42]。
4 TAMs与CRC预后
在CRC发生发展中,TAMs的作用十分复杂,并且越来越多研究发现,TAMs与CRC病人预后相关。有研究者称TAMs与更好的CRC病人预后相关,另一些研究者认为,TAMs与不良预后相关。TAMs与CRC病人预后的相关文献汇总见表2。
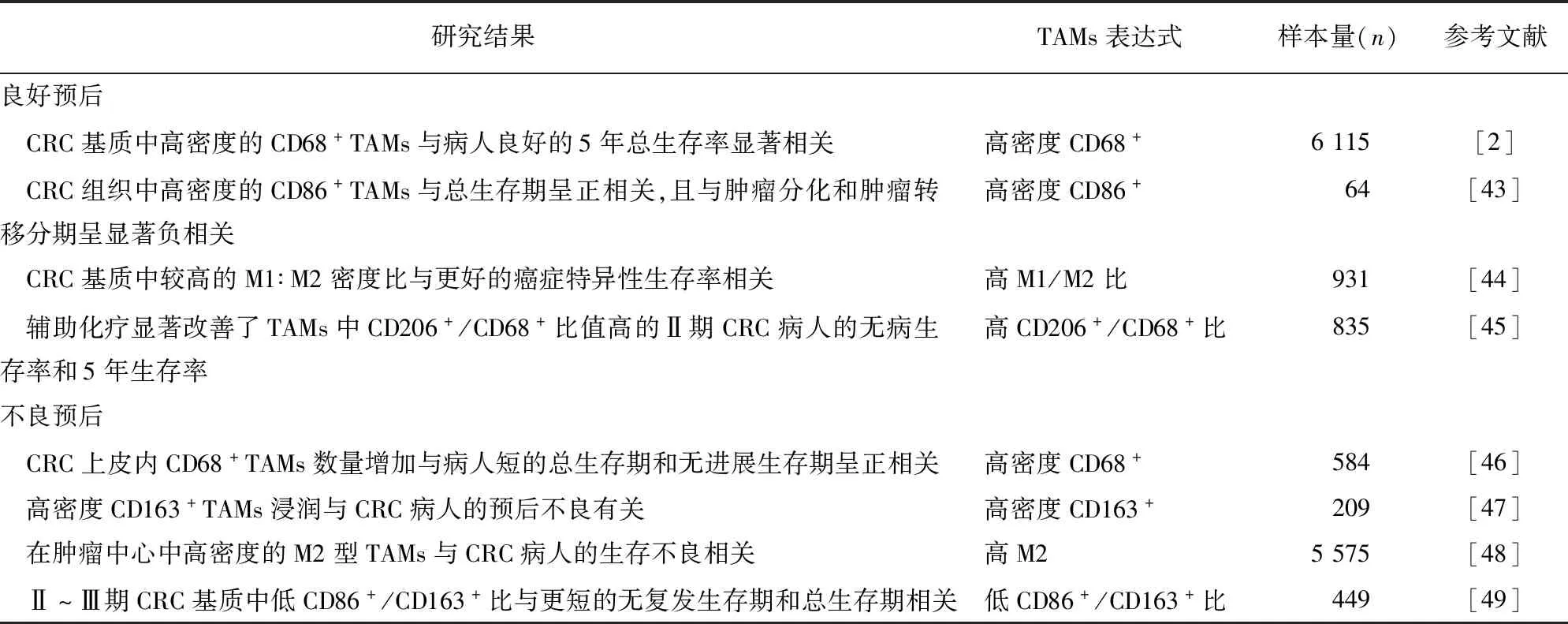
表2 TAMs与CRC病人预后的相关文献报道
不同类型和位置的TAMs对CRC病人具有不同的预后意义。有研究[2]发现,CD68作为泛TAMs的表面标志物,在CRC基质中高密度的CD68+TAMs与良好预后相关;而在CRC上皮内CD68+TAMs数量增加却与不良预后相关[46]。可见,TAMs总密度并不能作为CRC的预后评估,而TAMs的不同极化状态表现出不同的预后作用。如CRC组织中高密度的CD86+TAMs与总生存期呈正相关,且与肿瘤分化和肿瘤转移分期呈显著负相关[43];而高密度的CD163+TAMs和M2型TAMs与病人不良预后相关[47]。另外,不同亚型的TAMs比值对CRC预后也有预测价值。有研究发现,CRC基质中较高的M1∶M2密度比与更好的癌症特异性生存率相关[44];而低CD86+/CD163+比与CRC病人更短的无复发生存期和总生存期相关[49];并且,对于Ⅱ期CRC,CD206+/CD68+比值可作为术后辅助化疗的更好预后和预测性生物标志物[45]。这些发现表明,是不同亚型的TAMs及其比值,而不是其总体密度,可作为CRC的预测性生物标志物和预后危险因素。
5 展望
TAMs作为TME的重要组成部分,在CRC的发展过程中扮演了关键角色。通过探讨针对TAMs的相关免疫治疗CRC的策略,看到了治疗CRC的曙光,如抑制TAMs的募集和极化、重极化TAMs和免疫治疗中靶向TAMs。然而,许多化疗药物难溶于水,达不到预期治疗效果,用高分子材料包裹这些化疗药物并制备成纳米颗粒,可显著提高药物水溶性。由于TAMs主要来源于骨髓前体细胞分化的单核细胞,并且TAMs具有很强的吞噬作用,可吞噬进入体内的纳米颗粒,因此TAMs可作为抗肿瘤药物输送系统的载体,以提高药物对癌细胞的杀伤作用。另外在治疗过程中也存在许多新的挑战:首先,研究者们对靶向TAMs的治疗的研究还停留在小鼠实验阶段,然而小鼠和人巨噬细胞有很大差异,需要思考解决小鼠实验向人体实验转化的问题;其次,巨噬细胞在维持体内平衡方面具有重要作用,抑制TAMs的募集可能导致体内感染风险增加或组织驻留细胞执行其正常功能的能力受损;最后,TME中TAMs募集和极化的机制尚不完全清楚,并且TME十分复杂,单靠TAMs介导的抗肿瘤药物的递送进行治疗不足以根除肿瘤。
