幽门螺杆菌感染相关胃癌组织蛋白质组特征研究
2023-02-21孙佳萌黄永胜孙海丹郭正光康维明
孙佳萌,刘 震,黄永胜,孙海丹,郭正光,康维明*,孙 伟*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系,北京100005;2.中国医学科学院 北京协和医学院 基本外科,北京100730)
幽门螺杆菌(Helicobacterpylori,H.pylori,Hp)是一种螺旋形、革兰染色阴性,微需氧、鞭毛状的细菌,能够形成生物膜,并可以从螺旋状转化为球状[1]。Hp 感染是胃癌发生的重要危险因素之一,感染Hp的患者发生胃癌的风险比未感染者高3倍左右,胃癌患者Hp阳性率为75%-95%[2-3]。世界卫生组织(WHO)已将 Hp归类为 “I类”致癌因子[4]。但在一些情况下,在胃癌患者中未发现任何关于Hp感染的证据,这就提示在胃癌中存在Hp阴性胃癌[5]。
王炯等[6]通过对现有有关Hp阴性胃癌的研究成果进行总结分析后发现,与Hp阳性胃癌相比,Hp阴性胃癌患者的肿瘤恶行程度更高,预后更差。同样地,TSAI等[5]通过回顾性分析Hp阳性与Hp阴性的胃癌案例,发现Hp阴性胃癌患者的预后较差,且Hp阴性状态是胃癌预后不良的独立危险因素。但也有研究指出Hp的感染能够通过影响某些RNA的表达而促进肿瘤的发生发展,进而影响患者的预后情况[7]。目前关于不同Hp感染状态胃癌的研究还很少,还缺乏对二者差别的相关组学分析。
肿瘤异质性是恶性肿瘤的主要特征之一,可使肿瘤的生长速度、侵袭与转移、药物敏感性、预后等各方面产生差异。肿瘤异质性包括瘤内异质性和瘤间异质性,其组织病理学特征不同,分子特征也各异,其已知胃癌具有高度的肿瘤间异质性[8-9],但胃癌的瘤内异质性研究相关报道还很少。
近年来,组学及相关技术迅速发展,在临床生物学的研究中逐渐得到了广泛的应用。蛋白质组学以蛋白质组为研究对象,研究细胞或组织中蛋白质的组成变化及规律,是理解基因功能的重要方法之一[10]。基于质谱的高通量和高精度蛋白质组学技术的飞速发展使得蛋白质组学在肿瘤研究中得到广泛研究,目前已应用于胃癌[11-12]等癌症疾病的研究。
目前,对于胃癌的肿瘤异质性和Hp感染相关胃癌的蛋白质组学报道很少。本研究将通过最新的蛋白质组学方法,分析胃癌肿瘤异质性以及Hp阳性与Hp阴性胃癌蛋白质组差异,将有助于了解与Hp相关胃癌的蛋白质组特征,为今后寻找更高敏感性和特异性的新的治疗方法、提高患者的生存率提供了新的途径和思路。
1 材料与方法
1.1 材料
试剂:十二烷基硫酸钠(SDS,USB公司),三羟甲基氨基甲烷(Tris,拜尔迪公司),二硫苏糖醇(DTT,INALCO SpA公司),碘乙酰胺(IAM,拜尔迪公司),丙酮(分析纯,国药集团化学试剂公司),胰蛋白酶(Trypsin,华利世科技公司),水(质谱级)
研究对象:选取2019年就诊于北京协和医院的胃癌受试者,通过C13呼气实验和病理切片HE染色确认胃癌患者Hp的感染状态,选取Hp阳性患者和Hp阴性患者各1例,经外科手术切除肿瘤组织,收集患者的肿瘤组织不同部位标本各3个,相应地在距离肿瘤位置大约5 cm处取癌旁组织不同部位各3个,将采集的组织样本存放于-80℃冰箱冷冻保存。参与本研究的患者均签署知情同意书。
1.2 方法
1.2.1蛋白质提取和酶解 取组织样本剪碎后加入裂解液(2% SDS,20 mM Tris,pH 8.0),经超声助溶后离心去除未溶解的组织碎片。取200 μg蛋白质依次进行还原烷基化,加入工作浓度为10 mM DTT,95℃孵育5 min,降至室温后加入工作浓度为55 mM IAM,室温避光放置45 min,对暴露出来的巯基进行封闭。采用6倍体积的预冷丙酮对还原烷基化后的蛋白质进行沉淀,经14 000 g离心10 min后,弃去上清,在沉淀中加入20 mM Tris对纯化的蛋白质进行复溶。将蛋白质转移到经过平衡后的30 kDa超滤膜内套管中,酶解用FASP方法(Filter-aided sample preparation),胰蛋白酶酶解后肽段产物经SPE小柱纯化,取等量肽段分别加入1 μl的质谱时间校正肽段iRT进行后续液质串联检测分析。
1.2.2高效液相色谱-串联质谱检测 利用液-质联用仪器对于临床组织样本蛋白质的酶解产物进行差异蛋白质分析,每个反应上样量为2 μg 肽段。高效液相色谱分析采用Easy-nLC 1000 (Thermo Fisher Scientific公司),液相程序60 min,流速为 800 nl/min。A相成分是含0.1% FA的水溶液,B相成分是含0.1% FA 的乙腈溶液。液相有效分离梯度设置如下:1 min B相浓度从2%升至6% B;16 min B相浓度从6%升至10% B;23 min B相浓度从10%升至20% B;8 min B相浓度从20%升至28% B;5 min B相浓度从28%升至95% B。蛋白质组学分析采用Orbitrap Fusion Lumos质谱仪(Thermo Fisher Scientific公司),采集模式为阳离子模式,喷雾电压设置为 2.3 kV,离子传输管温度为 320℃。采用非依赖性数据采集方式(Data Independent Acquisition,DIA),设置13个质量扫描区段,一级质谱质荷比的扫描范围350-1300,分辨率为120000,自动增益控制AGC参数为3e6,最大离子注入时间30 ms,二级质谱分辨率为30000,自动增益控制AGC参数为1e5,最大离子注入时间为45 ms。质量隔离窗口为4Da,碰撞能量参数设置为23%,离子动态排除时间为30 ms。
1.2.3质谱数据分析和统计学处理 原始数据(raw格式文件)采用Spectronaut软件(Biognosys公司)构建谱图数据库,并对样本进行定量分析,检索数据库选用自2019年Uniprot 上下载的 human 数据库。差异蛋白质的筛选标准为:差异倍数(Fold Change)为2倍,同时满足p value≤ 0.05。对于筛选出的差异蛋白质采用Ingenuity Pathway Analysis(IPA,Biotech公司)软件进行生物学功能分析。对质谱数据库进行质谱检索后由Spectronaut软件进行统计学分析。用两独立样本ttest检验。以 p value ≤0.05为差异有统计学意义。
2 结果
收集Hp阳性和阴性胃癌患者的肿瘤及癌旁组织各1例,分别取肿瘤组织和相应癌旁组织的3个不同部位进行处理,经过质谱DIA定量分析,在两组样本中共鉴定到3 8684个肽段,5 536个蛋白质,鉴定出2个或以上肽段的蛋白质共有3 976个,用于后续差异定量分析。
2.1 胃癌肿瘤空间异质性分析
将Hp阳性与阴性肿瘤组织不同部位鉴定到的蛋白两两进行差异分析,以此来评估胃癌肿瘤内部异质性。根据Hp+与Hp-不同部位肿瘤组织蛋白数据分布显示(图1),T1/T2、T1/T3、T2/T3各组中差异倍数过大(log2FoldChange<-2或log2FoldChange>2)的蛋白在Hp阳性分别占全部蛋白的2.7%(139/5 225)、2.4%(127/5 227)、2.4%(127/5 228),在Hp阴性中分别占全部蛋白的4.4%(228/5 194)、5.0%(260/5 195)、5.7%(295/5 220),即胃癌肿瘤内存在一定的异质性。
将上述蛋白进行功能比较分析(图1),IPA分析结果显示,这些蛋白在能量代谢、细胞增殖与侵袭、细胞生存与死亡、免疫应答反应、病毒感染等相关通路的激活与抑制具有显著性差异。
在Hp阳性中,与能量代谢相关通路,如磷脂代谢、鞘磷脂代谢、固醇类的合成等具有显著差异;与细胞增殖侵袭相关通路,如肿瘤细胞的增殖和生长具有明显差异;与细胞存活与死亡相关通路,如细胞坏死、凋亡、自噬等功能都具有显著性差异,同时细胞活力与存活也具有显著性差异;与免疫应答相关通路,如活性氧物质的产生及数量、细胞修复、细胞内稳态等都差异显著,Hp感染的患者机体内免疫反应发生了变化;与蛋白质有关通路,如蛋白质的翻译具有显著差异性,也就是说Hp感染的胃癌肿瘤可能会通过影响蛋白的翻译进而影响蛋白的表达;与病毒感染相关通路,如HIV等RNA病毒感染具有显著性差异。相比于Hp阳性,在Hp阴性中,与细胞增殖侵袭相关通路,如肿瘤细胞的移动迁移以及侵袭等具有差异性显著;与免疫应答反应等相关通路,如与白细胞的结合、细胞内稳态具有显著性差异;与蛋白质有关通路,如蛋白质的产生以及转运差异性显著,未感染Hp的胃癌肿瘤可能会通过影响蛋白的产生和转运进而影响蛋白的表达。因此,胃癌肿瘤组织内异质性的存在可能影响了蛋白的表达,而且在Hp阴性和Hp阳性中影响的通路和功能不尽相同。

图1 a.Hp阴性与Hp阳性肿瘤组织内差异倍数过大蛋白数据分布散点图。纵坐标Value表示log2FoldChange。b.Hp阴性与Hp阳性肿瘤组织差异倍数过大蛋白的功能比较分析。颜色深浅表示p value大小,颜色越深表示差异越显著(p value<0.05具有显著性差异)。
2.2 胃癌与癌旁蛋白质组学差异分析
将鉴定到的3 976个蛋白质进行差异定量分析,Hp阴性和阳性的肿瘤组织与其各自的癌旁组织相比,按照上述筛选标准,在Hp阳性患者的肿瘤组织中发现1 843个蛋白的表达量与癌旁组织相比,发生改变,其中有1 049个蛋白上调,794个蛋白下调;在Hp阴性患者的肿瘤组织中发现1 630个蛋白的表达量发生变化,其中有703个上调差异蛋白,927个下调差异蛋白(表1和图2)。因此,无论是否感染Hp,胃癌的肿瘤组织蛋白质组特征与癌旁组织蛋白质组特征具有显著差异。

表1 质谱分析筛选的差异表达蛋白数目
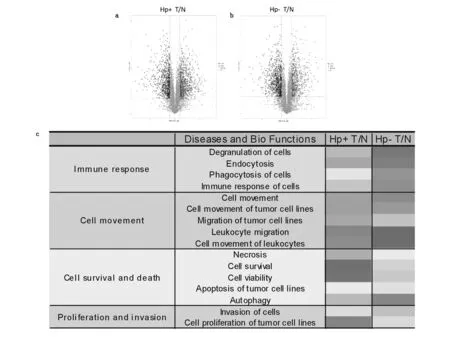
图2 a.Hp阳性肿瘤与癌旁差异表达蛋白火山图。b.Hp阴性肿瘤与癌旁差异表达蛋白火山图。c.Hp阳性与阴性的肿瘤与相应癌旁组织差异表达蛋白功能分析。颜色深浅表示z score大小,红色表示具有正相关性,蓝色表示具有负相关性,颜色越深表示相关性越强。
之后对上述差异表达蛋白进行功能分析(图2)。IPA分析结果表明,无论Hp的感染状态如何,胃癌的肿瘤组织与癌旁组织相比,与免疫应答反应、细胞迁移、细胞生存与死亡、细胞增殖侵袭有关功能发生变化。IPA结果显示,与免疫应答反应相关功能,如细胞脱颗粒、细胞吞噬作用、细胞免疫反应等都具有显著激活趋势,机体免疫应答反应增强;与细胞迁移相关功能,如肿瘤细胞的移动迁移、白细胞的移动迁移等细胞移动和迁移通路也被明显激活,体内细胞活动加强;与细胞存活死亡相关功能,如肿瘤细胞坏死以及凋亡相关通路具有显著抑制的趋势,细胞活力和细胞存活率整体增加,在Hp阳性中细胞自噬功能被激活而在Hp阴性中细胞自噬被抑制;与细胞增殖侵袭相关功能,如肿瘤细胞增殖和侵袭通路具有显著激活的趋势。
2.3 Hp阴性与Hp阳性胃癌蛋白质组学差异分析
通过差异定量分析(表1和图3),在肿瘤组织中,Hp阳性与Hp阴性相比,共有764个蛋白的表达量发生变化,其中有407个差异蛋白上调,有357个差异蛋白下调。因此,Hp阳性与Hp阴性两种胃癌肿瘤组织蛋白质组特征具有显著差异。
对Hp阳性与Hp阴性差异表达蛋白进行功能分析(图3),IPA结果显示,两者的肿瘤组织的差异表达蛋白与细菌生长、免疫反应、细胞迁移、细胞存活与死亡、细胞增殖侵袭等功能有关。

图3 a. Hp阳性与Hp阴性胃癌肿瘤组织差异表达蛋白火山图。b. Hp阳性与Hp阴性胃癌肿瘤组织差异表达蛋白功能分析。颜色深浅表示z score大小,红色表示具有正相关性,蓝色表示具有负相关性,颜色越深表示相关性越强。c. Hp阳性与Hp阴性胃癌肿瘤差异表达蛋白相关通路比较分析。横坐标表示-log(p value)。
功能分析(图3)结果表明,在肿瘤组织中,Hp阳性胃癌患者体内与细菌生长有关功能发生变化,如细菌生长通路被显著激活,而与细菌杀死有关通路被显著抑制。Hp阳性较Hp阴性胃癌,机体的免疫应答反应受到显著抑制作用,尤其是与细胞脱颗粒反应、白细胞迁移、细胞免疫反应以及炎症反应等功能受到重要影响。细胞迁移功能如肿瘤细胞系的移动迁移在Hp阳性中明显增强,但其他细胞的移动迁移如白细胞和吞噬细胞等具有免疫功能的细胞在Hp阳性中被显著抑制,从而导致Hp阳性患者机体的免疫应答反应降低,与上述结论互为一致。同时在Hp阳性患者体内,细胞坏死、肿瘤细胞系死亡通路被抑制,细胞凋亡增加,肿瘤细胞系活力以及细胞存活率大大升高,肿瘤细胞的增殖和侵袭能力也较Hp阴性大大增强。
通路分析(图3)结果表明,Hp阳性与Hp阴性的肿瘤组织相比,LXR/RXR激活通路差异最为显著,其次为急性期反应信号通路,与肿瘤相关经典信号通路如PI3K/AKT信号通路、VEGF信号通路、ERK/MAPK信号通路、PTEN信号通路、蛋白激酶A(PKA)信号通路、肿瘤微环境通路、PD-1,PD-L1癌症免疫治疗通路等都具有差异,与机体能量代谢相关通路如脂肪酸β氧化、氧化磷酸化等都发生变化,免疫与炎性信号通路如IL-8信号、B细胞受体信号等也具有差异性。
3 讨论
通过蛋白质组学分析发现,胃癌患者无论是否感染Hp,其肿瘤组织与癌旁组织相比,蛋白质组学特征差异显著,肿瘤组织与癌旁正常组织具有实质性区别,肿瘤组织中的蛋白表达量发生明显变化;这些差异表达蛋白使得患者体内一些信号通路以及功能发生改变,其中主要与细胞增殖、迁移、侵袭、存活、死亡以及免疫应答等相关信号通路和功能相关。之后比较了Hp不同感染状态下肿瘤组织的差异性,分析结果表明Hp阳性胃癌较Hp阴性胃癌,其肿瘤组织中的蛋白表达发生显著改变,也就是说这是两个不同的肿瘤实体,PI3K/AKT、VEGF、PTEN等信号通路在两者中也具有差异,体内细菌生长、细胞增殖、迁移、侵袭、存活、死亡、免疫应答等功能发生变化。
3.1 胃癌肿瘤异质性
胃癌是一种复杂的、异质性的疾病,先前已有研究指出不同个体间肿瘤异质性显著,但胃癌的瘤内异质性鲜有报道,在本研究中我们评估了胃癌肿瘤组织样本的瘤内异质性问题。由于Hp阴性胃癌病例较为罕见,样本收集较为困难,所以本研究的病例数受到限制。为了增加实验结果的可靠性,收集样本时取Hp阳性胃癌与Hp阴性胃癌患者肿瘤及癌旁组织的3个不同部位,作为三个生物学重复,然后对其三个生物学重复的结果取平均值进行后续数据分析。肿瘤异质性不仅可以影响诊断,同时也对治疗、疗效和疾病监测、耐药性和预后等产生影响,其与临床诊治密切相关,是实现精准诊疗和攻克肿瘤的重大挑战。
通常肿瘤异质性会影响某些基因的表达,胃癌的肿瘤内异质性在HER2基因背景下研究较多。Ryosuke Tajiri MD等人[13]利用免疫组化和荧光原位杂交联合分析,在51例HER2扩增的癌细胞中发现有41%的HER2扩增肿瘤存在HER2扩增的瘤内异质性。Wanjing Feng等[14]通过使用突变等位基因肿瘤异质性(MATH)评估了胃癌患者的肿瘤内异质性,结果显示高瘤内异质性较低瘤内异质性具有较差的预后及生存率。Phillip Stahl等[15]在研究胃癌中HER2、EGFR、CCND1和MYC基因扩增的异质性时发现肿瘤间异质性会影响这些基因的扩增状态,但是在单个转移瘤中没有发现明确的肿瘤内异质性。以上研究均显示胃癌肿瘤存在异质性并且会影响一些基因的表达,但是对于胃癌瘤内异质性各研究结果并不一致。根据我们目前的了解,暂无有关肿瘤异质性影响蛋白表达的报道。在本研究中,将Hp阴性与Hp阳性的肿瘤组织两两进行差异分析,结果显示,无论是Hp阴性还是Hp阳性,其肿瘤组织内蛋白的表达变化情况都有差别,存在肿瘤内异质性,并且影响蛋白的表达情况。并且功能分析显示,蛋白产生、翻译及转运等功能受到影响,更进一步证实胃癌肿瘤异质性会影响蛋白的表达。
3.2 胃癌肿瘤与癌旁组织蛋白质组学特征差异显著
先前胃癌的组学研究主要集中于基因组的改变,近年来蛋白质组学技术发展迅速,胃癌的蛋白质组研究可以提供更全面的基因表达水平及相应蛋白水平的变化情况。就胃癌的蛋白质组学方面而言,目前对它的理解还只是初步的。近年来两项对胃癌的大规模蛋白质组学研究值得我们关注。Sai Ge等[16]收集了84例弥漫性胃癌患者的肿瘤组织及相应的癌旁组织进行了蛋白质组分析,通过对蛋白质组数据分析发现肿瘤组织与癌旁组织的基因产物具有明显差别,通过蛋白质组数据可以将胃癌的肿瘤组织与癌旁进行明显区分,并将胃癌组织分为三个亚型,分别与细胞周期失调、EMT过程、免疫应答过程相关。还有一项来自韩国的关于弥漫型胃癌的大规模队列的蛋白基因组研究[17],Mun等人收集了80例患有弥漫型胃癌的年轻人群的配对的肿瘤组织和相应的癌旁组织以及血液样本,进行了全蛋白质组、磷酸化蛋白质组、N-糖基化蛋白质组分析。通过整合各蛋白质组数据以及基因组数据,发现胃癌的肿瘤组织与癌旁组织相比,在基因、RNA、蛋白质水平都发生了显著变化,同样利用蛋白质组学数据可以将胃癌进行分子分型,这些亚型分别与增殖、免疫反应、代谢和侵袭相关。以上两项研究结果均证实胃癌肿瘤组织与癌旁组织的蛋白质组学特征具有显著差异,可以根据蛋白质组特征区分胃癌肿瘤组织和癌旁组织。
同样在本研究中也有类似的发现。应用蛋白质组学技术对胃癌肿瘤组织和癌旁组织进行了分析,蛋白质组学数据结果可以将胃癌肿瘤组织与癌旁组织很好的区分开来,蛋白质组特征差异显著。并且对肿瘤组织和癌旁组织的差异表达蛋白进行功能分析,机体免疫应答反应、细胞增殖侵袭迁移以及细胞存活与死亡等功能都受到影响。之前的两项大规模胃癌蛋白质组研究为本研究结果提供了可靠证据,本研究结果也可作为胃癌的蛋白质组的补充研究,为今后胃癌的发生发展以及诊断治疗提供了更好的理解。
3.3 Hp阳性胃癌与Hp阴性胃癌肿瘤蛋白质组学特征差异显著
为了进一步深入研究胃癌的蛋白质组学特征,本研究中分析了感染Hp与未感染Hp的胃癌肿瘤组织的蛋白质组学特征。目前关于Hp阳性胃癌与Hp阴性胃癌的蛋白质组学特征的研究鲜有报道。在本研究结果中发现,Hp阳性与Hp阴性胃癌的肿瘤组织蛋白质组学特征差异显著,Hp感染状态会对肿瘤组织的蛋白表达产生一定影响,这可能是两种不同的肿瘤实体。通过对Hp阳性和Hp阴性胃癌的差异表达蛋白进行功能分析和通路分析发现,感染Hp的患者体内与细菌生长有关通路被显著激活,免疫应答反应受到抑制,具有免疫功能的细胞如白细胞、巨噬细胞等的增殖、迁移功能均被抑制;通路分析结果显示,PD-1,PD-L1介导的信号通路、肿瘤微环境、脂肪酸β氧化、氧化磷酸化等信号通路在Hp阴性和Hp阳性胃癌中具有差异。由此推测,机体在感染Hp后可能会影响患者的生存和预后情况。
Hp是胃内的特殊致病菌,是发生胃癌的重要因素之一,Hp的存在会影响胃内其他菌群的定值和分布。Wang Lili等[18]通过qPCR方法测定了慢性胃炎患者和胃癌患者的胃粘膜中的细菌数量,发现胃癌患者的胃粘膜中细菌数量明显多于慢性胃炎患者,并且还发现Hp的感染状态对细菌负荷有显著影响,Hp阳性患者的细菌载量明显高于Hp阴性患者,而且细菌数量与Hp的数量呈正相关,提示Hp感染是胃微生物群细菌数量的决定因素之一。因此,机体由于感染Hp可能会大大增加体内其他细菌的生长以及定值,与本研究结果显示的细菌生长通路激活以及细菌死亡通路抑制的结果是一致的。
Hp感染后会对机体的免疫系统产生影响。免疫应答是机体免疫系统识别并清除病原体的过程,通过有效的免疫应答过程,机体才能维持正常的内环境稳态。在胃癌组织中常常存在白细胞、肿瘤相关的巨噬细胞浸润以及会分泌大量的细胞炎性因子,导致出现炎症反应。但是从本研究结果中可以看到,患者在感染Hp后,机体的免疫应答反应和炎症反应反而出现了抑制现象。多项研究[19-21]指出,机体在感染Hp后,Hp表面的脂多糖(LPS)成分会使宿主的主要免疫机制如吞噬细胞活性等下调,导致免疫细胞对Hp的吞噬清除作用减弱,从而减弱甚至抑制宿主的免疫应答反应。同时LPS还会影响某些细胞炎症因子的表达如上调IL-18下调IL-1β等[20],减弱宿主的炎症反应;Hp的定值可以通过调节B细胞和T细胞信号通路从而逃避宿主免疫系统[22],IL-8信号通路、B细胞受体信号通路等在Hp阴性和Hp阳性中的差异性更好的印证了这一点,由此可以形成一个利于Hp生长的环境,促进Hp的生长增殖和定值。可能正是由于Hp表面LPS成分的存在使得宿主的免疫功能受到抑制,更加有利于Hp本身的生长和定值,从而促进了胃癌的发生发展过程。PD-1,PD-L1介导的信号通路、肿瘤微环境通路在Hp阳性与阴性胃癌中具有显著差异,其在抑制机体抗肿瘤免疫反应以及肿瘤免疫逃逸过程中都发挥着重要作用[23]。
Hp阴性与Hp阳性胃癌组织细胞的能量代谢方式具有显著差异。多项研究指出[24-26],胃癌疾病组与对照组相比,体内能量代谢发生失调,但在这些研究中并没有对Hp感染状态进行区分。René G.Feichtinger等人[27]采用免疫组化方法研究了氧化磷酸化系统在胃癌和胃炎中的作用,分析了Hp感染对几个关键线粒体蛋白的影响,与对照组织相比,肠型胃癌组织的氧化磷酸化作用复合物发生显著变化,并且这种变化与Hp感染无关,并推测在胃癌中发现的能量代谢的改变可能独立于细菌感染发生。目前关于Hp不同感染状态的胃癌研究还尚少。本研究结果显示能量代谢通路如脂肪酸β氧化、氧化磷酸化等与Hp的感染状态可能存在一定联系,在一定程度上为当前Hp不同感染状态的胃癌肿瘤的能量代谢研究提供了补充。但由于本研究受到样本数的限制,关于Hp感染状态对能量代谢的影响还需扩大队列进一步研究。
综上所述,本文应用蛋白质组学方法对胃癌的蛋白质组特征研究进行了研究,包括肿瘤异质性、肿瘤组织与癌旁组织差异及Hp阳性和阴性胃癌。通过本文研究发现,胃癌肿瘤存在异质性,并影响蛋白表达;胃癌的肿瘤组织和癌旁组织蛋白质组学特征差异显著,免疫应答反应、细胞迁移、细胞生存与死亡、细胞增殖侵袭等功能具有差异;Hp阳性胃癌与Hp阴性胃癌具有不同的蛋白质组学特征,肿瘤相关信号通路以及免疫应答、细胞迁移、细胞生存与死亡、细胞增殖侵袭等功能在Hp阳性胃癌与Hp阴性胃癌中表达也存在差异。本文研究加深了对胃癌发病机制的理解,为进一步进行胃癌发病机制研究提供了新的线索,也为胃癌的治疗干预和疾病预防提供了重要思路。
