黑树莓泡制酒的泡制工艺条件优化及抗痛风功效评价
2023-02-21张泽坤王一凡赖慧宁陈雨涔罗红宇
张泽坤,杨 涛,易 冲,王一凡,赖慧宁,陈雨涔,罗红宇
(1.浙江海洋大学 食品与药学学院,浙江 舟山 316022;2.烟台市海洋研究院,山东 烟台 264003)
痛风已成为我国高发的代谢性疾病,除遗传外,饮食不当和不良生活方式是痛风高发的主要原因[1]。痛风是由体内嘌呤代谢紊乱及(或)尿酸排泄减少导致的尿酸钠或尿酸钠结晶沉积在关节、组织、器官的一种临床综合征,其临床主要表现为高尿酸血症(hyperuricemia,HUA)和急性痛风性关节炎(gouty arthritis,GA)[2-4]。临床治疗常采用别嘌呤醇和非布司他抑制黄嘌呤氧化酶活性,从而间接遏制人体产生过高水平的血尿酸,但都存在不同程度的不良反应[5-6]。此外,苯溴马隆通过抑制肾小管对尿酸的重吸收,促进尿酸排泄降低血液中尿酸浓度,从而实现降尿酸的目的,但该药具有强烈的胃肠道反应和肝毒性等[7]。面对痛风发病率逐年增加的趋势,亟需寻找低毒、副反应小的新型抗痛风药物[8]。
黑树莓(Rubus mesogaeus)学名喜阴悬钩子,属于蔷薇科悬钩子,属多年生落叶灌木,果实为小浆果,被誉为天然绿色健康食品[9],富含生物活性物质如黄酮、多酚、花色苷等[10]。黄酮类化合物是一类具有抗肿瘤、降血压、抗炎、清除自由基等作用,且毒副作用小的天然产物[11-13]。有文献报道,植物的黄酮具有抑制黄嘌呤氧化酶(xanthine oxidase,XOD)活性,显示有潜在的抗痛风功效[14-15]。民间流传利用黑树莓泡制酒治疗痛风的偏方,但由于配方欠精准、泡制工艺较粗放,导致机理不明确、治疗功效不稳定[16]。基于前期课题组对黑树莓醇提工艺及其抑制XOD酶学特性研究的基础发现,黑树莓的醇提液可抑制XOD催化黄嘌呤生成尿酸,有缓解痛风功效[16-17]。研究表明,荞麦酒具有降血脂和胆固醇、软化血管等保健作用[18]。因此,以荞麦原浆酒代替白酒为酒基制备黑树莓泡制酒,以期开发一款具有营养保健效果的抗痛风产品。
本研究以黑树莓为原料、荞麦原浆酒为酒基进行泡制制备黑树莓泡制酒,通过单因素试验及响应面试验优化其泡制工艺条件,采用小鼠高尿酸血症模型和急性痛风性关节肿胀模型分析黑树莓泡制酒对小鼠血清和尿液中尿酸含量、血清的XOD活性及关节肿胀度变化的影响,以期探究黑树莓泡制酒对痛风的治疗效果,为抗痛风药物的开发提供实验基础和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
塔斯州黑树莓:浙江省余姚市塔斯州黑树莓研究所;黑树莓汁(黄酮含量为0.48 mg/mL):自制;荞麦原浆酒:市售。
无特定病原体(specific pathogen free,SPF)级美国癌症研究所(institute of cancer research,ICR)雄性小鼠35只,体质量(20.32±1.30)g,周龄6~8周,动物合格证号:SCXK 2014-0001,由浙江省实验动物中心提供,饲养于浙江海洋大学动物实验中心,温度(22±2.4)℃,相对湿度15%~25%,自由饮水摄食,每天灯照12 h,定期更换垫料。实验结束后颈部脱臼处死,之后交由学校动物实验中心统一处理。
1.1.2 试剂
尿酸钠(分析纯)、芦丁标准品(纯度≥98%):美国Sigma公司;别嘌呤醇、苯溴马隆:浙江舟山里肯大药房;尿酸(uric acid,UA)检测测试盒、黄嘌呤氧化酶(XOD)测试盒:南京建成生物工程研究所;甲醇(色谱级)、氧嗪酸钾、尿酸、氯化钠、无水乙醇(均为分析纯)、AB-8大孔吸附树脂:国药集团化学试剂有限公司。
1.2 仪器与设备
α-1502紫外可见分光光度计:上海谱元仪器有限公司;Tecan Spark多功能酶标仪:瑞士帝肯Männedorf公司;JJ500型电子天平:常熟市双杰测试仪器厂;Multifuge X1R高速冷冻离心机:美国Thermo Fisher Scientific公司;RV10自动控制性旋转蒸发仪:迪图(上海)生物科技有限公司;Agilent 1200高效液相色谱仪:南京利尔实验仪器设备有限公司;MD-99-2A柱层析系统:上海沪西分析仪器厂有限公司。
1.3 方法
1.3.1 黑树莓泡制酒的制备
以酒精度为47%vol的荞麦原浆酒作为酒基,荞麦原浆酒与黑树莓按液料比1∶1(mL∶g)在室温下泡制60 d,制得黑树莓泡制酒,总黄酮含量为0.96 mg/mL。
1.3.2 黑树莓泡制酒泡制工艺优化单因素试验
考察液料比(4.0∶1.0、3.0∶1.0、2.0∶1.0、1.5∶1.0、1.0∶1.0(mL∶g))、泡制时间(15 d、30 d、45 d、60 d、75 d)、荞麦原浆酒酒精度(39%vol、43%vol、47%vol、51%vol、55%vol)对XOD抑制率的影响。
1.3.3 黑树莓泡制酒泡制工艺优化响应面试验
在单因素试验基础上,以黑树莓泡制酒对XOD的抑制率(Y)为响应值,以影响黑树莓常温泡制效果的液料比(A)、泡制时间(B)和荞麦原浆酒酒精度(C)为自变量,对黑树莓泡制酒泡制工艺进行优化。利用Design-Expert 11.0.4软件设计3因素3水平的响应面试验,试验因素与水平见表1。

表1 黑树莓泡制酒泡制工艺优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for soaking process optimization of black raspberry soaking spirit
1.3.4 黑树莓泡制酒对XOD的抑制性能测定
以黄嘌呤为底物,XOD催化黄嘌呤生成的尿酸在波长290 nm下有明显的特征吸收峰,参考文献[19]的方法稍作修改。体系总体积为200 μL,将磷酸缓冲液、黄嘌呤氧化酶溶液、各样品依次加入96孔板,常温反应30 min,加入不同浓度黄嘌呤,具体加入量见表2。采用酶标仪在波长290 nm处每间隔20 s测定反应体系中尿酸的吸光度值,每组平行测定3次。以XOD抑制剂别嘌呤醇作为阳性对照,磷酸缓冲液为阴性对照。设置空白组是排除试剂本身对实验的干扰。据此计算不同样品在反应体系中黄嘌呤氧化酶(25 U/L)的活力,进行酶抑制实验。XOD酶活抑制率的计算公式如下:
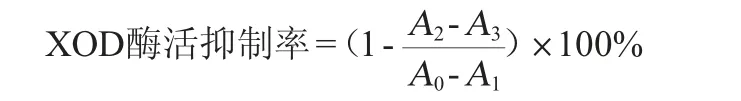
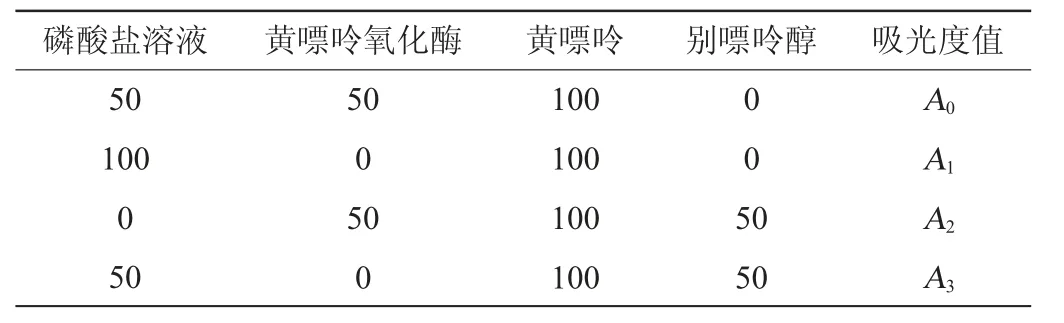
表2 黄嘌呤氧化酶活性测定实验组别设计Table 2 Design of experimental group for xanthine oxidase activity determination μL
1.3.5 试验动物的分组及造模
35只SPF级雄性小鼠适应性饲养7 d后,根据参考文献[20-22]按表3随机分为7组,具体分组见表3,除正常组按剂量(1 mL/100 g)灌胃小鼠外,其他各组每日上午九时腹腔注射造模药物(30 mg/100 g氧嗪酸钾+25 mg/100 g尿酸),连续9 d。在第5天腹腔注射造模药物后,正常组注射0.05 mL生理盐水,其余各组注射0.05 mL(25 mg/mL)尿酸钠诱导急性痛风性关节炎。从造模第5天开始,各组造模1 h后,正常组和模型组给予等体积生理盐水,其余各组按相应剂量灌胃实验药物。在第9天造模、给药后,小鼠禁食不禁水,3 h后收集尿液,新鲜尿样以3 500 r/min离心10 min,取上清液对尿液中尿酸含量进行测定。12 h后内眦取血,取血样在3 500 r/min离心10 min,测定血清中尿酸含量和XOD活力。

表3 实验动物的分组Table 3 Grouping of experimental animal
1.3.6 测定方法
(1)理化指标的检测
总黄酮含量的测定:参照参考文献[23],以芦丁的质量浓度(X)为横坐标,以波长505 nm时的吸光度值(Y)为纵坐标,绘制芦丁标准曲线,建立芦丁标准曲线回归方程Y=12.57X+0.010 4(相关系数R2=0.999 9),根据标准曲线回归方程计算样品中的总黄酮含量。
多酚含量测定:采用福林酚法,参照文献[24]方法,以没食子酸为标准品,以没食子酸质量浓度(X)为横坐标,以波长765 nm时的吸光度值(Y)为纵坐标,建立没食子酸标准曲线回归方程Y=11.23X+0.033 3(相关系数R2=0.999 1),根据标准曲线回归方程计算样品中的多酚含量。
花色苷含量的测定:采用分光光度计法[25],以芦丁不同质量浓度(X)为横坐标,以波长510 nm处的吸光度值(Y)为纵坐标,绘制芦丁标准曲线,其线性回归方程为Y=1.102X-0.010 4Y(相关系数R2=0.999 6)。
(2)小鼠体态观察
试验期间每天观察并记录各组小鼠的毛色、精神状态等情况。
(3)平均体质量和食量的变化
每天实验前固定时间记录各组小鼠平均体质量和饲料质量,评估实验对小鼠的影响。
(4)血清、尿液中尿酸含量的检测
按《尿酸(UA)检测试剂盒说明书》测定各组小鼠血清和尿液中尿酸的含量。
(5)血清中XOD活力的检测
按《黄嘌呤氧化酶(XOD)测定试剂盒说明书》测定各组小鼠血清中XOD的活力。
(6)关节肿胀度的测量
在实验的第5天造模、给药前,用记号笔标注小鼠受试部位,采用缚线法测量小鼠原始周长,注射尿酸钠混悬液后分别记录0 h、2 h、4 h、8 h的小鼠关节注射部位的周长,计算关节肿胀度,其计算公式如下:

1.3.7 统计分析
使用软件OriginPro 8.0进行绘图,采用SPSS 22.0统计软件对试验数据进行单因素方差分析及显著性、相关性检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 黑树莓泡制酒泡制工艺优化单因素试验结果
料液比、泡制时间和酒精度对XOD抑制率的影响见图1。由图1A可知,随着液料比在4.0∶1.0~1.5∶1.0(mL∶g)范围内的升高,黑树莓泡制酒对XOD酶的抑制率也逐渐增加;当液料比为1.5∶1.0(mL∶g)时,黑树莓泡制酒对XOD的抑制率为40.98%;液料比>1.5∶1.0(mL∶g)后,黑树莓泡制酒对XOD的抑制率逐渐平稳。因此,确定最适的液料比为1.5∶1.0(mL∶g)。由图1B可知,随着泡制时间在15~60 d范围内的增加,黑树莓泡制酒对XOD的抑制率增加较快;当泡制时间为60 d时,黑树莓泡制酒对XOD的抑制率为41.23%;但泡制时间>60 d后,黑树莓泡制酒对XOD的抑制率增长变缓。因此,确定最适的泡制时间为60 d。由图1C可知,随着酒精度的在39%vol~55%vol范围内增加,黑树莓泡制酒对XOD的抑制率逐渐增加;当酒精度为47%vol时,XOD的抑制率为39.85%;但当酒精度>47%vol之后,黑树莓泡制酒对XOD的抑制率增加缓慢。因此,确定最适的酒精度为47%vol。
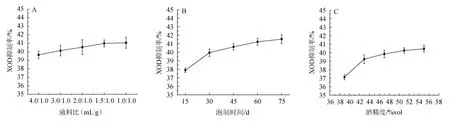
图1 液料比(A)、泡制时间(B)及酒精度(C)对黄嘌呤氧化酶抑制率的影响Fig.1 Effects of liquid and solid ratio (A),soaking time (B) and alcohol content (C) on the inhibition rate of xanthine oxidase
2.2 黑树莓泡制酒泡制工艺条件优化响应面试验
2.2.1 泡制工艺条件的优化
在单因素试验的基础上,以液料比(A)、泡制时间(B)、酒精度(C)为考察因素,黑树莓泡制酒对XOD的抑制率(Y)为响应值,采用基于Box-Benhnken设计的3因素3水平的响应面试验对黑树莓泡制酒泡制工艺条件进行优化,响应面试验设计及结果见表4,方差分析见表5。

表4 黑树莓泡制酒泡制工艺优化Box-Benhnken试验设计及结果Table 4 Design and results of Box-Benhnken experiments for soaking process optimization of black raspberry soaking spirit
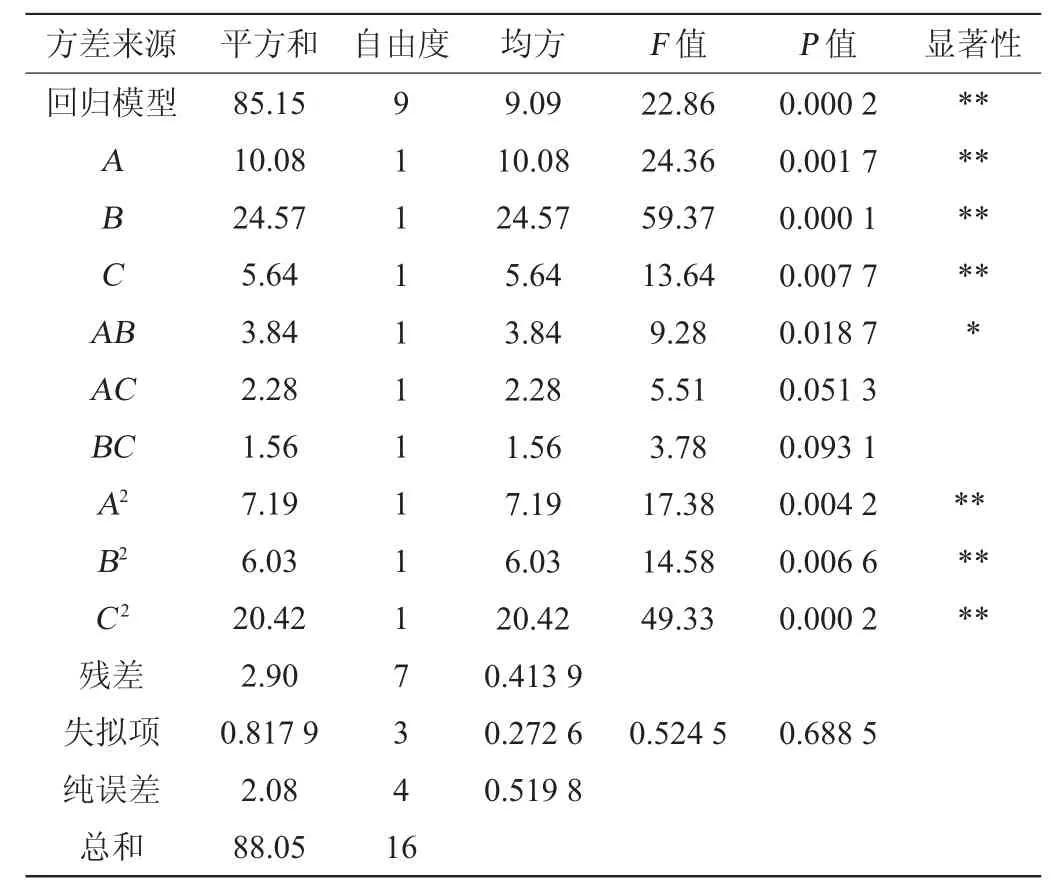
表5 回归模型方差分析Table 5 Variance analysis of regression model
利用Design-Expert 11.0.4软件对表4的试验数据进行二次多项回归拟合,得到响应值与各因素间的回归方程:
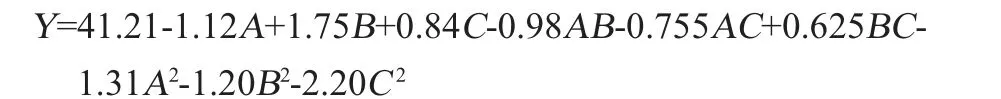
由表5可知,该回归模型极显著(P值=0.000 2<0.01),失拟项不显著(P值=0.688 5>0.05),说明此试验的模型设计合理,试验数据可信度高。由P值可知,一次项A、B、C和二次项A2、B2、C2对结果影响极显著(P<0.01),交互项AB对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。各因素的F值可以反映各因素对XOD抑制率的重要性,F值越大说明对XOD抑制率的影响越大。由F值可知,3个因素对黑树莓泡制酒XOD抑制率影响的主次顺序为泡制时间(B)>液料比(A)>酒精度(C)。
2.2.2 响应面分析
三维响应曲面图可以非常直观地反映出液料比、泡制时间、酒精度交互作用对XOD抑制率的影响,各因素间交互作用对XOD抑制率影响的响应曲面及等高线见图2。

图2 各因素间交互作用对黄嘌呤氧化酶抑制率影响的响应面及等高线Fig.2 Response surface plots and contour lines of effects of interaction between each factors on inhibition rate of xanthine oxidase
由图2可知,泡制时间(B)与液料比(A)交互作用的曲面较陡峭,表明二者交互作用对XOD抑制率影响显著(P<0.05),而酒精度与液料比、酒精度与泡制时间交互作用的曲面较为平缓,表明二者有交互作用,但交互作用不显著(P>0.05),这与回归模型方差分析结果一致。
根据软件分析,黑树莓泡制酒的最佳泡制工艺条件为:液料比1.03∶1.00(mL∶g)、泡制时间60 d、荞麦原浆酒酒精度48.98%vol,此时XOD抑制率理论值为43.13%。综合考虑3因素对XOD酶活的影响程度和实际操作成本,将最优泡制工艺条件适当调整为液料比1∶1(mL∶g),泡制时间60 d,荞麦原浆酒酒精度为49%vol。在此优化泡制工艺条件下,XOD抑制率的实际值为(42.68±0.61)%,实际值和理论值的相对误差为0.45%。黑树莓泡制酒的总黄酮含量为(0.965 8±0.004 8)mg/mL,多酚含量为(0.937 4±0.003 2)mg/mL、花色苷含量为(0.013 4±0.000 4)mg/mL,以XOD抑制率为判定条件,说明建立的数学模型准确可行,符合预期结果,可以作为黑树莓泡制酒工艺条件确定的依据。
2.3 黑树莓泡制酒抗痛风功效评价
2.3.1 小鼠的体态观察
实验期间,空白组小鼠的精神状态良好,毛发顺滑有光泽,反应迅速,饮食正常。模型组小鼠的的反应减缓,精神不振,毛发失去明显的光泽。各组小鼠关节注射尿酸钠后,正常组注射生理盐水后行动有明显的跛脚,随时间延长,除模型组外,跛脚现象逐渐消失。
2.3.2 小鼠平均体质量及食量
在小鼠实验期间,称量并记录每天的体质量和进食量,结果见表6。

表6 黑树莓泡制酒对小鼠体质量增长率及食量的影响Table 6 Effect of black raspberry soaking spirit on body mass growth rate and food intake in mice
由表6可知,各组小鼠体质量增长率均显著低于正常组(P<0.01),除别嘌呤醇组外,其余各组小鼠每天的平均食量也显著低于正常组(P<0.05),说明造模对小鼠体质量的增长率以及食量具有显著影响(P<0.05)。与模型组相比,苯溴马隆组在食量上差异显著(P<0.05),体质量增长率不显著(P>0.05)。别嘌呤醇组的小鼠在体质量增长率以及食量方面显著增加(P<0.05)。黑树莓泡制酒高剂量组以及黑树莓汁液组小鼠的体质量增长率及食量均显著小于模型组(P<0.05),其原因可能是高浓度的黑树莓泡制酒及黑树莓汁液影响小鼠的食欲,营养摄入不全面导致体质量增长率较低;而黑树莓泡制酒低剂量组小鼠体质量增长率与模型组差异不显著(P>0.05),但食量显著增加(P<0.05)。
2.3.3 小鼠血清及尿液中的尿酸含量
药物对高尿酸血症的作用主要通过小鼠血清中尿酸含量的高低来进行判定,此外通过测定小鼠尿液中尿酸含量也可以从侧面反映药物对尿酸排泄的效果。各组小鼠血清尿酸含量及尿液尿酸含量见图3。
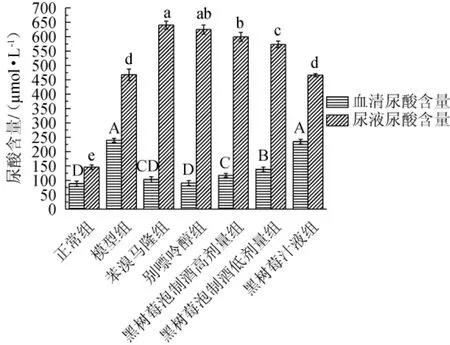
图3 黑树莓泡制酒对高尿酸血症小鼠血清和尿液中尿酸水平的影响Fig.3 Effect of black raspberry soaking spirit on uric acid levels in serum and urine of hyperuricemia mice
由图3可知,与正常组相比,模型组小鼠血清和尿液中的尿酸含量升高明显,差异显著(P<0.05),说明本实验的高尿酸血症小鼠模型构建成功。与模型组比较,除黑树莓汁液组外,苯溴马隆组、别嘌呤醇组、黑树莓泡制酒高剂量组、黑树莓泡制酒低剂量组中小鼠血清尿酸含量显著降低(P<0.05),各组别分别下降136.24 μmol/L、148.80 μmol/L、121.93 μmol/L、101.38 μmol/L(P<0.05),尿液中尿酸含量显著升高(P<0.05),各组别分别升高172.68 μmol/L、157.29 μmol/L、131.78 μmol/L、105.64 μmol/L(P<0.05)。由此说明黑树莓泡制酒可有效降低血清中尿酸含量,促进尿酸的排出,黑树莓泡制酒高剂量组与别嘌呤醇组尿液尿酸含量差异不显著(P>0.05),其血清尿酸含量与苯溴马隆组差异不显著(P>0.05),别嘌呤醇的药理作用是抑制XOD的酶活来抑制尿酸的形成,苯溴马隆的药理作用是抑制肾小管对尿酸的重吸收来降低血中尿酸含量[26],促进尿液尿酸的排出,黑树莓泡制酒降尿酸的机制是否兼而有之有待进一步探究。
2.3.4 小鼠血清的XOD活力
XOD在动物机体内催化黄嘌呤和次黄嘌呤生成尿酸,过多的尿酸会导致高尿酸血症[22]。目前通过抑制体内XOD的活性,阻断XOD催化嘌呤生成尿酸的途径,从而降低血液中的尿酸水平。各组小鼠血清中XOD活性的测定结果见图4。
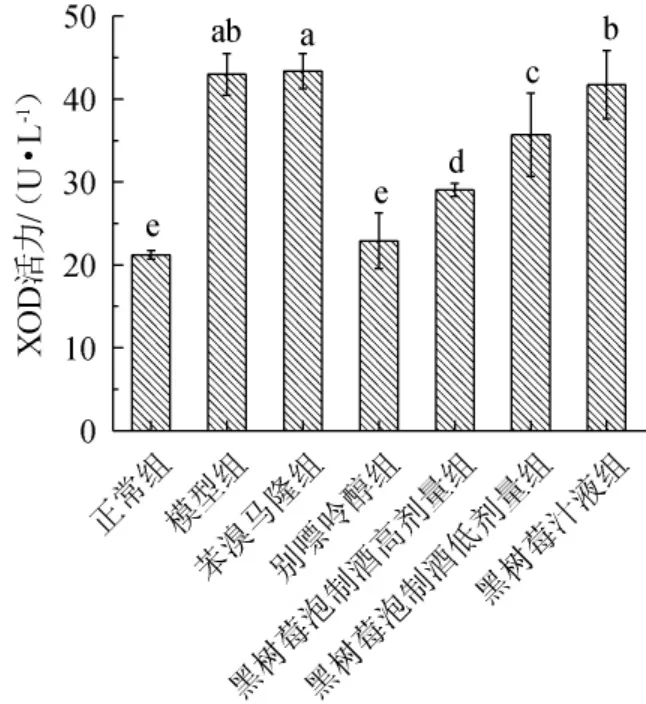
图4 黑树莓泡制酒对高尿酸血症小鼠血清中黄嘌呤氧化酶活性的影响Fig.4 Effect of black raspberry soaking spirit on xanthine oxidase activity in serum of hyperuricemia mice
由图4可知,与正常组相比,模型组XOD活力显著升高(P<0.05)。与模型组相比,别嘌呤醇组、黑树莓泡制酒高剂量组和黑树莓泡制酒低剂量组小鼠血清中的XOD活力水平显著降低(P<0.05),各组别分别下降20.07 U/L、13.93 U/L、7.31 U/L(P<0.05),黑树莓泡制酒和别嘌呤醇可以抑制XOD的活性,减少尿酸含量的生成,本实验结果和李昕卓等[27]的研究结果一致,但黑树莓泡制酒高剂量组、低剂量组抑制XOD的活性显著低于别嘌呤醇组(P<0.05)。苯溴马隆组小鼠血清中XOD活力水平和模型组无显著差异(P>0.05),这与苯溴马隆的药理作用机制有关。黑树莓汁液组的XOD活力水平与模型组无显著差异(P>0.05),说明灌胃黑树莓汁液对小鼠血清XOD活力无影响。
2.3.5 小鼠的关节肿胀度
采用穿刺法在小鼠关节内注射尿酸钠诱导小鼠产生急性痛风性关节炎,尿酸钠注射前后小鼠关节对比见图5,各组别不同时间对关节肿胀度的影响见表7。

图5 尿酸钠注射前后小鼠关节对比Fig.5 Comparison of mouse joints before and after sodium urate injection

表7 注射尿酸钠的不同时间对各组别小鼠关节肿胀度的影响Table 7 Effect of injection time of sodium urate on the joint swelling degree in each group of mice
由图5可知,小鼠关节在注射尿酸钠之后出现肿胀。由表7可知,正常组与样品组注射等量的生理盐水后,关节出现一定程度的肿胀,但随生理盐水的吸收肿胀快速消失,至8 h肿胀已完全消除。与正常组小鼠相比,注射完成后,模型组小鼠关节肿胀度极显著高于正常组(P<0.01),表明关节注射尿酸钠导致的急性痛风性关节炎模型成功;实验期间各药物组小鼠的关节肿胀度与正常组相比均有极显著差异(P<0.01)。与模型组相比,注射2 h后,正常组、苯溴马隆组、黑树莓泡制酒高剂量组、黑树莓泡制酒低剂量组小鼠的关节肿胀度均极显著降低(P<0.01),各组别分别降低12.36%、7.03%、5.37%、3.95%,说明黑树莓泡制酒可降低小鼠的关节肿胀度。苯溴马隆能够极显著降低关节肿胀度(P<0.01),苯溴马隆组的消肿效果好,与苯溴马隆通过抑制肾小管对尿酸的重吸收,促进尿酸排泄的药理作用有关[26]。别嘌呤醇组以及黑树莓汁液组关节肿胀度下降不显著(P>0.05)。
3 结论
本研究以黑树莓为原料、荞麦原浆酒为酒基进行泡制制备黑树莓泡制酒,通过单因素试验及响应面试验确定黑树莓泡制酒的最佳泡制工艺条件为:液料比1∶1(mL∶g)、泡制时间60 d、荞麦原浆酒酒精度49%vol。在此优化工艺条件下,黑树莓泡制酒对XOD活性的抑制率达到42.68%,总黄酮、多酚、花色苷含量分别为0.97 mg/mL、0.94 mg/mL、0.01 mg/mL。黑树莓泡制酒能够有效降低高尿酸血症小鼠血清中尿酸的含量,促进尿酸的排泄,可以抑制小鼠血清中的XOD活力,对小鼠的急性痛风性关节炎也有明显的消肿作用。高浓度的黑树莓泡制酒分别与别嘌呤醇促进尿酸排出、苯溴马隆降低血清尿酸的功效相当,下一步将对黑树莓泡制酒的药理作用机制进行研究。
