外泌体miRNAs
——运动促进心血管健康的新靶点
2023-02-21马春莲熊晓玲
马春莲,柳 华,熊晓玲,杨 翼
心血管疾病(cardiovascular disease,CVD)致死、致残率较高。美国心脏协会(Amer‑ican Heart Association, AHA)统计显示,2015—2018年全球≥20岁的成年人患CVD的几率达49.2%,2019年一年内全球因CVD死亡的人数约87.5万(American Heart Associa‑tion,2022)。《中国心血管健康与疾病报告2020》显示,我国各类CVD患者达3.3亿,因CVD死亡的人数占全国死亡人数的43%以上,CVD依然是我国居民的首要死因(国家心血管病中心,2021)。尽管心血管研究和临床护理的进步提高了CVD患者的生存率,但鉴于持续较高的死亡率,仍需要良好的预防、治疗策略。运动可以为身体多个系统带来益处,降低CVD和2型糖尿病(type 2 diabetes,T2D)35%~55%的发病风险(American Association of Diabetes Educators,2012),已经成为预防及缓解CVD的有效措施之一。
外泌体(exosomes,EXO)是由不同类型细胞分泌的直径在40~150 nm的细胞外囊泡(extracellular vesicles,EVs),可将其包裹的 microRNAs(miRNAs)、蛋白质、脂质等物质传递到受体细胞(Pluchino et al.,2019),在细胞之间、细胞与组织之间发挥重要的信息传递作用,参与多种生理和病理过程。EXO具有内分泌、旁分泌和自分泌的特性,不同细胞来源及细胞微环境会影响EXO的分泌及功能(Kalluri et al.,2020)。运动作为机体强烈的刺激可调控EXO的分泌及其内含物,体内75%的运动因子存在于EXO中(Safdar et al.,2016)。
miRNAs是一种长度为22~25个核苷酸,通过与mRNA的3’端结合,在转录后调控基因表达的非编码单链RNA(Henning,2021)。miRNAs通过降解mRNA或抑制mRNA的翻译,在生物发育、代谢调节、肿瘤发生发展等方面发挥重要调控作用。单个miRNA可以靶向数百个mRNA,而单个mRNA也可以被多个不同miRNAs靶向(Romao et al.,2014),体现出miRNA强大、复杂和灵活的调控潜力。哺乳动物超过60%的蛋白编码基因直接被miRNAs调控(Friedman et al.,2009)。exomiRs是EXO中重要的内含物,由于受脂质双层的保护,免于RNA酶分解(Shelke et al.,2014),从而能更有效地调控细胞转录后过程。
研究表明,EXO尤其EXO内含的miRNAs(exomiRs)参与了心血管健康的调控。运动促进心血管健康或许是EXO作为细胞间通讯媒介,介导运动产生了多系统效应。基于此,本研究对exomiRs介导运动在促进心血管健康方面的作用进行综述。
1 exomiRs的来源及去路
exomiRs的形成是复杂而精密的调控过程。细胞核内miRNA基因在RNA聚合酶的作用下生成前体miRNA(pre-miRNA),pre-miRNA出核后在细胞浆内经过进一步加工,形成成熟的miRNA(Michlewski et al.,2019)。EXO在生成过程中对细胞浆内成熟的miRNAs进行分选及包裹。细胞膜的内陷形成早期内体(early sorting endosome,ESE),ESE的膜内陷选择性地包裹细胞浆内的miRNAs、脂质、蛋白质等物质(Henning,2021),形成含有腔内小泡(intraluminal vesicles,ILVs)的晚期内体(late sorting endosome,LSE),随着ILVs的逐渐积累,LSE形成多泡体(multivesic‑ular bodies,MVBs)。溶酶体调控MVBs的降解及EXO的释放。MVBs生成后可以与溶酶体融合,被降解供细胞循环利用,也可以与细胞膜融合将ILVs释放到细胞外,即为含特定miRNAs的EXO(Kalluri et al.,2020)。EXO被释放后可以通过受体细胞内吞、受体-配体介导的胞吐、与受体细胞膜融合3种形式将exomiRs释放到受体细胞(Wang et al,2019)。进入受体细胞的exomiRs与mRNA靶基因结合(Achkar et al.,2016),从而调控靶基因的降解或抑制其翻译过程(图1)。
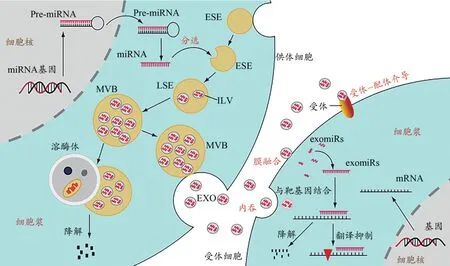
图1 exomiRs的来源及去路示意图Figure 1. Schematic Diagram of the Source and Destination of exomiRs
2 运动对EXO分泌及exomiRs表达的调控
2.1 一次性运动对EXO分泌及exomiRs表达的调控
Fruhbeis等(2015)对12名运动爱好者(每周运动超过3 h)进行研究发现,在一次性递增强度自行车运动至力竭(起始负荷50 W,每3 min增加50 W)过程中,运动强度达到个体乳酸阈强度前EXO的分泌就已经开始了。运动后即刻循环EXO的水平显著高于运动前,并在运动结束90 min后恢复到静息水平。男性大学生进行递增强度的自行车运动至力竭(起始负荷60 W,每1 min增加30 W),运动后即刻血浆中血小板和中性粒细胞来源的EVs显著升高,运动后2 h血浆中EVs的水平仍显著高于静息状态(Chaar et al.,2011)。Sossdorf等(2011)对 16名健康男性(根据运动水平分为训练组与久坐组)进行最大摄氧量和个体乳酸阈水平的测试发现,两组受试者分别以80%个体无氧阈强度进行90 min自行车运动后血小板、单核细胞、内皮细胞(endothelial cells,ECs)来源的EVs数量显著增加,但训练组血浆EVs峰值出现在运动后45 min,久坐组则出现在运动后2 h。有研究发现,运动员进行递增强度自行车运动至力竭(起始负荷40 W,每3 min增加40 W),运动后即刻ECs、血小板、各种类型白细胞来源的EVs显著增加(Brahmer et al., 2019)。以上研究结果显示,一次性运动能促进EXO的分泌,并且不同运动水平的受试者体内EXO产生与清除的代谢动力学不同。一次性运动促进心血管细胞来源EXO的分泌,由于EXO具有母细胞的某些特性,提示,运动诱导的心血管细胞来源EXO水平的变化可能与运动改善心血管功能、免疫调节、炎症有关。
exomiRs是EXO参与机体生理和病理过程调控的重要内含物。近年研究发现,运动参与了exomiRs生成过程的调控,并促进了特定exomiRs的表达。Whitham等(2018)研究发现,1 h自行车运动(30 min 55%O2max强度,20 min 70%O2max强度 ,10 min 80%O2max强度)可以促进包括EXO和ILVs结构蛋白在内的超过300种蛋白质表达增加,并且促进EVs向肝脏转移蛋白质。一次性有氧+抗阻运动(双腿以55%O2max强度进行45 min自行车运动+3组55% 1RM强度的单腿8~12次的伸膝运动,组间间歇2 min)上调了健康男性股外侧肌MVBs合成相关蛋白Clathrin和Alix的mRNA表达,同时促进了miRNA加工相关蛋白Dicer和Exportin 5的mRNA表达,并且运动诱导的MVBs合成相关蛋白基因表达量与miRNA加工相关蛋白基因表达量呈正相关(Garner et al.,2020)。提示,一次性运动促进了与EXO生成相关蛋白质的合成。
虽然,还没有直接证据证明一次性运动促进miRNAs分选并包裹进EXO,至少说明在运动中EXO和miRNAs的生物合成途径遵循着类似的时间轴,提示一次性运动可能促进miRNAs分选并包裹进EXO的动态过程。Lovett等(2018)发现,倍增跳跃联合下山跑的训练(10组10次90%最大跳跃高度,组间间隔1 min,跳跃完成5 min后以10 km/h的速度进行5组4 min的下山跑,坡度为10%,组间间隔2 min),可以选择性地改变健康男性循环EVs中的miR‑NAs,而这些EVs中表达改变的miRNAs参与了骨骼肌损伤后的内源性修复。D’Souza等(2018)发现,一次性高强度间歇运动(10组60 s最大输出功率的自行车运动,组间间歇75 s)使血浆EXO内含miR-126-3p、miR-23a-3p、miR-208a-3p等9种exomiRs表达显著上调,并且发生变化的exomiRs与运动诱导的骨骼肌及血浆中发生变化的miR‑NAs并不完全一致,提示,运动调控了EXO生成过程中miRNAs的分选,选择性地促进特定exomiRs的表达。
2.2 长期运动对EXO分泌及exomiRs表达的调控
长期规律性运动可以提高人体免疫力,缓解代谢综合征,提高生活质量(孙海波 等,2020)。长期运动是否能影响EXO分泌及exomiRs表达备受学者关注。Bertoldi等(2018)研究发现,相比于3月龄大鼠,21月龄及26月龄老年大鼠EXO特异性标志蛋白CD63的表达显著降低,2周中等强度的跑台运动(60%O2max,每天20 min)显著上调了老年大鼠循环EXO中CD63的蛋白表达,下调了循环EXO内活性氧(reactive oxygen species,ROS)水平。Wang等(2020)研究发现,4周中等强度的跑台运动(10 m/min)可增强小鼠循环内皮祖细胞(endothelial progenitor cells,EPCs)来源EXO的分泌,上调EPCs来源exomiR-126的表达水平,减少中动脉阻塞诱导的细胞损伤。前期研究发现,db/db糖尿病小鼠进行4周跑台运动(低强度5 m/min,中等强度10 m/min,每天60 min,每周5天)可强度依赖性地促进EPCs来源EXO的分泌,上调exomiR-126的表达水平(Ma et al.,2018)。此外,8周中等强度的有氧运动(7 m/min,每天300 m,每周5天)促进了db/db糖尿病小鼠心源性EXO中exomiR-455、exomiR-29b、exomiR-323-5p和exomiR-466的表达(Chaturvedi et al.,2015)。
相比于久坐者,周期性运动的老年人基础状态下血清exomiR-486-5p、exomiR-215-5p、exomiR-941的水平显著上调,两组受试者一次性运动后血清exomiRs的表达谱也不相同,周期性运动者血清中产生变化的exomiRs主要与代谢激活的信号转导有关(Nair et al.,2020),提示,长期运动通过调控循环exomiRs的表达谱调节老年人的代谢能力。Hou等(2019)对经过1年以上团体赛艇训练(每天1~2 h,每周6天)的运动员和未训练者进行研究发现,在最后一次运动24 h后血浆EXO大小、浓度未见显著差异。值得注意的是,长期运动者血浆EXO对心肌细胞有保护作用,而未训练者EXO则无此效应,EXO对心肌细胞的保护作用通过 exomiR-342-5p实现(Hou et al.,2019)。以上研究提示,长期规律性运动或许并不能改变基础状态下循环EXO的大小及浓度,但可以选择性地促进体内某些特定细胞来源EXO的分泌。更重要的是,长期运动能调控exomiRs的表达谱,运动通过调控特定exomiRs的表达变化发挥健康促进的有益效应。
3 exomiRs介导运动促进心血管健康
3.1 exomiRs介导运动促进心脏健康
研究发现,exomiRs参与了心血管健康的调控。Ruan等(2018)研究发现,速效救心丸(心绞痛和冠心病的常用药物)可以促进小鼠心肌间充质干细胞(mesenchymal stem cells,MSCs)来源EXO的分泌,抵抗缺血/再灌注(ischemia/reperfusion,I/R)产生的心肌损伤。心肌祖细胞(cardiac progenitor cells,CPCs)来源的exomiR-133a可以降低心肌肥厚,抑制细胞凋亡,促进心脏收缩功能(Izarra et al.,2014)。CPCs来源的exomiR-451可以保护心肌细胞缓解氧化应激性损伤(Chen et al.,2013)。干细胞移植能促进坏死心脏区域心肌及血管再生,是心血管疾病治疗中非常有应用前景的治疗手段。造血干细胞(hematopoietic stem cells,HSCs)由骨髓向外周的运转活力是影响移植效果的重要因素。富含miR-126的EVs能抑制骨髓HSCs血管细胞粘附分子1(vascular cell adhesion molecule1,VCAM1)的表达,促进HSCs向外周血的运转(Salvucci et al.,2012)。Shao等(2017)研究发现,在心肌梗死(miocardial infarc‑tion,MI)的治疗中,胚胎干细胞(embryonic stem cells,ESCs)来源的EXO能抑制心肌纤维化、炎症,改善心脏功能,治疗MI比ESCs移植更有效,该研究发现,ESCs来源的exomiR-15、exomiR-21显著富集是产生良好治疗效果的原因。小鼠I/R前5 min注射MSCs来源EXO可增强心肌细胞活力,减少45%的梗死面积,保护心室的结构及收缩功能(Arslan et al.,2013),提示,EXO作为MI治疗剂具有巨大潜力。MI发生后21天心脏疤痕组织已经形成,此时向心肌注射心肌球样细胞(cardiosphere-derived cells,CDCs)来源EXO,可增加心肌细胞的存活、减少心脏的疤痕、改善心室射血功能,CDCs来源的exomiR-146a的抗氧化应激效应在缓解MI损伤,保护心脏功能中发挥了关键作用(Ibrahim et al.,2014)。以上研究证实,多种细胞来源的EXO通过特定exomiRs的调控缓解了病理状态下心肌细胞的损伤,改善了心脏功能。
体育运动可以减少心肌梗死面积,促进CVD患者的心肺功能(石晓明 等,2017;Hou et al.,2019)。有研究证实,exomiRs参与了运动对心脏功能的调控。Brahmer等(2019)研究发现,中等强度的有氧运动引起血小板、白细胞、ECs等细胞来源EVs的释放。急性MI发生后,运动康复诱导心脏分泌富含抗纤维化作用的exomiR-29b、exomiR-323-5p、exomiR-455、exomiR-466,上述exomiRs可以下调基质金属蛋白酶 9(matrix metalloproteinase 9,MMP9),从而降低MI后的不良重塑(Chaturvedi et al.,2015)。Hou等(2019)建立大鼠MI模型并将长期运动者血浆EXO进行大鼠心外注射,发现运动诱导的血浆exomiR-342-5p可以靶向抑制caspase 9和c-Jun氨基末端激酶2(c-Jun N-terminal kinase enzyme,JNK2)基因的表达,降低心肌梗死面积,提高心室射血分数,对心肌产生保护效应。细胞实验发现,长期运动者血浆EXO能抑制细胞凋亡,降低乳酸脱氢酶(lactate dehydrogenase,LDH)的分泌,增加细胞活力,缓解心肌细胞因缺氧/复氧(hypoxia/reoxygenation,H/R)刺激而产生的损伤(Hou et al.,2019)。缺氧预处理可模拟机体运动中缺氧的特性,研究发现,缺氧预处理可以促进CPCs来源EXO的分泌,并使CPCs来源的exomiR-103、exomiR-15b、exomiR-292等7种exomiRs表达上调,参与ECs血管生成以及心肌成纤维细胞(cardiac fibroblasts,CFs)分化相关的调控,将CPCs来源EXO通过心肌注射应用于I/R大鼠,可促进血管生成,减少心肌纤维化,改善心脏射血功能(Gray et al.,2015)。综上,运动可以选择性地促进特定细胞来源exomiRs的表达,运动以及模拟运动特性的刺激所诱导的exomiRs表达变化在促进心血管健康中发挥了关键作用(表1)。
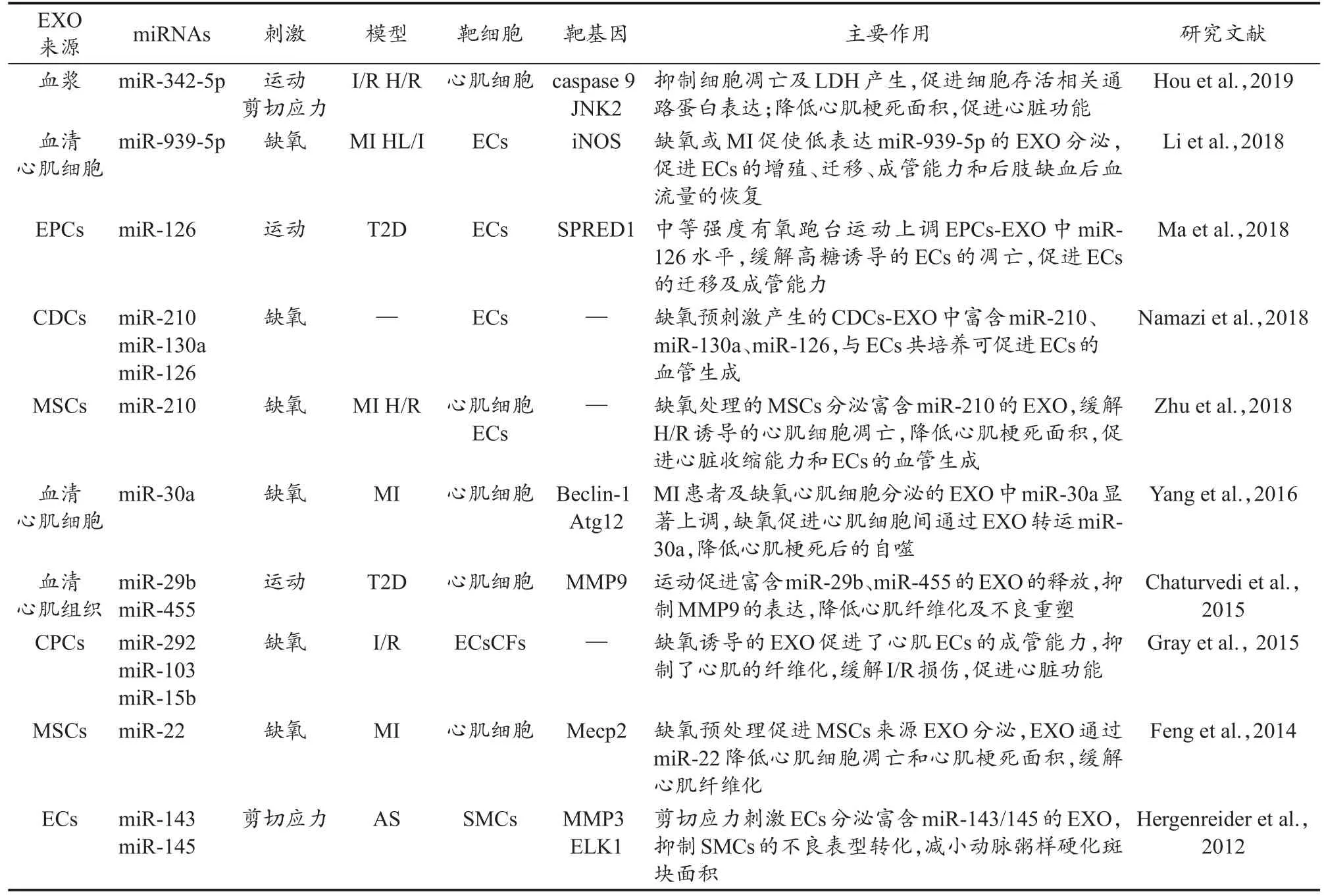
表1 运动及模拟运动特性的实验中exomiRs促进心血管健康的主要研究Table 1 The Main Research on the Promotion of Cardiovascular Health by exomiRs in the Experiments of Exercise and Simulated Exercise
3.2 exomiRs介导运动促进血管健康
伴随老龄化的发展,高血压、动脉粥样硬化(athero‑sclerosis,AS)等血管疾病高发。有研究发现,EXO以及exomiRs参与了血压及血管钙化的调节。Otani等(2018)将自发性高血压大鼠(spontaneously hypertensive rats, SHR)血浆EXO腹腔注射入正常大鼠体内能引起收缩压升高、胸主动脉壁增厚、胶原减少和心室肌纤维化,相反将正常大鼠血浆EXO注射进SHR大鼠体内,能使收缩压降低,心室肌纤维化得到缓解。骨髓MSCs来源EXO的运用可以降低高磷共孵育平滑肌细胞(smooth muscle cells, SMCs)的钙含量和碱性磷酸酶活性,抑制SMCs的钙化(Guo et al.,2019)。骨髓 MSCs来源 exomiR-146a可以靶向抑制SMCs硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)的活性,降低ROS的产生及SMCs的成骨样分化,缓解糖基化终产物对血管SMCs的损伤(Wang et al.,2018)。MSCs来源EXO与CDCs共培养改变了CDCs中miRNAs的表达谱,在MI后促进CDCs的存活,降低心肌纤维化,增加毛细血管密度(Zhang et al.,2016)。当将人体CD34+干细胞EXO注入小鼠缺血后肢(hind-limb ischemia,HL/I)时,可通过exomiR-126-3p抑制ECs出芽相关蛋白1(sprouty-related protein-1,SPRED1)的表达,改善缺血后肢毛细血管密度,促进后肢运动能力(Mathiyalagan et al.,2017)。Van Balkom等(2013)研究发现,ECs通过exomiR-214以自分泌的方式促进ECs的迁移、血管生成,改善毛细血管扩张失调。
运动可以促进血管的顺应性,缓解动脉硬化,逆转SMCs的不良表型转化,提高其收缩功能(陈金鳌 等,2014;廖静雯 等,2018;王帝之 等,2019)。有证据表明,exomiRs参与了运动对心血管调控的有益效应。少年男子自行车运动员急性运动中和运动后,调控血管功能的miR-126显著增加(Kilian et al.,2016),而miR-126主要来自ECs并大量存在于循环EVs中(Jansen et al.,2014)。4周中等强度的跑台运动(10 m/min,每天60 min,每周5天)可以上调EPCs来源exomiR-126水平,缓解高糖诱导的ECs凋亡,促进ECs的迁移及成管能力(Ma et al.,2018)。运动可以造成体内缺血、缺氧,能量需求及血流剪切应力增加等急性应激反应。用能量剥夺的体外实验模拟在体运动状态的研究发现,能量剥夺促进ECs分泌EVs,并将其富含的miR-126、miR-21转运到 SMCs(Wahl et al.,2016),提示,在运动状态下,EVs充当了ECs和SMCs之间信息交流及物质转运的媒介,调控运动对血管的有益效应。另一项研究发现,能量剥夺促进心肌细胞释放富含葡萄糖转运蛋白1(glucose transporter 1,GLUT1)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)、LDH和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3phosphate dehydrogenase,GAPDH)的EXO,这些EXO被邻近的ECs摄取,参与ECs的能量代谢调节(Garcia et al.,2016)。剪切应力增加是运动中血流产生的重要变化。体外研究发现,剪切应力刺激促进久坐者血小板来源EVs的释放(Chen et al.,2010)。以剪切应力刺激人血管ECs可以促进EXO的分泌并上调exomiR-143、exomiR-145的表达,将EXO与SMCs共培养诱导了SMCs基因表达变化及表型转化,缓解了载脂蛋白E(apolipopro‑tein E, ApoE)基因敲除小鼠动脉粥样硬化的形成(Hergen‑reider et al.,2012)。心肌缺血时供血供氧能力受损,而血管生成对于促进缺血心脏的再灌注和功能恢复至关重要。缺氧预处理可以促进CDCs来源EXO中exomiR-210、exomiR-130a和exomiR-126的表达上调,用CDCs来源EXO与血管ECs共培养后,可促进ECs的血管生成(Namazi et al.,2018)。以上在体及离体研究提示,多种细胞来源的EXO通过exomiRs在心血管细胞功能调控中发挥了关键作用(图2)。exomiRs介导运动促进了体内多个系统的信息交流及物质转运,在病理状态下发挥对心血管系统的保护效应。

图2 不同细胞来源exomiRs对心血管细胞的调控Figure 2. Regulation of Cardiovascular Cells by exomiRs from Different Cells
4 exomiRs在CVD中的未来应用展望
4.1 exomiRs作为CVD预测和诊断的生物标志
exomiRs表达谱受身体健康状况影响,特定疾病会诱导体内产生特异性exomiRs(Garcia-Contreras et al.,2017)。在心肌病的诊断中,患者循环exomiR-133a在肌酸激酶、肌钙蛋白等传统生物标志物升高之前就发生了显著升高(Kuwabara et al.,2011),提示,特定exomiRs在预测心肌病发病中具有很高的敏感性。在所有MI患者中,大约25%会在1年内发生心力衰竭而面临死亡(Velagaleti et al.,2008)。Matsumoto等(2013)研究发现,急性MI后2~3周患者血清exomiR-194和exomiR-34a显著增加,而这些exomiRs的水平增加更易于使患者在后期发展成心力衰竭。稳定型冠心病患者循环exomiR-199a、exomiR-126的水平与心血管不良事件发生风险呈负相关,而循环miR-199a和miR-126与心血管不良事件发生风险并无相关性(Jansen et al.,2014)。加之被脂质膜包裹免受RNA酶的降解(Cheng et al.,2014),循环exomiRs相比循环miRNAs能更加敏感而稳定地预测心血管健康状态。此外,长期运动能上调循环exomiR-342-5p以及心源性exomiR-29b、exomiR-323-5p、exomiR-455、exomiR-466的表达,产生心血管保护效应(Chaturvedi et al.,2015;Hou et al.,2019),提示,在心肌梗死患者的运动康复中,可以通过测试上述exomiRs的表达判断疾病进展及运动康复效果。相比临床指标,exomiRs在CVD的诊断、病理发展、不良心血管事件发生风险预测中具有较高的敏感性,有望发展为CVD风险预测、临床诊断以及运动康复效果评定的生物标志物。
4.2 exomiRs成为CVD靶向治疗的新方法
运动通过调控EXO的代谢动力和exomiRs表达谱对心血管产生保护作用。干细胞来源的EXO具有母细胞的某些特性,可以降低心肌纤维化和不良重塑,促进血管增生,提高心血管功能,在CVD的治疗中比母细胞产生更好的效果(Davidson et al.,2018)。加之EXO的纯化、输送和储存比干细胞制备和输送更加简单和快捷。所以,收集健康年轻人或长期运动者的血液并制备EXO,将其注入CVD患者体内,有望成为治疗CVD的新方法。EXO是转运核酸的天然载体,相比现有的核酸载体具有更加优越的循环稳定性、生物相容性和较低的毒性(Lin et al.,2020)。随着对EXO生物生成、包装机制、生理特性的了解,未来通过基因技术将某些特定miRNAs装载到EXO制备纳米药物,利用EXO归巢能力强、靶外效应小的特点(Floriano et al.,2020;Tomasetti et al.,2017)实施无细胞靶向治疗CVD,将成为可能。
5 结语
EXO分泌是体内存在的基本生理过程,分泌缺乏将诱发病理过程(Alexander et al.,2017)。运动促进了特定EXO的分泌,调控了exomiRs的表达谱,exomiRs介导运动在促进心血管健康方面发挥了重要作用,在临床CVD的预防、诊断及治疗中具有很好的应用前景。但是,目前的研究与临床应用还有一定距离,某些问题尚待进一步阐释:1)EXO的粒径范围与EVs中微囊泡的粒径范围出现重叠(Lawson et al.,2016),不同研究中EXO粒径的界定也有分歧(Lawson et al.,2016;Pluchino et al.,2019),需在未来研究中规范EXO的粒径范围,确保研究结果的准确性。2)鲜见exomiRs介导运动调控心血管健康的研究,尤其是在体研究。后期尚需加大研究力度,期望临床实现运动处方科学指导运动来调控exomiRs的表达,从而达到内源性非药物治疗CVD的目的。3)不同细胞来源EXO的半衰期不同(Saunderson et al.,2014;Takahashi et al.,2013),不同注射途径也会影响EXO在体内的分布(Zhou et al.,2020)。因此,后期在EXO的代谢动力学方面还需深入研究,以便能在临床应用中寻找治疗CVD的最佳注射时间和注射途径。
