microRNA125a-3p对滋养层细胞功能的调控作用及机制
2023-02-19刘倩张琦谢青贞
刘倩,张琦,谢青贞
(武汉大学人民医院生殖医学中心,武汉 430060)
胚胎着床是人类和胎生动物生殖生理过程中的一个重要环节,绝大多数的妊娠丢失被认为发生于胚胎着床期间[1]。滋养层细胞在胚胎着床和整个妊娠过程中具有重要作用,其功能失调会导致胚胎着床失败、自然流产、妊娠滋养层细胞疾病等妊娠相关性疾病的发生。然而滋养层细胞功能的调控机制至今仍未完全明确。
microRNAs(miRNAs)是一类非编码的小RNA,在蛋白质的转录后表达过程中发挥重要作用。其中,microRNA125a-3p(miR-125a-3p)在抑制细胞增殖分化、侵袭等活动方面具有重要作用,并在多种肿瘤细胞中异常表达[2]。在生殖方面,miR-125a-3p被指出参与了卵母细胞的成熟过程[3]。细胞外信号调节激酶(ERK1/2)等信号传导通路的活化也受到miR-125a-3p的调控[4]。我们的前期研究首次发现滋养层细胞中存在Fyn的表达,后者可调控滋养层细胞的功能(未发表数据)。miR-125a-3p被证实可通过与Fyn mRNA 3′端的非翻译区相结合,直接抑制Fyn的表达和活性,其对细胞活动的影响至少部分依赖于Fyn的作用[5]。因此,本研究拟进一步检测miR-125a-3p在不同滋养层细胞系中的表达特点,并从滋养层细胞行为角度探索miR-125a-3p的作用及相关机制,以进一步了解胚胎着床过程及滋养层细胞功能调控,为相关妊娠并发症的诊治提供新依据。
材料和方法
一、细胞系
人滋养层细胞系HTR-8/SVneo,绒癌细胞系JAR和JEG-3均购自ATCC(American Type Culture Collection),培养在37℃、5%CO2条件下。
二、主要试剂和仪器
RPMI 1640、MEM、胎牛血清、胰酶-EDTA溶液(0.25%)、青霉素-链霉素混合液、Opti-MEMI均购自美国GIBCO公司,Trizol购自美国Ambion公司,HiScript Reverse Transcriptase(RNase H)、5×HiScript Buffer、50×ROX Reference Dye Ⅱ、SYBR Green Master Mix均购自南京诺唯赞生物科技股份有限公司,miR-125a-3p inhibitor及阴性对照、miR-125a-3p引物、U6引物、GAPDH引物均来源于上海捷瑞生物工程有限公司,Lipofectamine 2000购自美国Thermo公司,CCK8细胞增殖及细胞毒性检测试剂盒购自美国MCE公司(MedChemExpress),Transwell小室和Matrigel基质胶均购自美国Corning公司,细胞凋亡检测试剂盒购自南京凯基生物,RIPA裂解液、BCA蛋白浓度测定试剂盒、蛋白A/G-琼脂糖均购自上海碧云天生物技术有限公司,抗GAPDH兔多克隆抗体购自杭州贤至生物有限公司,抗Fyn兔单克隆抗体、抗信号传导和转录激活因子3(STAT3)兔单克隆抗体、抗ERK鼠单克隆抗体、抗p-ERK兔单克隆抗体均购自英国Abcam公司,抗p-STAT3兔单克隆抗体购自美国CST公司,HRP标记羊抗小鼠二抗和HRP标记羊抗兔二抗均购自武汉博士德生物工程有限公司,通用酪氨酸激酶测定试剂盒购自日本Takara公司。
ABI QuantStudio6实时荧光定量PCR仪购自美国Applied Biosystems公司,Odyssey红外荧光扫描成像系统购自美国LI-COR公司,奥利巴斯光学显微镜IX51购自日本OLYMPUS公司,多功能酶标仪Flexstation 3购自美国Molecular Devices公司,CytoFLEX流式细胞仪购自美国Beckman Coulter公司。
三、实验方法
1.实时荧光定量PCR:Trizol法提取细胞中的总RNA,分光光度计检测纯度。按照HiScript Reverse Transcriptase试剂说明合成cDNA,采用20 μl的cDNA、引物、SYBR Green 和ROX reference dye Ⅱ混合物构成PCR反应体系,2-ΔΔCT计算目的基因的相对表达量。所用引物序列如下:miR-125a-3p正向引物:5′-TGCGCACAGGTGAGGTTCTTGG-3′,反向引物:5′-CCAGTGCAGGGTCCGAGGTATT-3′;茎环引物:5′-GTCGTATCCAGTG-CAGGGTCCGAGGTATTCGCACTGGATACGAC-GGCTCCCA-3′;U6正向引物:5′-CGCTTCGGCAGCACATATAC-3′,反向引物:5′-AAATATGGAACGCTTCACGA-3′;Fyn正向引物:5′-GCACGGACAGAAGATGAC-3′,Fyn 反向引物:5′-CCAATCACGGATAGAAAGT-3′;GAPDH正向引物:5′-TCAAGAAGGTGGTGAAGCAGG-3′,GAPDH反向引物:5′-TCAAAGGTGGAGGAGTGGGT-3′。
2.细胞转染及分组:细胞培养于37℃恒温培养箱中,胰蛋白酶消化传代。选取指数生长期的HTR-8/SVneo、JEG-3细胞,待细胞融合度约为70%时,利用Lipofectamine 2000进行分组转染:(1)空白对照组(CK组),未做任何处理;(2)阴性对照组(NC组),转染NC-inhibitor;(3)实验组(inhibitor组),转染miR-125a-3p inhibitor。转染6 h后换液,转染24 h后收集各组细胞以备检测。
3.CCK-8法检测细胞增殖情况:取指数生长期的细胞以5×103/孔接种于96孔板,转染24 h后,每孔加入10 μl CCK-8,37℃培养4 h,酶标仪测定450 nm波长下各孔吸光值(OD450)。
4.Transwell法检测细胞侵袭能力:分别收集各组细胞,无血清培养基稀释细胞浓度至3×105/ml。无血清培养基稀释Matrigel胶至终浓度1 mg/ml。24孔板中预先加入4℃预冷800 μl 10% FBS的培养基(含双抗),并放入Transwell小室,在Transwell小室上室底部中央垂直加入100 μl Matrigel胶,37℃温育4~5 h使其干成胶状,后在Transwell上室分别加入200 μl各组细胞悬液,37℃、5%CO2培养24 h。70%乙醇固定细胞,0.5%结晶紫染色。倒置光学显微镜下,随机选择5个100倍视野,计算侵袭细胞数。
5.流式细胞仪检测细胞凋亡情况:用培养基调整指数生长期的细胞密度到5×105/ml,接种于6孔板,每孔1 ml细胞悬液,转染24 h后按照AnnexinV-APC/7-AAD细胞凋亡检测试剂盒进行操作。同时设阴性对照,即正常细胞不加AnnexinV-APC和7-AAD;阳性对照1,以凋亡效果最明显的溶剂组作为阳性对照,只加5 μl AnnexinV-APC单标;阳性对照2,以凋亡效果最明显的溶剂组作为阳性对照,只加5 μl 7-AAD单标。流式细胞仪上机检测,以nnexinV-APC和7-AAD双阳、AnnexinV-APC单阳细胞视为凋亡细胞。
6.Western blot检测蛋白表达:细胞裂解后提取总蛋白,BCA法测定总蛋白浓度。通过12%聚丙烯酰胺凝胶电泳(SDS/PAGE)分离蛋白,并通过电印迹转移到聚偏氟乙烯(PVDF)膜。室温下,5%脱脂奶粉封闭1 h,一抗孵育,4℃过夜。漂洗后,HRP标记二抗室温孵育1 h。显影,曝光,BandScan分析胶片灰度值。
7.免疫共沉淀法检测Fyn活性:将总细胞裂解蛋白液与50 μl蛋白A/G-琼脂糖珠混合,混合物4℃ 10 000g离心10 min,取上清液,加入5~30 μg靶向FYN特异性抗体,室温孵育1 h,再加入30 μl蛋白A/G-琼脂糖,室温孵育20 min。使用通用酪氨酸激酶测定试剂盒,依照说明书测定Fyn激酶活性。
四、统计学分析

结 果
一、miR-125a-3p在3种不同细胞系中的表达水平
采用实时荧光定量PCR检测HTR-8/SVneo、JAR和JEG-3细胞中miR-125a-3p的表达,结果显示,miR-125a-3p mRNA相对表达水平在HTR-8/SVneo、JAR和JEG-3细胞中依次降低,以HTR-8/SVneo细胞为参照,分别为(1.000±0.012)、(0.664±0.022)和(0.322±0.019),组间比较均有统计学差异(P<0.01)(图1)。
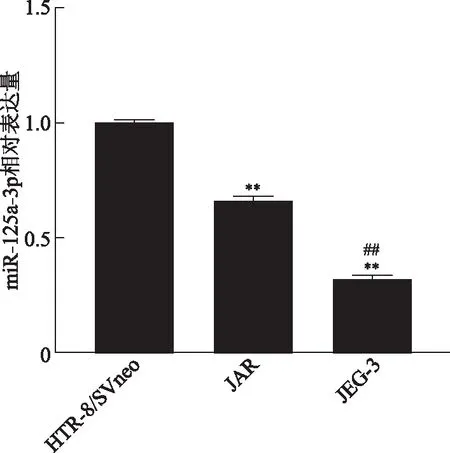
与HTR-8/SVneo组比较,**P<0.01;与JAR组比较,##P<0.01。图1 miR-125a-3p在不同细胞系中的表达
二、miR-125a-3p干预对其在滋养层细胞中表达水平的影响
干预实验以miR-125a-3p表达最高的HTR-8/SVneo细胞系和miR-125a-3p表达最低的JEG-3细胞系为实验对象,转染miR-125a-3p inhibitor后,实时荧光定量PCR检测滋养层细胞中miR-125a-3p表达水平。HTR-8/SVneo和JEG-3细胞中inhibitor组miR-125a-3p的相对表达水平显著低于空白对照组(CK组)及阴性对照组(NC组)[分别为(0.406±0.038)vs.(1.000±0.029)vs.(1.031±0.098),(0.415±0.035)vs.(1.000±0.093)vs.(1.060±0.092),P<0.05](图2)。

A:HTR-8/SVneo细胞;B:JEG-3细胞。与其他两组比较,*P<0.05。图2 HTR-8/SVneo细胞和JEG-3细胞转染miR-125a-3p inhibitor后的表达抑制
三、miR-125a-3p对滋养层细胞增殖能力的影响
CCK-8检测结果显示,转染miR-125a-3p inhibitor后滋养层细胞的增殖能力增强(图3)。HTR-8/SVneo细胞的增殖率,CK组为(100.000±3.808)%,NC组为(99.408±0.854)%,inhibitor组则升高至(142.190±3.297)%,inhibitor组与其他两组比较具有统计学差异(P<0.05)。JEG-3细胞的增殖率,CK组为(100.000±1.762)%,NC组为(98.821±3.064)%,inhibitor组则升高至(120.917±2.239)%,inhibitor组与其他两组比较具有统计学差异(P<0.05)。
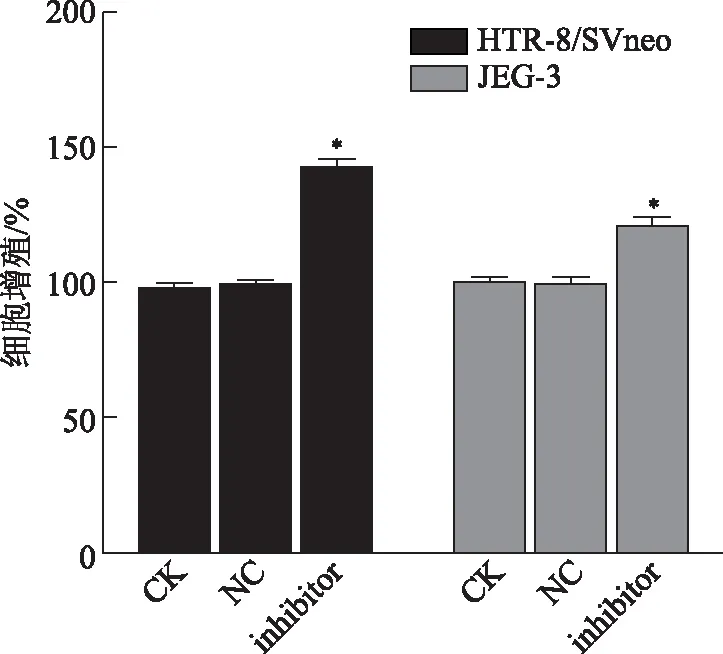
与其他两组比较,*P<0.05。图3 miR-125a-3p对滋养层细胞增殖能力的影响
四、miR-125a-3p对滋养层细胞侵袭作用的影响
Transwell小室实验结果显示,HTR-8/SVneo细胞系中miR-125a-3p inhibitor转染细胞的侵袭数量较CK组和NC组显著增加[(1.422±0.062)vs.(1.000±0.025)vs.(1.006±0.027),P<0.05];JEG-3细胞系中inhibitor组的细胞侵袭数量较CK组和NC组显著增加[(1.286±0.026)vs.(1.000±0.022)vs.(1.010±0.033),P<0.01](图4)。
五、miR-125a-3p对滋养层细胞凋亡的影响
流式细胞仪检测结果显示,miR-125a-3p抑制后,滋养层细胞的凋亡数量减少(图5)。HTR-8/SVneo细胞的凋亡率,CK组为(6.137±0.159)%,NC组为(6.437±0.266)%,inhibitor组则下降至(2.290±0.223)%,inhibitor组与其他两组比较具有统计学差异(P<0.01)。JEG-3细胞的凋亡率,CK组为(6.793±0.134)%,NC组为(7.547±0.273)%,inhibitor组则为(4.287±0.333)%,inhibitor组与其他两组比较具有统计学差异(P<0.05)。

A:不同处理下滋养层细胞相对侵袭数量:与其他两组比较,*P<0.05,**P<0.01。B:各组Transwell小室实验结果:图中蓝紫色显示为迁移到下层的细胞。图4 miR-125a-3p对滋养层细胞侵袭能力的影响

A:不同条件下滋养层细胞凋亡情况的流式细胞散点图;B:各组细胞的凋亡率:与其他两组比较,*P<0.05,**P<0.01。图5 miR-125a-3p对滋养层细胞凋亡的影响
六、miR-125a-3p对滋养层细胞中Fyn的表达和活性的影响
HTR-8/SVneo和JEG-3细胞进行转染实验后,检测Fyn的mRNA和蛋白表达,以及活性变化。结果显示,miR-125a-3p inhibitor转染组中Fyn的mRNA和蛋白表达量明显增加,活性水平亦明显升高(图6)。HTR-8/SVneo细胞中Fyn mRNA相对表达水平:CK组为(1.000±0.108),NC组为(0.990±0.082),inhibitor组上升至(3.590±0.184),inhibitor组与其他两组相比有显著性差异(P<0.01);HTR-8/SVneo细胞中Fyn蛋白相对表达量:inhibitor组(2.851±0.205)显著高于CK组(1.018±0.204)和NC组(1.000±0.241)(P<0.05);HTR-8/SVneo细胞中Fyn的活性水平:inhibitor组[(73.311±3.090)U/5×106细胞]显著高于CK组[(25.322±2.025)U/5×106细胞]和NC组[(32.000±1.732)U/5×106细胞](P<0.01)。JEG-3细胞呈现出类似的改变,inhibitor组Fyn mRNA相对表达水平(2.070±0.130)显著高于CK组(1.000±0.089)和NC组(1.080±0.102)(P<0.01);Fyn蛋白相对表达量(2.797±0.047)显著高于CK组(1.125±0.020)和NC组(1.000±0.047)(P<0.01);Fyn活性水平[(154.200±2.810)U/5×106细胞]显著高于CK组[(108.684±3.888)U/5×106细胞]和NC组[(103.242±2.755)U/5×106细胞](P<0.01)。
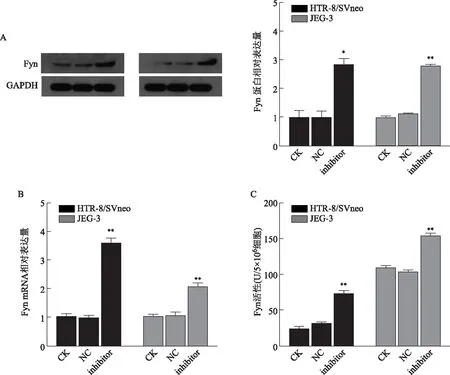
A:Western blot检测Fyn蛋白水平;B:实时荧光定量PCR检测Fyn mRNA水平;C:免疫共沉淀检测Fyn活性水平。与其他两组比较,*P<0.05,**P<0.01。图6 抑制miR-125a-3p后Fyn mRNA和蛋白表达及活性变化
七、miR125a-3p对滋养层细胞中相关信号通路的影响
采用Western blot检测抑制miR-125a-3p后滋养层细胞中相关信号通路ERK1/2和STAT3的磷酸化水平,以评估miR-125a-3p是否可通过ERK1/2-STAT3通路对滋养层细胞的功能发挥调控作用。如图7显示,转染miR-125a-3p inhibitor后,ERK1/2及STAT3的磷酸化水平均不同程度增加。HTR-8/SVneo细胞中miR-125a-3p inhibitor转染组中的ERK1/2和STAT3磷酸化比值为(0.904±0.071)、(0.903±0.018),分别显著高于CK组的(0.322±0.024)和(0.308±0.052)以及NC组的(0.338±0.024)和(0.332±0.054)(P<0.05);JEG-3细胞中miR-125a-3p inhibitor转染组中的ERK1/2和STAT3的磷酸化比值为(0.913±0.090)、(0.893±0.113),分别显著高于CK组的(0.271±0.020)和(0.348±0.091)以及NC组的(0.298±0.006)和(0.341±0.096)(P<0.05)。

A:不同条件下各蛋白的代表性Western blot条带;B:不同条件下ERK1/2的磷酸化水平;C:不同条件下STAT3的磷酸化水平;与其他两组比较,*P<0.05。图7 miR-125a-3p对滋养层细胞中ERK1/2-STAT3信号通路的影响
讨 论
滋养层细胞是一类特殊的上皮细胞,具有强大的侵袭能力。妊娠过程中,滋养层细胞对子宫的侵袭过程类似肿瘤的浸润转移,但与肿瘤细胞不同,滋养层细胞的活动同时受到刺激因子和抑制因子的调控而具有时空特异性和自限性。滋养层细胞自身、子宫上皮和基质细胞、子宫自然杀伤细胞及巨噬细胞等产生的各类因子均可调控滋养层细胞的行为及功能,酪氨酸激酶JAK-STAT3、ERK1/2、Wnt等多条信号通路参与其中。各因素维持动态平衡是保证滋养层细胞发挥正常功能的关键[6-7]。滋养层细胞功能异常与胚胎着床失败、自然流产、妊娠滋养层细胞疾病、子痫、胎儿宫内生长受限等妊娠并发症的发生相关。
人胎盘可不同程度地表达大量miRNAs,滋养层细胞是其主要来源[8-9]。使用miRNA阵列等高通量测序方法已在正常人类胎盘中鉴定出600多种miRNAs[10]。同样,从胎盘分离的滋养层细胞中也检测到762种miRNAs,其中大约一半明显表达,部分特异性表达于人胎盘,且这些miRNAs的表达随着妊娠时期的变化而改变[9]。miRNA在胎盘中的时间表达模式提示其在不同妊娠时期可能具有特定功能,并在妊娠的建立和维持中发挥重要作用。而正常妊娠和病理妊娠胎盘组织中miRNA的表达也不同。Hromadnikova等[11]的研究显示,与正常妊娠胎盘相比,子痫前期和胎儿宫内生长受限患者胎盘中miR-515-5p、miR-517-5p和miR-520a-5p等多种miRNA表达改变,提示miRNA可通过某些靶向基因调控滋养层细胞行为和功能,包括凋亡、迁移和侵袭等。例如子痫前期胎盘中高表达的miR-24-3p靶向作用于视黄醇结合蛋白4,抑制滋养层细胞的增殖和侵袭[12]。而另一些miRNAs则可能促进滋养层细胞的活动,在相关疾病中发挥相反作用。有研究发现,miR-18b通过下调Notch2依赖的T细胞免疫球蛋白粘液素3/雷帕霉素复合物1通路,促进滋养层细胞的增殖和侵袭,进而有利于改善子痫前期状态[13]。
miR-125a-3是miR-125a家族的成员,起源于pre-miR-125a的3′端。既往报道指出,miR-125a-3p通常在癌细胞中异常表达,对各种类型癌症的发展具有不同的影响,可作为肿瘤诊断的标志因子及治疗靶点[14-15]。例如,miR-125a-3p在人乳头状甲状腺癌组织和细胞系中的表达水平分别低于正常甲状腺组织和正常甲状腺细胞系,对于乳头状甲状腺癌细胞的生长和转移具有显著抑制作用[16]。本研究发现滋养层细胞可表达miR-125a-3p,并且在不同滋养层细胞系中表达水平亦存在差异,提示miR-125a-3p的表达与滋养层细胞状态及功能有关。我们的进一步研究证实,miR-125a-3p对于滋养层细胞的增殖、侵袭同样具有抑制作用,同时可促进滋养层细胞的凋亡。此为对miR-125a-3p在滋养层细胞中表达及作用的首次研究。
我们的前期研究发现,Fyn可促进滋养层细胞的活动。Fyn为非受体酪氨酸激酶Src家族中的一员,可表达于多种细胞的质膜上,通过调控各类信号传导通路,参与细胞的分化、凋亡、运动和侵袭等,在肿瘤的发生发展和免疫细胞的增殖分化中具有重要作用。值得注意的是,miR-125a-3p被证实可通过与Fyn mRNA 3′端的非翻译区相结合直接抑制Fyn的表达和活性,miR-125a-3p对肿瘤细胞的调控作用至少部分依赖于Fyn[17]。本研究中,转染miR-125a-3p inhibitor后,滋养层细胞中Fyn蛋白、mRNA表达及活性均显著升高,这也证实在滋养层细胞中miR-125a-3p同样对Fyn发挥负调控作用。
ERK1/2信号通路主要参与细胞增殖活化、形态维持、骨架重建等,与滋养层细胞的功能密切相关。最近的一项研究指出,ERK1/2通路参与调控滋养层细胞的侵袭迁移活动[18]。另有研究表明,在不同的刺激因子下,ERK1/2通路活化,STAT3随即发生磷酸化,促进JEG-3细胞的侵袭[19]。ERK1/2通路被抑制后,人滋养层细胞系HTR8/SVneo的增殖、侵袭能力和IFN-γ的分泌水平均下降[20]。本研究转染miR-125a-3p inhibitor后,滋养层细胞中ERK1/2和STAT3的磷酸化水平均显著升高,提示在滋养层细胞中miR-125a-3p可抑制ERK1/2-STAT3信号通路的活化。
综上所述,本研究首次发现滋养层细胞中存在miR-125a-3p的表达,且其在绒癌细胞系中低表达,表达水平与滋养层细胞功能相关。通过对Fyn和ERK1/2-STAT3信号通路的抑制作用,miR-125a-3p可抑制滋养层细胞的增殖和侵袭,促进其凋亡,进而在胚胎着床中发挥重要作用。对于临床样本及动物实验的研究将在后续进一步开展,并更深入探讨调控机制。本研究有利于进一步理解胚胎着床过程及滋养层细胞的功能调控,并为胚胎着床失败、自然流产、妊娠滋养层细胞疾病的防治提供理论参考。
