创新药医保准入差异化管理国际经验及启示
2023-02-18颜建周李大双任晓悦曾添筑丁文静
颜建周 李大双 任晓悦 曾添筑 丁文静 邵 蓉
(中国药科大学国际医药商学院 南京 211198)
近年来,我国不断深化医疗保障制度改革,出台了《关于深化医疗保障制度改革的意见》(中发〔2020〕5 号)、《基本医疗保险用药管理暂行办法(国家医疗保障局令第1 号)》(2020)等政策法规,明确了医保目录动态调整的基本原则和方式等,并组织开展了多次创新药准入谈判实践,极大鼓励了医药创新。自2017 年以来,共有近300 个创新药通过医保谈判进入医保目录,平均降幅达到50%以上[1],大大加速了创新药的医保准入,提高了我国患者的创新药可及性。
随着我国医药创新能力的不断提升,我国每年获批和在研的新药数量快速增长。2017 年—2021 年我国上市新药总数达到328 个[2],处于上市审评或临床试验阶段的在研新药数量也屡创新高,预示着未来新药上市数量将逐年持续增加。现行的医保准入制度在鼓励医药创新、保障用药可及的同时,将面临创新药数量快速增长与医保基金可负担性的矛盾和挑战。另一方面,我国创新药同质化严重,大部分为Me-too 等创新程度较低的跟随创新,真正做源头创新的药品较少。《“十四五”生物经济发展规划》明确提出,要提升生物医药原始创新能力,保障人民生命健康和国家生物安全[3],源头创新被推向了我国生物医药发展战略的新高度。
在新形势下,迫切需要制度创新以平衡医保基金持续健康发展与创新药可及性之间的关系,同时从需求侧引导医药产业创新方向,以创新驱动国家发展战略。因此,探讨我国创新药医保准入中基于创新程度不同,实施差异化医保准入政策就具有重要的现实意义。
1 创新药医保准入差异化管理国际经验
1.1 英国
1.1.1 ICER 阈值调整。英国依据药品满足患者需求情况、产品创新改进情况、药品可替代性等方面对阈值进行适当的调整,对治疗严重威胁生命的疾病的药物和填补临床需求的药物、表现出更突出的治疗创新性以及与其他药品相比有更大改进的药品设定更高的阈值,实现对高创新性高临床价值的药品在医保准入阶段的激励。
2013 年英国国家卫生和临床技术优化研究所(National Institute for Health and Clinical Excellence, NICE)开展了高度专业技术(Highly Specialized Technology,HST)评估计划,针对超罕用药(即在英国发病人数少于1000 或发病率≤1:50000 的罕见病治疗药物),首先对ICER 阈值进行调整,阈值放宽至10 万英镑/QALY,低于10 万英镑/QALY的超罕用药可以直接准入医保[4]。其次对每QALY 所需ICER 超过10万英镑的药物进行QALY 权重调整,保障临床疗效突出药品的医保准入。例如,药物A 在权重调整前每延长1 个QALY 需要11 万英镑,且相较于标准疗法能够延长18 个QALY,则药物A 在权重调整后的ICER 为6.1 万英镑/QALY(11 万英镑/1.8=6.1 万英镑),符合HST模式下成本效果评估要求,允许直接进入医保[5]。
1.1.2 风险分担协议。英国自2009 年引入患者准入计划(Patient Access Scheme,PAS),该计划由制药企业提出申请、由英国国家医疗服务体系(National Health Service,NHS)和企业达成风险分担协议,为患者提供获得高价创新药的机会,并专门设立了患者准入计划联络处负责该项政策实施[6]。
PAS 风险分担方案有两类,一是基于财务的风险分担方案(Financial-Based Risk-Sharing Agreements,FBRSA),二是基于结果的风险分担方案(Performance-Based Risk-Sharing Agreements,PBRSA)。FBRSA 的主要目标是控制预算影响,增强药品可及性,主要的措施包括控制患者使用上限、控制费用上限及在开始阶段提供折扣或免费治疗等。PBRSA 的目标则是收集药品真实使用数据、根据患者使用药物的效果进行精准支付,采取基于疗效付款或仅对参与研究的患者付费(见图1)。
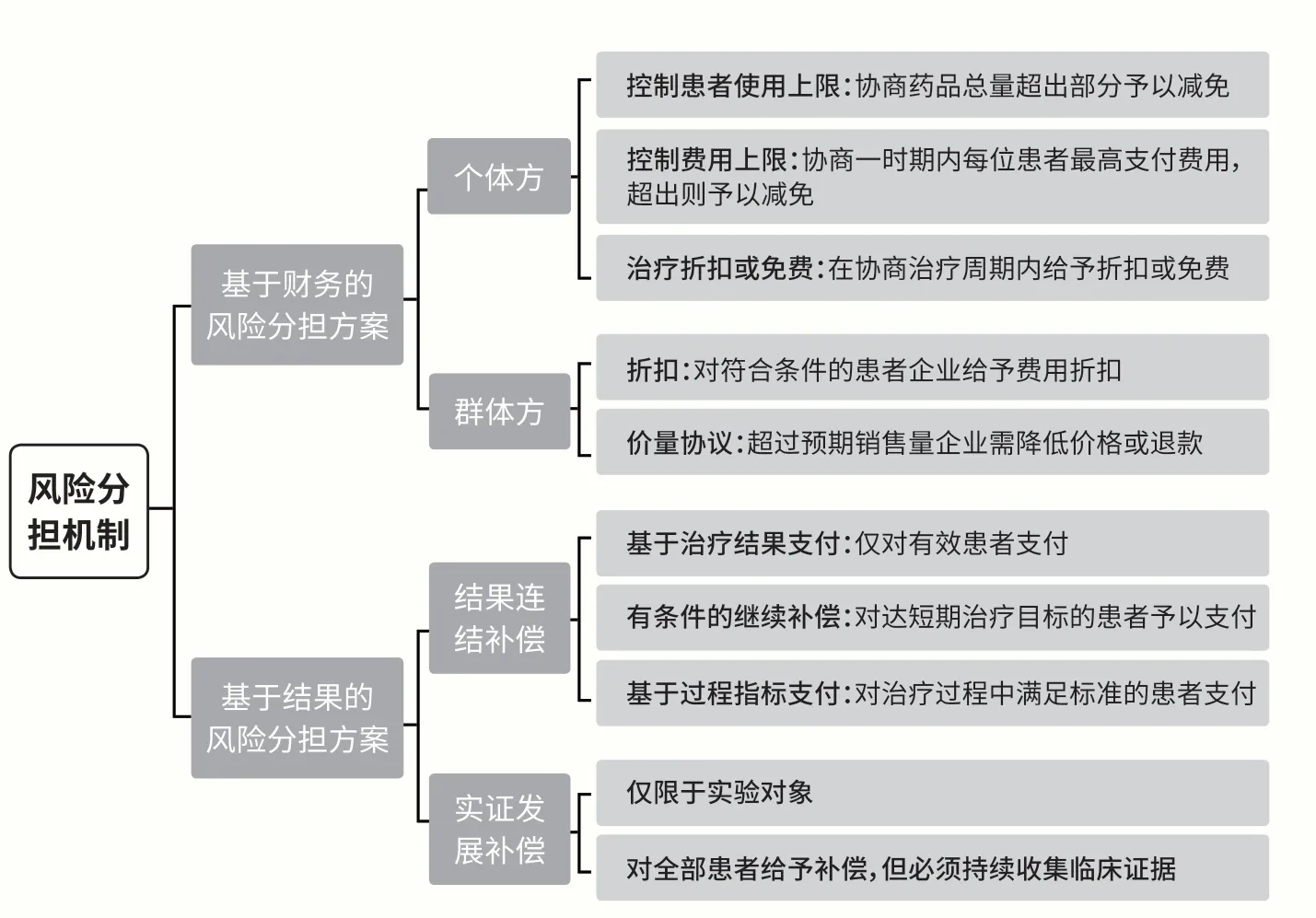
图1 PAS 风险分担方案
2019 年NHS 发布药品商业框架(NHS Commercial Framework for Medicines),制定了更灵活的风险分担协议,包括PAS、商业准入协议(Confidential Commercial Agreements,CAA)、管理准入协议(Managed Access Agreements,MAA)和预算影响测试(Budget Impact Test,BIT)四种途径。除PAS 外,企业可根据自身条件和诉求选择协议类型,如当制药企业认为药品价值相较于NICE 设定的成本效果阈值可以更高时、不同适应症治疗价值不同不适合统一价格的药品时,可以签订CAA 协议,保证最大程度体现创新药的创新价值和临床价值。
1.1.3 不确定性管理。高创新性、高临床价值创新药在上市初期多基于Ⅱ期单臂临床试验的证据,在医保准入过程中缺乏足够临床数据证明长期疗效,此类药品在医保准入时往往存在一定的不确定性风险。为降低此类风险,“附条件批准-准入后再评价-基于再评价评估药品价值”的动态调整机制被域外典型国家广泛运用于医保准入决策中。英国的癌症药物基金(Cancer Drugs Fund,CDF)会分担创新抗癌药准入NHS 的不确定性风险[7]。CDF 首先会评估药品是否具有潜在的疗效和成本效果以及是否可以通过补充数据降低不确定性,在评估通过后会与其签订数据收集协议及预算风险分担协议,明确厂商在协议期内的义务,以降低因初始数据不足而造成的创新抗癌药的不确定性风险。厂商在获得CDF 基金准入后需开展相关研究并收集证据,最后协议到期后,NICE 将针对新收集的数据及证据重新评估抗癌药品的ICER值,当ICER 值符合NHS 阈值时作出NHS 报销准入的建议,若不满足NHS 阈值要求,则作出拒绝准入的决策。在保证高创新性、高临床价值的创新药医保准入的同时,降低医保的不确定性风险(见图2)。

图2 英国癌症基金会高值药品准入管理流程
1.2 日本
1.2.1 定价机制。日本的新药定价主要根据有无类似药而采取类似药定价法或成本定价法。如果医保目录已经收录了类似的药品,那么就采用类似药比较法确定新药的价格。厚生劳动省会根据药品的创新程度增加一个溢价,而药品的创新程度是根据以下四点判断的[8]:①新的作用机制;②更高的疗效或者安全性;③改善目标疾病的治疗;④有益的药物配方。溢价的比例会根据药物创新程度有所不同,溢价范围为5%—120%[9];对于获得“先驱认定”(类似于我国的“突破性治疗药物”)且在日本优先上市的药品,会直接给予10%—20%的溢价(见图3)。

图3 类似药比较法的调整加价
对优先在日本上市且无合适参照药的高创新性、高临床价值创新药会采取成本加成定价法,成本是指生产、管理、利润等的费用加和,其中利润会根据药品创新程度有所不同,若创新程度较高,该药物的利润会在标准利润率的基础上进行上升调整。
1.2.2 ICER 阈值调整。为了缓解日益增长的医疗费用,日本自2012 年开始采用成本效益评估结果对医保目录中的药品价格进行调整,根据现有的报销水平、过去支付意愿调查结果、人均GDP 和各国基准值,试行期将500 万日元/QALY、750 万日元/QALY 和1000万日元/QALY 作为基准值。而对于特殊药品则会单独设定基准值,如治疗方法有限的罕见病、小儿疾病、恶性肿瘤等治疗药品基准值为750 万日元/QALY、1125 万日元/QALY、1500 万日元/QALY[14]。对于填补了治疗空白的创新药品,会给予一个较高的基准值,有利于源头创新药品获得较高的定价,激励源头创新药品的研发。
1.3 澳大利亚
1.3.1 ICER 阈值调整。澳大利亚的药品福利计划(Pharmaceutical Benefits Scheme,PBS)目录准入过程中,会基于多个原则和标准对ICER 阈值进行动态调整,包括临床必需且无替代疗法、具有显著的临床治疗价值、药品无报销情况下患者负担能力和“救援原则”[10]。救援原则主要包括目标患者病情严重进入生命终末期、药物目标患者数量非常少两个方面。澳大利亚目前仍然是以隐性阈值的方式进行成本效果的评估,并未公布明确的成本效果阈值,但通过明确阈值调整的基本原则和标准,也一定程度上保证了高创新性、高临床价值等创新药的准入灵活性(见图4)。

图4 澳大利亚ICER 阈值调整原则
1.3.2 风险分担协议。澳大利亚的风险分担协议包括两种,分别是“基于临床结果的协议”和“基于基金支出的协议”,基于费用的协议只关注药品进入目录后的费用支出与预算影响分析的差异,主要包括采取量价协议、折扣、剂量上限和费用上限等方式减少费用支出。基于临床结果的协议则将报销水平、价格与患者个体和群体的临床效果相关联,基于临床疗效调整药品的准入和报销水平、价格等[11]。
1.3.3 上市后审查。高创新性、高临床价值创新药在注册上市阶段往往缺乏足够的临床证据,在进行医保准入决策时存在一定的不确定性,为加强对创新药医保准入后的持续监管,澳大利亚建立了药品福利计划准入后再审查制度[12]。为保证创新药医保准入后持续监测临床效果和成本效果,药品福利咨询委员会(Pharmaceutical Benefits Advisory Committee,PBAC)将与药企签订再审查的协议,在准入后药企将持续开展相关研究,提供包括RCT 证据、真实世界证据等[13],实现包括管理药品临床效果和经济性的不确定性、监测药品的合理使用、提高药品的使用质量等目标。
1.4 韩国
1.4.1 定价机制。韩国对申请进入医保目录的创新药,其定价通常采用药物经济学评价和国际参考价的方法。对于有替代药的,基于临床疗效选择药物经济学评价、加权均价等方法确定,而对于无替代药,尤其是针对罕见病、癌症等高创新性、高临床价值的创新药,则会采取7 国(美国、日本、德国、法国、瑞士、英国、意大利)调整最低价或者平均价[14](见图5)。

图5 韩国新药支付价制定办法
1.4.2 ICER 阈值调整。韩国目前尚未颁布官方的ICER 阈值,基于过往决策实践经验的隐性阈值约为23124 美元/QALY(约合1 倍人均GDP)[15]。对用来治疗严重的癌症、罕见病等生命末期患者且替代程度较低的高创新性、高临床价值药物,韩国给予了更高的阈值,如重大疾病、严重疾病、无替代疗法和限制性替代疗法药品分别平均提高阈值1700 万、1400 万、1200万、800 万韩元/QALY。
1.4.3 风险分担协议。2014 年起,韩国针对高创新性药品缺乏足够成本效果或循证证据,引入了风险分担协议机制[16]。实行风险分担协议的创新药有较明确的遴选条件:无替代或无等效的抗肿瘤药物;对生命有威胁的罕见病的药品;由韩国药物补偿评价委员会(Drug Reimbursement Evaluation Committee,DREC)基于药品创新性和临床价值、疾病的严重程度、社会影响及对卫生保健带来的影响指定的其他药物。
韩国风险分担协议方案(Risksharing Agreements,RSA)形式多样,包括根据治疗效果决定报销情况,若患者治疗达到阈值目标,则可继续治疗并获得药费的报销,反之药企则返还医保报销的药费;对最高的药品预算进行封顶,如对抗肿瘤药物或罕见病药物销售额度超过原先谈判设定期望目标用量的130%;资金返还,即超过预先确定的医保报销费用时需要返还资金;对每个病人的药品费用封顶,该方法根据预设的销售量或医保报销的人数支付,如超过限额按百分比进行费用返还[17]。
2 启示和建议
2.1 药品创新等级划分
基于前述我国医药创新的现状和国家战略方向,可将新药划分为源头创新药品和非源头创新药品。由于这是我国特有的一个发展阶段,国际上尚无对于源头创新明确、统一的定义和认定标准。
从科学性角度,源头创新一般是指新靶点、新结构、新机制,但在医保评审过程中很难进行准确判断。在当前医保准入体系中,对重大创新的认定常用重大新药创制专项,然而重大新药创制专项在2020年已收官,之后的药品已无机会进行专项的申报。另外,医保更关注的是可以填补治疗空白或带来显著临床改善的药品,药品审评中心(Center for Drug Evaluation,CDE)“突破性治疗药物”的认定标准与此高度一致,同时借鉴日本的做法,建议对于2020 年之后上市的药品使用“突破性治疗药物”作为源头创新的认定标准。药品评审报告数据显示,在2020 年—2021 年所有申请“突破性治疗药物”的药物中,仅有18.8%能够最终成功获得该认定[18,19]。由此可见,能够获得“突破性治疗药物”认定的药物数量远少于Ⅰ类新药,这也能够确保基于该创新分类的差异化管理不会带来医保基金支出的显著增加。
2.2 基于创新程度差异化设置创新药医保准入政策
为构建与医药创新发展相匹配的医保准入政策,建议我国探索在综合评审、价格测算等阶段针对源头创新药品设置差异化的医保准入政策和标准。
在综合评审阶段:(1)源头创新药品因其临床急需性,往往会被纳入优先审评审批,在医保准入机制中,也应将源头创新药品优先纳入医保药品准入谈判范围,给予谈判资格,以更快地让患者获益;(2)差异化设置评审维度的权重,对于源头创新药品,适当增加其创新性指标权重。
在价格测算阶段:(1)源头创新药品往往在刚上市时临床研究数据有限,药物经济学研究缺乏合适参照药,可适当简化或豁免CEA等申报材料;(2)在现有基础上,探索基于创新程度、临床价值的提升、填补临床空白等因素给予源头创新药品一定的溢价,比如适当提高ICER 阈值等;(3)针对经过预算影响评估后被认定为基金影响有限的源头创新药品,探索实施先准入、后评价、再动态调整的医保动态调整机制。
2.3 降低源头创新药品医保准入的不确定性风险
源头创新药品的创新程度显著高于其他品种,较多基于单臂临床试验证据进行附条件批准上市,因而无法在上市前完整收集与参照药品头对头的系统性临床研究数据,导致疗效和安全性的对比数据不足,使得源头创新药品准入医保目录时存在一定的不确定性,增加了医保谈判准入中的决策风险。为降低相关风险,建议我国探索以源头创新药品为试点对象,构建基于附条件准入的创新药医保准入机制,在提高源头创新药品可及性、激励创新药物研发的同时,有效降低因评价证据的有限性带来的医保准入不确定性风险。
在实施层面可以分四个阶段有序开展:(1)在医保初始谈判阶段,由综合组、药经测算组和基金测算组专家确定因证据不足导致的不确定性问题,汇总后由医保部门反馈至企业;(2)在协议签订阶段,除药品支付标准协议外,医保部门还应与企业签订关于不确定性问题解决的义务协议,即企业承诺在规定期限内按照要求完成相关研究,用于降低药品初始准入时的不确定性;(3)在协议期内,企业应履行不确定性问题的解决义务,积极开展临床研究、真实世界研究及准入后风险管理研究,并接受药品审评中心的监督管理;(4)在续约准入阶段,企业应提交补充研究材料并对不确定性问题进行说明,医保部门据此和自己掌握的资料对续约药品进行再评价,并将评价结果作为是否续约及确定续约支付标准的依据之一。
2.4 发挥多层次医疗保障体系支持创新的作用
我国是世界上最大的发展中国家,经济增长较快但整体水平仍然不高,社会经济承受能力有限,因而基本医疗保险筹资水平较低,保障能力有限。为满足人民群众日益增长的多层次医疗保障需求,我国出台了《“健康中国”2030 规划纲要》(2016)、《中共中央 国务院关于深化医疗保障制度改革的意见》(中发〔2020〕5 号)等政策法规,推动构建以基本医疗保险为主体,医疗救助为托底,补充医疗保险、商业健康保险、慈善捐赠、医疗互助共同发展的多层次医疗保障制度体系。
对于高创新价值、高临床价值的源头创新药品,如果预算影响分析结果显示确实超出医保基金承受能力的,可以探索多层次医疗保障制度相互衔接、共同承担的保障体系。如在量价协议中引入商业健康保险,规定超出风险点的部分由商业健康保险支付、充分发挥惠民保等城市定制型商业健康保险的补充作用、引入医疗救助和医疗互助对源头创新药品共同支付等。通过构建多层次医疗保障体系,拓宽源头创新药品支付渠道,在降低医保基金压力的同时,提高源头创新药品的可及性。
2.5 重视医保谈判定价对本土源头创新药品国际化发展的影响
因创新药在上市初期难以形成临床价值与价格之间的对应关系,其定价以及价格的管理显得尤为重要。目前国际上存在包括外部参考定价在内的多种药品定价机制,采取外部参考定价的国家有美国、加拿大、日本、部分欧盟成员国等。外部参考定价主要利用多个国家的药品价格为依据制定药品价格,能够提高药品价格的适宜性,在一定程度上降低决策风险。因此,外部参考定价正被越来越多的国家所使用。我国在医保准入决策过程中,亦会参考该药品在发达国家及周边国家/地区的价格。
经济发展水平、地理位置、市场特征等是大部分国家确定参考国的主要考量因素,部分国家如卢森堡会将原产国的价格作为重要参考依据。短期之内,随着我国创新药价格对国际市场价格的影响逐步加大,因为地理位置、医疗保险模式、创新能力等原因,我国创新药尤其本土创新药的价格将会被日本、韩国等周边国家以及以原产国价格为参考的国家纳入参考范围,从而影响国际药品价格的形成。从长期来看,随着我国经济发展水平的进一步提升、医药政策的逐步完善,我国将逐步被加拿大、法国、德国等医药产业发达国家纳入“参考篮子”,我国创新药品的国际影响力将进一步加大。以中国作为“首发国”的本土源头创新药品在我国的价格不仅影响国内市场的发展,未来也会影响国际市场的定价策略。因此,建议在医保准入环节将本土源头创新药品是否进军海外市场、参与国际竞争等因素适当纳入考虑范畴,推动本土源头创新药品以更加合理的价格寻求海外发展,在价格方面“不输在起跑线上”。
