黄酮类化合物的抗菌作用及机制研究进展
2023-02-15张珍珍梅秀珍徐业芬冯志新
王 健, 张珍珍, 梅秀珍, 徐业芬, 冯志新,3
(1.西藏农牧学院动物科学学院,西藏林芝 860000; 2.江苏省农业科学院兽医研究所,江苏南京 210014;3.南京农业大学动物医学院,江苏南京 210095)
在临床上,人们通常使用抗生素来治疗细菌性疾病,由于抗生素的广泛使用,细菌对广泛使用的抗菌药物的耐药性增强,导致耐药细菌感染问题逐渐增多,严重影响了现有抗菌治疗的疗效和安全。现有抗生素的耐药机制是由于细菌突变后,病原菌可以通过细菌外排泵加速抗生素外排,以减少药物在细菌内扩散所需的时间[1],并改变细菌孔蛋白的结构,降低细菌对抗生素内流的渗透性[2],破坏水解酶的抗菌性,改变抗生素的结合位点[3],抗生素无法对细菌起作用。因此有必要寻找替代抗生素的新型药物。
黄酮类化合物又称多酚类化合物,因其具有抑制多种病原微生物(包括多药耐药细菌)生长的趋势而受到关注[4]。具有多种生物活性功能,包括抑菌、抗病毒、抗肿瘤、酶抑制作用等,由于其具有显著的抑菌活性,有替代部分抗生素的可能,已被应用于抑菌治疗[5]。这类化合物可以改变膜的通透性、抑制核酸合成、破坏细胞壁、抑制细胞质膜功能和抑制细菌活性[6]。黄酮类化合物还能通过与宿主关键细胞信号通路等众多细胞靶标的相互作用,发挥调控炎症等重要作用,包括预防和治疗各种细菌感染引起的疾病,如伤口感染、呼吸道感染、胃肠道疾病和尿路感染等[7]。黄酮类化合物通过核因子-κB(NF-κB)通路和丝裂原活化蛋白激酶(MAPKs)通路等途径抑制白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等细胞因子的释放,最终抑制细菌导致的炎性症状[8]。
1 黄酮类化合物
黄酮类化合物是一类低分子量的多酚类物质,普遍存在于水果、蔬菜中。黄酮类化合物的核心结构是一个二苯丙烷(C6—C3—C6)骨架,黄酮类化合物的化学性质取决于3碳链的不饱和度和氧化程度,现阶段已经发现了超过9 000种黄酮类化合物,根据其化学结构可以分为黄酮、黄酮醇、黄烷酮、黄烷醇、异黄酮和花青素(表1)等[9-10]。
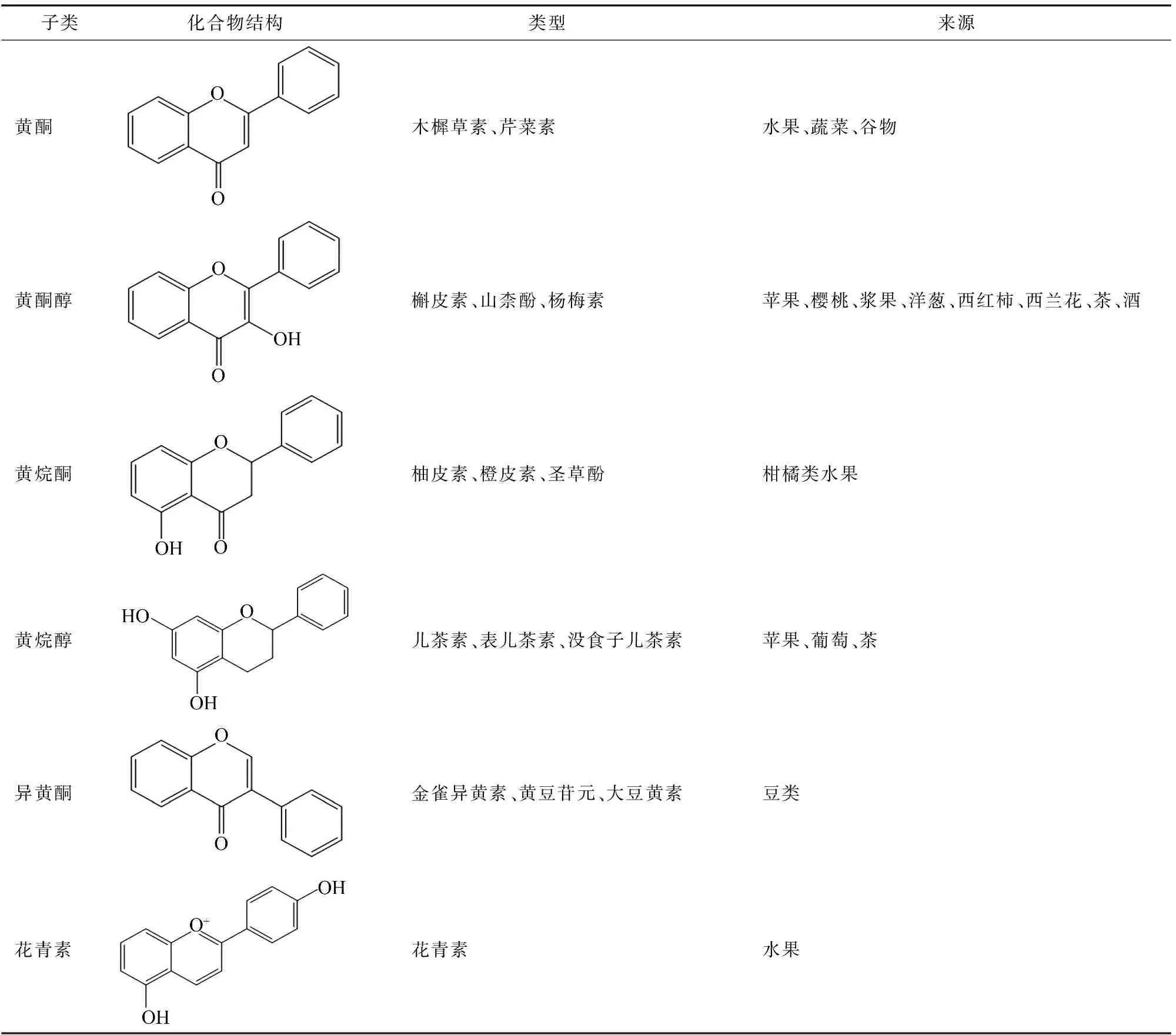
表1 黄酮类化合物分类和结构及来源
1.1 黄酮
黄酮是黄酮类化合物中最大的一个亚类之一,其特征是黄酮骨架中的C-2和C-3之间存在双键,并且具有不饱和的C-3链。主要分布于高等植物中,研究最多的是芹菜素和木樨草素。芹菜素是黄酮类中最有代表性的化合物,存在于蔬菜、植物及其饮料中,芹菜、 欧芹中含有大量的芹菜素,具有显著的抗菌作用、抗炎作用和抗痉挛作用,芹菜素能抑制变形链球菌,最低抑菌浓度(MIC)为 1.3 μg/mL[11-12]。木樨草素与芹菜素类似,存在于蔬菜和水果中,如西兰花、芹菜、欧芹、苹果等,作为一种清除活性氧(ROS)的抗氧化剂和由于自动氧化而作为一种促氧化剂,木樨草素具有抗炎作用、抗癌作用、抗过敏作用,木樨草素能抑制化脓性链球菌,MIC为78 μg/mL[13]。
1.2 黄酮醇
黄酮醇是一类以3-羟基-2-苯基色-4-酮为骨架的黄酮类化合物。这类黄酮类化合物有显著的抗氧化、抗菌活性。常见于水果和蔬菜中,主要存在于果皮和叶子中,如洋葱、韭菜、苹果、葡萄及其制品中。黄酮醇类包括槲皮素、杨梅素、山柰酚等[14]。
槲皮素存在于洋葱、西兰花、苹果、茶和红酒中,它是一种水溶性植物色素,具有高抗氧化和抗炎活性,对包括金黄色葡萄球菌在内的一些菌株显示出显著的抗菌活性,槲皮素对牙龈卟啉单胞菌有显著的抑制作用,MIC为0.012 5 μg/mL[15-16]。杨梅素常见于浆果、蔬菜以及植物衍生的茶和葡萄酒中。它以游离和糖苷结合的形式天然存在,难溶于水,杨梅素具有广泛的生物活性,包括抗氧化、抗癌、抗糖尿病和抗炎作用,杨梅素作为抑制金黄色葡萄球菌感染的α溶血素抑制剂,MIC为16 μg/mL[17]山柰酚是一种黄酮醇抗氧化剂,存在于菠菜、羽衣甘蓝和西兰花中。山柰酚能抑制大肠杆菌,MIC为 25 μg/mL[18]。
1.3 黄烷酮
黄烷酮也称二氢黄酮,黄烷酮类的结构骨架是2,3-二氢-2-苯基色烯-4-酮,具有饱和的C环,作为黄酮类化合物中最大的亚群之一,在植物中广泛存在,尤其是柑橘类植物[19]。常见的黄烷酮类包括柚皮素、橙皮素、淫羊藿醇、异苦参素及各自的衍生物。黄烷酮类化合物中柚皮素的研究最为广泛,具有抗菌活性、抗氧化活性、抗炎和抗微生物活性,柚皮素通过其抗氧化特性和清除自由基的能力来进行有效预防和治疗肝病,抑制血小板凝结、抗粥样动脉硬化等疾病,此外,柚皮素还可以抑制脂多糖诱导的巨噬细胞产生促炎细胞因子,减少硝酸盐和亚硝酸盐的产生,柚皮素对革兰氏阳性菌如谷草杆菌、变形链球菌等有很好的抗菌活性,MIC为 200 μg/mL[20-21]。
1.4 黄烷醇
黄烷醇类是一类非常复杂的黄酮类化合物,其骨架结构为黄烷-3-醇。黄烷醇主要存在于茶、葡萄酒、可可、苹果及其制品中,儿茶素被认为是单宁的主要组成成分,是黄烷醇的最重要代表。绿茶和红茶中含有丰富的儿茶素,不同类型的儿茶素包括儿茶素、表儿茶素、没食子儿茶素、表没食子儿茶素、儿茶素没食子酸酯、表儿茶素没食子酸酯、没食子儿茶素没食子酸酯和表没食子儿茶素没食子酸酯[22-23],原花青素是儿茶素的二聚体、低聚体和聚合物,被称为缩合单宁的一种。儿茶素可以抑制变形链球菌,MIC为1 mg/mL,联合罗伊氏菌素使用可以降至 125 μg/mL[24]。
1.5 异黄酮
异黄酮类的结构骨架是3-苯基色满骨架。异黄酮被列为最具雌激素的化合物之一,具有抑菌、抗菌、抗病毒和抗氧化活性。异黄酮的主要来源是豆类,包括大豆和大豆制品,红三叶草和葛根中也含有大量的异黄酮,包括染料木黄酮、黄豆苷元、大豆黄素、芒柄花黄素等[25-26],现阶段研究较多的是染料木黄酮和黄豆苷元这2种异黄酮。染料木黄酮被称为植物雌激素,可以调节类固醇激素受体和多种代谢途径,使其成为预防和治疗常见疾病的重要成分,染料木黄酮能抑制金黄色葡萄球菌,MIC为 32 μg/mL[27]。黄豆苷元是另一种存在于大豆中的异黄酮,是染料木素的非活性类似物,黄豆苷元也能抑制金黄色葡萄球菌,MIC为32 μg/mL[27]。异黄酮结构上与雌激素相似,因此异黄酮可以与雌激素受体结合[28]。
1.6 花青素
花青素是多羟基和多甲氧基衍生物的糖苷。花青素不稳定,通常以糖基化形式存在。花青素通常作为植物色素赋予花朵和果实红色、紫色和蓝色3种颜色。黄酮结构中作为取代基存在的羟基和甲氧基的数量和位置不同形成不同的花青素。迄今为止,已在植物中鉴定出超过650种花青素化合物。天然存在的花青素主要包括飞燕草素、花青素、矮牵牛素、牡丹素、锦葵素、天竺葵素。花青素在水果和蔬菜中含量丰富,例如蓝莓、红甘蓝、番茄、紫甘薯、茄子等[29]。酰化花青素能抑制金黄色葡萄球菌和大肠杆菌的活性,降低膜完整性、ATP浓度、pH值以及破坏细胞形态,MIC分别为0.312、4.000 mg/mL[30]。
2 抗菌作用机制
黄酮类化合物的抗菌机制包括2个方面,一方面直接抑制细菌生长,包括改变细胞膜通透性引起细胞质损伤、抑制核酸合成、抑制能量代谢、细胞膜损伤、细胞壁损伤;另一方面是间接抑制细菌生长,药物作用能抑制相关信号通路(NF-κB、MAPKs等)的表达,抑制促炎细胞因子的释放,调节T细胞分化以及促炎免疫细胞的激活和浸润。
2.1 黄酮类化合物的直接抑菌活性
2.1.1 改变细胞膜通透性 细胞膜适当的细胞膜流动性对于细菌维持正常的细胞功能非常重要,例如细胞分裂、扩散和运输离子,抗菌药物一般通过靶向细菌的细胞膜和关键生物大分子来发挥作用,破坏细胞膜通常是抗菌物质的主要作用方式[31]。黄酮类化合物进入机体后,作用于菌体细胞,通过增加细胞膜的通透性或降低膜的流动性引起细胞质损伤[32]。例如柚皮素可以增加金黄色葡萄球菌细胞膜的流动性,改变细胞膜的通透性和完整性,进而导致细胞内物质、离子和遗传物质的泄露,抑制细菌活性。当柚皮素的浓度为2.2 mmol/L时,14 h 未见金黄色葡萄球菌生长[33]。此外,3 μg/mL头孢他啶和3 μg/mL芹菜素联合使用会损害耐头孢他啶的阴沟肠杆菌的细胞质膜,导致细胞内成分泄露,发挥抗耐药菌作用[34]。
2.1.2 抑制能量生成 研究报道,黄酮类化合物可以抑制大肠杆菌ATP合成酶活性,ATP合成酶是一种高度保守的酶,具有F1和F02个区段,在大肠杆菌中,F1由α3β3γδεab2c10组成,而F0由ab2c10组成[35]。ATP的合成和水解发生在F1部分的3个催化位点,而质子的运动则通过包埋在膜上的F0区段进行[36]。大量的多酚化合物已被证明可以结合在不同的多酚结合位点,并抑制ATP合成酶合成,多酚结合位点位于F1区段的α、β、γ亚基的交界处,因此黄酮类化合物的抑制作用是通过结合在三磷酸腺苷合成酶的多酚结合位点上,阻断γ亚基的顺时针或逆时针旋转[37]。例如,对大肠杆菌ATP合成酶最有效的抑制剂包括黄芩素、表儿茶素,表儿茶素通过降低ATP合成酶的活性来抑制变形链球菌的产酸和耐酸特性[35]。
2.1.3 抑制核酸合成 黄烷醇和异黄酮还可以通过抑制DNA拓扑异构酶活性来抑制核酸合成,芹菜素和槲皮素等黄酮类化合物对DNA旋转酶活性有明显的抑制作用,槲皮素可抑制细菌旋转酶的超螺旋活性,并诱导DNA裂解[38]。研究发现,在 0.1 μmol/L 剂量下,金雀异黄素改变了哈维氏弧菌的细胞分裂,随后抑制了其生长。同样,参与细菌环状染色体复制的DNA旋转酶在抗大肠杆菌时也被鞣花酸抑制[39]。此外没食子儿茶素没食子酸酯通过抑制二氢叶酸还原酶的活性来抑制结核分枝杆菌、金黄色葡萄球菌、大肠杆菌的生长,MIC值分别为6.25、0.10、6.00 μg/mL[40]。
2.1.4 抑制细菌毒性 由革兰氏阳性菌和革兰氏阴性菌产生透明质酸酶作为重要的毒力因子可直接与宿主组织相互作用。在细菌发病机制中,透明质酸酶介导的透明质酸降解增加了结缔组织的渗透性并降低了体液的浓度[41]。研究发现黄酮醇类化合物,如槲皮素可以作为透明质酸裂解酶抑制剂,来抑制无乳链球菌[42]。黄酮类化合物的抑制作用随着黄酮类化合物结构中羟基数量的增加而增加[43]。
此外,黄酮类化合物,尤其是儿茶素由于抗氧化特性可以用于中和金黄色葡萄球菌细菌毒性因子,MIC为78~156 μg/mL[44]。同样,黄芩苷和染料木黄酮也可以用于中和金黄色葡萄球菌的外毒素,MIC分别为300、128 μg/mL[45-47]。没食子儿茶素没食子酸酯可通过与细胞膜的结合来抑制放线杆菌聚合酶释放白细胞毒素,MIC为 10 μg/mL[48]。
2.1.5 对细菌细胞质膜的损伤 细胞质膜负责渗透压调节、呼吸和转运过程、肽聚糖的生物合成以及脂质的合成。维持膜完整性是先决条件,其被破坏可直接或间接导致代谢功能障碍并最终导致细菌死亡[49]。细菌细胞壁的主要成分是肽聚糖,黄酮类化合物可以使细菌细胞壁中肽聚糖以及蛋白质的合成受阻,最终导致细菌细胞膜和细胞壁的损伤。没食子儿茶素没食子酸酯通过产生ROS,导致弧菌细胞膜通透性改变和膜损伤,MIC为256 μg/mL[50]。另外,FAS-Ⅱ通路在革兰氏阴性菌细胞壁和细胞膜的合成中是必不可少的,分枝杆菌的细胞壁中含有一种特有的脂肪酸为分枝杆菌酸,是由哺乳动物FAS-Ⅰ型和细菌FAS-Ⅱ型合成,使该脂肪酸具有高抗性,因此可以通过抑制这2种脂肪酸合成酶活性来寻找新的药物。据报道,槲皮素、山柰酚、桑黄素、杨梅素、黄芩素、木樨草素和儿茶素可以抑制哺乳动物型FAS-Ⅰ,异甘草素可用于抑制牛分枝杆菌细菌型FAS-Ⅱ的活性[51]。
2.2 黄酮类化合物的间接抑菌活性——通过调节宿主的免疫反应发挥抗菌作用
2.2.1 黄酮类化合物治疗幽门螺旋杆菌感染引起的胃黏膜病变 幽门螺旋杆菌是引起胃肠病变的主要原因之一,幽门螺旋杆菌感染可引起慢性胃炎、胃溃疡和十二指肠溃疡,更严重的可引起胃癌。幽门螺旋杆菌感染宿主后,通过Toll样受体(TLR4)激活下游信号通路,包括NF-κB通路,机体IL-6、IL-12、TNF-α和γ干扰素(IFN-γ)等促炎细胞因子的水平显著增加,导致胃黏膜细胞和胃组织病变增加,胃黏膜屏障破坏,引起中性粒细胞浸润和细胞骨架破坏[52]。
研究发现,荷叶黄酮对幽门螺旋杆菌感染引起的胃黏膜损伤有抑制作用,荷叶黄酮含有山柰酚、槲皮素等化合物,但黄酮类化合物无法直接对幽门螺旋杆菌起抑制作用[53]。化合物作用于胃组织后,能够抑制NF-κB通路,下调胃组织中IL-6、IL-12、TNF-α和IFN-γ细胞因子的水平,降低炎症反应,修复胃黏膜并改善黏膜屏障功能[54]。
除此以外,黄酮类化合物如芹菜素能有效抵抗幽门螺旋杆菌感染,用芹菜素处理(9.6~74.0 μmol/L)显著增加了IκBα的表达,进而抑制NF-κB的激活和炎性因子COX-2、ROS、IL-6和IL-8的水平,能有效治疗幽门螺旋杆菌感染引起的胃上皮细胞炎症[55]。
2.2.2 黄酮类化合物治疗大肠杆菌引起的结肠炎 在结肠炎感染大鼠模型中,大鼠感染致病性大肠杆菌后,受肠道微生物群的影响,NF-κB和MAPKs信号通路被激活,还原型辅酶Ⅱ表达增加,IκB磷酸化水平升高和NF-κB p65活化,从而导致肠屏障功能破坏。此外T细胞被分化为促炎Th1和Th17效应细胞,并增加了感染期间免疫细胞被激活和浸润的程度[56]。大鼠经34.6 mg/kg木樨草素悬液灌胃后,可以抑制肠道内各种病原物的生长并增加各种有益菌群例如乳酸杆菌等来保护肠屏障的完整性,调节T细胞抑制Th1和Th17效应细胞分化,产生抗炎IL-10,并抑制NK-κB和MAPKs信号通路,下调还原型辅酶Ⅱ的表达,减少氧化应激,抑制IκB磷酸化和NF-κB p65与DNA的结合活性[57]。
2.2.3 黄酮类化合物治疗支原体引起的肺炎 在肺炎支原体感染小鼠模型中,支原体感染后,激活了肺组织中Wnt/β-连环蛋白(β-catenin)和 NF-κB 通路,β-catenin和NF-κB p65水平升高,进而促进T细胞、成纤维细胞和巨噬细胞中促炎因子IL-6、IL-1β和TNF-α的释放,并抑制抗炎因子IL-10的水平。而使用黄酮类化合物桑辛素后,Wnt/β-catenin 和 NF-κB 信号通路被明显抑制,β-catenin 和NF-κB p65水平降低,促炎因子IL-6、IL-1β和TNF-α降至正常水平,同时抑炎因子IL-10的水平显著降低[59],能有效抑制肺炎支原体感染引起的肺炎。
鸡毒支原体(MG)通过激活Toll样受体(TLR)信号转导NF-κB通路和促炎细胞因子的表达,引起严重的肺部炎症和细胞损伤。黄芩苷是从黄芩中提取的黄酮类化合物,具有抗菌和抗炎活性,能回调因MG感染引起的鸡成纤维细胞活性下降,抑制TLR6、髓样分化因子88(MyD88)和NF-κB的mRNA表达水平,抑制NF-κB p65核转位,抑制MG感染后鸡肺部IL-1β、IL-6和TNF-α的表达。结果表明,黄芩苷可以通过Toll样受体6(TLR6)介导的NF-κB通路抑制鸡毒支原体诱导的肺部炎症[60-61]。
2.2.4 黄酮类化合物治疗由肺炎链球菌引起的流感病毒并发症 甲型流感病毒(IAV)感染通常与由细菌病原体引起的继发症有关,最常见的是肺炎链球菌,IAV和肺炎链球菌存在一种由神经氨酸酶(NA)介导的致命协同机制,NA存在于2种病原体上,病毒NA促进病毒繁殖和传播,肺炎链球菌生成NA并接近肺上皮细胞上的受体,同时病毒NA为肺炎链球菌定殖和生长提供附着受体和营养物质。因此,需要寻找能够对病毒和细菌NA起双重抑制作用的药物。研究发现中草药桑白皮作为抗感染药物,其异戊二烯黄酮衍生物:桑根酮G和桑根酮醇A,能抑制流感病毒和肺炎链球菌的NA,进而抑制肺炎链球菌的生长和生物膜的形成[62]。此外,小鼠体内感染肺炎链球菌模型中,7-羟基黄烷酮(1 mg/小鼠)能显著减少肺中存活的肺炎链球菌数量[63]。
2.2.5 黄酮类化合物治疗肺炎克雷伯菌感染 肺炎克雷伯菌是一种革兰氏阴性菌,兼性厌氧菌,感染机体后可引起急性损伤,导致包括肺炎和败血症在内的严重感染。肺炎克雷伯菌感染后肺组织出现水肿、炎性细胞大量聚集和肺泡出血,NF-κB和MAPK通路激活,p38、ERK、JNK以及IκB和NF-κB p65的磷酸化水平升高,炎性细胞因子TNF-α、IL-6、IL-1β和PGE2水平显著升高,氧化应激指标髓过氧化物酶(MPO)和丙二醛(MDA)水平显著增加,超氧物歧化酶(SOD)和谷胱甘肽(GSH)水平下降[64]。研究发现从百蕊草中分离的紫云英苷(kaempferol-3-O-glucoside,KA)可以通过抑制一氧化氮合成酶(iNOS)合成来发挥抗炎活性,在感染肺炎克雷伯菌前1 h按50、100、200 μg/kg的KA剂量腹腔注射小鼠,与对照组相比,KA处理小鼠中性粒细胞和巨噬细胞数量减少,NF-κB 和MAPK通路被抑制,随着KA剂量的升高,p38、ERK、IκB和NF-κB p65的磷酸化逐渐被抑制,炎性细胞因子的水平逐渐降低。并且氧化应激被抑制,MPO和MDA水平降低,SOD、GSH水平升高[65]。
3 黄酮类化合物应用前景
细菌抗生素耐药性对全世界人类和动物的健康构成了严重的威胁,植物中含有许多天然化合物,可作为抗菌药物和替代药物,如黄酮类、生物碱等,许多研究将天然化合物作为抗生素的替代物,这些化合物易分离且对机体几乎无害[66]。黄酮类化合物通过不同的机制发挥抑菌作用。可以直接抑制细菌活性,以及联合抗生素来抑制细菌活性,能够增加耐药菌株的敏感性,并且可以减少抗生素的剂量,还可以通过调控宿主细胞的免疫反应间接抑制细菌诱导的炎症。这将为今后探索替代抗生素药物或者减少抗生素剂量提供新的思路。
然而,动物机体对黄酮类化合物的生物利用率较低,大部分被机体吸收后迅速被代谢排出体外,需要在维持活性不变的基础上提高黄酮类化合物的水溶性,并进行结构修饰,使其具有针对性和高效性[67]。因此,有必要提高并优化黄酮类化合物的提取技术,形成一套完整高效的提取工艺流程,为今后新药物的研发奠定基础。
