基于大型无脊椎动物群落多样性的张家界野生大鲵生境质量评价
2023-02-12谢宜兴邓智勇陈家法谢玉坤欧东升王崇瑞
高 峰,向 劲,谢宜兴,邓智勇,陈家法,谢玉坤,欧东升,王崇瑞
(1.湖南省水产科学研究所,长沙 410153;2.湖南省水产原种场,长沙 410153;3.湖南张家界大鲵国家级自然保护区事务中心,湖南张家界 427400)
20世纪以来,人口快速扩张使得生物多样性和生态系统进入了“人类纪元”,即人类成为自然的主导者[1]。由此带来的全球变化(包括土地利用的改变,生境破碎化和全球气候变化等)对生态系统的生物及非生物特征产生了显著的影响[2]。
大鲵(Andriasdavidianus)隶属两栖纲有尾目隐鳃鲵科,是国家Ⅱ级重点保护野生动物,世界自然保护联盟(International Union for Conservation of Nature,IUCN)将其列为极危(critically endangered)物种。大鲵作为世界上现存体型最大的两栖动物[3],也是我国两栖动物的代表物种,其主要分布在长江和珠江中上游及汉水上游深山峡谷的溪流中,在陆地和淡水生态系统间的物质交换、营养循环和能量流动方面发挥着重要的作用[4]。
张家界位于武陵山区东北部,湖南省西北部,具有独特的自然景观和气候特征,是我国重要的野生大鲵原生栖息地之一[5]。随着改革开放,社会经济飞速发展,张家界地区的旅游业成为该地区的主要支柱产业,尽管当地采取了一系列生态资源保护措施,但大量的人类活动势必对该地区溪流湿地生态环境的稳定性造成压力[6],为监测其对野生大鲵及生境的影响,研究者主要围绕大鲵生境及种群分布[7]、繁殖行为[8]、活动节律[9]、栖息地水质[10]、饵料鱼丰度、底栖动物群落结构[11]等方面的变化开展了一系列调查研究。
大型无脊椎动物是湿地生态系统的重要组成部分,作为食物链的中间环节,它既是其它水生动物的天然饵料,也是更小型生物的捕食者,还能通过呼吸作用、钻蚀、摄食有机质等行为促进物质循环与能量流动,在提高生态系统稳定性中发挥着重要作用。同时,大型无脊椎动物迁移能力相对较差,对环境污染及变化通常少有回避能力,因此湿地生态系统的自然演变和受污染状况也能通过大型无脊椎动物的群落结构变化体现出来[12]。由于大型无脊椎动物的群落结构相对稳定且采样方便易鉴定,研究大型无脊椎动物群落结构变化动态成为水生态监测与研究工作的重要方式[13]。
目前,大型无脊椎动物已广泛应用于国内外大型河流、湖泊、溪流等多种水体的评价和相关研究[14-16],但关于大型无脊椎动物对大鲵栖息生境的评价研究却十分罕见,仅王崇瑞等[17]于2013、2014年采用大型无脊椎动物生态群落特征对张家界大鲵自然栖息地进行了评价。本研究于2020年8月对张家界大鲵历史和现有栖息地河段进行了大型无脊椎动物群落调查,通过分析大型无脊椎动物群落及其与环境因子相关性,对12个历史和现有大鲵栖息地河段进行生境评价,为野生大鲵及其生境保护和修复提供数据支持与科学依据。
1 材料与方法
1.1 采样区域
本次12个采样点(S1~S12),S1~S9均设置在湖南张家界大鲵国家级自然保护区内的历史或现有的大鲵出苗点溪流或河段,S10~S12位于张家界市内沅水水系支流源头,因有大鲵分布,作为大鲵核心区来对待。2020年8月,分别对12个大鲵历史或现存出苗点河段的大型无脊椎动物进行了调查。采样点具体信息见表1和图1。
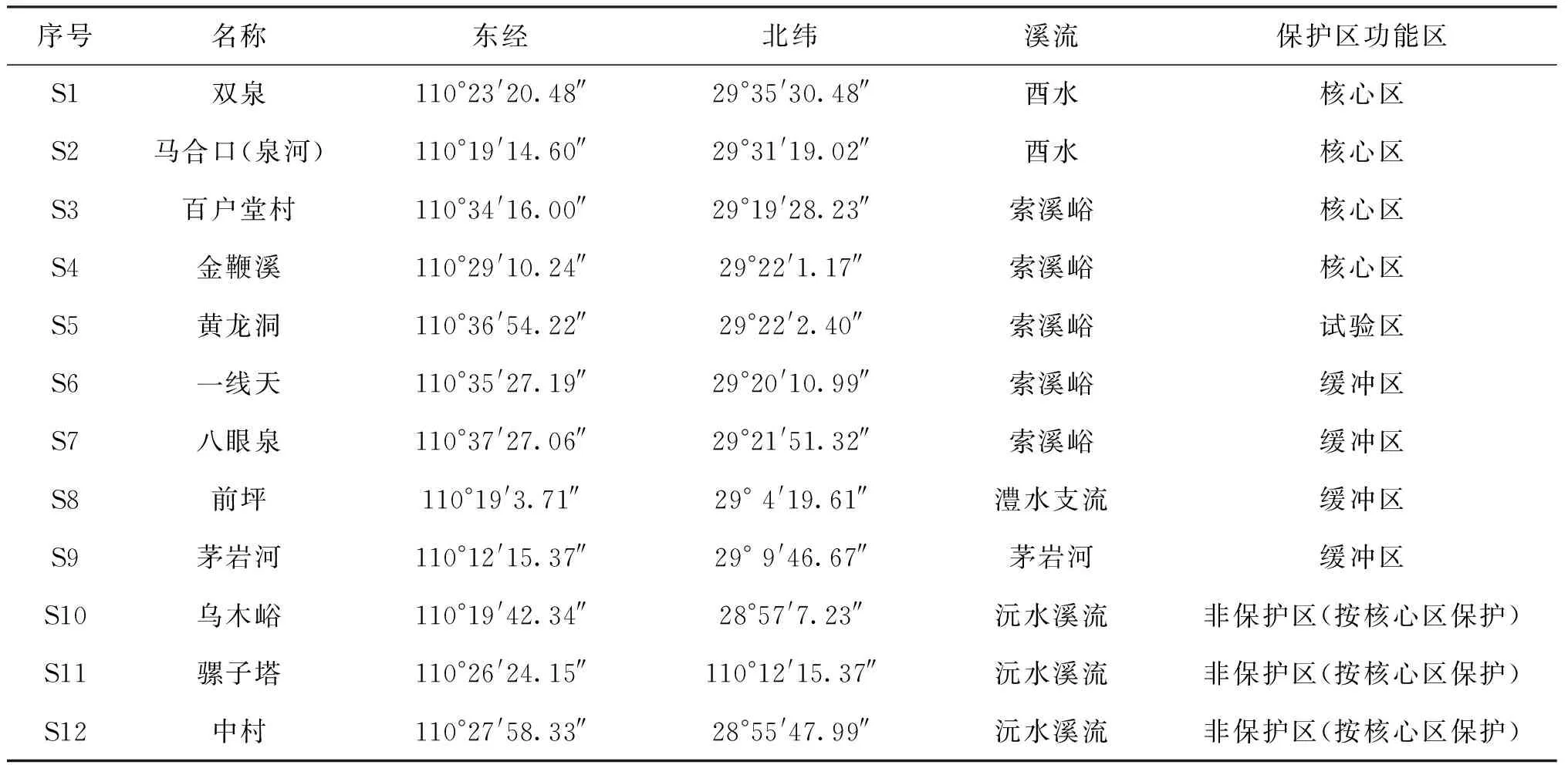
表1 采样点基本信息Tab.1 The information of sampling sites
1.2 样品采集与测定
采用40目的索伯网(Surber sampler,0.09 m2)进行大型无脊椎动物采集,采集时先将索伯网放置于水流下方,然后将水流上方的大型石块仔细清洗,并搅动底质至10 cm深度,使大型无脊椎动物随水流进入网中。每个样点重复采集3~5次,混合保存。采集的底质样本经40目尼龙筛清洗后倒入广口瓶,并于当日以解剖盘进行分检。将采集到的大型无脊椎动物以90%的乙醇溶液固定后带回实验室,进行镜检鉴定、分类、计数和称重步骤前清洗样品并吸干表面水分。其中,镜检使用体式解剖镜与生物显微镜,使用0.000 1 g的电子天平称量。参考文献[18-20]鉴定至属或种水平。
采用梅特勒-托利多SevenGoTMpH-SG2测定每个采样点的水温和pH,采用ISY-ProQuatro便携式水质分析仪(美国维赛公司)测定溶氧和氧化还原电位,其余指标按照地表水环境质量标准[21]进行测定。
1.3 数据处理与结果分析
1.3.1 大型无脊椎动物群落特征
在分析各样点大型无脊椎动物群落特征过程中,根据每个物种出现的频率及数量,计算物种优势度指数[22]:
(1)
式(1)中:Y为物种优势度,ni为第i种生物的数量,N为所有生物的数量之和,fi为第i种生物的出现频率。当Y>0.02时,该物种即为群落中的优势种生物。

图1 大型无脊椎动物采样点分布Fig.1 The Sampling sites of macroinvertebrates
采用大型无脊椎丰度/生物量比较曲线(Abundance Biomass Comparison Curve,简称ABC曲线)进行生境稳定性描述[23],将丰度与生物量的贡献度分别由大到小排列,A曲线为丰度累积贡献度的连线,B曲线为生物量累计贡献度的连线,两曲线与坐标轴所围面积的差值为W值,表示群落受干扰程度,公式为:
(2)
式(2)中Ai为第i种生物的丰度,Bi为第i种生物的生物量,S为生物总种类数。W值越大代表生境受干扰越少,群落稳定性越强,当W值小于0时,表示生境受到较多干扰,群落稳定性较低。
群落的生物多样性采用香农-威纳(Shannon-Wiener)指数进行描述[24、25]:

(3)
式(3)中S为大型无脊椎动物种类数,Pi为第i种生物的个体在全部个体中的比例。当H′<1时,表示重度污染,H′值在1~3范围内表示中度污染,H′>3表示轻度污染或无污染。总体来说,H′值越大,群落中物种多样性越高。
考虑到采样地点为较洁净的水源性水流,且各样点之间未连通或属于不同支流,本研究围绕不同大型无脊椎动物的耐污能力差异,采用BI(Biotic Index)指数进行生态污染等级评价[26、27]:
(4)
式(4)中N为群落总丰度,ni与ti分别表示第i种生物的数量及耐污值参数。当BI ≤ 4.2,表最清洁状态;4.2
1.4 统计分析
以WPS Excel软件整理调查数据,图表制作主要使用Origin Pro 2021软件进行。
采用SPSS 20.0软件对大型无脊椎动物群落进行Pearson分层聚类[28],根据物种数量特征,同一类群落的个体相似性较强,类间个体差异性相对较大,在未先验知的情况下对群落亲疏程度进行自动分类[29]。
采用Canoco 5.0软件分析大型无脊椎动物与水环境因子的相关性,由于重金属离子在绝大部分样点未被检出,选择水温(T)、pH、溶氧(DO)、氧化还原电位(ORP)、悬浮物(SS)、总氮(TN)、氨氮(NH3-N)、总磷(TP)、高锰酸盐指数(CODMn)、钙(Ca)及总大肠杆菌(MPN)共11种水质数据与8种大型无脊椎动物优势种丰度值分别置于不同数据表中,对物种进行对数标准化处理[30],然后进行DCA分析以确定选用线性模型(RDA)或单峰模型(CCA)进行群落—环境相关性分析,采用蒙特卡罗方法选择贡献度相对较高的环境变量构建模型。
2 结果与分析
2.1 水环境因子
大型无脊椎动物采样点水质结果见表2。各点平均水温为(23.09±3.55)℃,水温最低点出现于S1,仅19.6 ℃,最高点出现于S11,为29.6 ℃;水体中溶氧含量稳定,且处于较高水平;汞、砷、铅、镉、铜、锌及六价铬含量极低,在绝大部分样点未被检出,该区域水质符合地表水Ⅰ类标准;根据CODMn、NH3-N、MPN对各样点的水质进行划分,该区域基本处于Ⅰ-Ⅱ类,其中CODMn仅在S12为Ⅱ类,其它样点均为Ⅰ类,TN在各点位差异较大,分布于Ⅰ类与劣Ⅴ类水之间;TP在大多数点位属于Ⅱ类水质,仅在S1为劣Ⅴ类。整体来说,该研究水域属于Ⅱ类水质,但部分点位呈现出富营养化风险。

表2 张家界大鲵栖息地水体理化参数空间分布Tab.2 Spatial distribution of physical and chemical parameters of water
2.2 大型无脊椎动物群落结构
2.2.1 种类组成
共采集到大型无脊椎动物85属种(部分未分类到种),隶属于5门8纲15目。其中扁形动物门与线形动物门各有1种属、分别占比1.18%,环节动物门与软体动物门各4种属、分别占比4.7%,节肢动物门种类最多,共有75种属、占比高达88.2%。
12个采样点共采集大型无脊椎动物4 283个,根据各种属的总个数与出现频率,得到优势度Y>0.02的优势种属共8种,均隶属于昆虫纲(表3)。
2.2.2 丰度与生物量
本次调查中,大型无脊椎动物的丰度与生物量在各点呈现出较大差异,平均丰度为1 301.79 ind./m2,其中S11最高,为8 122.22 ind/m2,S2最低,仅70.37 ind/m2(图2a)。生物量平均值为14.32 g/m2,其中S1最高,为73.61 g/m2,S6最低,仅0.92 g/m2(图2b)。
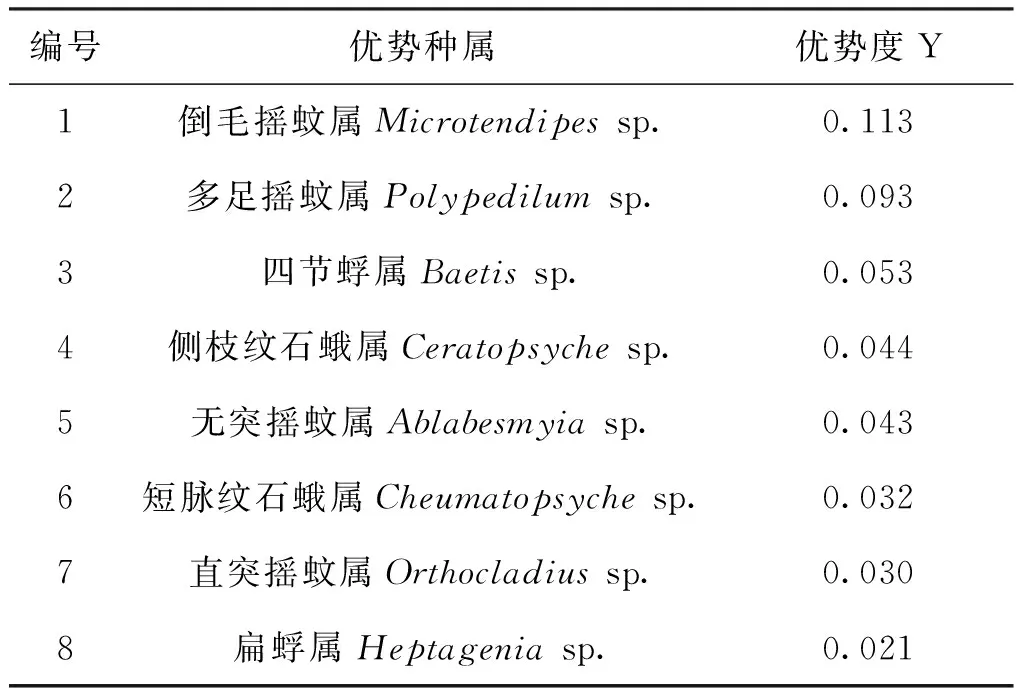
表3 优势种属及其优势度Tab.3 Dominant species and degree of dominance

图2 研究区域的大型无脊椎动物密度与生物量分布Fig.2 Density and biomass distribution of benthic animals in the study area
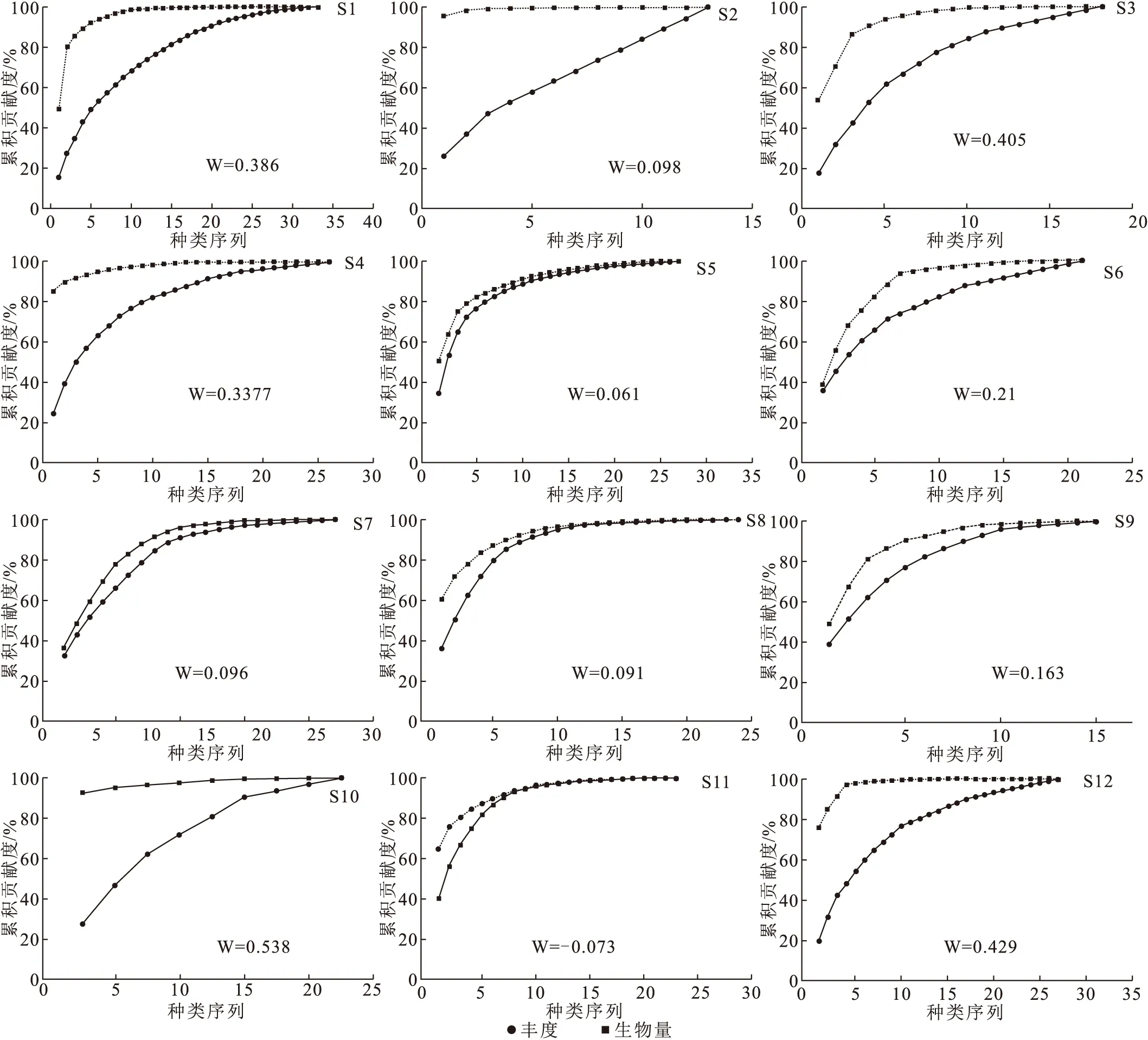
2.2.3 丰度生物量比较曲线
基于大型无脊椎动物群落的丰度与生物量差异,以丰度生物量比较曲线(ABC曲线)对各采样点生态受干扰情况进行比较(图3)。样点S1、S2、S3、S4、S8、S10及S12呈现出同一特征,生物量曲线的起始位置明显高于丰度曲线起始位置,且曲线间无交叉重叠,生物量曲线始终位于丰度曲线上方,表示大型无脊椎动物群落未受到明显的干扰;样点S5、S6、S7及S9的曲线的生物量曲线也位于丰度曲线上方,但两曲线的起点或整体相隔较近,表示受到的较弱的干扰;S11生物量曲线起点位置低于丰度曲线,后交叉重叠至一起,表示该群落中大型无脊椎动物整体占比较少,即该样点受到了一定程度的干扰。
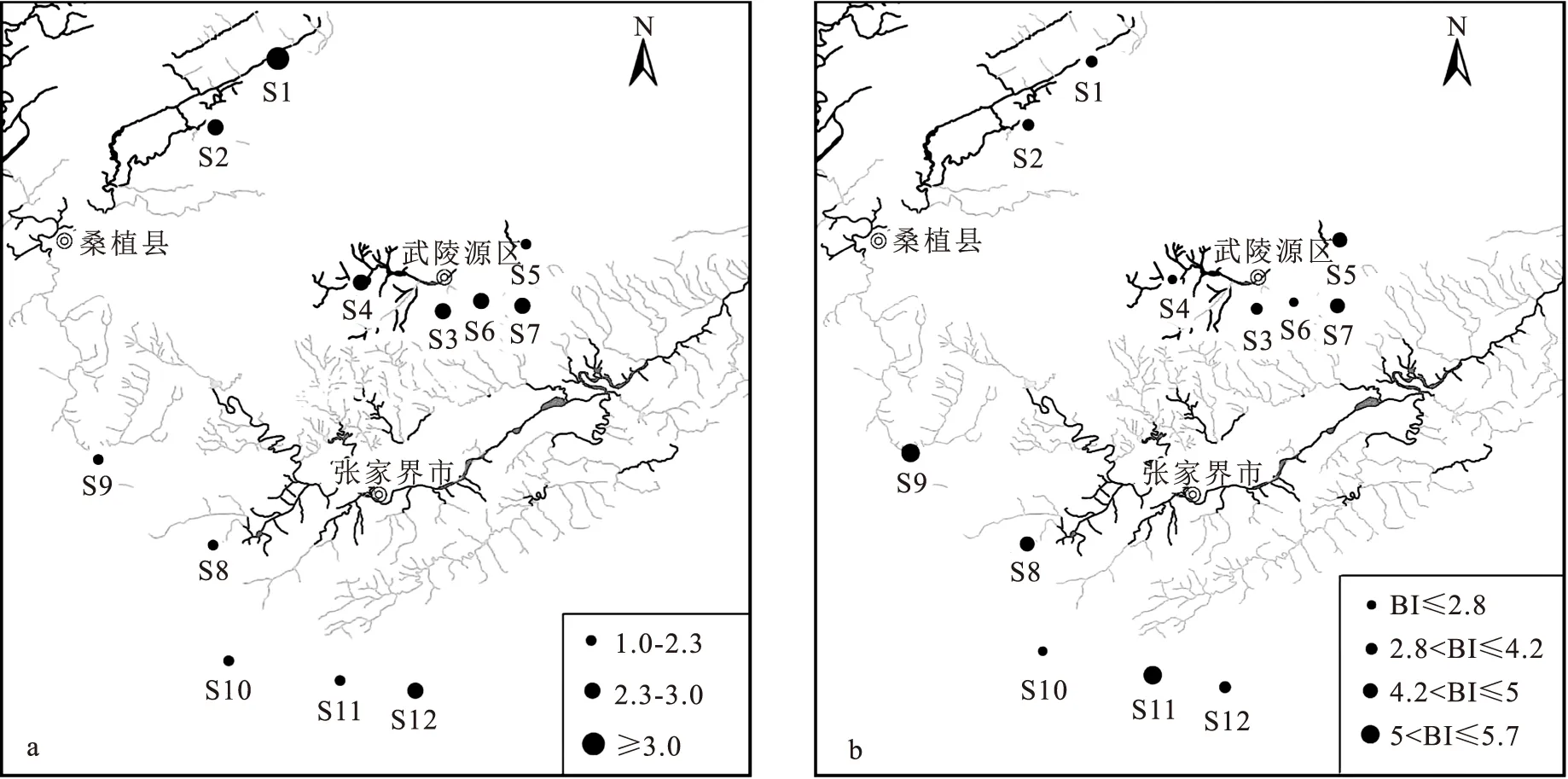
图3中各样点的W值排列特征与ABC曲线特征基本一致。仅样点S11为负数,W值为-0.073,其余样点的W值均为正数,与群落生物量曲线起点位于丰度上方相对应。表示除S11之外,其余样点的大型无脊椎动物均在群落中占有相应比重,其中W最大值出现于S2、为0.698,说明该点受干扰程度最小。对W值进行排序,样点受干扰程度从大到小的结果为:S11 2.2.4 各样点的生境健康评价 大型无脊椎动物群落多样性指数在1.45~3.03之间,平均值为2.34。总体来说(图4a),仅S1的H′值>3,为轻度污染或无污染状态,其余样点均为中污染状态,其中S10、S11相对较严重。 图4b为各样点的大型无脊椎动物群落BI指数,BI指数平均值为3.88,最大值出现于S11,为5.58,最小值出现于S10,为1.86。根据BI指数评价阈值进行划分,S1、S2、S3、S4、S6、S10及S12均为最清洁状态,S5、S7、S9及S11相对稍差,但仍属于清洁状态。 将物种丰度、生物量、ABC曲线法W值、BI指数、Shannon指数H′这5个能反映大型无脊椎动物群落结构特征的参数与环境因子进行Pearson相关性分析(图5),丰度与高锰酸盐指数呈显著负相关,与NH3-N呈极显著负相关;生物量与水温呈显著正相关;W值与高锰酸盐指数呈显著正相关,与NH3-N呈极显著正相关;H′则主要与水温呈正相关关系。 将大型无脊椎物种优势种与水环境因子进行DCA分析,第一轴梯度值小于3,因此选用RDA进行分析。鉴于环境因子多于进行分析的物种数量,会导致RDA分析结果的准确度降低,因此采用前置选择(forward selection)筛选出解释度较高的8个环境因子进行分析。冗余分析结果中,第一、二轴的特征值分别为0.414 6和0.169 3,解释度合计为58.39%。各项环境因子中,仅悬浮物浓度对大型无脊椎动物有显著影响(F=3.3,P=0.016),造成物种分布差异的贡献率为35.6%。RDA分析图中(图6),大型无脊椎动物丰度特征整体呈现出3个群体的特点。群体1为直突摇蚊属,与TP和TN正相关,与pH、MPN、SS、NH3-N负相关;群体2包括短脉纹石蛾属、四节蜉属、多足摇蚊属及侧枝纹石蛾属,与水温和TP正相关,而受到SS、MPN及NH3-N等因子较强的负面效应;群体3为扁蜉属、无突摇蚊属和倒毛摇蚊属,与水温正相关,与SS、NH3-N、MPN及CODMn表现出负相关性。 图3 各采样点的ABC曲线特征及W值Fig.3 ABC curve features and W values of each sampling point A曲线(红色)为丰度累积贡献度的连线,B曲线(蓝色)为生物量累计贡献度的连线。 图4 各采样点的Shannon-Wiener指数(a)与BI指数等级(b)Fig.4 Shannon-Wiener index and BI index grades of each sampling point a为Shannon-Wiener指数;b为BI指数。 图5 大型无脊椎动物群落特征与环境因子的相关性分析热图Fig.5 Heat map of correlation analysis between benthic community characteristics and environmental factors “A”表示大型无脊椎动物丰度,“B”表示大型无脊椎动物生物量,“BI”表示BI指数,“W”表示ABC曲线法W值,“Shannon”表示Shannon-Wiener指数。 图6 大型无脊椎动物优势种与环境因子的RDA的排序图Fig.6 RDA ranking of dominant macroinvertebrate species and environmental factors Hep sp.表示扁蜉属;Mic sp.表示倒毛摇蚊属;Che sp.表示短脉纹石蛾属;Abl sp.表示无突摇蚊属;Bae sp.表示四节蜉属;Pol sp.表示多足摇蚊属;Cer sp.表示侧枝纹石蛾属;Ort sp.表示直突摇蚊属。 基于各样点底栖生物的种类及其对应丰度,按照群落特征的近似程度进行Paerson分层聚类(图7)。由于相似性距离较远,S5点未被显示于聚类图中。在2类聚类结果中,S2自成一类,与其它样点的差异较大。当细化聚类结果后,S10的独立性相对较高,其次为S6及S11。进一步细化分类,S1、S3、S8为一类,S9与S12归为一类,S4与S7为一类,其中S1、S3、S8与S9、S12相对较近。 图7 大型无脊椎动物群落特征聚类分析树状图Fig.7 Cluster analysis tree of macroinvertebrate community characteristics 在湖北神农架、流溪河上游及河南省西峡大鲵自然保护区等典型溪流地区,由于纬度、水温、水源等原因,均表现出昆虫纲占主要优势的特征[31、32],本研究的调查结果与此一致,昆虫纲在大型无脊椎动物中占绝对优势,且8种优势种均隶属于节肢动物门昆虫纲。有研究结果显示,昆虫纲是野生幼鲵的重要天然饵料[33],推断其对调查区域中大鲵种群恢复有重要影响。大型无脊椎动物丰度的变化范围为70.37~8 122.22 ind./m2,生物量的变化范围为0.92~73.61 g/m2,丰度及生物量在各样点均表现出较大差异。主要是由于各样点的水源较独立且相互连通较少,从而导致营养盐、理化指标等生境因子差异较大[13]。 目前基于大型无脊椎动物群落特征的水生态评价方法较多,但各自的适用范围及特点存在差异[34]。ABC曲线的W值来自大型无脊椎动物丰度与生物量的相对比值,主要用于描述群落中个体的相对大小,以评价大型无脊椎动物的群落成熟度或生态恢复程度。Shannon指数H′是以大型无脊椎动物个体的不定性预测评估群落的整体稳定性,样品数量越多则预测越准确。BI指数则是基于不同种类大型无脊椎动物对污染的耐受度及敏感度差异,评价群落受污染情况[35]。三种评价方法中,各样点评价结果基本吻合,主要为S11及S5、S7、S8、S9的水环境质量相对较低。王备新等[36]在秦淮河上游进行大型无脊椎动物调查时发现,多种生态评价方法的效果较单一使用Shannon指数方法更接近实际情况。本研究中也发现了这一现象,BI指数较另两种方法的水质评价结果更好,显示所有样点为清洁状态。由于BI指数是基于生物耐污能力差异的评价方法,因此表明,研究区域并未受到大型无脊椎动物高敏感度污染物的直接干扰,而是有部分样点特别是S11等主要受到环境波动的间接干扰,而导致水生态现状相对较差。 大型无脊椎动物对不同理化因子变化的敏感度存在较大的种间差异,因而不同大型无脊椎动物群落在水环境指标发生变化时也会产生差异化演变[37,38]。群落特征与环境因子的相关性分析热图显示,CODMn和NH3-N对大型无脊椎动物表现出显著性抑制效果(P<0.05)。此外,随着水温升高,大型无脊椎动物生物量和群落Shannon指数H′值随之升高,这一结果与王尽文等[39]的研究结论一致。总体来说,张家界大鲵栖息地大型无脊椎动物群落变化的主要驱动因子为CODMn和NH3-N,其次为水温。 RDA分析结果显示,环境因子对大型无脊椎动物的优势种分布产生了显著影响。悬浮物是湿地中污染物对水生态环境造成物理、化学以及生物作用的重要途径,在水生生物完成地球化学循环作用的过程中发挥着重要的迁移转化作用[40],其对水生生物群落的影响是多种效应叠加的结果[41]。黄翠等[42]指出悬浮物与大型无脊椎生物无直接关联,但是对大型无脊椎动物的重要饵料——浮游生物有明显的抑制作用,谭颖等[43]也提出了悬浮物主要是以降低水生生物初级生产力的方式影响底栖生物生长。本研究调查结果中,短脉纹石蛾属、无突摇蚊属、四节蜉属、多足摇蚊属及侧枝纹石蛾等优势种均属于滤食性生物,悬浮物或是通过抑制其天然饵料(浮游生物等)的生长从而间接与上述优势种产生负相关关系。已有研究表明,旅游干扰引起了悬浮物浓度提高,但是悬浮物的组成种类及占比有待进一步调查研究[44]。由于高锰酸盐指数及氨氮、总磷等营养盐的含量整体相对较低,且与悬浮物浓度未表现出相关性,推测张家界大鲵栖息地中水质悬浮物增长的主要原因为水土侵蚀造成的泥沙含量升高。RDA分析图中,悬浮物浓度与群体2呈负相关关系,由于群体2的4种优势种中有3种为EPT物种[45],因此认为,悬浮物浓度较低是EPT物种生长的重要环境条件。此外,直突摇蚊属与总氮、总磷呈现出较明显的正相关关系,而同属摇蚊科的倒毛摇蚊属则与总氮、总磷呈负相关,说明隶属于同科的不同种类大型无脊椎动物对水生态条件的敏感性也存在较大差异[46]。 王崇瑞等[17]2013与2014年1月在该地区的调查结果显示,大型无脊椎动物的平均密度为1 640.7 ind./m2、平均生物量为11.78 g/m2。本次调查发现大型无脊椎动物的平均密度有所降低,平均生物量有所提高,推测采样的季节差异为造成这一变化的原因[43]。根据ABC曲线方法,本次调查中显示大型无脊椎动物群落受到中等干扰的S11(骡子塔),在2013年的调查结果中即为中等干扰状态,由于周边广布采石场与涉水工程,水土侵蚀引起悬浮物浓度过高的水生态威胁不容忽视。此外,Shannon指数H′在各样点平均值与前次调查基本一致,说明张家界大鲵栖息地水生态环境在近年来整体处于较稳定状态。参照殷梦光等[47]的研究结果,栖息地水生态环境并不是目前影响调查地区野生大鲵种群数量恢复的主要因素。 由于植被组成、光照条件及土壤理化性质存在差异,导致洞穴内、外的大型无脊椎动物群落特征产生明显差异[11]。调查结果中S5(黄龙洞)与其它样点的聚类距离较远,说明在张家界大鲵栖息地,洞穴内、外的生境差异也造成了大型无脊椎动物的群落结构特征呈现较大区别。有研究发现,重度旅游干扰会影响大鲵洞穴分布及栖息地生境质量[10],本次调查中水生态结果较差的S11(骡子塔)与位于张家界森林公园核心景区的S4(金鞭溪紫草潭)、S7(八眼泉)表现出一定程度的群落相似性,同时,S5和S7的ABC曲线与BI指数结果均低于各样点平均水平,说明随着近年旅游热度的持续上涨,张家界森林公园核心景区中有部分溪流湿地的水生态环境受到了影响。后续的生态研究工作中有必要进一步开展系统化监测,为该地区生态保护管理工作提供更为丰富的科学依据。2.3 大型无脊椎动物群落结构与环境因子相关性分析


2.4 大型无脊椎动物群落相似度分析

3 讨论
3.1 大型无脊椎动物群落分布特征
3.2 大型无脊椎动物的主要环境驱动因子
3.3 张家界大鲵栖息地的水质评价
