三甲胺柱[5]芳烃的合成及其抑菌性能
2023-02-12吴惠香赵登奇黄建颖杨利军
吴惠香,杨 华,赵登奇,黄建颖,杨利军
(浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江 杭州 310018)
在食品工业中,由于细菌会在食品、管道、空气和其他食物接触物的表面或内部大量生长繁殖[1],即使使用现代食品保存技术,微生物腐败也会导致过多的食品劣变。由金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)引起的食品污染即使在发达国家也非常普遍。从农场到餐桌这一连续过程中的任何一个环节都有可能导致细菌污染的发生,并最终引起食源性疾病[2]。迄今,食源性疾病已经成为全球范围内日益严重的公共卫生问题[3],并且可以造成全球范围内巨大的经济损失。为防止食品污染造成食源性疾病的暴发,定期对食品加工设备进行清洗和消毒是一项非常重要的步骤。然而,细菌耐药性的出现导致传统的抑菌剂和杀菌剂(如抗生素和一些纳米材料)的抑菌、杀菌效果逐渐降低,迫切需要不断研发新型抑菌和杀菌剂[4-7]。
柱芳烃(图1)是一类具有相对较大空腔和对称柱状结构的新型超分子化合物。根据柱芳烃形成单元数目的不同可分为柱[n]芳烃(n=5,6,7,8,9,10…),因其富π-电子空腔和双环上氧原子的冠醚状排列而具有独特的主客体性质[8]。目前柱[5]芳烃已被较多用于构建超分子聚合物、互锁分子和生物分子杂化材料[9-10]。基于柱芳烃的应用研究已覆盖吸附材料[11]、离子检测[12]、氨基酸识别和蛋白质吸附[13]、药物可控释放、癌症治疗[14]、催化[15]、光治疗[16]、细胞胶水[17]等领域。

图1 柱[5]芳烃的化学结构Fig.1 Chemical structures of pillar[5]arene
柱芳烃的生物活性近几年才初步得到揭示[18-19],其独特结构在不同领域的功能组装体方面还具有很大的开发潜力。例如,季铵盐和咪唑基团不同脂肪链的阳离子柱[5]芳烃[20-21]、带有肽链的支柱[5]芳烃[22]和基于两性离子柱[5]芳烃的带正电纳米聚集体[23]等陆续被报道具有较好的抑菌和抑制生物被膜活性。因此,本实验在溴代柱[5]芳烃上引入季铵盐基团,得到水溶性阴离子为溴离子的柱[5]芳烃盐,并以S.aureusATCC 6538和E.coliDH5α菌株为供试菌,研究三甲胺柱[5]芳烃的抑菌性能;利用噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)法测定其细胞毒性,旨在为开发新型有效无毒的抑菌剂提供更多的可能性和理论依据。
1 材料与方法
1.1 菌株、材料与试剂
S.aureusATCC 6538 中国工业微生物菌种保藏管理中心;E.coliDH5α 日本Takara公司。
HeLa细胞、MCF7细胞购于美国模式培养物集存库。
胎牛血清(fetal bovine serum,FBS)、DMEM(Dulbecco’s modified Eagle’s medium)培养基、RPMI 1640培养基 上海麦克林生物化学有限公司;青霉素/链霉素、结晶紫及其他常用试剂 上海阿拉丁化学试剂有限公司;胰蛋白酶(酶活力≥2500 U/mg) 美国Gibco公司;MTT 美国Sigma公司。
1.2 仪器与设备
AVANCE III 500 NMR超导核磁共振(nuclear magnetic resonance,NMR)仪 德国Bruker公司;H-7650型透射电子显微镜(transmission electron microscopy,TEM) 日本日立公司。
1.3 方法
1.3.1 三甲胺柱[5]芳烃的合成及表征
参考Joseph等[20-21]的方法并稍作修改,合成路线如图2所示。将9.910 g对苯二酚二羟乙基醚和31.500 g三苯基膦加入以乙腈(250 mL)作为溶剂的反应瓶中,随后在0 ℃下边搅拌边缓慢加入39.800 g四溴化碳。待固体完全溶解,在室温下反应4 h。反应结束后,将反应液倒入冷水(500 mL)中有白色固体析出;通过抽滤得到固体,并用体积分数60%甲醇溶液(100 mL)冲洗固体。将粗产品用甲醇进行重结晶,析出固体后抽滤干燥得到产物1(产量10.360 g、产率64.3%)。

图2 三甲胺柱[5]芳烃的合成路线Fig.2 Synthesis route of pillar[5]arene based on trimethylamine
将3.240 g化合物1(10 mmol)加入以1,2-二氯乙烷(130 mL)为溶剂的反应瓶中,完全溶解后加入0.570 g多聚甲醛(19 mmol)和2.4 mL三氟化硼乙醚(19 mmol),室温反应10~30 min。反应结束后加入水淬灭,分液漏斗分液,取下层有机相用无水硫酸钠进行干燥;通过真空蒸馏获得粗产物。将粗产物用二氯甲烷-石油醚(1∶2,V/V)进行柱色谱分离,得到白色固体为化合物2(产量1.04 g、产率30.4%),即溴代柱[5]芳烃。
将0.168 g化合物2加入以无水乙醇(100 mL)为溶剂的反应瓶中,再加入4 mL三甲胺(15 mmol),90 ℃下回流反应24 h。反应结束后旋转蒸发得到白色固体为化合物3,即三甲胺柱[5]芳烃(产量0.250 g、产率78.1%)。
采用1H NMR对合成的各化合物进行表征,测定温度为室温,其中化合物1和2以氘代氯仿(CDCl3)为溶剂,化合物3以重水(D2O)为溶剂;同时采用高分辨质谱(high-resolution mass spectra,HRMS)对化合物3进行表征,电喷雾电离离子源。
1.3.2 三甲胺柱[5]芳烃的最小抑菌浓度和最小杀菌浓度测定
参考Sun Zhimin[24]和Liu Yuhong[25]等的方法并稍作修改,S.aureusATCC 6538培养于含40%(体积分数,下同)甘油、1%(质量分数,下同)葡萄糖的胰酪大豆胨肉汤培养基中;E.coliDH5α培养于含40%甘油、1%葡萄糖的LB(Luria-Bertani)培养基中,并保藏于-80 ℃冰箱中,使用前活化两次,放置在振荡培养箱中37 ℃、150 r/min培养12 h;对活化好的菌株按照平板计数法进行菌落计数,调整培养基中菌株浓度约为1h 106CFU/mL,置于4 ℃冰箱贮藏备用。
采用微量肉汤法测定最小抑菌浓度(minimal inhibit concentration,MIC),使用96 孔板通过梯度稀释法配制不同质量浓度的样品溶液。吸取100 μL不同质量浓度样品溶液于96 孔板中,加入1h 106CFU/mL菌液使每孔菌株接种密度为5h 105CFU/mL,三甲胺柱[5]芳烃终质量浓度依次为0.008~2.000 mg/mL。以等体积不含菌液的培养基无菌水溶液为空白对照,等体积含菌液的培养基和无菌水为阴性对照;金黄色葡萄球菌以甲氧西林为阳性对照,大肠杆菌以多黏菌素B为阳性对照。将96 孔板在37 ℃、100 r/min培养24 h后,用酶标仪于600 nm波长处测定光密度(optical density,OD)值。MIC为完全抑制微生物生长的最低浓度。
从MIC测定实验无明显细菌生长的孔中吸取100 μL溶液涂布于含0.6%酵母浸粉的胰酪大豆胨琼脂培养基上,在恒温恒湿培养箱中37 ℃静置培养24 h后观察平板菌落生长情况。三甲胺柱[5]芳烃最小杀菌浓度(minimal bactericidal concentration,MBC)为培养24 h后细菌平板无菌落生长所对应的最小浓度。
1.3.3 生物被膜形成实验
参照文献[20]的方法,按体积分数1%将测试菌株过夜培养物添加到含1%葡萄糖的新鲜LB培养基中,用生长培养基稀释至5h 105CFU/mL。将100 μL菌液和100 μL不同终质量浓度待测化合物溶液添加到96 孔板每孔中,37 ℃下不搅拌孵育24 h。孵育结束后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤孔,去除浮游细菌。剩余的细菌在室温下用质量分数0.4%结晶紫溶液染色15 min后再次用PBS洗涤,将微孔板倒置并在纸巾上轻轻拍打以除去多余液体,风干,加入200 μL体积分数95%乙醇溶液,最后在600 nm波长处测定每孔OD值。以不加待测化合物为对照组,按式(1)计算生物被膜形成量。

1.3.4 透射电子显微镜观察细胞膜损伤情况
参照文献[26]的方法并稍作修改。将细菌过夜培养至108~109CFU/mL,反复离心(4 ℃、5000 r/min,5 min)收集细菌于管底,直到肉眼可见米粒大小沉淀,加1 mL质量浓度为MIC的抑菌剂三甲胺柱[5]芳烃于离心管中,以不加抑菌剂为对照组,37 ℃、150 r/min振荡培养3 h,用体积分数2.5%戊二醛溶液固定,漂洗后用体积分数1%锇酸溶液固定1 h,用体积分数30%~80%乙醇溶液依次脱水后,再用体积分数90%丙酮溶液和无水丙酮继续脱水,用丙酮与包埋剂Spurr混合溶液(1∶2,V/V)处理样品1 h,再使用此包埋剂与3 倍体积的丙酮混合,处理样品3 h,最后用纯包埋剂处理,室温下过夜后,切片、染色,最后用TEM对切片进行观察并保存图片。
1.3.5 细胞毒性实验
通过MTT测定法评估柱[5]芳烃的细胞毒性[27]。HeLa细胞培养在含10% FBS和1%青霉素/链霉素的DMEM培养基中,HeLa细胞和MCF7细胞在含10% FBS和1%青霉素/链霉素的RPMI 1640培养基中培养。细胞生长为单层并融合时,加入1.5 mL胰蛋白酶溶液(0.5 g/100 mL,PBS配制)孵育5 min,离心(500hg、10 min),收集细胞,弃去上清液。加入3.00 mL血清补充培养基以中和残留的胰蛋白酶,并将细胞以1.00h 104cells/mL重悬于血清补充培养基中,在37 ℃、5% CO2条件下培养15 h待细胞贴壁生长。弃原培养基,然后用不含或含不同质量浓度柱[5]芳烃的新鲜血清补充培养基继续培养4 h或12 h,然后每孔加入20 μL 0.50 mg/mL MTT溶液,37 ℃下培养4 h后,移除MTT溶液,并用PBS洗涤细胞3 次。添加100 μL二甲基亚砜溶解甲瓒晶体,并通过酶标仪于570 nm波长处测定OD值。以未处理细胞作为对照。细胞活力按式(2)计算。

1.4 数据处理与分析
每组实验均进行3 次平行,结果用平均值±标准差表示。采用Excel 2016软件对数据进行统计分析,Origin 8.0软件作图,采用单因素方差分析,通过Duncan’s test法进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 三甲胺柱[5]芳烃的表征结果
各化合物的结构如图3、4所示,以苯二酚二羟乙基醚为原料,通过简单常规的有机反应合成溴代柱[5]芳烃(化合物2),随后在无水、无氧、室温条件下与三甲胺反应,得到三甲胺柱[5]芳烃(化合物3)。

图3 化合物1(A)、2(B)和3(C)的1H NMR谱Fig.3 1H NMR spectra of compounds 1 (A),2 (B) and 3 (C)
化合物1结构的表征结果为:1H NMR(500 MHz,CDCl3):δ6.86(s,4H)、4.24(t,J=6.3 Hz,4H)、3.61(t,J=6.3 Hz,4H);化合物2结构的表征结果为:1H NMR(500 MHz,CDCl3):δ6.91(s,10H)、4.23(t,J=5.6 Hz,20H)、3.84(s,10H)、3.63(t,J=5.6 Hz,20H);化合物3结构的表征结果为:1H NMR(500 MHz,D2O):δ6.92(s,10H)、4.42(s,20H)、3.90(s,10H)、3.77(s,20H)、3.19(s,90H)。化合物3的HRMS表征结果为:m/z1055.7550([M-2Br]2+),相对分子质量2271.2350。

图4 化合物3的HRMS图Fig.4 HRMS spectra of compound 3
2.2 三甲胺柱[5]芳烃对S.aureus ATCC 6538和E.coli DH5α的MIC和MBC
添加不同质量浓度三甲胺柱[5]芳烃、甲氧西林和多黏菌素B培养S.aureusATCC 6538和E.coliDH5α 24 h后,经肉眼观察到澄清孔的试剂浓度即为MIC(图5、6),进一步通过测定OD值评估三甲胺柱[5]芳烃对S.aureusATCC 6538和E.coliDH5α的MIC(图7),MBC测定平板涂布结果如图8、9所示。由表1可知,三甲胺柱[5]芳烃对S.aureusATCC 6538的MIC和MBC分别为0.125 mg/mL和1.000 mg/mL,对E.coliDH5α的MIC和MBC分别为和0.250 mg/mL和>1.000 mg/mL。结果表明三甲胺柱[5]芳烃对S.aureusATCC 6538抑菌效果优于E.coliDH5α,三甲胺柱[5]芳烃对E.coliDH5α的MIC是S.aureusATCC 6538的2 倍。

图5 不同质量浓度三甲胺柱[5]芳烃培养S.aureus ATCC 6538(A)和E.coli DH5α(B)24 h后96 孔板结果图像Fig.5 Pictures of S.aureus ATCC 6538 (A) and E.coli DH5α (B)cultured on 96-well plate in the presence of trimethylamine-based pillar[5]arene at different concentrations for 24 h


图6 不同质量浓度甲氧西林培养S.aureus ATCC 6538(A)和多黏菌素B培养E.coli DH5α(B)24 h后96 孔板图像Fig.6 Pictures of S.aureus ATCC 6538 cultured in the presence of methicillin and E.coli DH5α cultured in in the presence of polymyxin B at different concentrations for 24 h on 96-well plate
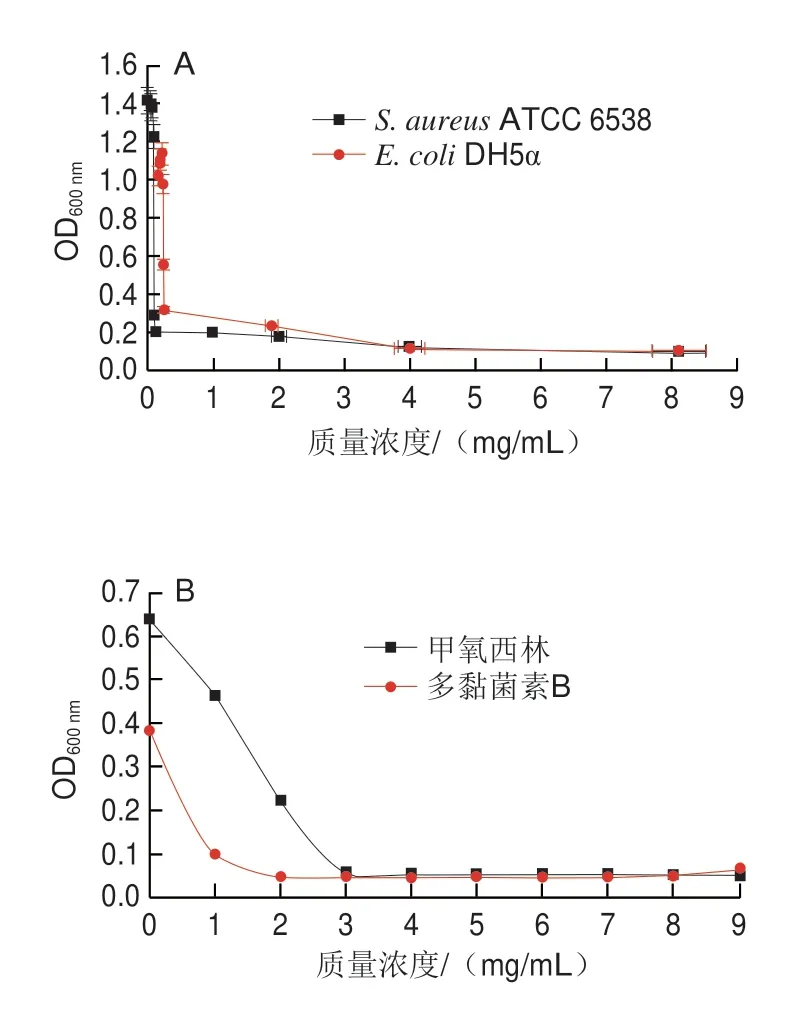
图7 浊度法分析三甲胺柱[5]芳烃对S.aureus ATCC 6538和E.coli DH5α的抑制作用Fig.7 Inhibitory effect of trimethylamine-based pillar[5]arene on the growth of S.aureus ATCC 6538 and E.coli DH5α evaluated by turbidity method

图8 三甲胺柱[5]芳烃对S.aureus ATCC 6538(A)和E.coli DH5α(B)的抑制作用Fig.8 Antibacterial effect of trimethylamine-based pillar[5]arene against S.aureus ATCC 6538 (A) and E.coli DH5α (B)

图9 甲氧西林对S.aureus ATCC 6538(A)和多黏菌素B对E.coli DH5α(B)的抑制作用Fig.9 Antibacterial effect of methicilin against S.aureus ATCC 6538 (A)and polymyxin B against E.coli DH5α (B)

表1 三甲胺柱[5]芳烃对S.aureus ATCC 6538和E.coli DH5α的MIC和MBCTable 1 MIC and MBC of trimethylamine-based pillar[5]arene against S.aureus ATCC 6538 and E.coli DH5α mg/mL
2.3 三甲胺柱[5]芳烃对生物被膜形成的抑制作用
如图10A所示,随三甲胺柱[5]芳烃质量浓度的增加,S.aureusATCC 6538生物被膜形成量不断降低。从结晶紫染色图中也可以明显看出,在0.125 mg/mL三甲胺柱[5]芳烃作用下,S.aureusATCC 6538生物被膜形成量为31.15%。如图10B所示,随三甲胺柱[5]芳烃质量浓度的增加,E.coliDH5α生物被膜形成量也不断减少,呈一定质量浓度依赖性。总体而言,三甲胺柱[5]芳烃对S.aureusATCC 6538生物被膜形成的抑制作用优于对E.coliDH5α。

图10 三甲胺柱[5]芳烃对S.aureus ATCC 6538(A)和E.coli DH5α(B)生物被膜形成的影响及结晶紫染色图Fig.10 Effect of trimethylamine-based pillar[5]arene on the formation of S.aureus ATCC 6538 (A) and E.coli DH5α (B) biofilm and results of crystal violet staining
2.4 三甲胺柱[5]芳烃对菌株细胞膜的损伤作用
如图11所示,在不加三甲胺柱[5]芳烃的情况下,S.aureusATCC 6538具有完整的细胞结构,细胞壁和细胞膜完整平滑,细胞质厚实紧密,细胞质中间可见一道隔膜;而当加入三甲胺柱[5]芳烃后,S.aureusATCC 6538细胞壁和细胞膜遭到损伤,失去细胞壁和细胞膜保护的细胞质变得松散,内容物开始向环境中泄漏,细胞壁和细胞膜有孔洞出现。未经三甲胺柱[5]芳烃处理的E.coliDH5α呈短杆状,细胞壁、细胞膜平滑完整,细胞质内物质致密。E.coliDH5α细胞壁相对于S.aureus较薄,符合革兰氏阴性菌的特点。此外,还可以看出E.coliDH5α细胞膜和细胞质之间有细微间隙。而经三甲胺柱[5]芳烃处理后E.coliDH5α细胞壁、细胞膜变得模糊不清,细胞膜通透性发生改变,细胞质内物质发生絮状凝结并变得疏松。同时E.coliDH5α形态也发生变化,出现皱缩并向内弯曲凹陷。
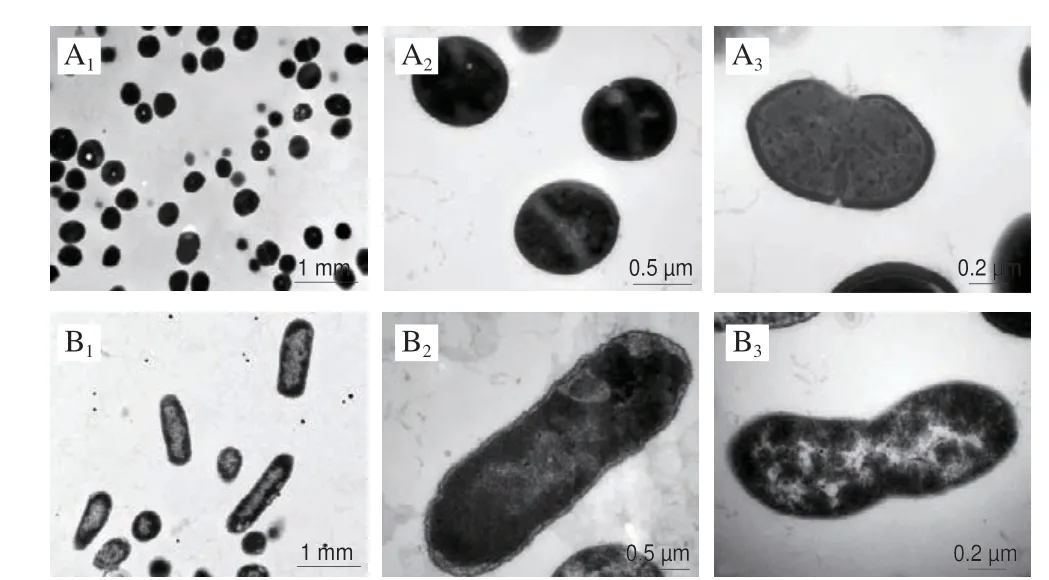
图11 三甲胺柱[5]芳烃处理处理前后S.aureus ATCC 6538(A)和E.coli DH5α(B)的TEM图像Fig.11 TEM images of S.aureus ATCC 6538 (A) and E.coli DH5α (B)before and after treatment with trimethylamine-based pillar[5]arene
2.5 三甲胺柱[5]芳烃的细胞毒性
如图12A所示,随着三甲胺柱[5]芳烃质量浓度的增加,相比于不加三甲胺柱[5]芳烃的对照组,HeLa细胞存活率下降,但细胞存活率仍保持较高水平,当质量浓度达到2 mg/mL时,24 h后细胞存活率仍大于80%,这与Gao Lingyan等[23]研究报道结果类似。如图12B所示,极低质量浓度的三甲胺柱[5]芳烃略微促进了MCF7细胞的生长,这可能是实验误差所致,也可能是细胞对三甲胺柱[5]芳烃的刺激反应所致。在不同质量浓度三甲胺柱[5]芳烃处理下,24 h培养后HeLa和MCF7细胞的存活率均比4 h培养后高,说明三甲胺柱[5]芳烃对这两种细胞均无毒,细胞能够正常存活。


图12 不同质量浓度三甲胺柱[5]芳烃处理对HeLa(A)和MCF7(B)细胞存活率的影响Fig.12 Cell viability of HeLa (A) and MCF7 (B) cells treated with different concentrations of trimethylamine-based pillar[5]arene after 4 and 24 h of incubation
3 讨论
近年来,由于细菌病原体对常规抗菌药物的耐药性增加,迫切需要开发有效的新型抑菌剂和抑菌材料以控制这些细菌病原体引起的感染和腐败。柱芳烃是除冠醚、环糊精、杯芳烃以及葫芦脲以外的一类新型大环主体,因其独特的柱状结构和在制备不同领域功能组装体方面的潜力而备受关注。
本研究以二氯甲烷为溶剂,三氟化硼乙醚催化1,4-二溴乙氧基苯与多聚甲醛发生聚合反应,经柱层析分离纯化得到溴代柱[5]芳烃,最后三甲胺与溴代柱[5]芳烃经亲核取代反应得到阳离子水溶性柱[5]芳烃,其中阴离子为溴离子。通过NMR和HRMS对所合成物质进行结构表征,然后选取S.aureusATCC 6538和E.coliDH5α两种常见细菌菌株进行抑菌性能研究。菌悬液浓度和OD值成正比,OD值越小则证明物质的抑菌性能越强[24-25]。本实验结果表明,三甲胺柱[5]芳烃处理后,在未达到MIC时,OD值较高,96 孔板中培养基浑浊,表明菌株生长未受到抑制并在培养基中大量繁殖;当达到MIC时,液体培养基开始澄清,表明细菌生长受到抑制,相应OD值则显著降低。平板涂布实验结果表明,在达到MIC时细菌生长仅被抑制,一旦给与细菌合适的生长条件,细菌仍会生长繁殖形成菌落。随着三甲胺柱[5]芳烃质量浓度增加,平板上的菌落数量也随之下降,在达到MBC时,菌株停止生长。总地来说,三甲胺柱[5]芳烃对革兰氏阳性菌的抑菌效果优于革兰氏阴性菌,这与Joseph等[20-21]研究结果一致。
此外,在对生物被膜形成影响的实验中,随着三甲胺柱[5]芳烃质量浓度的增加,S.aureusATCC 6538和E.coliDH5α生物被膜形成量逐渐减少,呈质量浓度依赖性,并且三甲胺柱[5]芳烃对革兰氏阳性菌的抑制效果优于革兰氏阴性菌。
为了更直观地了解抑菌剂对细菌细胞膜的影响,可采用TEM进行观察,通过对比对照组与处理组细菌细胞膜形态差异,以及抑菌剂对细菌细胞膜的损伤情况,从而大致推断抑菌剂的抑菌机制[28-29]。TEM观察结果显示,三甲胺柱[5]芳烃会影响S.aureusATCC 6538和E.coliDH5α的细胞膜通透性,导致膜穿孔、菌体裂解,使胞内物质大量流失而使菌体死亡。
食品防腐剂的过度添加会使细菌产生耐药性,导致传统抑菌剂的效果逐渐降低;而大多数化学合成防腐剂长期食用存在潜在致病风险,加之人们对食品安全问题的日渐重视,因此研发一种新型无毒、抗菌效果好的抑菌剂非常重要。本实验采用MTT法分析三甲胺柱[5]芳烃的生物安全性,与传统方法相比,MTT法是最简便的测定细胞活力方法之一[30]。实验结果表明MIC范围内三甲胺柱[5]芳烃对HeLa和MCF7细胞均无毒性,具有作为新型食品防腐剂或者抑菌药物的潜力。
本实验合成了水溶性三甲胺柱[5]芳烃,具有一定的抑菌效果,且毒性很低,可与其他抑菌剂复配使用,但其抑菌机制需进一步探讨。
