沸石负载纳米零价铁去除水中Sb(Ⅲ)和Sb(Ⅴ)的研究
2023-02-04张心怡薛浩天李庆旭孟晓光
张心怡,龚 斌,薛浩天,李庆旭,赵 颖,孟晓光
中国环境科学研究院,北京 100012
随着工业企业的发展,锑(Sb)在全球范围内的用量逐渐增加,随之带来的锑污染现象也日渐严重,引起人们的关注. 在自然界中,锑主要有三种氧化还原态,包括+3、-3和+5,其中Sb(Ⅲ)的毒性较Sb(Ⅴ)更大[1-2]. 在缺氧条件下,Sb(Ⅲ)主要以Sb(OH)3的形式存在,而在好氧环境中,Sb(Ⅴ)的主要形式为Sb(OH)6-,可以在大多数环境pH范围内稳定存在[3].岩石风化是锑的自然来源,而人类活动的加剧加速了锑的释放与迁移,湖南省大型锑矿区矿山排水、地表水和地下水中的Sb浓度可分别高达7.50、6.38和23.0 mg/L[4-5],含锑产品生产加工过程中废水的无序排放也可能导致水体锑污染.
调查与研究[6]已经证实,环境领域中锑浓度的升高会对人类健康和生态系统造成较高风险. 长期饮用高锑水会导致严重的健康问题,包括皮肤病、心肌炎和癌症等[7]. 考虑到高锑水潜在的健康风险,中国、美国和欧盟分别制定了饮用水中Sb的最大允许浓度,分别为5、6和10 μg/L[8]. 目前也发展了许多技术用来去除饮用水和废水中的锑,如化学沉淀、离子交换、膜技术等[9-11],其中吸附是一种简单有效且成本较低的方法. 主要吸附剂有石墨烯、膨润土、铁氧化物、Fe-Mn双金属氧化物等[12-14]. 但大多数吸附剂对锑的吸附易受到环境因素的影响,包括环境pH、离子强度、竞争性阴离子等,环境条件的变化可能会改变吸附平衡,从而导致吸附的锑再次脱附到环境中[15].
纳米零价铁(nZVI)是地下水、土壤修复中常用的工程纳米颗粒之一,作为重金属和卤代有机物的有效修复材料,逐渐被应用到锑污染的去除中[16-17]. 有氧条件下,nZVI氧化产生Fe(Ⅲ)的过程中可以与锑发生腐蚀产物吸附、共沉淀或螯合以及Fe0还原等复杂的相互作用[18],锑能稳定存在于铁沉淀物的结构中,不易脱附或解吸,nZVI对锑具有良好的去除效果.但Fe0纳米颗粒在水中易团聚并缺乏稳定性[19],负载固体材料改性可以进一步提高nZVI的应用范围和锑的吸附效果. 已有研究[20-21]将ZVI负载到活性炭、碳纳米管、黄铁矿和高岭石上,有效增加了对Sb(Ⅲ)和Sb(Ⅴ)的吸附能力. 天然沸石具有较大的比表面积,且在吸附、离子交换和原子/分子捕获能力等方面具有优越的性能,也是一种良好的负载材料[22].
该研究采用液相还原的方法制备天然沸石负载的纳米零价铁颗粒(Z-ZVI),揭示该材料的结构特性,对比分析不同配比材料对锑的去除能力,探究最佳的沸石负载量,通过吸附动力学、吸附等温线、溶液初始pH和共存阴离子试验评价复合材料对Sb(Ⅲ)和Sb(Ⅴ)的去除性能,结合X射线衍射(XRD)和X射线光电子能谱(XPS)等表征方法,对Z-ZVI可能的锑去除机制进行讨论;同时,结合模拟含锑地下水吸附和脱附试验探究材料的实际应用效果和稳定性,以期为锑污染地下水的修复提供参考.
1 材料与方法
1.1 试剂与仪器
1.1.1主要试验试剂
天然斜发沸石,购于元亨净水材料公司;六水氯化铁、硼氢化钾、焦锑酸钾、酒石酸锑钾、氢氧化钠、无水乙醇、多元素标准溶液,均为分析纯;硝酸、盐酸,均为优级纯.
1.1.2主要试验仪器
冷冻干燥机(LGJ-10,上海乔枫实业有限公司);恒温水浴振荡器(ED-8801,安徽立辰科技有限公司);电感耦合等离子体发射光谱仪(5110 VDV,Agilent Technologies,美国);扫描电子显微镜(Gemini 300,ZEISS,德 国);X射 线 衍 射 仪(X′Pert PRO MPD,Panalytical,荷兰);全自动比表面及孔隙度分析仪(ASAP2460,Micromeritics,美国);X射线光电子能谱仪(Thermo Scientific K-Alpha,Thermo Fisher,美国).
1.2 沸石负载纳米零价铁材料的制备与表征
1.2.1沸石负载纳米零价铁的制备
天然斜发沸石在使用前置于1 mol/L HNO3溶液中振荡10 h以除去可溶性杂质,经去离子水洗涤3~5次后在100 ℃烘箱中干燥,后过筛备用.
采用化学还原负载[23]的方式制备质量比分别为1∶3、1∶6、1∶10、1∶15的纳米零价铁/沸石材料. 将不同质量预处理后的沸石粉(4.2、8.4、14、21 g)分别与100 mL 0.25 mol/L FeCl3溶液充分混合并提前搅拌2 h,后转移至三颈烧瓶内. 在N2环境下以5 mL/min的速率滴加等体积的KBH4溶液并不断搅拌,烧瓶内逐渐产生黑色絮状颗粒. 待反应结束后,分别用脱氧超纯水和无水乙醇冲洗烧瓶底部的黑色沉淀3~5次,随后进行真空冷冻干燥. 反应过程中不加入乙醇等分散剂. 制备好的Z-ZVI材料呈灰黑色粉末状,密封保存在阴凉处.
1.2.2复合材料表征
用扫描电子显微镜和X射线衍射仪对制备的nZVI、Z-ZVI材料和天然沸石的表面形貌特征及组成进行表征. 采用全自动比表面及孔隙度分析仪测定复合材料的比表面积、平均孔径和孔隙体积. 采用X射线光电子能谱仪测定反应前后Z-ZVI的元素组成及价态变化.
1.3 Sb(Ⅲ)和Sb(Ⅴ)的吸附试验
1.3.1不同铁/沸石配比材料吸附锑效果试验
分别向初始浓度为20 mg/L的Sb(Ⅲ)和Sb(Ⅴ)溶液中添加相应质量的不同铁/沸石比Z-ZVI材料及nZVI材料(以Fe0计)(0.5 g/L),于室温下以220 r/min的速率振荡3 h,取样过0.45 μm滤膜,用电感耦合等离子体发射光谱仪(ICP-OES)测定反应后Sb的剩余浓度及Fe的浸出浓度.
1.3.2吸附动力学试验
选取天然沸石、nZVI、1∶10 Z-ZVI及1∶15 Z-ZVI四种材料作为吸附剂,在水溶液中分别对Sb(Ⅲ)和Sb(Ⅴ)进行动力学吸附试验,并采用准一级动力学与准二级动力学吸附模型描述吸附速率,相关方程及参数意义见表1. 调节溶液pH=7.0±0.1,分别在5 min、10 min、20 min、40 min、l h、2 h、4 h、8 h、12 h、24 h的时间节点取样过滤. 其余反应条件及锑浓度测定方法同1.3.1节. Sb(Ⅲ)和Sb(Ⅴ)在不同采样时刻下的吸附量通过式(1)计算:

表1 动力学吸附模型和等温吸附模型的表达式与参数意义Table 1 Expressions and parameter meanings of kinetic adsorption model and isothermal adsorption model

式中:C0为溶液初始浓度,mg/L;Ct为t时刻溶液瞬时浓度,mg/L;qt为t时刻重金属在吸附剂上的吸附量,mg/g;V为溶液体积,L;m为吸附剂质量,g.
1.3.3初始pH影响试验
选取天然沸石、nZVI与1∶10 Z-ZVI材料进行初始pH对Sb(Ⅲ)和Sb(Ⅴ)吸附的影响试验. 用NaOH和HCl调节溶液pH分别为3、5、7、9、11,3种材料的添加量同1.3.1节,根据动力学吸附试验结果在最佳平衡时间取样并立即过0.45 μm滤膜,测定Sb、Fe浓度和反应终点pH.
1.3.4等温吸附试验
根据吸附动力学试验和初始pH影响试验优化统一取样时间和溶液pH. 初始Sb(Ⅲ)和Sb(Ⅴ)的浓度范围均设置为5、10、20、30、40、60、80、100 mg/L,选用Langmuir和Freundlich等温吸附模型进行拟合,拟合方程与参数见表1,其余反应条件同1.3.1节.
1.3.5共存阴离子影响试验
在Sb(Ⅲ)和Sb(Ⅴ)水溶液中分别添加1和10 mmol/L的采用不同酸调节pH,避免引入干扰离子. 于室温下振荡反应后测定溶液中Sb的剩余浓度及Fe的浸出浓度.
1.4 模拟含锑地下水吸附和脱附试验
根据文献[24]调查所得锑矿区实际地下水阴阳离子浓度配制该试验所用模拟地下水,其中Ca2+、K+、Na+是含量较为丰富的阳离子,其次是Mg2+,阴离子浓度由高到低依次为地下水中还含有微量的其他离子,如等. 配置10 mg/L NaHCO3,5 mg/L CaCl2、MgCl2·6H2O,2 mg/L MgSO4·7H2O,1 mg/L NH4Cl、NaNO3,0.5 mg/L K3PO4·3H2O,0.1 mg/L Na2CO3、Na2SiO3·9H2O, 0.05 mg/L FeSO4·7H2O, 5 μg/L Na2MoO4·2H2O、ZnSO4·7H2O,模拟地下水中各成分浓度,调节pH为7.0±0.1. 加入1:10 Z-ZVI复合材料对不同锑污染程度地下水进行吸附试验. 反应4 h后将固体产物过滤分离,用超纯水清洗后烘干. 将吸附锑后的复合材料重新加入50 mL不含锑的模拟地下水中继续振荡进行脱附试验,反应12 h后过0.45 μm滤膜,测定溶液中Sb浓度. Sb(Ⅲ)和Sb(Ⅴ)的脱附率可以通过式(2)计算:

式中:d为脱附率,%;Ce为溶液平衡浓度,mg/L;Ce(t)为脱附溶液中锑平衡浓度,mg/L.
1.5 数据测定与分析
溶液中总Sb和总Fe浓度采用电感耦合等离子体发射光谱仪(ICP-OES)测定,锑标准曲线的相关系数>0.999 9,检出限为0.01 mg/L. 采用Excel 2021进行数据描述性统计与单因素方差(ANOVA)分析,采用Origin 2019绘图.
2 结果与讨论
2.1 材料的性质与表征
采用SEM观察nZVI、沸石及二者复合材料的表面形貌. 由图1可见,纳米零价铁颗粒粒径大小为50 nm左右,但各颗粒之间紧密连接,总体呈现链状结构. 天然沸石的表面较为光滑,无明显孔隙,总体形貌呈块状分布. 改性后,复合材料中的nZVI颗粒在沸石表面均匀分布,以短链状或单球状镶嵌在沸石表面和孔隙中,大大减少了纳米零价铁颗粒之间的团聚,增加了复合材料的比表面积,与BET测定结果一致,Z-ZVI的比表面积比纯nZVI高出2倍有余.
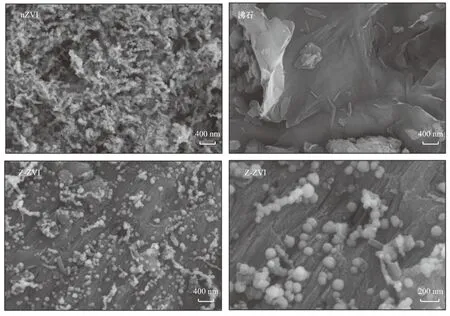
图1 nZVI、沸石和Z-ZVI的SEM图像Fig.1 SEM images of nanoscale zero-valent iron, zeolite and zeolite-supported nanoscale zero-valent iron
采用XRD对三种材料的主要成分进行表征,结果〔见图2(a)〕表明,nZVI图谱中出现了较强的Fe0衍射峰(2θ=44.8°),天然沸石图谱在9.8°、22.3°、26.6°等处均出现特征峰,表明沸石的主要矿物成分为Clinoptilolite-Na、Clinoptilolite-Ca和SiO2. Z-ZVI在相同位置(22.3°、26.6°和44.8°处)同时出现Fe0和沸石的特征峰,说明nZVI很好地负载在了沸石表面,在保留沸石特征结构的基础上引入Fe0,反应后Z-ZVI图谱中出现铁氧化物的特征峰,而Fe0峰消失.
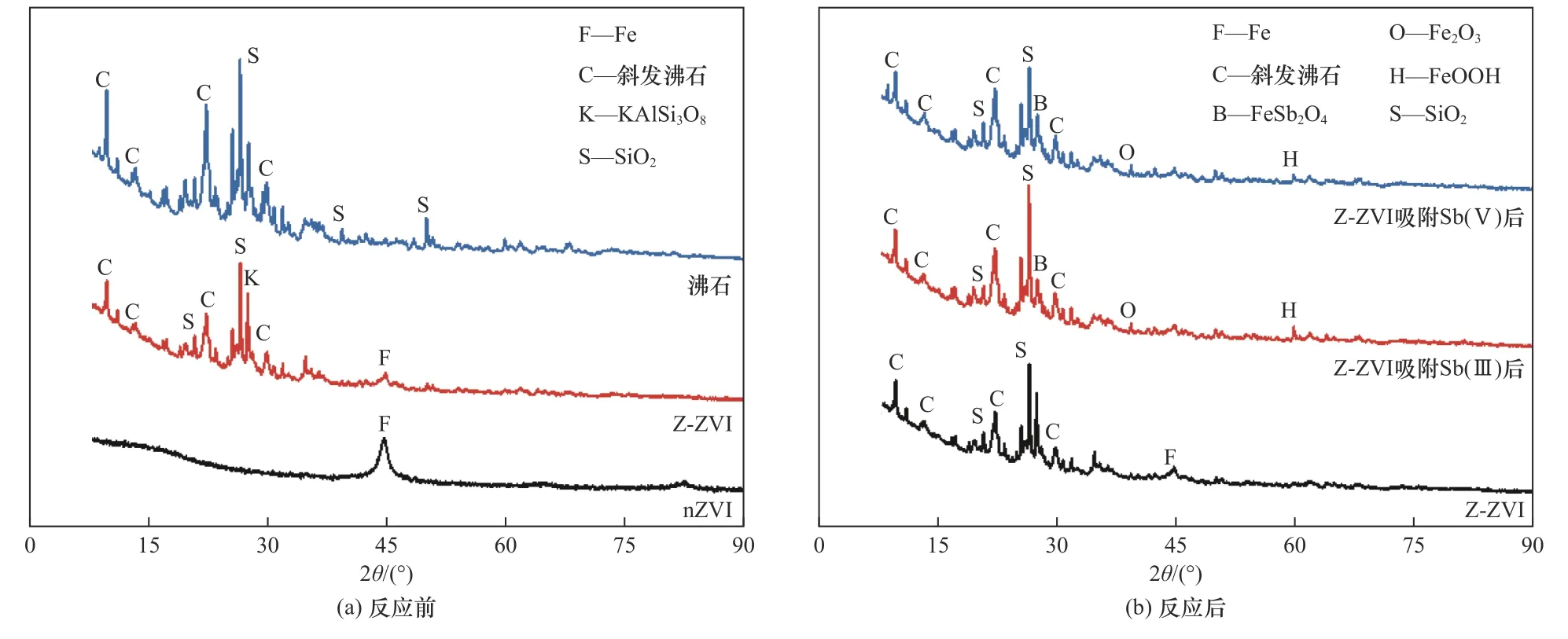
图2 nZVI、沸石和Z-ZVI反应前后的XRD图谱Fig.2 XRD patterns of nanoscale zero-valent iron, zeolite and zeolite-supported nanoscale zero-valent iron before and after reaction
采用BET测定复合材料的比表面积结果见表2.Fe0纳米颗粒在沸石上的稳定化负载在一定程度上防止了Z-ZVI复合材料中铁颗粒的团聚,从而导致更高的比表面积(54.54 m2/g),远高于nZVI (19.71 m2/g)和天然沸石(11.81 m2/g),这与Tasharrofi等[25]的研究结果相似. 对此,有研究者提出改性沸石具有更高的比表面积可能是因为沸石表面和沸石结构通道中形成了Fe(Ⅲ)相的多孔层[26]. 相对于nZVI,Z-ZVI的孔体积以及孔径大小有所增加,但对比天然沸石的孔径变化不大,说明固定的Fe0没有严重阻断或破坏沸石的孔隙通道[27].

表2 nZVI、Z-ZVI及天然沸石的比表面积和孔结构Table 2 Specific surface area and pore structure of nanoscale zero-valent iron, zeolite-supported nanoscale zero-valent iron and natural zeolite
2.2 沸石负载纳米零价铁对不同价态锑吸附试验结果
2.2.1不同铁/沸石配比Z-ZVI材料对Sb(Ⅲ)、Sb(Ⅴ)的吸附效果
对比不同铁/沸石比例下锑的吸附效果(见图3)可知,在一定的反应条件下,随着沸石添加比例的提高,沸石-纳米零价铁复合物对Sb(Ⅲ)和Sb(Ⅴ)的去除率逐渐增加,其中1∶3和1∶6配比材料对Sb的去除率与nZVI相差不大. 1∶10和1∶15配比材料具有较高的Sb去除效果,但对比之下二者的差距并不明显,对Sb(Ⅲ)的去除率均超过90%,后选取二者继续进行吸附动力学试验进行比较.
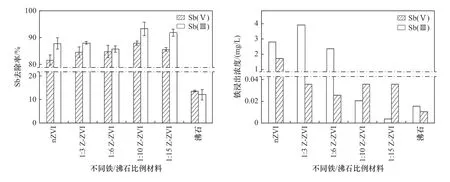
图3 不同铁/沸石配比Z-ZVI材料对溶液中Sb的去除率以及Fe的浸出浓度变化Fig.3 Removal rate of Sb and leaching concentration of Fe by Z-ZVI materials with different ratios
总体来看,Z-ZVI和nZVI对Sb(Ⅲ)的去除效果更好,与已有研究结果[28]一致,这主要归因于Sb(Ⅲ)和Sb(Ⅴ)的空间构型不同. Sb(OH)3具有不对称的四面体构型和一对非共享的电子,而Sb(OH)6-具有对称的八面体结构,空间构型的差异可能会影响反应能垒,导致不同的反应动力学[29]. 同时,通过测定反应后Fe的浸出浓度发现,沸石负载能显著降低nZVI反应过程中铁离子的浸出,使nZVI在保持较高活性的同时还具有一定稳定性,从而降低纳米金属颗粒应用过程中的潜在环境生态风险[30].
试验结果显示,在Fe添加量相同的情况下,改性材料较单位纯零价铁发挥了更大的吸附效果,与沸石作为分散剂解决了纳米零价铁自身团聚的缺陷有关,沸石的添加可以有效保持其反应活性与稳定性,更易保存.
2.2.2吸附动力学试验
通过吸附动力学试验可知,溶液中Sb浓度随反应时间的增加先迅速降低后逐渐趋于平滑. 其中Sb(Ⅲ)在吸附4 h后其浓度几乎不再变化,逐渐达到吸附平衡,Sb(Ⅴ)的吸附反应相较之下比较缓慢,在8 h后其浓度波动减小,达到平衡(见图4). 4种材料中,1∶10和1∶15配比材料对溶液中Sb的去除速率较快,反应达到平衡时对Sb(Ⅲ)的去除率为90%左右,对Sb(Ⅴ)的去除率也在60%左右,显著高于天然沸石和纯nZVI. 其中1∶10配比材料对Sb(Ⅲ)的去除率略高于1∶15配比材料,且制备时材料用量更少,考虑成本效益后选取1∶10配比的Z-ZVI进行后续试验.
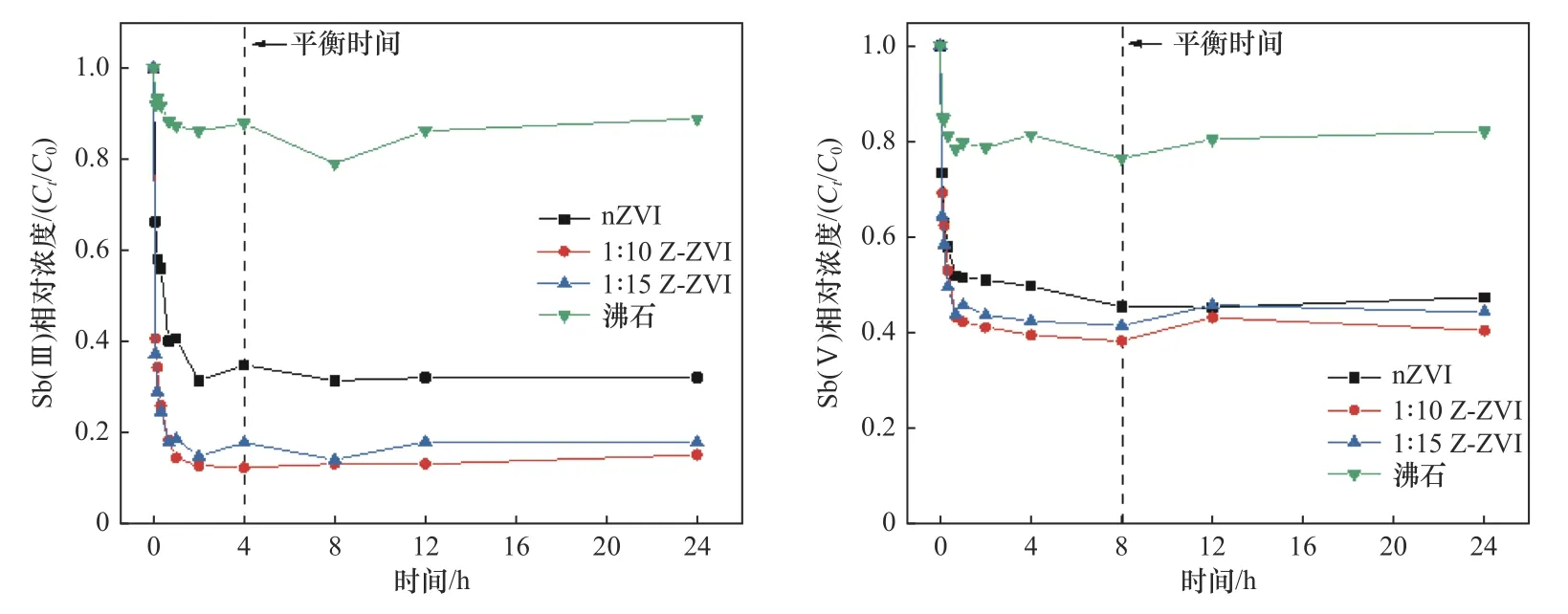
图4 不同材料对Sb(Ⅲ)和Sb(Ⅴ)的吸附动力学过程Fig.4 Adsorption kinetics of Sb(Ⅲ) and Sb(Ⅴ) on different materials
如图5所示,对nZVI和改性Z-ZVI吸附Sb(Ⅲ)和Sb(Ⅴ)的过程进行准一级动力学和准二级动力学模型的拟合(由于天然沸石对Sb吸附效果较弱,暂不拟合),拟合参数见表3. 从表3所示的决定系数R2可以看出,准二级动力学模型更符合Sb(Ⅲ)和Sb(Ⅴ)在两种材料上的吸附动力学特性〔对于Sb(Ⅲ),qe为20.12~155.05 mg/g;对 于Sb(Ⅴ),qe为11.77~101.31 mg/g〕,说明化学反应在Sb(Ⅲ)和Sb(Ⅴ)的吸附过程中具有重要意义[31]. Z-ZVI对Sb(Ⅲ)和Sb(Ⅴ)的吸附速率常数k2明显高于nZVI,沸石的添加增加了复合材料表面的离子交换性能,该过程相较于络合和沉淀等反应更加迅速[27].
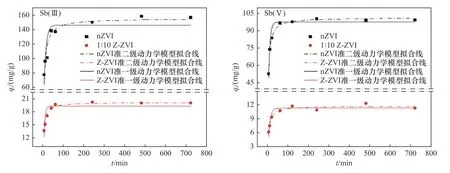
图5 不同材料对Sb(Ⅲ)和Sb(Ⅴ)的吸附动力学模型拟合曲线Fig.5 Adsorption kinetics model fitting curves of Sb(Ⅲ) and Sb(Ⅴ) on different materials

表3 准一级和准二级动力学模型对Sb在不同材料上的吸附拟合参数Table 3 Pseudo-first-order and pseudo-second-order kinetic equation fitting parameters of Sb adsorption on different materials
2.2.3等温吸附试验
从等温吸附曲线(见图6)可以看出,Z-ZVI对Sb(Ⅲ)和Sb(Ⅴ)的吸附能力随初始锑浓度的升高而增加,平衡吸附量的增加速率由快变慢,并逐渐趋于平缓. 通过Langmuir和Freundlich等温吸附模型对Z-ZVI吸附Sb(Ⅲ)和Sb(Ⅴ)的数据分别进行拟合,结果如表4所示. 其中,Freundlich等温吸附模型中1/n的大小表示吸附的难易程度,当0<1/n<1时有利于吸附的发生,当1/n>1时对吸附过程是不利的[32].该试验中对于Sb(Ⅲ)和Sb(Ⅴ),n分别为2.141、2.641,1/n均小于1,表明Z-ZVI易于吸附水溶液中的Sb.对Sb的两种价态,非均匀吸附的Freundlich等温吸附模型拟合的效果更好(R2<0.94),说明该模型更适用于描述沸石-纳米零价铁对Sb的吸附,这表明ZZVI复合材料表面形成了具有不同吸附活性的分散位点,导致表面吸附不均匀[28].
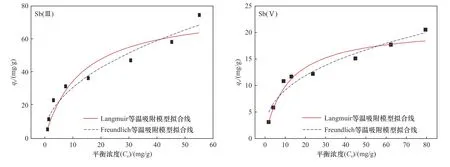
图6 Z-ZVI材料对Sb(Ⅲ)和Sb(Ⅴ)等温吸附模型拟合Fig.6 Fitting of Sb(Ⅲ) and Sb(Ⅴ) isothermal adsorption models by zeolite-supported nanoscale zero-valent iron
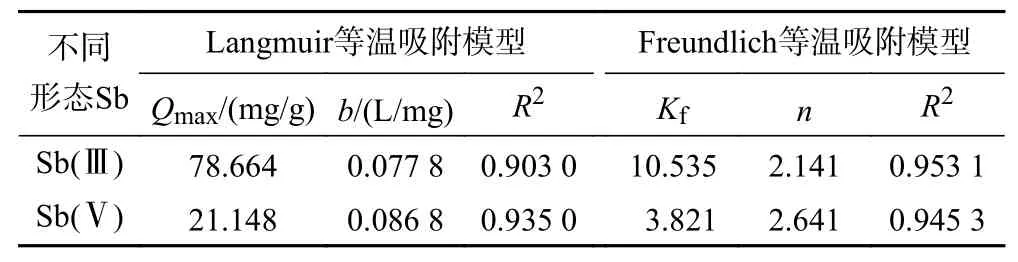
表4 Z-ZVI材料对Sb(Ⅲ)和Sb(Ⅴ)等温吸附的模型拟合参数Table 4 Model fitting parameters of Sb(Ⅲ) and Sb(Ⅴ) isothermal adsorption of zeolite-supported nanoscale zero-valent iron materials
2.2.4溶液初始pH对锑吸附影响
不同初始pH下Sb(Ⅲ)和Sb(Ⅴ)的去除率以及不同吸附剂处理下吸附终点pH的变化情况如图7所示. 由7图可见,nZVI和Z-ZVI材料反应终点的pH相比初始pH均有所上升,Fe0腐蚀过程中存在Fe0与水溶液中H+及O2之间的反应,H+被消耗,同时产生的铁(氢)氧化物也呈碱性[33].
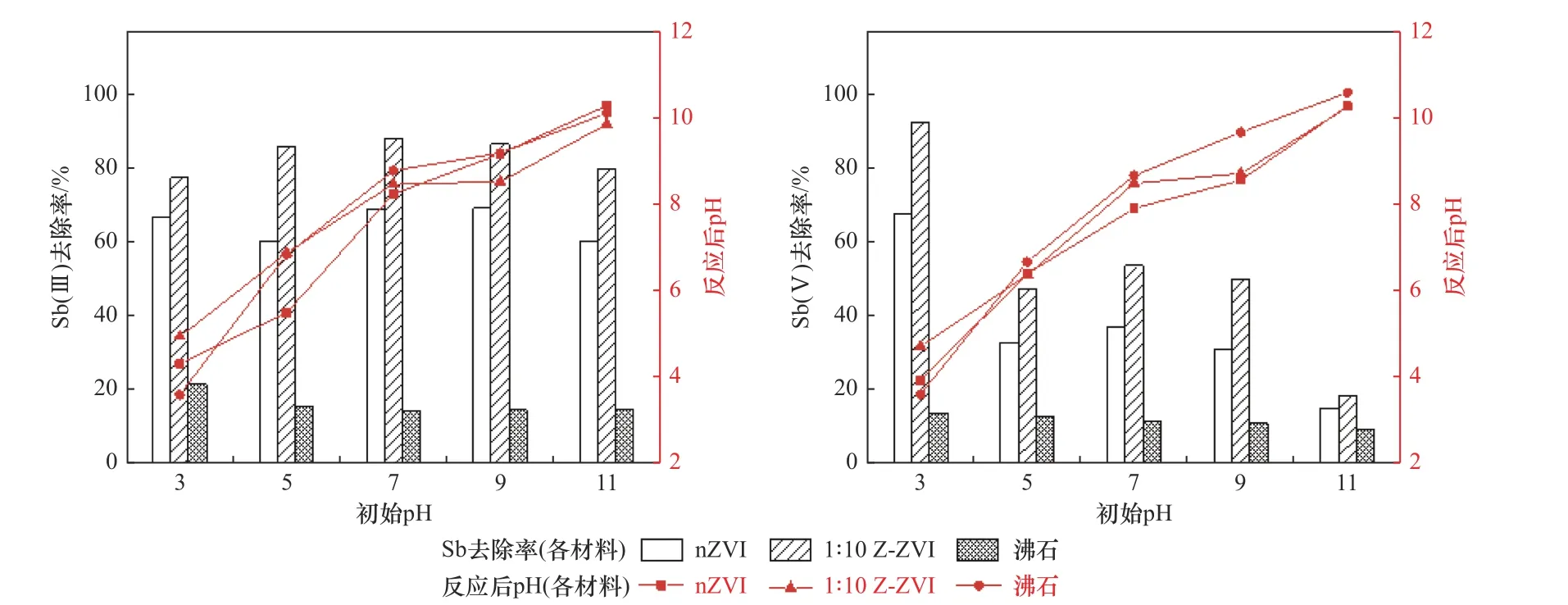
图7 初始溶液pH对Sb(Ⅲ)和Sb(Ⅴ)吸附的影响Fig.7 Effect of initial solution pH on adsorption of Sb(Ⅲ) and Sb(Ⅴ)
Sb(Ⅲ)的去除率受pH变化的影响不大,总体去除率保持在80%~90%之间,随初始pH的升高,Sb(Ⅲ)的去除率总体呈现先略微上升后略微下降的趋势,在中性条件下Sb(Ⅲ)的去除率最高. 但在酸性条件下Sb(Ⅴ)的去除率明显高于中性和碱性条件下,在pH=11.0下,Sb(Ⅴ)的吸附能力相对较低,这与Sb(Ⅲ)和Sb(Ⅴ)在中性条件下的存在形式不同有关,Sb(Ⅴ)主要以的形式存在. 较低的pH有利于吸附剂表面质子化,带正电荷位点的增加增强了其与阴离子之间的静电吸引[34],零价铁材料酸性条件下的活性也更高. 强碱性条件下,吸附剂表面的负电荷更大. 静电斥力增强导致吸附能力下降[35].但在较低pH下Fe的浸出浓度大大增加,这是因为在强酸性条件下,铁在吸附剂表面发生溶解[36]. 但相较于纯nZVI,沸石负载后的ZVI含铁氧化物更少溶解,因此络合吸附不同价态Sb的效果更稳定.
2.2.5共存阴离子对锑吸附影响
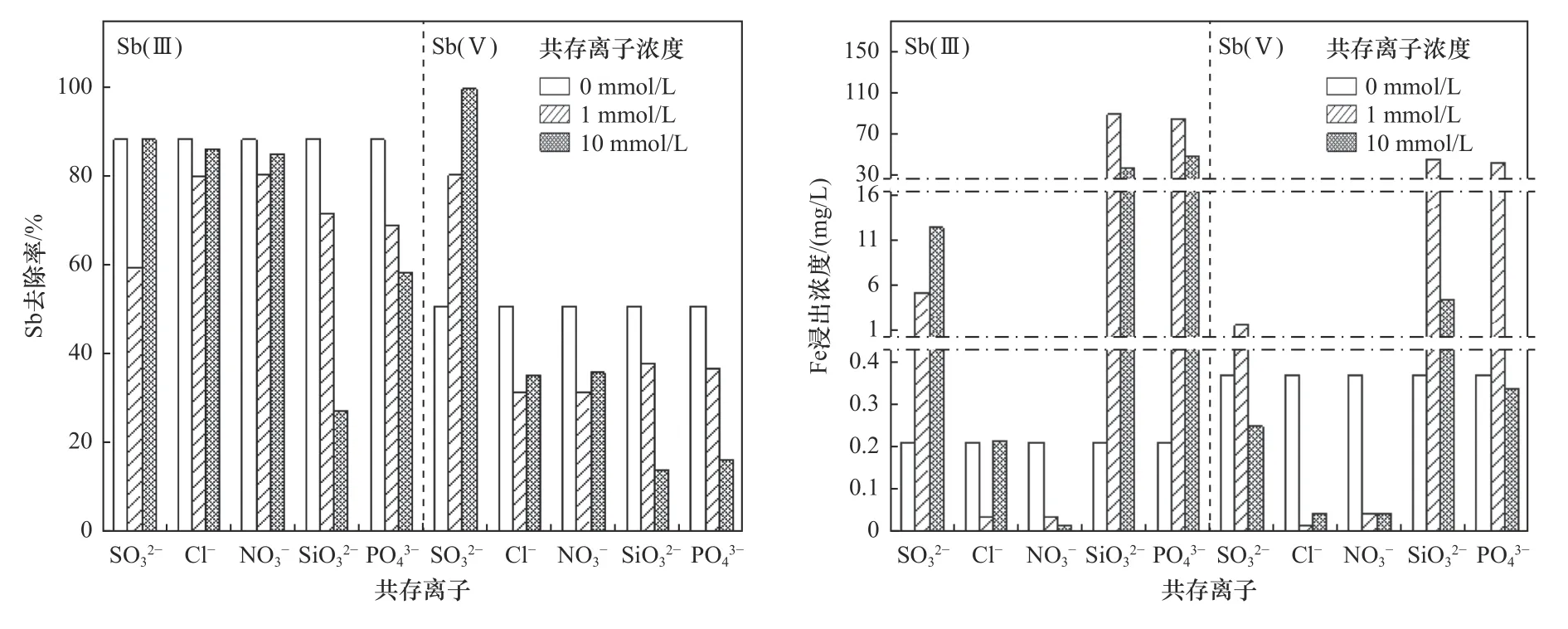
图8 共存阴离子对复合材料吸附Sb(Ⅲ)和Sb(Ⅴ)效果的影响Fig.8 Influence of coexisting anions on the adsorption effect of Sb(Ⅲ) and Sb(Ⅴ)
2.3 复合材料除锑作用机制
将反应24 h后分别吸附Sb(Ⅲ)和Sb(Ⅴ)的1:10配比材料进行XRD和XPS表征,对比分析反应前后材料组成的变化. 从图2(b)可以看出,吸附Sb(Ⅲ)和Sb(Ⅴ)后Fe0的特征峰消失,出现FeOOH和Fe2O3等铁氧化物的衍射峰,说明在反应过程中Fe0发生氧化,与锑结合生成了Fe-Sb(Ⅲ)氧化物、氢氧化物等,即锑通过吸附共沉淀附着在铁氧化物、氢氧化物上. 沸石的特征峰变化不大,说明沸石结构在反应过程中仍然保持完整性,不受系列反应的影响,可为nZVI的转化提供一个稳定的基底.
同时,从XPS表征结果中观察到,吸附后的全谱中出现Sb 3d轨道,Fe 2p轨道中Fe0的特征峰逐渐消失,轨道向高结合能移动,氧化状态提升,且分别在714.8、728.4 eV和711.2、724.6 eV处存在FeOOH和Fe2O3的特征峰[40],这与XRD结果一致〔见图9(b)〕.通过对Sb 3d轨道分析发现,Sb(Ⅲ)和Sb(Ⅴ)在吸附过程中均有Sb(0)的形成,在吸附过程中存在还原作用. Sb3+/Sb0(+0.2 V,298 K)的标准还原电位完全高于Fe2+/Fe0(-0.44 V,298 K)[31],电化学还原在Sb(Ⅲ)和Sb(Ⅴ)的去除中起作用. 其中,78.58%的Sb(Ⅲ)被还原成Sb(0),Sb(Ⅴ)也被逐步还原成Sb(Ⅲ)和Sb(0).因此,Sb的去除过程中同时存在吸附和还原作用,反应初始Sb首先吸附在Z-ZVI表面,随着反应发生,部分Sb发生还原,部分Sb与Fe(Ⅱ)或Fe(Ⅲ)络合形成混合氧化物,铁氧化物将吸附的Sb包裹在铁化合物和沸石基底中,并进一步还原少量Sb.
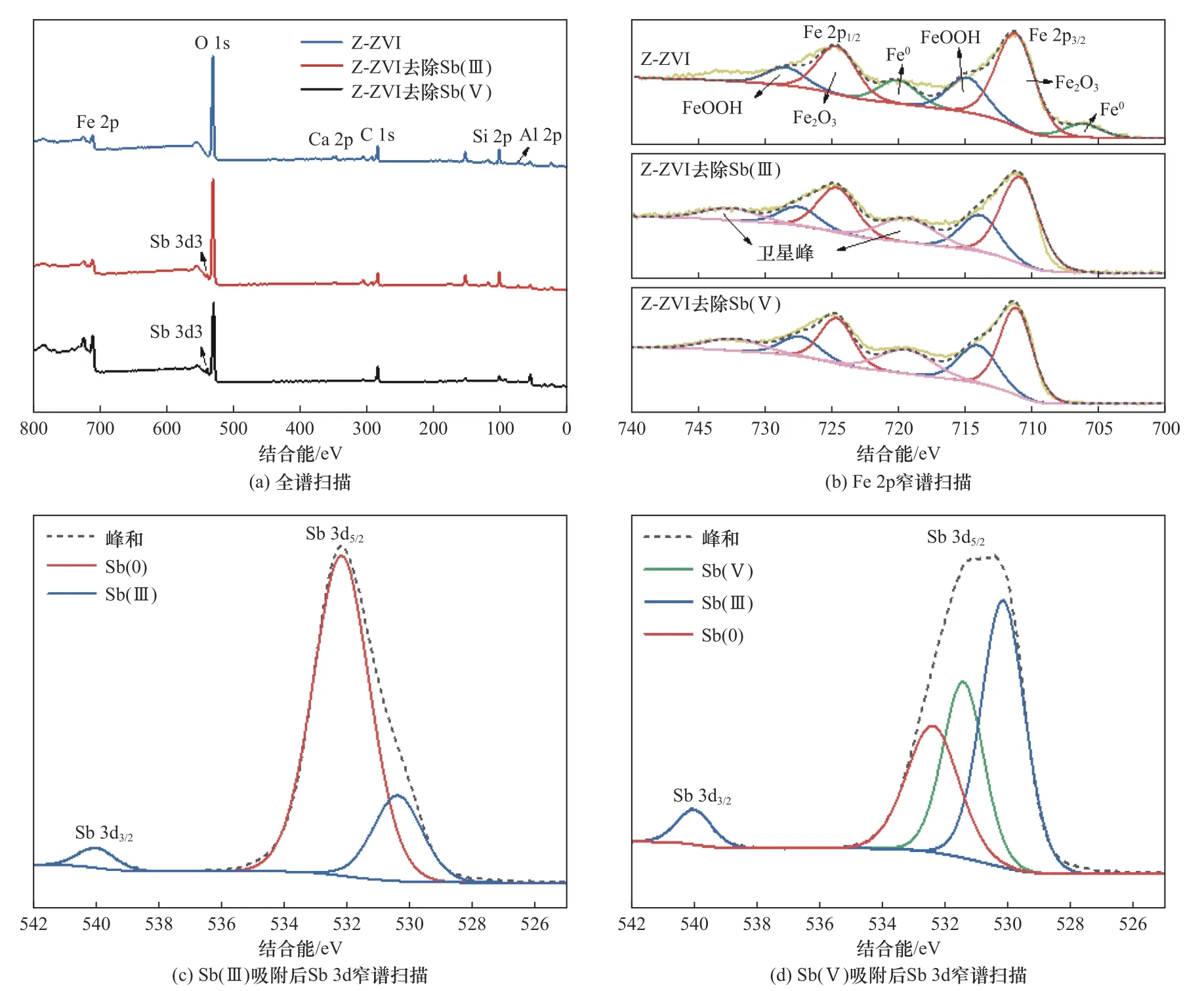
图9 对Sb(Ⅲ)和Sb(Ⅴ)吸附后的XPS全谱、Fe 2p、Sb 3d窄谱的扫描表征Fig.9 XPS full spectrum, Fe 2p and Sb 3d narrow spectrum scanning characterization after Sb(Ⅲ) and Sb(Ⅴ) adsorption
2.4 模拟含锑地下水吸附和脱附试验
通过模拟不同锑污染程度地下水探究Z-ZVI材料在实际水环境中对Sb(Ⅲ)和Sb(Ⅴ)的去除效果.从图10(a)可以看出,Sb的去除率随Sb初始浓度的增加而降低,高锑污染水中Sb(Ⅲ)的去除率均在80%以上,Sb(Ⅴ)的去除率可达60%. 在较低锑污染程度下Sb(Ⅲ)和Sb(Ⅴ)的去除率均超过96%,反应4 h后模拟地下水中锑浓度可降至0.01 mg/L. 结果显示,Z-ZVI材料对不同锑污染模拟地下水均有良好的修复效果,在实际地下水应用中具有一定潜力.
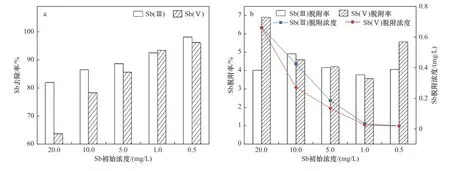
图10 Z-ZVI对模拟地下水中锑的去除和脱附效果Fig.10 Adsorption and desorption of antimony in simulated groundwater by zeolite-supported nanoscale zero-valent iron
通过脱附试验探究Z-ZVI材料的稳定性,结果如图10(b)所示. 在不含锑的模拟地下水中振荡反应12 h后发现,Sb的脱附量远小于吸附量,脱附率为3.5%~6.9%,在较低污染程度下Sb浓度维持在0.02 mg/L以下. 结果表明,Z-ZVI材料在锑吸附过程中具有一定稳定性,锑在反应过程中与形成的铁氧化物发生络合或共沉淀作用,稳定存在于铁氧化物结构中,不易脱附.
3 结论
a) 液相还原法制备的天然沸石负载纳米零价铁材料在不同价态锑的吸附方面表现出优良性能,其中1∶10配比复合材料对Sb(Ⅲ)和Sb(Ⅴ)的最大吸附量分别为20.12和11.77 mg/g,吸附过程符合准二级动力学模型和Freundlich等温吸附模型. 沸石的负载有效保持了nZVI的反应活性,并增强了其稳定性以拓宽应用范围.
b) pH在锑的吸附过程中起着重要作用,其通过改变材料表面性质产生影响,导致不同价态锑在不同pH条件下的吸附过程有显著差异. 酸性条件有利于Sb(Ⅴ)的去除,而Sb(Ⅲ)在较宽pH范围内均能被有效吸附. PO43-、SiO32-等阴离子对Sb的吸附具有一定程度的抑制作用,但在实际环境浓度下的影响不大.
c) XRD和XPS分析证实,Z-ZVI材料在吸附过程中产生含锑铁(氢)氧化物来固定和去除锑,同时,在Fe0氧化过程中还伴随着高价锑的还原,两种机制均有助于去除水中的锑. 在模拟锑污染地下水环境中,复合材料对不同锑污染程度地下水均有良好的修复效果.
