亚胺培南联合磷霉素对多重耐药鲍曼不动杆菌的试验研究
2023-02-01王亚萍汪华学
王亚萍,郭 普,汪华学
(蚌埠医学院第一附属医院 1. 重症医学科; 2. 检验科,安徽 蚌埠 233004)
鲍曼不动杆菌是一种革兰阴性的机会性致病菌,可导致免疫功能低下和危重患者发生医院感染[1-2]。近年来,多重耐药鲍曼不动杆菌(multidrug resis-tanceAcinetobacterbaumannii,MDR-AB)感染的报道不断增多,而临床上可供选择的治疗药物有限,抗菌药物联合应用被认为是潜在有效的治疗方法[3-5]。作为β-内酰胺类抗生素之一的碳青霉烯类药物通过与青霉素结合蛋白共价结合来抑制细菌细胞壁的合成[6]。磷霉素(FOS)是一种由链霉菌属产生的磷酸烯醇丙酮酸类似物,可以干扰细菌细胞壁形成并具有穿透细菌生物膜的能力[7],与其他抗菌药物联合使用对包括鲍曼不动杆菌在内的非发酵菌有很强的抗菌活性[8-11]。本研究通过体内外试验,研究亚胺培南(IMP)联用FOS对7株体外分离MDR-AB的抗菌活性,同时比较IMP与FOS、阿米卡星(AMK)、替加环素(TGC)、多粘菌素B(PB)的体外协同作用,进一步探讨IMP联合FOS对MDR-AB生物膜形成及活性氧(reactive oxygen species,ROS)产生的影响,为临床防治MDR-AB感染提供参考。
1 材料与方法
1.1 材料
1.1.1 试剂及仪器 亚胺培南(CAS号:74431-23-5)、磷霉素钠(CAS号:26016-99-9)购自美国CSNpharm公司。MH琼脂及MH肉汤购自英国Oxoid公司。贝博○RBBcellProbe○R活细菌/死细菌染色试剂盒购自上海贝博生物科技有限公司。活性氧检测试剂盒及D-PBS均购自上海碧云天生物技术有限公司。磷酸盐缓冲液,K-B药敏由蚌埠医学院第一附属医院检验科微生物室提供。VITEK比浊仪购自法国生物梅里埃公司;酶标仪购自瑞士Tecan贸易股份公司;流式细胞仪购自美国克曼库尔特公司;超高分辨率激光扫描共聚焦显微镜购自德国蔡司公司。
1.1.2 试验菌株与动物 临床分离的7株MDR-AB均由蚌埠医学院第一附属医院检验科提供。药敏质控菌株为大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853。大蜡螟购自中国天津尚伟轩鱼需有限公司,长度15~25 mm,重量200~300 mg。
1.2 试验方法
1.2.1 菌株鉴定 菌株通过VITEK 2 Compact细菌鉴定仪以及飞行时间质谱系统鉴定,耐药性通过K-B纸片法进行检测,药敏结果判定参照2020版美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)[12]标准。
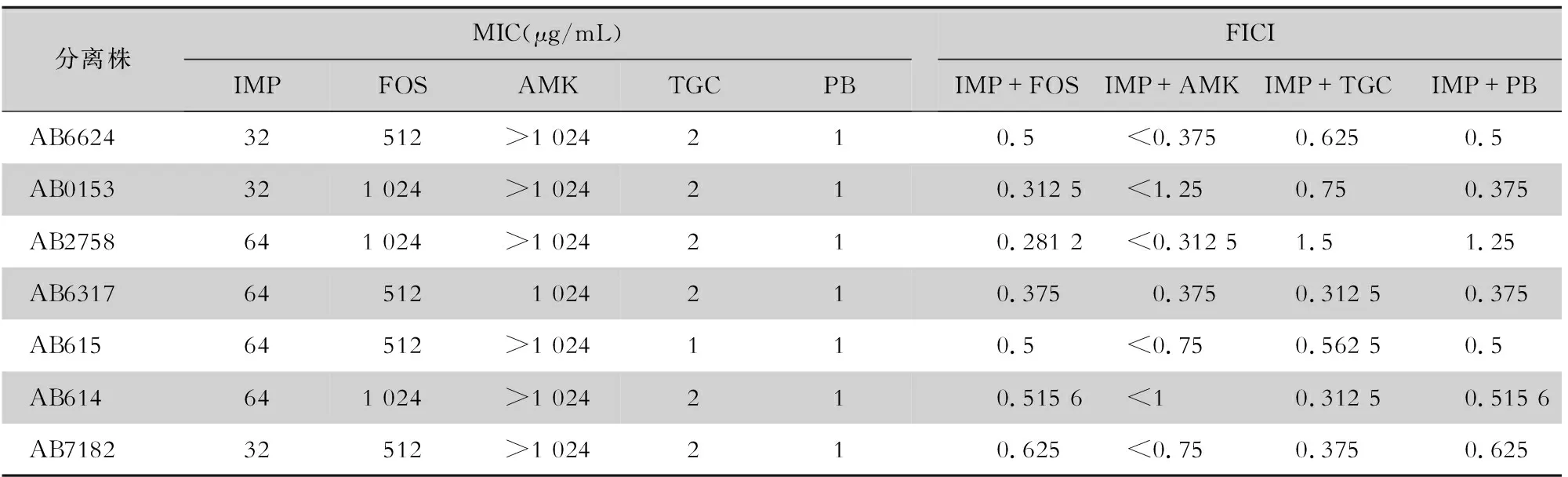
1.2.2 最低抑菌浓度(MIC)及部分抑菌浓度指数(FICI)测定 根据CLSI 2020版推荐的微量肉汤稀释法测定7株MDR-AB对IMP、FOS、PB、AMK、TGC的单药MIC,根据单药MIC结果继续使用微量棋盘法测定7株MDR-AB对IMP分别与FOS、TGC、PB的联合MIC并计算FICI。FICI=MICA药联用/MICA药单用+MICB药联用/MICB药单用。判断标准:FICI≤0.5,协同作用;FICI>2.0,拮抗作用;0.5 1.2.3 时间杀菌曲线 选取菌株AB6624与AB0153,用无菌M-H肉汤将孵育的对数生长期细菌制备菌悬液调节至1.5×108CFU/mL。然后根据两株菌单药MIC结果,选择4×MIC的IMP与3×MIC的FOS单药或者联合用药与菌液共孵育,同时把不加入药物的菌液同步培养作为空白对照组。分别在0、4、8、12、24 h从各组中取10 μL菌液,并用无菌磷酸盐缓冲液(PBS)阶梯性稀释10倍,混匀后各取10 μL接种于MHA琼脂平板上,37℃培养箱培养12 h后进行菌落计数并构建杀菌曲线。判断标准:协同效应定义为联合比单药最强效应的抗菌药物超过细菌初始量2log10CFU/mL的减少;杀菌效应定义为细菌菌落数较初始接种菌落数降低≥3log10CFU/mL[13]。 1.2.4 菌落生物膜测定 1.2.4.1 结晶紫染色法半定量生物膜 以M-H肉汤中孵育的对数生长期细菌制备菌悬液,调节菌悬液浓度至1.5×108CFU/mL,将菌液接种于96孔聚苯乙烯平板,每株菌接种3孔,每孔100 μL。设空白对照组、对照组、IMP(0.5×MIC)组、FOS(0.5×MIC)组、IMP+FOS(0.5×MIC的IMP+0.5×MIC的FOS)组,分别加入等体积抗菌药物,将96孔板置于37℃恒温培养箱孵育48 h,吸出菌液,使用PBS冲洗3遍去除游离菌,室温晾干。每孔加入200 μL 95%甲醇固定15 min,自然风干后再加入200 μL 0.01%的结晶紫染色液染色15 min;吸出结晶紫染色液,使用PBS反复冲洗,自然风干后加入95%乙醇200 μL放入37℃恒温培养箱充分溶解生物膜上的结晶紫,于590 nm处用全波段酶标仪测定光密度(OD)值。 1.2.4.2 共聚焦显微镜观察菌落生物膜内细菌活力 生物膜制备同1.2.4.1,将菌液接种于共聚焦皿中培养48 h,然后吸出菌液,使用0.85%氯化钠溶液冲洗三遍去除游离菌,按说明书使用贝博○RBBcellProbe○R活细菌/死细菌染色试剂盒中PI和BBcellProbe○RN01两种荧光染液对菌落生物膜进行染色,染色结束后使用0.85%氯化钠溶液清洗,重复清洗2遍最后用吸水纸吸干水分,避光转移并使用激光共聚焦扫描显微镜观察。 1.2.5 细菌ROS水平检测 以M-H肉汤中孵育的对数生长期细菌制备菌悬液,调节菌悬液浓度至1.5×108CFU/mL,接种2 mL菌液于5 mL玻璃管中。设置空白对照组、IMP(0.5×MIC)组、FOS(0.5×MIC)组、IMP+FOS(0.5×MIC的IMP+0.5×MIC的FOS)组及活性氧阳性对照组,按照分组分别加入10 μL抗菌药物及活性氧阳性对照,将玻璃管置于37℃恒温培养箱孵育30 min,离心后用0.85%氯化钠溶液洗2次,然后根据说明书配置浓度为10 μM ROS检测荧光探针(DCFH-DA)工作液,使用200 μL重悬细菌后置于37℃恒温培养箱避光孵育30 min,离心后加入0.85%氯化钠溶液洗两次,再用200 μL PBS重悬,立即上流式细胞仪检测,每组收集105个细菌的数据。 1.2.6 构建大蜡螟模型 1.2.6.1 大蜡螟毒力检测试验 以M-H肉汤中孵育的对数生长期细菌制备菌悬液,倍比稀释成菌液浓度分别为107、106、105的3个试验组,第4组为注射PBS对照组,第5组设置为空白对照组,使用25 μL微量注射器注射。将幼虫置于37℃培养箱孵育96 h,每24 h观察幼虫存活量。同一浓度重复3次,计算每株菌的LD80。 1.2.6.2 大蜡螟体内抗菌药物敏感试验 根据毒力试验得到的LD80配制菌液浓度感染大蜡螟幼虫。每株菌设置5组,每组15只幼虫,其中1~3组为试验组,注射相应浓度菌液;第4组为PBS对照组,注射PBS缓冲液;第5组为空白对照组。注射完毕后将幼虫置于37℃培养箱中孵育2 h,然后对试验组幼虫模拟人体剂量一次性给予10 μL抗菌药物,分为IMP单药组、FOS单药组和IMP+FOS联合组,其中IMP和FOS的人体剂量分别为50、160 mg/kg。注射完抗菌药物后,将幼虫置于37℃培养箱继续孵育96 h,每12 h观察并记录每组幼虫死亡数量,比较存活率。 1.3 统计学方法 应用SPSS 16.0软件进行统计学分析,每组试验重复3次,采用t检验进行比较,对于生存率曲线比较,使用Log-rank(Mantel-Cox)检验分析结果。P≤0.05为差异有统计学意义。 2.1 以IMP为基础的联合用药对7株临床分离MDR-AB的MIC及FICI IMP联合FOS对其中5株MDR-AB的FICI值为0.281 2~0.5,为协同作用;对其中两株菌FICI为0.5~1.0,为相加作用。IMP+FOS组联用较其他组协同率高。见表1。 表1 IMP与4种抗菌药物单用及联合用药对MDR-AB的作用结果(n=7) 2.2 IMP联合FOS对MDR-AB的杀菌曲线 IMP联合FOS对菌株AB6624的杀菌曲线显示,4×MIC的IMP与3×MIC的FOS联合处理组在8 h的细菌菌落数较IMP和FOS单药应用降低>2log10CFU/mL,说明两药联合有协同效应,见图1。菌株AB0153的杀菌曲线显示,4×MIC的IMP与3×MIC的FOS处理组在4 h的细菌菌落数较两药单药应用时降低>2log10CFU/mL,说明两药联合具有协同效应。4×MIC的IMP与3×MIC的FOS联合处理组在24 h的细菌菌落数较初始接种量降低>3log10CFU/mL,说明两药联用具有杀菌效应,见图2。 图1 IMP联合FOS对菌株AB6624的杀菌曲线 图2 IMP联合FOS对菌株AB0153的杀菌曲线 2.3 IMP联合FOS对AB6624、AB0153生物膜的影响 选取菌株AB6624、AB0153,通过结晶紫染色法测定IMP联合FOS对菌株生物膜体外抑制活性。培养48 h后,AB6624与AB0153的两药联合处理组OD(590)值均低于对照组(均P<0.01),表明IMP联合FOS对MDR-AB生物膜形成具有抑制作用。见表2。 表2 结晶紫染色法测定IMP与FOS单药及联合用药对菌株AB6624、AB0153生物膜形成的影响(n=3) 2.4 IMP联合FOS对MDR-AB生物膜内细菌活力的影响 激光共聚焦显微镜进一步观察IMP联合FOS对MDR-AB生物膜形成以及膜内细菌存活的影响。根据前期试验结果,选取菌株AB0153进行试验,与对照组相比,IMP联合FOS处理组生物膜>结构稀疏,细菌数量低于对照组及单药处理组,说明两药联合对细菌生物膜形成具有抑制作用。根据不同颜色荧光强度推算,两药处理组生物膜中包埋的死菌比例高于对照组,差异具有统计学意义(P<0.05),表明两药联合对MDR-AB生物膜中细菌具有抑制作用。见图3、4。 注:绿色为活菌,红色为死菌。 注:*表示P<0.05。 2.5 IMP联合FOS对MDR-AB内ROS水平影响 为了探究IMP联合FOS的杀菌机制,采用流式细胞仪分析两药联合对菌株AB0153胞内ROS水平影响,相比于对照组及单药处理组,IMP联合FOS处理组ROS水平升高,差异具有统计学意义(P<0.05),提示两药联合可能通过提高细菌内ROS水平发挥杀菌作用。见图5、6。 图5 IMP与FOS单药及联合用药细菌内ROS水平变化流式细胞术检测峰图(n=3) 注:*表示P<0.05;**表示P<0.01。 2.6 IMP单药及联合用药大蜡冥生存率 菌株AB0153的LD80为1.0×106CFU/mL;IMP联合FOS对MDR-AB感染的幼虫具有保护作用,两药联合可以提高大蜡螟幼虫的生存率(中位生存时间96 h),差异具有统计学意义(P=0.022)。见图7。 图7 IMP与FOS单药及联合用药后蜡螟幼虫生存率曲线 鲍曼不动杆菌是医院内免疫功能低下及病危患者发生侵袭性感染的常见病原菌,近年来抗菌药物的滥用导致MDR-AB的流行。碳青霉烯类抗生素是临床治疗耐多药革兰阴性杆菌感染的一线药物,其耐药性的增加使MDR-AB相关感染难以根除[4]。根据2021年CHINET中国细菌耐药监测结果,耐碳青霉烯类鲍曼不动杆菌对IMP的耐药率高达99.5%。FOS既往被用于治疗大肠埃希菌引起的非复杂性尿路感染,近期研究[8, 14]表明,FOS联合其他抗菌药物对铜绿假单胞菌和鲍曼不动杆菌等非发酵菌具有很强的抗菌活性,具体作用机制尚不明确。 本研究表明,IMP联合FOS对MDR-AB主要表现为协同作用,两药联合具有明显的杀菌效应,相比于联合其他抗菌药物协同率高。生物膜形成是细菌的一种耐药机制,细菌可以在生物膜中生长并躲避机体免疫应答,阻碍抗菌药物发挥作用,而FOS与其他抗菌药物联合使用可以穿透细菌生物膜结构并抑制生物膜形成[7, 15]。本试验选取的MDR-AB菌株具有强生物膜形成能力,IMP联合FOS可以显著抑制其生物膜形成并破坏生物膜结构,生物膜内活菌数量降低,提示两药联合可能通过抑制生物膜形成发挥协同作用。ROS是生物有氧能量代谢中生成的副产物,当细菌在抗菌药物作用下发生ROS过量积累时可以通过芬顿反应产生大量羟自由基,羟自由基可以直接损伤DNA、破坏蛋白质及脂质,从而导致细胞死亡,近年来被认为是与杀菌抗生素活性相关的机制之一[16]。本研究发现,相比于空白对照组和单药处理组,IMP联合FOS可以提高细菌内ROS水平,说明两药联合可能通过促进ROS的产生发挥协同作用。体内大蜡螟感染模型试验进一步验证两药的协同效应,IMP联合FOS治疗后的感染组大蜡螟存活率高于单药治疗组以及对照组,说明两药联合对感染鲍曼不动杆菌的大蜡螟幼虫具有保护作用。 综上所述,本试验通过收集临床的MDR-AB,构建体内外试验观察IMP联合FOS的抗菌活性,发现两药联合具有协同作用,并且可以通过抑制细菌生物膜形成及促进ROS产生参与杀菌过程。两药联合较单药应用对感染MDR-AB的大蜡螟具有更好的疗效,为IMP联合FOS临床治疗MDR-AB感染提供了证据。 利益冲突:所有作者均声明不存在利益冲突。2 结果








3 讨论
