电针原发性高血压模型大鼠太冲、曲池穴观察 microRNA-9 对其下游靶点 P2X7 受体、炎性因子、血管紧张素II 的影响
2023-01-17岳炳南孙娇李晓璐周子娴刘鑫刘清国
岳炳南 孙娇 李晓璐 周子娴 刘鑫 刘清国
原发性高血压是一种常见的慢性疾病,导致了约62%的中风和49%的心脏疾病发作[1]。 目前,该疾病的主要治疗手段为口服药物,而电针降压则具有副作用少、绿色高效的优势。 本团队前期对电针降压机制进行了大量实验探究,研究发现针刺太冲穴可以通过提高不同靶脑区的葡萄糖代谢水平发挥其降压的中枢效应,而下丘脑室旁核在激活的脑区中表现十分活跃[2],课题组还验证了电针可降低血管紧张素II 及炎症因子的表达,延缓高血压疾病的发生发展[3],除此之外,电针还可以通过调节非编 码 RNA ( 如 microRNA) 降 低 血 压[4-5], 而microRNA 则通过参与转录后的基因表达调控,作用于下游受体蛋白,进而影响心血管系统相关细胞的基本功能[6-7]。 基于以上,课题组使用基因检测和分子生物学技术来验证电针对miRNA-9 的影响,通过miRNA-9 对高血压相关的炎症因子白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor, TNF-α)、 血 管 紧 张 素 II ( angiotensinII,ANGII)、P2X7 受体(recombinant purinergic receptor P2X ligand gated ion channel 7, P2RX7),以及小胶质细胞的影响来探讨电针的降压机制。
1 材料与方法
1.1 实验动物与分组
本实验采用自发性高血压大鼠(spontaneous hypertension rat, SHR)为动物模型,12 周龄雄性SHR和Wistar Kyoto 大鼠(SPF 级,250 ~280 g)均购于北京维通利华实验动物技术有限公司,许可证号为SYXK(京)2016-0006。 所有动物单笼饲养,温度恒定在25 ~27℃,并给以12 小时的光照,自由进食、进水。 大鼠在组织提取前一天禁食禁水。 实验经北京中医药大学动物实验伦理委员会审批,所有动物手术均在10%水合氯醛麻醉的情况下严格进行,以减少动物痛苦。
实验共分为五组,将40 只SHR 大鼠随机分为4组:假手术组、miR9 抑制剂+电针组、电针组、模型组(每组10 只),10 只 WKY 大鼠作为空白组。 其中,miR9 抑制剂+电针组行双极插管植入术后注射miRNA-9 拮抗剂,并给以两周电针治疗;假手术组予以注射相同剂量脑脊液,不电针但进行抓取;电针组注射相同剂量脑脊液,进行两周电针治疗;模型组、空白组均只进行抓取。
1.2 主要实验仪器和试剂
试剂:miRNA-9 抑制剂(MCE 公司,HY-10074A,10 μmol);TRIzol 试剂(Invitrogen,10296028),CDNA合成试剂盒(ABI-invitrogen,11752050)和SYBY-qPCR混合物(ABI-invitrogen,4472920);Pierce BCA 蛋白质测定试剂盒(Servicebioc,G2026);P2RX7 受体抗体(abcam,ab109054);重组Anti-Iba1 抗体[EPR16588](abcam,ab178846)。
仪器:无创血压测试仪(BP-6),酶标分析仪(Rayto RT-6100),化学发光仪(CLINX 6300),电泳仪(Servicebio,BT-2);荧光定量 PCR 仪(Applied biosystems USA StepOne Software) 凝胶成像仪(biorad,2500);冷冻切片机(Leica),免疫组化扫描仪(3DHISTECH KFT),显微镜(CIC,XSP-C204);一次性针灸针(0.16 mm×7 mm,中研泰和股份有限公司)。
1.3 下丘脑室旁核双极插管植入术与脑室内注射
大鼠适应性喂养 7 天后,采用戊巴比妥钠(0.2 mL/100 g)腹腔麻醉注射,麻醉起效后,在大鼠脑立体定位图谱和文献研究的指导下,通过脑立体定位仪标记室旁核的位置(前囟门后1.8 毫米,矢状缝两侧0.9 毫米,颅顶下7.9 毫米),消毒后,在室旁核两侧进行钻孔操作,植入双极插管后,将牙科水泥涂于伤口[8-9]。 为减轻动物的痛苦,手术过程尽量轻柔,并使用电热毯为大鼠保暖,术后5 天内每日给以青霉素抗炎治疗。 本实验共对20 只SHR进行手术,手术中大鼠死亡1 只,术后大鼠死亡3只,后续购入5 只后对其中4 只进行手术,补充至缺失组。
注射过程:微量注射器的针头与PE 管相连,在排气后插入双极插管的两侧。 每次单侧的下丘脑室旁核给药剂量为100 nL,注射持续约5 分钟。 每隔12 小时注射一次,连续给药14 天。
1.4 干预方法
行植入术5 天后,对电针组、microRNA-9 抑制剂+电针组进行电针干预,持续2 周。 干预方法如下:将消毒后的一次性针灸针(0.16 mm×7 mm)直刺大鼠双侧的曲池、太冲穴2 mm,均使用平补平泻法。 得气后连接电针仪,电流强度为1 mA,频率2 Hz,留针20 分钟后出针。 为减轻大鼠的恐惧、缓解SHR 大鼠的暴躁行为,我们在治疗过程中使用不透明的袜子制作了一个小型的针灸室,在无电针治疗的假手术组、模型组、空白组进行抓取,并将动物放入袜子20 分钟。
1.5 取材及指标检测
1.5.1 取材 干预结束后1 天进行下丘脑取材,大鼠在10%水合氯醛麻醉后开胸,并使心脏暴露,使用0.9%的氯化钠溶液以及4%的多聚甲醛灌注后,按照大鼠脑立体定位图谱取出下丘脑,一部分常规脱水后,使用石蜡包埋,制作切片(厚10 μm),另一部分保存于-80℃冰箱待检测蛋白。
1.5.2 血压测量 所有大鼠用恒温器预热15 分钟,使其温度稳定在36℃左右。 用无创血压仪连续3 次测量大鼠在安静和清醒状态下的尾部压力取平均值,以避免噪音和其他外部环境刺激对收缩压的影响。 为减少误差,在针灸前0 天和针灸后3、7、10、14 天的上午 8:00 ~12:00 测量收缩压,整个采集过程尽量保持轻柔,避免刺激大鼠,以免引起血压波动。
1.5.3 RNA 提取与实时荧光定量多聚核苷酸链式反应(real-time quantitative polymerase chain reaction,RT-PCR) 剂按照制造商的说明用TRIzol 试从下丘脑室旁核提取含有 miRNA 和 P2X7 受体的mRNA。 按照制造商的说明书使用CDNA 合成试剂盒和SYBY-qPCR 混合物,内源性对照(U6)作为内部参考,使用熔解曲线估计扩增带的纯度。 通过2-ΔΔCt方法计算 miRNA-9 和 P2X7 受体 mRNA 相对定量。
1.5.4 ELISA 使用Rayto RT-6100 以及相应的ELISA 试剂盒检测下丘脑匀浆的上清液和取自腹主动脉血浆中 ANGII、IL-6 和 TNF-α 的浓度,详细操作见于制造商的使用说明。
1.5.5 Western blot 使用Pierce BCA 蛋白质测定试剂盒(Servicebioc G2026)评估下丘脑室旁核中的P2X7 受体的蛋白质浓度,根据试剂盒说明,制作10%的聚丙烯凝胶后,将10% 的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳用于分离样品,然后将其电子转移到 PVDF 膜(0.45 μm Servicebioc G6015)上,使用300 mA 恒流膜半小时。 一抗(P2X7 受体,β-actin)加入后,4℃孵育过夜,二抗室温孵育90 分钟后,使用 AlphaEase FC、Adobe 软件分析 P2X7 受体蛋白质的表达。
1.5.6 免疫组化和图像分析 将下丘脑组织在4%多聚甲醛中浸泡24 小时,用Leica 冷冻切片机将含有下丘脑室旁核的样品切片,厚度为10 μm,后将切片依次浸泡在二甲苯、无水乙醇、85% 酒精、75%酒精、蒸馏水中,在微波炉中加热至沸腾,再将组织切片放在修复盒中进行10 分钟抗原修复,然后将切片浸泡在3%的过氧化氢溶液中,在室温遮光环境下培养25 分钟,用PBS 清洗后,在摇床上摇晃3 次(每次5 分钟),用PAP 笔在组织周围标记,加入3%BSA(Solarbio A8020)覆盖圈中的组织,室温下密封30 分钟。 在玻片上加入PBS,滴入按比例制备的一抗,将玻片放在4℃的盒中,孵育过夜。 加入免疫组化试剂盒中相应种类的二抗(HRP 标记)覆盖组织,室温下孵育50 分钟,DAB 显色反应后,用Harris 苏木精(品诺飞生物技术有限公司)反染。 最后用显微镜和扫描仪进行图像采集(graph bar=20 μm),采用使用 Image J 软件计算平均光密度(average density,AOD)来反应各组小胶质细胞的激活程度。
1.6 统计学分析
本文所有数据通过SPSS 26.0 进行分析,所有计量资料经检验均为正态分布、方差齐,并以均数±标准差()表示,数据采用单因素方差(ANOVA)分析,两两比较采用 LSD 检验。 线性检验通过Pearson 相关分析进行分析。 其中 PCR 数据通过2-ΔΔCt方法计算相对定量,免疫组化的平均光密度数据(AOD=总密度/区域面积)使用Image J 软件计算。P<0.05 被认为具有统计学意义。
2 结果
2.1 各组大鼠收缩压
在手术和电针治疗前,假手术组、模型组、miRNA-9 抑制剂+电针组、电针组大鼠的收缩压明显高于空白组大鼠(P<0.01),且模型组的大鼠在实验中保持了相对稳定的高血压状态。 第七天起,电针组大鼠同假手术组相比,收缩压有了明显下降(P<0.05),经过14 天的治疗,电针组与 miRNA-9抑制剂+电针组相比,收缩压明显更低(P<0.05)如表1。
表1 各组大鼠收缩压变化情况比较(,mmhg)

表1 各组大鼠收缩压变化情况比较(,mmhg)
注: 与空白组相比, aP<0.01;与假手术组相比, bP<0.05,cP<0.01;与miRNA-9 抑制剂+电针组相比, dP<0.05。
组别 鼠只 第0 天 第3 天 第7 天 第10 天 第14天模型组 5 167.0±3.39a 167.4±2.30a 169.0±2.91a 169.4±2.40a 171.6±2.07a 91 108.8±2.58假手术组 5 167.6±2.88a 168.4±2.41 169.4±3.04 170.0±4.18 172.4±2.30 miRNA-9 抑制剂+电针组 5 166.2±1.30a 164.4±1.67 162.8±0.84 162.2±0.83 161.4±2.07电针组 5 167.0±2.23a 166.2±1.30 163.8±1.48b 161.6±2.64c 158.0±1.58d空白组 5 110.4±3.20 111.0±2.00 111.4±3.50 109.4±3.
2.2 电针对SHR 下丘脑室旁核中miRNA-9 水平的影响
采用RT-PCR 技术检测电针治疗后各组下丘脑室旁核miR-9 的水平。 与空白组大鼠相比,模型组miRNA-9 的水平较低(P<0.05)。 此外,与假手术组、miR9 抑制剂+电针组相比,电针组均明显提高了miRNA-9 表达水平(P<0.01),见表2。
表2 各组大鼠下丘脑室旁核miRNA-9 表达水平比较()

表2 各组大鼠下丘脑室旁核miRNA-9 表达水平比较()
注: 与空白组相比, aP<0.05;与假手术组相比, bP<0.01;与miRNA-9 抑制剂+电针组相比, cP<0.01。
水平模型组 5 0.80±0.36组别 鼠只 下丘脑室旁核miRNA-9 a 1.67±0.14假手术组 5 0.51±0.08 miRNA-9 抑制剂+电针组 5 0.48±0.10电针组 5 2.74±0.35bc空白组5
2.3 miRNA-9 对 IL-6、TNF-α 和 ANGII 的影响
由于电针可以明显提高microRNA-9 的水平,且microRNA-9 抑制剂减弱了电针降压的疗效,为进一步探究其机制,课题组检测了高血压的下游指标IL-6、TNF-α 和 ANGII 的水平。
2.3.1 各组大鼠血清及室旁核中IL-6 水平 与空白组相比,模型组中的IL-6 含量明显较高(P<0.01);与假手术组相比,电针组明显降低了血清及室旁核中IL-6 的含量(P<0.01);与miRNA-9 抑制剂+电针组相比,电针组IL-6 的含量明显降低(P<0.01),见表3。
表3 各组大鼠血清及室旁核中IL-6 表达水平比较(,pg/mL)
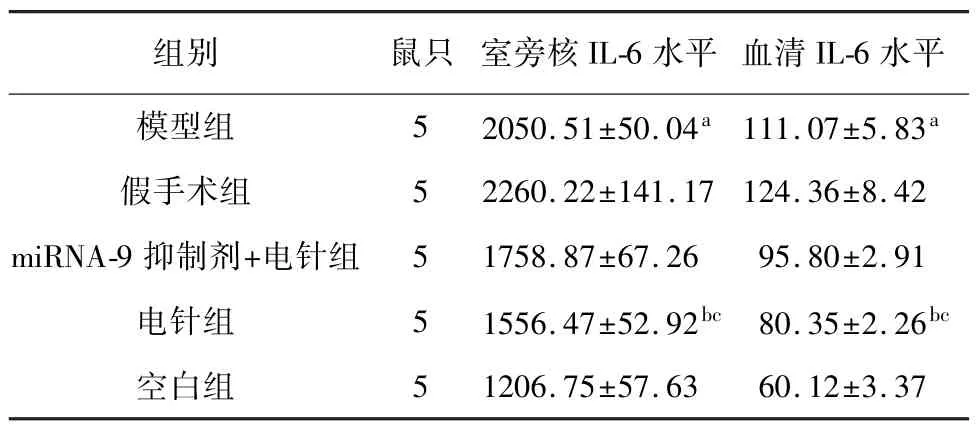
表3 各组大鼠血清及室旁核中IL-6 表达水平比较(,pg/mL)
注:与空白组相比, aP<0.01;与假手术组相比, bP<0.01;与miRNA-9 抑制剂+电针组相比, cP<0.01。
水平模型组 5 2050.51±50.04a 111.07±5.83组别 鼠只 室旁核IL-6 水平 血清IL-6 a 5 1206.75±57.63 60.12±3.37假手术组 5 2260.22±141.17 124.36±8.42 miRNA-9 抑制剂+电针组 5 1758.87±67.26 95.80±2.91电针组 5 1556.47±52.92bc 80.35±2.26bc空白组
2.3.2 各组大鼠血清及室旁核中TNF-α 水平与空白组相比,模型组中的TNF-α 含量明显较高(P<0.01);与假手术组相比,电针组血清及室旁核中 TNF-α 的含量下降明显(P<0.01);与miRNA-9 抑制剂+电针组相比,电针组 TNF-α 的含量明显更低(P<0.05),见表4。
表4 各组大鼠血清及室旁核中TNF-α表达水平比较(,pg/mL)

表4 各组大鼠血清及室旁核中TNF-α表达水平比较(,pg/mL)
注: 与空白组相比, aP<0.01;与假手术组相比, bP<0.01;与miRNA-9 抑制剂+电针组相比, cP<0.05。
血清TNF-α组别 鼠只 室旁核TNF-α 水平 水平模型组 5 2050.51±50.04a 188.75±9.91a假手术组 5 1678.42±68.81 198.98±3.50 miRNA-9 抑制剂+电针组 5 1466.17±57.16 163.03±13.53电针组 5 1338.29±45.34bc 150.20±8.63bc空白组5 1064.33±59.26 110.93±5.65
2.3.3 各组大鼠血清及室旁核中ANGII 水平 与空白组相比,模型组中的 ANGII 含量明显较高(P<0.01);与假手术组相比,电针组明显降低了ANGII 的含量(P<0.01);但电针组与miRNA-9 抑制剂+电针组相比无明显差异(P>0.05)。 见表5。
表5 各组大鼠血清及室旁核中ANGII表达水平比较(,pg/mL)

表5 各组大鼠血清及室旁核中ANGII表达水平比较(,pg/mL)
注: 与空白组相比, aP<0.01;与假手术组相比, bP<0.01。
水平组别 鼠只 室旁核ANGII 水平血清ANGII模型组 5 3.35±0.34a 20.25±0.94a假手术组 5 3.71±0.20 19.82±1.03 miRNA-9 抑制剂+电针组 5 2.17±0.16 14.57±1.23电针组 5 2.03±0.34b 14.36±0.76b空白组5 1.26±0.13 10.71±0.67
2.4 miRNA-9 对室旁核 P2X7 受体蛋白、P2X7 受体mRNA 水平的影响
在验证miRNA-9 的抗炎作用后,我们推测这可能与miRNA-9 抑制P2X7 受体和小胶质细胞的激活有关,为此进行了进一步验证。
2.4.1 各组大鼠室旁核P2X7 受体蛋白表达及P2X7 受体 mRNA 水平 为验证 P2X7 受体和miRNA-9 在电针治疗中的相关性,课题组检测了各组大鼠下丘脑室旁核中P2X7 受体mRNA 和蛋白表达水平。 与空白组大鼠相比,模型组 P2X7 受体mRNA 水平明显升高(P<0.01);电针治疗后,mRNA 水平明显低于假手术组(P<0.01);与miRNA-9 抑制剂组相比,电针组的mRNA 水平也明显较低(P<0.01)。
此外,与空白组大鼠相比,模型组P2X7 受体蛋白水平明显升高(P<0.01);电针组蛋白含量明显低于假手术组(P<0.01);与miRNA-9 抑制剂+电针组相比,电针组蛋白含量较低(P<0.05),电针治疗降低了SHR 中P2X7 受体的表达,但miRNA-9 抑制剂阻断了这一效应,见表6、图1。
表6 各组大鼠P2X7 受体蛋白mRNA、P2X7 受体蛋白表达结果()
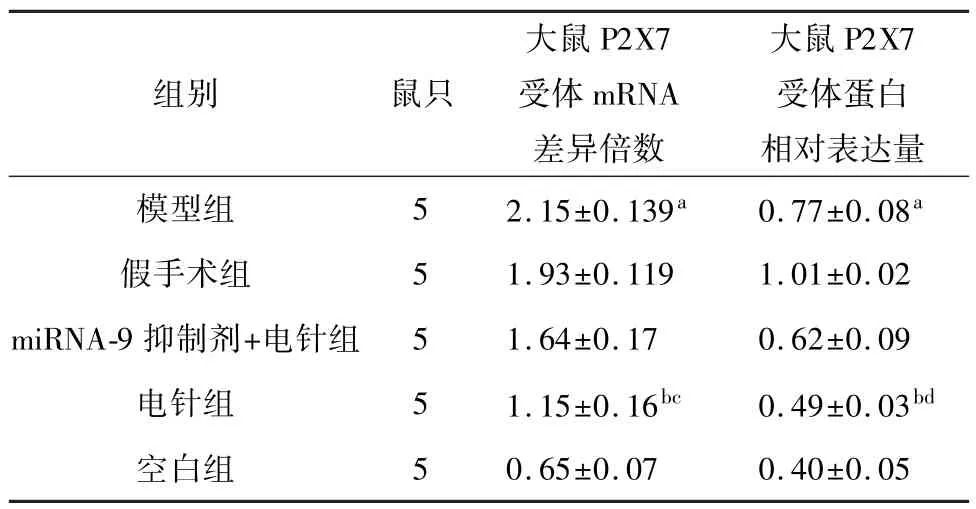
表6 各组大鼠P2X7 受体蛋白mRNA、P2X7 受体蛋白表达结果()
注: 与空白组相比, aP<0.01;与假手术组相比, bP<0.01;与miRNA-9 抑制剂+电针组相比, cP<0.01;与miRNA-9 抑制剂+电针组相比, dP<0.05。
组别 鼠只大鼠P2X7受体蛋白相对表达量模型组 5 2.15±0.139a 0.77±0.08大鼠P2X7受体mRNA差异倍数a 5 0.65±0.07 0.40±0.05假手术组 5 1.93±0.119 1.01±0.02 miRNA-9 抑制剂+电针组 5 1.64±0.17 0.62±0.09电针组 5 1.15±0.16bc 0.49±0.03bd空白组

图1 各组大鼠室旁核内P2X7 受体蛋白表达情况
2.4.2 miRNA-9 和P2X7 受体线性关系分析 为评估大鼠miRNA-9 水平是否影响P2X7 受体在下丘脑室旁核的表达,分析了两者之间的线性关系。 结果显示,在下丘脑室旁核中,miRNA-9 相对含量与P2X7 受体蛋白表达以及mRNA 水平之间存在线性关系(P<0.01),呈负相关。 见图2。
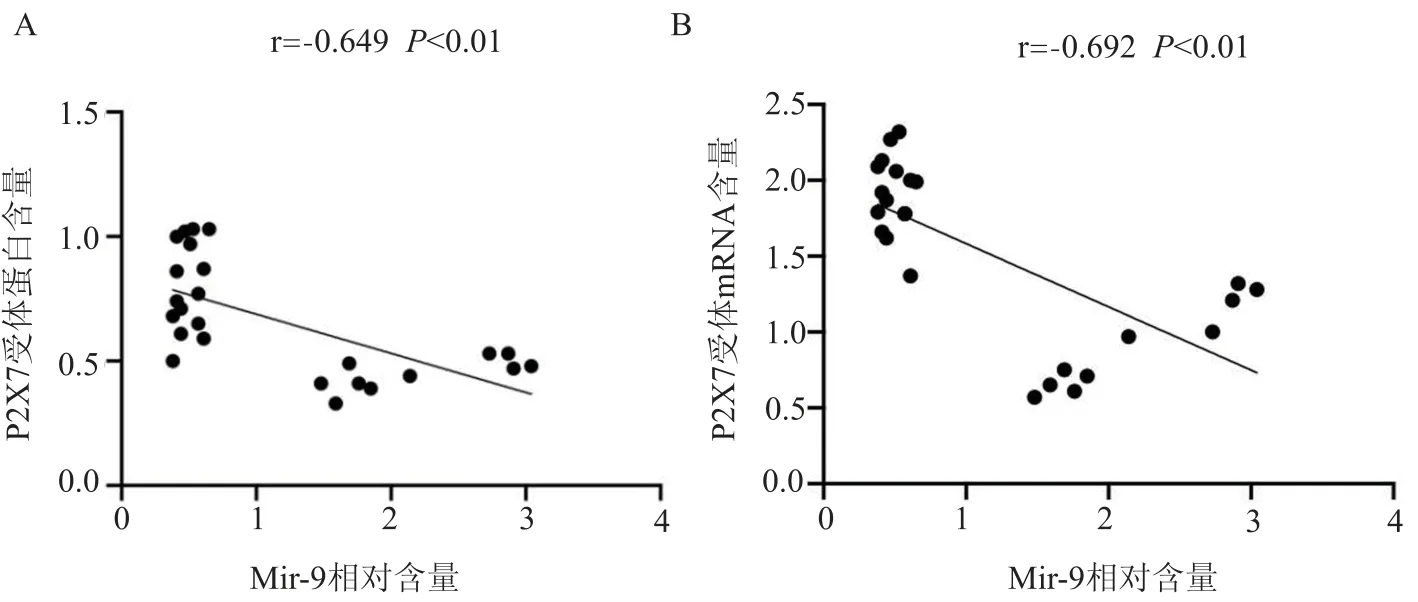
图2 大鼠室旁核中miRNA-9 与P2X7 受体蛋白水平、mRNA 水平的Pearson 线性相关性分析(共计25 组数据)
2.5 各组大鼠室旁核内小胶质细胞的激活情况
免疫组化结果显示:在室旁核内,与空白组大鼠相比,模型组、假手术组小胶质细胞数量明显较多,着色较深,表达明显;相比于miRNA-9 抑制剂+电针组,电针组着色明显较浅,小胶质细胞表达不明显,miRNA-9 抑制剂明显刺激了小胶质细胞的激活。
此外,课题组进一步通过计算AOD 来反映小胶质细胞激活情况。 与空白组大鼠相比,模型组AOD值明显较高(P<0.01);与假手术组相比,电针组AOD 值明显较低(P<0.01),与miRNA-9 抑制剂+电针组相比,电针组AOD 值同样较低(P<0.01)。 见表7、图3。

图3 各组大鼠室旁核小胶质细胞激活情况(免疫组化,×40,标尺:20 μm)
表7 各组大鼠室旁核小胶质细胞AOD 水平比较()
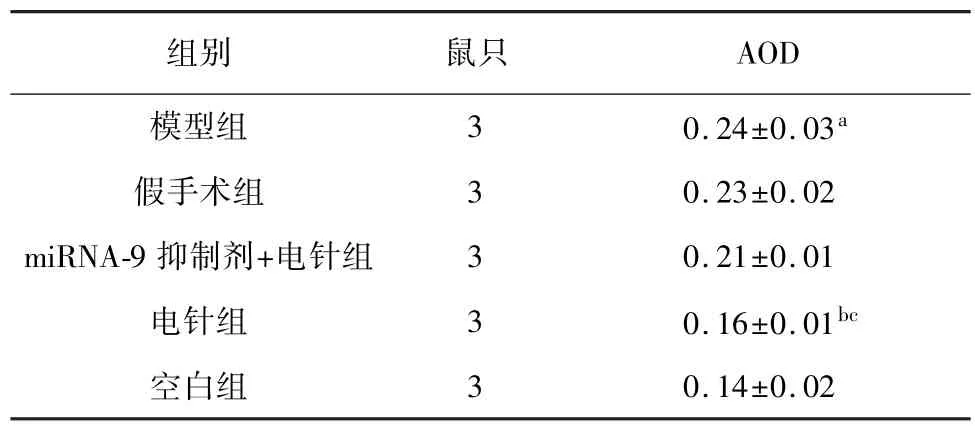
表7 各组大鼠室旁核小胶质细胞AOD 水平比较()
注: 与空白组相比, aP<0.01;与假手术组相比, bP<0.01;与miRNA-9 抑制剂+电针组相比, cP<0.01。
AOD模型组 3 0.24±0.03组别 鼠只a 0.14±0.02假手术组 3 0.23±0.02 miRNA-9 抑制剂+电针组 3 0.21±0.01电针组 3 0.16±0.01bc空白组3
3 讨论
中医认为高血压病属“头痛”“眩晕”范畴,《素问·至真要大论》云:“诸风掉眩,皆属于肝。”高血压病的病责脏腑在肝。 肝气郁滞,气郁化火,导致肝火上炎,在病理状态下,肝阳易亢化成风,风阳上扰清明之府,可导致眩晕。 太冲穴作为降压主穴可以起到良好的降压效果,是现代临床及实验研究中治疗高血压疾病的首选穴位之一。 实验研究发现,电针太冲穴可以从肾素—血管紧张素—醛固酮系统、胰岛素抵抗、氧化应激、交感神经兴奋等多个方面实现降压[10-11]。 曲池穴亦为降压常用腧穴,针刺曲池穴可通过多个信号通路及途径调控血压变化[12-13]。 针刺后对机体细胞因子、信号通路、神经递质表达及其理化性质的改变都极具研究价值。
microRNA 与心血管疾病的发生、发展息息相关[14]。 其中,miRNA-9 可以靶向调控多种受体,如PDGFR-beta、Toll 途径等对心血管功能进行调节[15-16],这表明miRNA-9 可能是高血压潜在的生物标志物。 本研究发现,电针增加了miRNA-9 在SHR大鼠下丘脑室旁核中的表达,进而起到降低血压的疗效。 此外,miRNA-9 能够促进神经系统的发育、抑制神经炎症[17]。 课题组同样发现,室旁核内miRNA-9 明显缓解了SHR 的神经炎症,此过程可能与其抑制P2X7 受体的表达有关。 但发现,在电针治疗过程中,miRNA-9 并未影响血管紧张素II 的表达,这值得后学者进一步探究。 而 ANGII 是肾素—血管紧张素—醛固酮系统的主要产物,通过影响炎性因子、交感神经兴奋性等方式破坏下丘脑室旁核的神经平衡,导致高血压的发生[18]。 电针对ANGII 过表达而导致的高血压疾病有良好的治疗效果[3],在本研究中,经电针治疗后,SHR 室旁核及血清中ANGII 及炎症因子的表达受到明显抑制。
P2X7 受体在免疫细胞中广泛表达,是一种ATP离子通道,为多个microRNA 的靶点[19-20],该受体加速了血管紧张素II 的释放及血管收缩,并导致强烈的炎症反应[21-22],电针可以通过对P2X7 受体的调控,影响大鼠痛觉敏化、改善微环境炎症反应等等[23-24],课题组同样发现电针治疗后,SHR 大鼠室旁核内P2X7 受体能够靶向地被microRNA-9 调节,但microRNA9 的抗炎作用是否完全与P2X7 受体的抑制相关,仍需进一步验证与讨论。
小胶质细胞是中枢神经系统中的免疫细胞,基于对小胶质细胞的抑制作用,电针可以改善小鼠的记忆能力、调节信号通路抑制炎症反应等[25-26]。 研究显示,电针抑制了小胶质细胞的激活,但在miRNA-9 抑制剂使用后,小胶质细胞明显更加活跃,体现了其抗炎作用,
总之,电针通过miRNA-9 抑制了P2X7 受体的表达及小胶质细胞的激活,同时降低了室旁核及血浆中炎症因子IL-6、TNF-α,但并未抑制ANGII 的释放,这提示应对其下游指标进行进一步检测,例如活性氧以及交感神经的兴奋性等。
