参竹降糖方对气阴两虚型高血糖大鼠免疫内分泌及骨骼肌胰岛素抵抗的影响
2023-01-17高晶扈觐玺刘佳琪姜斯佳冯颖童王景霞赵晋燕曾亚力
高晶 扈觐玺 刘佳琪 姜斯佳 冯颖童 王景霞 赵晋燕 曾亚力
2 型糖尿病(diabetes mellitus type 2,T2DM)在中医以“消渴”论治,临床研究表明气阴两虚证在糖尿病中最为多见,并为糖尿病前期的常见证型[1],且有医家认为气阴两虚证可贯穿糖尿病的整个病程[2]。 T2DM 患者多因暴饮暴食、过食肥甘厚腻等致食积、湿热蕴结于脾胃,使脾胃受损,运化失常,致清阳不升、浊阴不降,若日久迁延不愈,燥热之邪耗气伤津,则发为气阴两虚之证[3]。 当代名中医施今墨先生指出:“血糖者,饮食所化之精微也,若脾失健运,血中之精就不能输布脏腑。”[4]可见脾失健运、精不正化是其关键,故当以健脾益气为主,顾护脾胃,兼以养阴生津,保全津液,达到止渴之效。“参竹降糖方”是根据中医辨证保健理论组方而成[5],以人参健脾益气,助中焦健运,津液生化有源,葛根升清降浊,恢复脾气散精之能,辅以玉竹、桑叶、青钱柳养阴润燥,生津止渴,以及蜂胶补虚弱、止消渴,共奏益气养阴,生津止渴之功,且益气而不助热,养阴而不滋腻。 前期研究显示参竹降糖方能降低气阴两虚型高血糖模型大鼠的空腹血糖,调节脂代谢紊乱,缓解胰岛素抵抗,提高胰岛素敏感性及增强胰岛β 细胞功能,改善体质症状[6]。 本研究进一步观察参竹降糖方对气阴两虚型高血糖模型大鼠证候相关的免疫和内分泌指标,及其对肌肉组织糖代谢的影响,并从骨骼肌胰岛素信号通路探讨其可能的作用机制。
1 材料与方法
1.1 动物
雄性 SD 大鼠90 只,体质量(220±20)g,购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006],SPF 级大鼠维持饲料,由北京科澳协力饲料有限公司提供;特殊高脂饲料(猪油10%、蔗糖15%、蛋黄粉10%、酪蛋白5%、胆固醇1.2%、胆酸钠0.2%、碳酸氢钙 0.6%、石粉0.4%、鼠维持饲料52.6%)由北京斯贝福生物技术有限公司提供;动物饲养于北京中医药大学动物实验室的屏障环境中,室温为(24±2)℃,空气相对湿度为(50±10)%,光照 12 小时/天,自由饮水。 动物伦理审批号:BUCM-4-2019110201-4032。
1.2 药物
人 参 ( 批 号: 20190501-1)、 桑 叶 ( 批 号:20190501)、葛根(批号:20190501)、玉竹(批号:20190501)、青钱柳(批号:20190518),以上饮片均购于河北祁新中药颗粒饮片有限公司;蜂胶粉(含70%蜂胶)购于河南长葛(批号:20190618)。 制备方法:人参、玉竹、桑叶、葛根、青钱柳、蜂胶粉按以下比例 1.5 ∶3 ∶3 ∶4 ∶3 ∶0.5(单位:g),除去蜂胶粉以外中药饮片均用水提浓缩而得,每次配药时再按比例加入蜂胶粉。 十味消渴胶囊购于天津中新药业集团股份有限公司(批号:09950063)。
1.3 试剂与仪器
链脲佐菌素(streptozotoci,STZ,美国 Sigma 公司,批号:S0130);L-甲状腺素钠(美国BioRuler,批号:r5703);肌糖原(批号:20200309)、肝糖原(批号:20200309)、游离脂肪酸(free fatty acid,FFA,批号:20200110)、免疫球蛋白 G(immunoglobulin G,IgG,批号:20200310)、免疫球蛋白M(immunoglobulin M, IgM,批号:20200310)、三磷酸腺苷酶(adenosine triphosphatase, ATP, 批 号: 20200311)、 雌 二 醇(estradiol,E2,批号:20200312),睾酮(testosterone,T,批号:20200312)、超氧化物歧化酶(superoxide dismutase, SOD, 批 号: 20200312 )、 丙 二 醛(malondialdehyde,MDA,批号:20200110)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX,批号:20200313)、白细胞介素6(interleukin 6,IL-6,批号:20200110)、白细胞介素 1β(interleukin1β,IL-1β,批号:20200110)、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α,批号:20200311),以上试剂盒均够自北京华英生物技术研究所;促甲状腺激试剂盒(thyroidstimulatinghormone,TSH,优尔生生物科技有限公司,批号:L191114633);三磷酸腺苷试剂盒(adenosine triphosphate,ATP,批号:20200309)、BCA法蛋白含量测定试剂盒(批号:KGP902),均够自南京建成生物工程有限公司;蛋白裂解液RIPA(美国Sigma 公司,批号:r0278);抗兔 IgG HRP 辣根过氧化物酶(美国Cell Signaling 公司,批号:ab6721);兔抗鼠胰岛素受体抗体(insulin receptor,INsR,bioss 公司,货号:bs-7531R);兔抗鼠胰岛素受体底物1 抗体(insulin receptor substrate1,IRS1,abcam 公司,货号:ab66153);兔抗鼠磷脂酰肌醇3 激酶抗体(phosphatidylinositol 3 kinase,PI3K,abclonal 公司,货号:A0265);兔抗鼠葡萄糖转运蛋白4 抗体(glucose transporter 4,GLUT4,abcam 公司,货号:ab188317)。
台式高速冷冻离心机(Heal Force, 型号:Neofuge 15R),涡旋混合器(Servicebio,型号:MXF),全自动研磨仪(赛维尔生物,型号:KH-Ⅲ),全自动生化分析仪(美国Rayto 公司,型号:CHEMRAY 120),酶标仪(美国Thermo 公司,型号:1410101),紫外分光光度计(上海现科仪器有限公司,型号:752-P 型),脱色摇床(北京六一仪器厂,型号:WD-9405A),电泳仪(美国Bio-Rad 公司,型号:1645050-OG),转膜仪(美国Bio-Rad 公司,型号:1704150),凝胶成像系统(美国UVP 公司,型号:e142362)。
1.4 分组与模型制备
1.4.1 分组 大鼠适应性喂养5 天后,禁食过夜12 小时后,使用便携式血糖测定仪取尾静脉血测量血糖值,测定给葡萄糖前(即0 小时)血糖值,在测定给2.5 g/kg BW 葡萄糖后0.5、2 小时血糖值,作为该批次动物基础值[6]。 以0、0.5 小时血糖水平分6 个组,每组15 只,即空白组、模型组、阳性药组、参竹降糖方高、中、低剂量组。
1.4.2 模型制备 采用胰岛素抵抗糖/脂代谢紊乱模型,结合中医气阴两虚证候的造模方法,建立由劳倦伤脾、T4 皮下注射、高脂饲料喂养合并STZ 注射造成的气阴两虚型高血糖大鼠模型[6-8]。 适应性喂养5 天后,开始造模,造模周期维持33 天。 操作方法:(1)第一周各组给予维持饲料饲养,一周后模型组、阳性药组及参竹降糖方高、中、低剂量组更换高热能饲料,喂养3 周。 (2)负重游泳力竭运动:在实验的8 ~21 天灌胃给药结束1 小时后进行负重力竭游泳运动,在大鼠尾根部负荷其体质量10%的铅块作为重物,放入0.8 m×0.8 m×1 m 的游泳桶内,水深0.7 m,水温(20±5)℃,保证大鼠在水中不能用尾巴接触桶底,每桶放置2 只[9]。 力竭标准:①游泳动作明显失调,不能再坚持。 ②大鼠鼻尖没过水面超过3 秒不能回到水面。 停止游泳运动,及时捞起,吹干毛发。 (3)T4 皮下注射:在实验第22 ~28天下午14:00 进行上颈部皮下注射T4 混悬液(L-甲状腺素钠,0.2 mg/kg)。 (4)在实验第 28 天 T4 注射结束后,模型组、阳性药(十味消渴胶囊)组及参竹降糖方高、中、低剂量组禁食24 小时(不禁水),在实验第29 天给予2%STZ 溶液(30 mg/kg)一次性腹腔注射(现用现配,取适量STZ,锡纸避光于冰块之中避光保存,用0.1 mol/L 柠檬酸—柠檬酸钠缓冲液在冰浴中配置溶液,pH=4.5),注射量为1 mL/100 g体质量。 注射后继续给予高热能饲料喂饲5 天,实验结束。
1.5 给药方法
适应性喂养结束后,从实验开始第一天给每组动物进行预防给药,灌胃时间连续33 天(给药体积:1 mL/100 g)。 空白对照组不做处理,模型组给予同体积溶剂,阳性药组给予十味消渴胶囊1.32 g/kg(相当于成人7.92 g/天)、参竹降糖方高、中、低剂量组分别灌胃参竹降糖方混悬液7.5 g/kg、2.5 g/kg、1.25 g/kg(相当于成人 45 g/天、15 g/天、7.5 g/天),灌胃体积为 10 mL/kg。
1.6 检测指标与方法
1.6.1 血清中肌糖原、肝糖原、FFA、IgG、IgM、激素等指标的检测 大鼠巴比妥钠腹腔注射麻醉腹主动脉取血,3000 r/分钟、离心半径2 cm,离心10 分钟,取上清液,4℃保存待测。 采用比色法在全自动生化仪检测各组大鼠血清中肝糖原、肌糖原、FFA、IgG、IgM、ATP、ATP 酶水平。 采用酶联免疫法按照试剂盒说明检测血清中E2、T、TSH 水平。
1.6.2 骨骼肌中 SOD、MDA、GSH-PX、IL-6、IL-1β、TNF-α 的检测 大鼠巴比妥钠腹腔注射麻醉,剪开大鼠后肢内侧皮肤,暴露股四头肌,顺着股骨方向用眼科剪剪下肌肉组织,并放入冻存管,迅速液氮冻存,并保存在-80℃冰箱中备用。 采用比色法按试剂盒说明在全自动生化仪上检测各组大鼠肌肉中SOD、MDA、GSH-PX 的含量。 采用酶联免疫法按照试剂盒说明检测骨骼肌中 IL-6、IL-1β、TNF-α 的含量。
1.6.3 骨骼肌中 IRS1、INsR、PI3K、GLUT4 蛋白表达的检测 用RIPA 蛋白裂解液抽提蛋白质。 BCA法测定蛋白含量,总蛋白20 μg 上样,经10% SDS-聚丙烯酰胺凝胶电泳,电转移至 NC 膜上,用含5%脱脂奶粉的TBST 封闭后加入1 ∶1 000 稀释的相应的一抗,4℃摇床孵育过夜,TBST 漂洗3 次,加入1 ∶2 000辣根过氧化物酶标记的二抗,室温孵育1小时,TBST 漂洗3 次后,用 Western Blot 荧光检测试剂盒显影、定影。 结果用图象分析仪分析。
1.7 统计学方法
采用SAS 9.4 进行统计分析。 数值用均值±标准差()表示,数据进行正态分布及方差齐性检验,组间数据比较用单因素方差(One-way ANOVA)分析,各组方差齐时采用Levene 进行统计分析;方差不齐采用Welch 进行统计分析,P<0.05 表示有统计学意义。
2 结果
2.1 各组大鼠血清肝糖原、肌糖原、FFA 水平比较
与空白组进行比较,模型组大鼠肝糖原、肌糖原水平显著降低(P<0.01),FFA 水平显著升高(P<0.01)。 与模型组进行比较,阳性药组和参竹降糖方高、中、低剂量大鼠肝糖原、肌糖原显著升高(P<0.01),FFA 显著降低(P<0.01)。 见表 1。
表1 各组大鼠血清肝糖原、肌糖原、FFA 水平的比较()

表1 各组大鼠血清肝糖原、肌糖原、FFA 水平的比较()
注: 与空白组比较, aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
组别 鼠只 肝糖原(mg/g) 肌糖原(mg/g) FFA(mmol/L)10 26.66±2.94 2.77±0.34 0.38±0.01模型组 10 15.78±2.04b 1.58±0.21b 0.58±0.03b阳性药组 10 25.43±1.36d 2.60±0.16d 0.32±0.02d参竹降糖方低剂量组 10 22.83±2.59d 2.38±0.29d 0.35±0.02d参竹降糖方中剂量组 10 19.12±3.38d 1.96±0.30d 0.33±0.06d参竹降糖方高剂量组 10 19.37±1.91d 2.07±0.15d 0.31±0.03空白组d
2.2 各组大鼠血清 IgG、IgM、ATP、ATP 酶水平的比较
与空白组进行比较,模型对照组大鼠IgG、IgM、ATP、ATP 酶显著降低(P<0.01)。 与模型组进行比较,阳性药组大鼠IgG、IgM、ATP、ATP 酶升高(P<0.01),参竹降糖方高、中、低剂量组 IgG、IgM、ATP、ATP 酶显著升高(P<0.05,P<0.01)。 见表2。
表2 各组大鼠血清IgG、IgM、ATP、ATP 酶水平的比较()
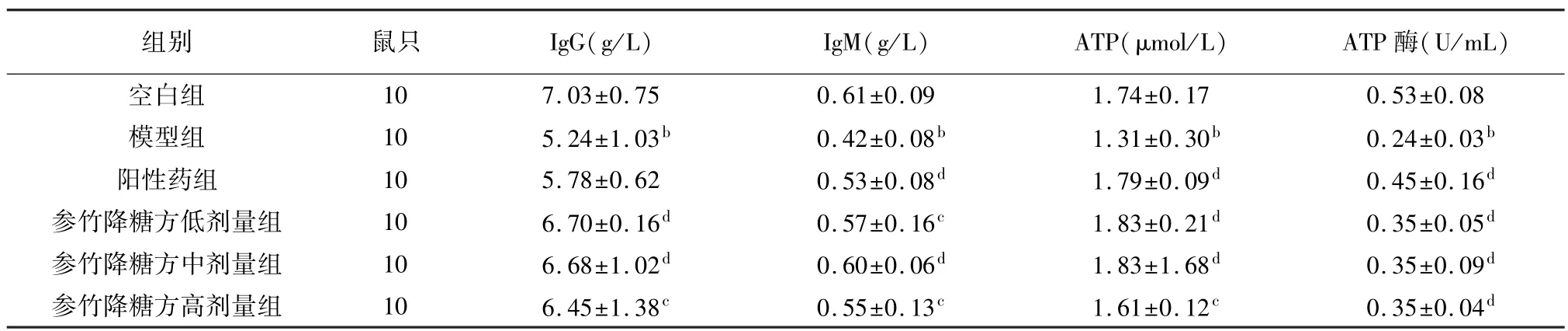
表2 各组大鼠血清IgG、IgM、ATP、ATP 酶水平的比较()
注: 与空白组比较, aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
组别 鼠只 IgG(g/L) IgM(g/L) ATP(μmol/L) ATP 酶(U/mL)10 7.03±0.75 0.61±0.09 1.74±0.17 0.53±0.08模型组 10 5.24±1.03b 0.42±0.08b 1.31±0.30b 0.24±0.03b阳性药组 10 5.78±0.62 0.53±0.08d 1.79±0.09d 0.45±0.16d参竹降糖方低剂量组 10 6.70±0.16d 0.57±0.16c 1.83±0.21d 0.35±0.05d参竹降糖方中剂量组 10 6.68±1.02d 0.60±0.06d 1.83±1.68d 0.35±0.09d参竹降糖方高剂量组 10 6.45±1.38c 0.55±0.13c 1.61±0.12c 0.35±0.04空白组d
2.3 各组大鼠血清E2、T、TSH 水平比较
与空白组进行比较,模型组大鼠血清中T 水平显著降低(P<0.01),E2、TSH 显著升高(P<0.01)。与模型组进行比较,阳性药组和参竹降糖高、中、低剂量组大鼠T 水平显著升高(P<0.05,P<0.01)、E2、TSH 显著降低(P<0.01)。 见表 3。
表3 各组大鼠血清E2、T、TSH 水平比较()

表3 各组大鼠血清E2、T、TSH 水平比较()
注: 与空白组比较, aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
组别 鼠只 E2(pg/mL) T(ng/mL) TSH(pg/mL)10 41.93±3.08 2.28±0.58 711.13±171.42模型组 10 46.38±2.48b 0.82±0.10b 1251.04±175.51b阳性药组 10 36.62±8.06d 1.25±0.46d 820.10±254.78d参竹降糖方低剂量组 10 34.10±2.53d 1.85±0.63d 748.51±209.72d参竹降糖方中剂量组 10 35.03±7.36d 1.45±0.31d 600.58±117.43d参竹降糖方高剂量组 10 37.66±4.66d 1.30±0.61c 762.57±93.96空白组d
2.4 各组大鼠骨骼肌 SOD、MDA、GSH-PX 水平比较
与空白组进行比较,模型组大鼠MDA 显著升高(P<0.01),SOD、GSH-PX 显著降低(P<0.01)。与模型组进行比较,阳性药组和参竹降糖方高、中、低剂量组大鼠 MDA 显著降低(P<0.01),SOD、GSH-PX显著升高(P<0.01)。 见表 4。
表4 各组大鼠骨骼肌SOD、MDA、GSH-PX 水平的比较()

表4 各组大鼠骨骼肌SOD、MDA、GSH-PX 水平的比较()
注:与空白组比较, aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
组别 鼠只 SOD(U/mL) MDA(nmol/mL) GSH-PX(U/mL)10 10.39±0.46 0.56±0.02 191.00±8.45模型组 10 7.85±0.95b 0.99±0.04b 82.81±9.78b阳性药组 10 11.92±1.11d 0.69±0.05d 133.80±18.15d参竹降糖低剂量组 10 11.27±0.89d 0.61±0.05d 126.90±15.31d参竹降糖中剂量组 10 10.81±2.67d 0.63±0.03d 101.50±4.43d参竹降糖高剂量组 10 13.16±1.49d 0.73±0.10d 109.40±8.85空白组d
2.5 各组大鼠骨骼肌炎性因子IL-6、IL-1β、TNF-α水平的比较
与空白组进行比较,模型组大鼠炎症因子IL-6、IL-1β、TNF-α 显著升高(P<0.01),差异有统计学意义。 与模型组进行比较,阳性药组和参竹降糖方高剂量组、中剂量组、低剂量组大鼠IL-6、IL-1β、TNF-α显著降低(P<0.05,P<0.01),差异有统计学意义。见表5。
表5 各组大鼠骨骼肌IL-6、IL-1β、TNF-α 水平的比较()

表5 各组大鼠骨骼肌IL-6、IL-1β、TNF-α 水平的比较()
注: 与空白组比较, aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
组别 鼠只 IL-1β(pg/mL) IL-6(pg/mL) TNF-α(pg/mL)10 1.74±0.18 8.77±0.54 5.99±0.65模型组 10 3.41±0.29b 16.42±3.54b 12.10±2.18b阳性药组 10 2.31±0.17d 8.82±0.69d 6.41±0.48d参竹降糖低剂量组 10 2.76±0.32d 9.36±1.10d 7.36±1.18d参竹降糖中剂量组 10 2.23±0.28d 13.21±1.23c 6.91±0.30d参竹降糖高剂量组 10 2.78±0.17d 12.50±1.82d 5.68±0.57空白组d
2.6 各组大鼠骨骼肌 INsR、IRS1、PI3K、GLUT4 蛋白表达水平的比较
与空白组进行比较,模型组大鼠 IRS1、INsR、PI3K、GLUT4 蛋白表达显著降低(P<0.01)。 与模型组进行比较,阳性药组大鼠IRS1、PI3K、GLUT4 显著升高(P<0.01),低剂量组 IRS1、PI3K、GLUT4 显著升高(P<0.01),高、中剂量组 IRS1、INsR、PI3K、GLUT4 显著升高(P<0.01,P<0.05)。 见表 6、图 1。
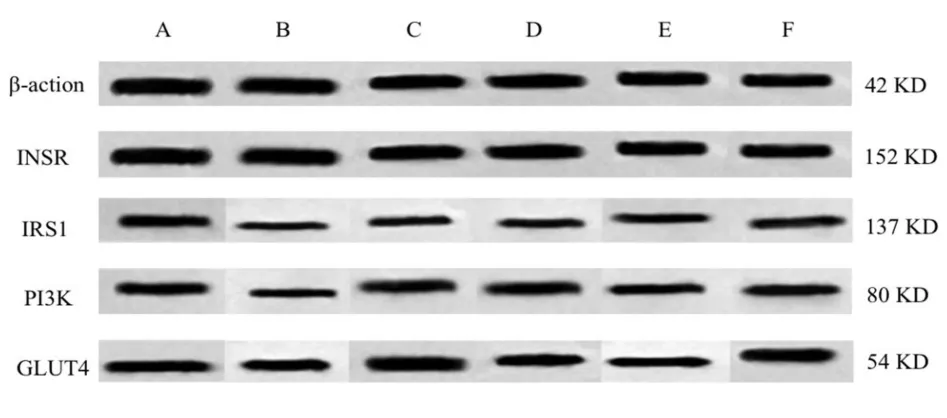
图1 各组大鼠骨骼肌IRS1、INsR、PI3K、GLUT4 蛋白条带对比图
表6 各组大鼠骨骼肌IRS1、INsR、PI3K、GLUT4 蛋白表达水平的比较()

表6 各组大鼠骨骼肌IRS1、INsR、PI3K、GLUT4 蛋白表达水平的比较()
注: 与空白组比较, aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
0.50±0.07 0.44±0.03 0.71±0.14 0.46±0.05模型组 6 0.33±0.06b 0.26±0.01b 0.42±0.02b 0.23±0.02b阳性药组 6 0.39±0.07 0.34±0.06d 0.59±0.10d 0.31±0.02d参竹降糖低剂量组 6 0.39±0.07 0.34±0.05d 0.57±0.07d 0.28±0.01d参竹降糖中剂量组 6 0.44±0.06d 0.31±0.04d 0.57±0.08d 0.30±0.04d参竹降糖高剂量组 6 0.42±0.07c 0.31±0.05c 0.59±0.11d 0.33±0.04 INsR IRS1 GLUT4 PI3K空白组组别 鼠只6 d
3 讨论
糖原是葡萄糖在机体内的主要储存形式,主要包括肝糖原和肌糖原,二者可影响机体血糖水平调控,糖尿病胰岛素抵抗影响葡萄糖进入肝及骨骼肌细胞合成糖原,造成血糖水平升高。 本研究模型组大鼠肝糖原、肌糖原显著下降,表明其血糖调控能力下降,参竹降糖方各剂量组能显著增加肝糖原和肌糖原指数,表明本方可增加糖原含量,调控血糖水平。 前期研究显示,参竹降糖方不仅能调控血糖血脂水平,还能使气阴两虚型高血糖模型大鼠进食量、饮水量、排便量、排尿量、肛温降低,体质量增加,毛色恢复光泽,情绪稳定,说明本方对气阴两虚证候表征也有明显的改善作用[6]。 气阴两虚证候外在表现的症状和体征是由其内在的生物学病理状态所导致的,研究其内在生物学指标有助于阐明证候的科学内涵。
有学者认为中医所讲的脾主运化之功与线粒体物质能量代谢过程具有相似性,线粒体内脂肪、糖及蛋白质通过三羧酸循环和氧化磷酸化生成ATP,为生命活动供能,类似于脾运化水谷精微并将之输布全身[9]。 脾气虚则机体运化失常,线粒体能量代谢损伤,ATP 酶活性下降,氧化磷酸化产生的ATP 减少,产能减少,推动机体的各项生命运动能力下降,导致免疫器官萎缩,免疫功能低下[10-12]。阴虚存在内分泌激素分泌增加和产热相对增加的病理状态[13]。 TSH 可促进甲状腺素分泌,从而调控机体能量代谢,促进糖的吸收,加速肝糖原等能量物质的氧化分解。 研究发现在2 型糖尿病各证型患者中,气阴两虚证患者血清TSH 含量明显增加[14]。高孕酮气阴两虚证T2DM 男性患者胰岛功能最差,E2 水平明显升高[15]。 药理研究显示,肾阴虚雄性小鼠的血清E2、E2/T 升高,该结果与临床研究相契合[16]。 在本实验中,模型组大鼠血清中ATP 含量,ATP 酶活力,IgG、IgM 含量均显著降低,TSH 含量显著升高,T 含量显著降低,E2 含量显著升高,说明气阴两虚型高血糖大鼠机体内能量代谢异常,供给不足,免疫功能下降,且甲状腺激素、性激素均出现紊乱。 给与参竹降糖方,则能使模型大鼠的 ATP 含量,ATP 酶活力,IgG、IgM 含量均显著升高,使TSH显著降低,T 显著升高,E2 显著降低。
研究显示,骨骼肌胰岛素信号通路蛋白表达降低是胰岛素抵抗产生的重要原因。 在正常状态下[17],胰岛素与细胞膜上的结合后,引起IRS1 酪氨酸化,进而进一步激活下游通路蛋白PI3K,被激活的PI3K 可加速GLUT4 从细胞内转移至细胞膜,以增加葡萄糖的摄取[18]。 而病理状态下,过量的FFA可促发氧化应激反应,诱导炎症因子释放,进而影响胰岛素通路蛋白表达和信号传递[19-20]。 在本实验中,模型组大鼠血清FFA、骨骼肌MDA 水平显著升高,SOD、GSH-Px 水平显著降低,且 IL-6、IL-1β、TNF-α 炎症因子水平显著升高,IRS1、INsR、PI3K、GLUT4 蛋白表达水平显著降低,表明气阴两虚高血糖大鼠糖脂代谢紊乱,引起氧化应激和炎症反应,骨骼肌胰岛素信号通路蛋白表达异常。 而参竹降糖方能显著降低血清FFA 含量,骨骼肌MDA 水平和 IL-6、IL-1β、TNF-α 炎症因子水平,显著升高SOD、GSH-Px水平,以及胰岛素信号通路蛋白水平,表明参竹降糖颗粒可抑制骨骼肌氧化应激和炎症反应,调节胰岛素通路蛋白水平,从而提高胰岛素敏感性,以调控血糖稳定。
综上所述,参竹降糖方可通过抑制骨骼肌的氧化应激和炎症反应,恢复骨骼肌胰岛素信号通路的传导,缓解胰岛素抵抗,达到调控血糖血脂稳定的作用。 且本方可通过健脾益气,养阴生津,调节气阴两虚型高血糖大鼠的能量代谢、免疫功能、激素分泌等多个环节,达到综合治疗的目的。 本研究为指导参竹降糖方临床防治糖尿病提供了一定的依据,但尚需开展中医辨证分型的人体试验进一步研究。
