铀对植物的胁迫效应研究进展
2023-01-14乔新燕吴仁杰曹少飞李建国
乔新燕 吴仁杰 曹少飞 李建国 原 寒
(中国辐射防护研究院,山西 太原 030006)
铀是一种密度和硬度较大的银白色金属,作为一种自然发生的元素,原始的铀有234U(0.006%)、235U(0.711%)和238U(99.283%)三种同位素。铀主要通过人类活动进入土壤。随着核能事业的发展,铀矿的开采以及核燃料的制备、循环、后处理等导致铀尾矿周围的土壤铀污染严重[1-2]。研究表明,铀主要通过食物链进入人体,影响人体的新陈代谢,危害人体健康,造成肾衰竭、神经衰弱症、不孕不育甚至人体智力缺陷等毒害症状[3-6]。近年来,各种铀污染土壤修复方法得到大力发展,主要包括物理修复、化学修复和生物修复。客土法、电动修复法等物理修复方法的经济成本较高,且会改变当地的土壤环境[7];化学修复法包括土壤冲洗和固化修复,不仅会对土壤生物活性、肥力、结构产生有害作用,而且有可能会造成二次污染[8];生物修复尤其是植物修复,因其原位修复、易于操作、成本低廉、对环境友好等特点而成为一种理想的铀污染土壤修复方法[9-10]。植物修复是将类似于印度芥菜(Brassica juncea)[11-12]和向日葵(Helianthus annuusL.)[13]等超富集植物种植在铀污染区域,利用根系对铀吸收并将其积累在根部或转移到地上部分,通过超富集植物的重复种植和收割进而降低土壤中的铀含量。但铀作为一种非必需元素,通常在地质样品中只有Ⅳ和Ⅵ两种价态,且铀的生物活性也受各种环境因素的影响,易附着、累积在植物体内,当铀浓度超过一定阈值,会使植物根系发黑甚至坏死,进而抑制植物茎、叶乃至整株生长发育[3,14-19]。本研究总结了近年来关于铀对植物胁迫效应的研究成果,旨在为研究铀从土壤到植物、以及铀在植物中的转运机制提供参考,进而为中轻度铀污染土壤的植物修复奠定理论基础。
1 铀对植物生长发育的影响
铀是一种有毒害效应的重金属元素,其对植物的胁迫效应因植物生长发育阶段而异,主要体现在种子萌发(表1)和营养生长阶段。
1.1 种子萌发阶段
铀对种子萌发的毒害是一种生理学效应。在植物生长周期中,种子萌发阶段是植物生长周期的起点和感知外界环境变化的最初阶段,也是评价植物铀耐受性的重要阶段。在玉米(Zea maysL.)种子萌发的早期(2~4 d),用浓度为1 mmol·L-1的铀溶液处理玉米种子,其萌发率会显著降低[20]。郝希超等[21]对24 种牧草进行铀胁迫下的种子萌发分析,发现种子的萌发率受铀浓度影响,有7 种牧草种子在铀胁迫下具有较好的发芽能力,铀浓度小于50 mg·L-1时,对种子萌发具有一定的促进作用,而当铀浓度大于100 mg·L-1时,则对牧草种子的萌发具有明显的抑制作用。类似的结果在其他研究中也被证实,如将Cleome amblyocarpaBarr.& Murb 种子在7 种不同浓度(0、50、100、150、200、250、300 mg·L-1)的UO2(NO3)2·6H2O 溶液中处理,结果发现所有浓度组种子萌发率都超过40%,在低浓度(铀溶液浓度为100、150、200 mg·L-1)时,种子的萌发率随浓度的增长而逐渐增加,分别为59%、62%、72%;但高浓度(铀溶液浓度为250、300 mg·L-1)条件下,种子萌发率比200 mg·L-1溶液中要低,且萌发率随着浓度的增加呈下降趋势,分别为66%和62%[22](表1)。对于此现象,目前有两种解释:一是低水平的铀会刺激某些酶来提高种子的萌发率,并导致种子快速萌芽[20];二是低水平的铀会降低植物种子的蒸腾速率,进而提高种子对水分的利用效率,因此提高了种子的萌发速率[18]。

表1 铀对植物种子萌发的影响Table 1 Effects of U on seed germination of plants
1.2 营养生长
由于铀总是会优先积累在植物的根部,所以最先受到铀影响的是植物根部。植物根的生长受到铀的毒害已经在不同的植物中被观察到。据报道,蚕豆(Vicia fabaL.)幼苗在不同浓度(0、5、10、15、20、25 µmol·L-1)铀溶液中处理72 h,与对照相比,高浓度铀溶液中植株根部会有发黑的迹象,能量色散光谱仪(energy dispersive spectrometer,EDS)分析结果表明当铀浓度超过10µmol·L-1时,铀在蚕豆的根部细胞中就会有积累;X 射线荧光光谱分析(X-ray fluorescence,XRF)结果表明铀溶液浓度为5~25 µmol·L-1时,铀在根部的积累量随铀浓度的增加而增加,由225.5 mg·kg-1增加到了6 250.94 mg·kg-1[23]。同时,还有研究发现番茄(Lycopersicon esculentumMiller)幼苗在铀胁迫条件下,根细胞的形状、大小异常,细胞核、细胞器结构发生明显改变,根细胞边缘的形成层受到破坏[24]。表明铀的主要蓄积器官是根系,铀过量蓄积明显损伤了根的微观结构,减少了根部生物量,进而影响了植株整体的生长发育。
铀对植物地上部分的影响因植物种类而异,前人通过添加不同浓度二水合醋酸铀酰来模拟不同程度(0、20、50、100 和150 mg·kg-1)铀污染土壤,结果表明黑麦草(Lolium perenneL.)植株干重和株高均随铀浓度的增加而减少[25]。郝希超等[21]采用盆栽培养方式,设置铀处理浓度分别为0(CK)、20、50、100、150 mg·kg-1,将5 种牧草种子直接播种,生长60 d 后进行测定,发现高浓度下牧草生长受到明显抑制,在试验铀浓度范围内,果树草(Dactylis glomerataL.)的单盆干重随铀浓度升高呈先上升后下降的趋势,在铀浓度为20 mg·kg-1时达到最大,当铀浓度高于100 mg·kg-1时,果树草单株干重较对照减少56.03%,株高降低54.51%。上述指标的下降是由于铀减少了地上部分细胞的分裂,抑制了植株的光合作用。也有研究证明铀对植物地上部分生长的影响主要是由于铀抑制了根的生长和发育,导致经过根运输的水分和矿物质减少[3,26],另一个原因是铀会稍微缩短细胞的生长周期,影响必需元素的稳态[27]。
2 铀对植物生理生化特性的影响
2.1 呼吸作用
最新的研究表明,铀能显著抑制哺乳动物线粒体呼吸电子传递链上的两种关键酶:细胞色素c 氧化酶(复合体IV)和ATP 合酶(复合体V),进而影响其呼吸代谢[28]。Zhang 等[23]将蚕豆幼苗在15、20、25µmol·L-1UO2(NO3)2·6H2O(238U)溶液中处理72 h 研究铀与植物呼吸作用之间的关系,结果发现蚕豆根部呼吸速率随着铀浓度的增加而逐渐降低,与对照相比,铀浓度为15 µmol·L-1时,呼吸速率降低了12.97%,铀浓度为25µmol·L-1,呼吸速率降低了28.57%。作者进一步通过转录组和代谢组结果给出如下解释:(1)在代谢水平上,铀导致细胞内能量代谢途径中相关代谢物表达不平衡;(2)在转录水平上,铀胁迫明显抑制了糖酵解、三羧酸循环途径中相关基因的表达,尤其是氧化磷酸化途径,铀胁迫显著抑制了线粒体电子传递链中细胞色素c、解偶联蛋白和F1-ATP 酶基因的表达,进而使根的呼吸速率下降[23]。紫薯和普通甘薯根系转录组结果显示,与对照组相比,在铀处理组(25µmol·L-1)普通甘薯糖酵解-三羧酸(tricarboxylic acid,TCA)途径和线粒体电子传输链途径中鉴定出26 个差异表达基因,其中6 个上调基因,20 个下调基因;在紫薯糖酵解-TCA途径和线粒体电子传递链途径中共鉴定出36个(11个上调和25 个下调)差异表达基因,说明铀暴露明显干扰了细胞的糖酵解和TCA 途径,导致甘薯能量代谢障碍[16]。但刘泽伟等[29]的研究结果与之相反,他们将蚕豆幼苗根系在浓度为25 µmol·L-1的铀溶液中处理,与对照组(U-0µmol·L-1)的蚕豆幼苗根系进行转录组测序分析对比,发现线粒体呼吸代谢途径相关基因表达量明显增加,共检测到差异表达基因27 个,包括23 个显著上调基因和4 个显著下调基因,如ATP synthesis.alternative oxidase gene、ATP synthesis.NADH-DH.complex Ⅰ和ATP synthesis.NADH-DH.typeⅡ.internal matrix gene 的表达量分别增加了3.97、3.35 和3.33 倍。这是由于高浓度的铀胁迫抑制了蚕豆幼苗的光合作用,但增强了其根系的呼吸代谢,刘泽伟等[29]认为这可能是蚕豆对铀毒害的一种适应机制。因此铀与植物呼吸作用之间的关系有待继续深入探究。
2.2 光合作用
非生物胁迫,特别是重金属胁迫,会影响植物光合作用,导致光合速率下降,植株发育滞缓,甚至在一些情况下会使植物死亡[15,30-31]。大量研究表明,铀会使多种植物,如睡莲(Nymphaea tetragonaGeorgi)[32]、鬼针草(Bidens pilosaL.)[33]和豌豆(Pisum sativumL.)[34]等的光合色素(叶绿素a、叶绿素b和类胡萝卜素等)含量下降。另外,铀(U)诱导的活性氧(reactive oxygen species,ROS)过量产生,会使膜脂过氧化,叶绿体结构完整性遭到破坏,导致叶片叶绿素含量下降,并且过量ROS 也会抑制参与光呼吸途径基因的表达[34]。与不加铀的对照相比,高浓度铀污染土壤也会使高梁[Sorghum bicolor(L.)Moench]、藜(Chenopodium albumL.)等植株的叶绿素含量降低[35]。色素作为类囊体膜上色素蛋白复合体的组成成分,其含量的降低通常伴随着水和光氧化过程受阻,以及光合膜蛋白的组分发生改变,因此铀处理会导致植物光系统的捕光能力下降,进而使光合能力降低[23,34,36]。Imran等[33]研究发现,鬼针草光系统Ⅱ(photosystem Ⅱcomplex,PSⅡ)最大光化学量子产量(maximum photochemical efficiency,Fv/Fm)随铀胁迫浓度的增加而降低。邓章轩等[37]以三种苔藓植物为材料,设置了0、2.5、5、10、20 mg·L-1五种铀处理浓度,培养72 h,发现对铀敏感的大羽藓[Thuidium cymbifolium(Dozy et Molk.)Dozy et Molk.]中叶绿素a、叶绿素b、总叶绿素含量、光系统Ⅱ的有效量子产量[effective quantum yield of PS Ⅱphotochemistry Yield,Y(Ⅱ)]、光化学淬灭系数(photochemical quenching,qP)和非光化学荧光淬灭系数(nonphotochemical quenching,qN)均随铀胁迫浓度的增加而显著降低,在20 mg·L-1达到最低,但Fv/Fm无显著变化。赵继武等[38]研究表明铀胁迫会使黑麦草光合速率和气孔导度显著降低。Zhang 等[23]研究也表明蚕豆植株在0~25µmol·L-1U(VI)溶液中处理以后,植株的光合作用参数(净光合速率和气孔导度)明显降低(表2),这些光合参数的降低是由于铀破坏了植物的光合碳代谢途径,原因可能是铀抑制了类囊体膜上参与水的光解、电子传递链和ATP 合成相关基因表达,同时许多参与卡尔文循环的基因表达在铀胁迫条件下也明显下调,导致ATP 的合成受阻,电子传递链堵塞,卡尔文循环停滞[23-24]。
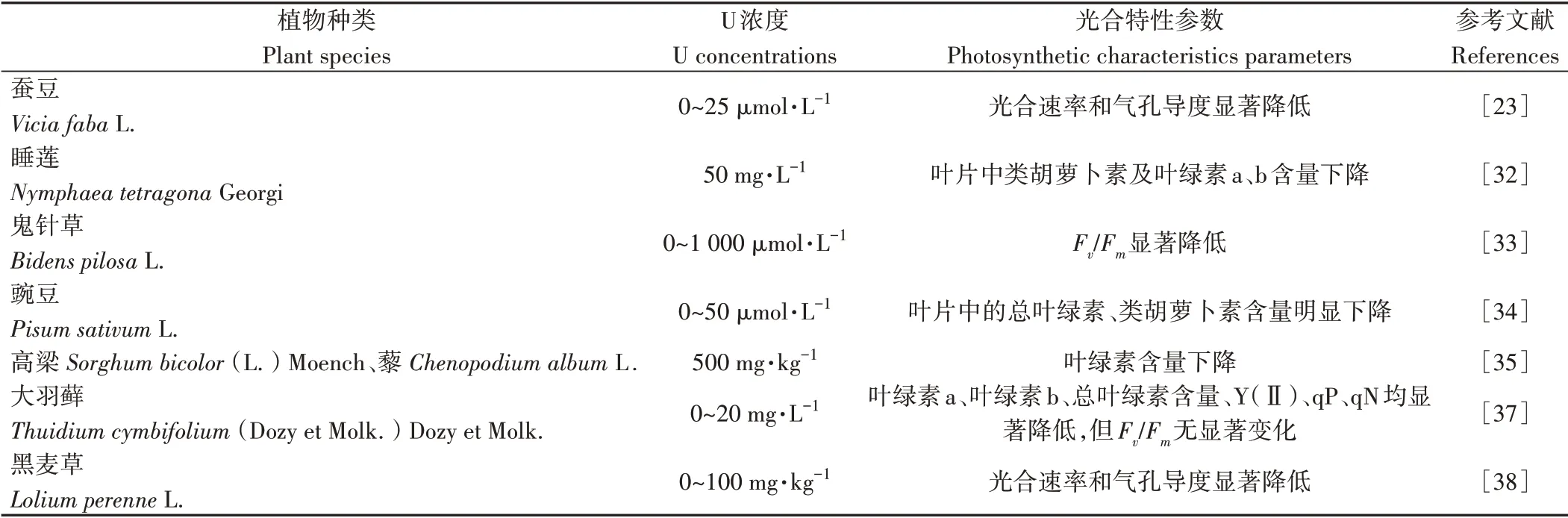
表2 铀对植物光合作用的毒害效应Table 2 Toxic effects of U on photosynthesis in plants
2.3 氧化损伤
在铀胁迫下,植物细胞中的ROS 主要包括超氧阴离子(O2·-)、过氧化氢(H2O2)和羟基自由基(·OH)等[39-41]。这些ROS 主要存在于各种大量的细胞器中,如叶绿体、线粒体、过氧化物酶体和内质网[42]。ROS的过量积累是由其产生和清除的不平衡造成的,过度积累ROS 会攻击脂肪酸链的氢原子[30],导致产生醛类物质和膜脂自由基[43]。有研究表明,ROS 作为信号分子也参与植物对环境胁迫的响应,与其他重金属相同,U 通过与植物细胞中的生物大分子相互作用产生ROS,扰乱细胞正常的生理代谢[32,44]。通过二甲基联苯胺(diaminobenzidine,DAB)、氮蓝四唑(nitro-blue tetrazolium,NBT)染色的结果发现,铀处理后,蚕豆植株第二片真叶的颜色随着铀浓度的增加逐渐加深,说明铀明显诱导植物叶片中H2O2和O2·-积累,使正常生理代谢紊乱[19]。
杨昊等[45]通过水培试验研究了伊乐藻(Elodea canadensisMichx.)在不同初始铀浓度胁迫下铀的富集特征及铀对抗氧化酶活性的影响,结果表明,随着初始铀浓度的上升,伊乐藻对铀的富集量上升,当水体中初始铀浓度为30 mg·L-1时,铀的富集量达到最大,为14 mg·kg-1(干重),对抗氧化酶活性的影响最为明显,其中超氧化物歧化酶(superoxide dismutase,SOD)活性较对照组下降86.3%,过氧化物酶(peroxidase,POD)活性较对照组上升202.4%,过氧化氢酶(catalase,CAT)活性较对照组上升291.6%。贾文甫等[46]通过盆栽控制性试验,研究了土壤不同浓度(0、25、50、100、200、400 mg·kg-1)铀胁迫对反枝苋(Amaranthus retroflexusL.)生理生化指标的影响,结果显示中低浓度铀胁迫下,SOD、POD 和CAT 被激活,保持高活性水平,有效抵御了铀毒害,高浓度铀胁迫下,三种酶活性均降低,SOD活性低于对照,ROS量超过了酶系统的清除能力,致使膜系统遭到破坏,而细胞质膜的损坏使细胞中能够积累更多量的铀,对植物造成损伤。李宇林等[47]分别设置5、30、55 mg·L-1铀溶液处理泽泻(Alisma plantagoaquaticaL.)和鱼腥草(Houttuynia cordataThunb.)两种湿生植物,结果发现泽泻和鱼腥草的抗氧化酶活性均呈现先升高后降低的趋势,在铀浓度为30 mg·L-1时,两种植物的POD、SOD、CAT 活性均达到最大值,分别比对照上升11.79%、114.69%、69.64%和6.03%、19.91%、10.71%。上述结果表明,在铀浓度为5、30 mg·L-1时,植株抗氧化酶系统可以清除多余的自由基和过氧化物,而铀浓度达到55 mg·L-1时,植物体产生的抗氧化酶无法清除所产生的大量自由基和过氧化物,从而使抗氧化酶活性降低。
膜脂过氧化是评估金属对植物氧化损伤的标志,丙二醛(malondialdehyde,MDA)含量的高低可以反映植物膜脂过氧化程度和遭受逆境伤害的程度以及植物的抗逆性。前人研究表明,水培生长50 d 的拟南芥[Arabidopsis thaliana(L.)Heynh.]在50 µmol·L-1铀溶液中处理48 h 后,MDA 含量与对照相比显著升高[48]。李宇林等[47]研究发现鱼腥草MDA 含量随铀浓度的增加而上升。铀和镉污染土壤中生长的向日葵植株MDA含量比正常条件下升高了34.15%[30]。上述结果说明铀胁迫使植物膜脂过氧化程度增加,膜的完整性遭到了破坏(表3)。

表3 铀对植物的氧化损伤Table 3 Effects of U on oxidative damage in plants
2.4 渗透调节
渗透调节是植物响应外界逆境胁迫的第一道屏障之一,当植物受到非生物胁迫时可通过积累渗透调节物质来进行渗透调节[49]。脯氨酸(proline,Pro)作为渗透调节物质,具有清除ROS,保护细胞膜结构及调节氧化还原平衡等作用[50];植物体内的可溶性蛋白也是一种渗透调节物质,熊凡[51]通过水培方式,设置5种铀浓度梯度(0、0.1、1、5、10 mg·L-1)处理芦苇[Phragmites australis(Cav.)Trin.ex Steud.],发现芦苇根部和叶片中游离Pro和可溶性蛋白含量都随着铀浓度的升高呈先升高后降低趋势。有研究发现铀处理番茄幼苗中的Pro含量比正常条件下生长的植株含量高[21]。泽泻叶片中可溶性蛋白含量随着铀浓度的增加呈降低趋势,其中铀浓度为55 mg·L-1时可溶性蛋白含量最低[47];猜测可溶性蛋白可与游离的铀酰离子结合形成复合物,减轻铀对植物的伤害症状。另有研究报道,水培生长14 d的蚕豆幼苗,在不同浓度的铀溶液中处理72 h,蚕豆根中另一种渗透调节物质可溶性糖的含量随着铀浓度的增加逐渐降低,与对照相比,当铀溶液浓度为15、25 mg·L-1时,可溶性糖含量分别降低了12.72%、26.29%[23](表4)。

表4 铀对植物渗透调节的影响Table 4 Effects of U on osmotic regulation in plants
2.5 营养代谢
前人研究表明,植物中代谢物超过20 万种,在重金属胁迫下涉及氨基酸代谢、有机酸代谢、糖酵解等多种代谢途径变化,重金属通过干扰营养成分,调节营养元素的吸收、分配和转运,进而导致植物发生中毒现象[52-53]。铀也通过一种复杂的方法影响植物矿质营养代谢[53-54]。已有研究证明,铀(Ⅵ)胁迫阻断了蚕豆中P、K、Na、Ca、Mg、Fe、Zn、Cu 和Mn 9 种元素的正常吸收和转运,尤其是植株地上部分、根和整株中的P含量与对照组相比均明显下降,而且与P转运有关的基因,如无机磷酸盐转运蛋白的表达量明显降低,作者猜测P代谢异常可能是铀对植物生长发育毒害的主要原因之一[26]。同时也有研究结果证明铀会扰乱车轴草[Galium odoratum(L.)Scop.]中P、K、Mg、Zn 和Ca 的吸收和分配[55];7 d大的拟南芥植株在铀胁迫下的基础营养代谢紊乱,表现在P、K、Na、Ca、Mg、Fe、Zn、Cu、Mn 9 种元素的吸收和分配异常[54]。这些元素作为蛋白质、核酸等大多有机物质的组成成分,以多种方式参与植物体内的多种营养代谢过程,对植物生长发育有着直接或间接的作用。目前对于铀胁迫导致矿质营养元素代谢不平衡的机制解释如下:(1)胞间连丝是植物体内运输矿质营养成分、糖分、氨基酸和有机酸等重要的运输通道之一,铀积累在植物细胞壁中,会破坏胞间连丝结构[26,56];(2)铀作为一种非必需元素,与矿质营养元素运输载体竞争性结合,进而阻断相关矿质营养元素代谢[48,57];(3)铀胁迫铀会抑制营养元素吸收和转运载体相关基因的表达,不利于植物营养代谢正常进行[24,26]。
2.6 水分代谢
植物体内90%以上的水分用于蒸腾作用,蒸腾拉力介导根系对水分的吸收和利用。蚕豆幼苗暴露在25 µmol·L-1硝酸铀酰溶液下时,与对照相比,植株根系表现出发黑的迹象,其总根长变短、根直径和总根体积均减少,且蒸腾速率也降低[23]。同时植物对水分的吸收和转运主要依靠水孔蛋白的调控作用[58]。前人研究表明,植物在镉、铜、汞、铅、锌等重金属胁迫下,水孔蛋白基因的表达受到抑制[59-60]。Aranjuelo 等[48]研究证实,铀会诱导拟南芥ROS 过量产生及叶片气孔关闭,进而导致植株光合作用减弱、蒸腾速率下降,并且使质膜内蛋白-水孔蛋白基因表达下调,说明铀影响了拟南芥植株的水分代谢平衡。
3 铀对植物的基因毒害作用
基因毒害代表着机体功能紊乱,主要包括染色体畸变和DNA 结构被破坏,铀对动物和人体的基因损害已有较多报道,但少有研究证实铀会对植物基因产生毒害[36,41]。植物短时间(24~72 h)暴露在铀胁迫条件下,不会直接对其DNA 结构造成损伤,而是通过诱导ROS 过量产生对植物造成伤害[41,61]。DNA 复制叉是植物细胞中DNA 复制的基本结构,它的形成需要多种蛋白参与。最近研究发现,与对照相比,在铀胁迫条件下蚕豆植株中相关基因ORC、CDC45、MCM、CCNA和CCNB1的表达明显下调,这些基因下调会导致细胞分裂保持在分裂间期,因此会减弱有丝分裂指数,抑制DNA 复制叉的形成,进而延迟细胞增殖,说明铀胁迫会抑制DNA复制[41]。DNA被损坏之后,植物体内会启动一系列DNA 修复基因[62]。然而铀胁迫会导致参与DNA 修复的13 个基因(如RBX1、PCNA、RAD54、MSH6、BLM、RPA1等)下调,从而阻止DNA 修复[41]。另外铀胁迫会诱导植物细胞染色体发生畸变,细胞分裂受阻,导致细胞周期停滞,同时铀胁迫还会抑制抗氧化酶活性,破坏细胞壁的结构[23,61,63]。正常条件下,微管细胞骨架能够控制细胞分裂,Özdemir 等[61]观察到铀胁迫会破坏鹰嘴豆(Cicer arietinumL.)、菜豆(Phaseolus vulgarisL.)、豇豆(Vigna anguiculataL.)和荷包豆(Phaseolus coccineusL.)植物根尖细胞有丝分裂,推测可能是由于铀胁迫诱导微管细胞骨架降解,进而影响细胞分裂的正常进行。铀胁迫也会明显改变CAT1和CAT2基因的表达,并导致总CAT 酶活性下降,膜脂过氧化增加[63],糖蛋白是植物细胞壁的组成部分,有研究结果证明铀胁迫会影响糖蛋白基因的表达,导致植物细胞壁被破坏,最终影响植物根的发育[24]。
4 展望
目前有关铀对植物生长发育、生理生化代谢等方面的研究已取得较大进展,但许多科学问题还有待进一步深入研究探讨,主要总结如下:
第一、铀具有Ⅲ、Ⅳ、Ⅴ和Ⅵ四种价态,其中Ⅲ、Ⅴ价态较活泼,不能在环境中稳定存在,通常在水和土壤介质中铀是以Ⅳ和Ⅵ价态金属化合物或氧化物形式共存。前人研究表明外界环境因素如土壤有机质含量、pH 值、氧化还原电位等理化性质会影响铀价态的转换[10](图1),但需进一步证实这些因素内部之间是如何相互作用来影响铀价态转换的。

图1 环境因子影响铀价态Fig.1 The environmental fators affecting uranium valence state
第二、铀主要是通过根部吸收从土壤转移到植物,铀进入植物根部后,一部分会留在根部,对根的生长发育产生毒害效应,另一部分则会从根部转运进入植物地上部分,影响地上部分的生长发育。目前已有研究并未从遗传分子学水平上对植物根部吸收铀和铀从根部转运到地上部分的机制作出解释,同时铀对植物胁迫效应的分子机制也需要进一步挖掘。这些过程都与基因表达水平有很大的相关性,可以采用基因组学、转录组学、蛋白组学和代谢组学等不同层次组学的方法,建立基因-转录-翻译等不同代谢水平的网络体系,探究铀胁迫最终是如何影响植物生理生化,有助于深入研究铀胁迫下植物根部吸收铀、铀从根部转运到地上部分以及铀对植物胁迫效应的分子机理(图2)。
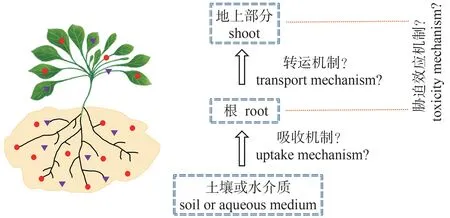
图2 铀从土壤或水介质到植物的转移过程Fig.2 The transfer of uranium from soil or aqueous medium to plants
第三、尽管已有许多研究证实了铀对植物生长发育阶段的影响,但大都聚集于种子萌发阶段与营养生长阶段,而对于铀是否会影响植物生殖生长阶段的形态、组织与器官发育状况并未有相关研究成果。植物的生殖生长是植物生长到一定大小之后进行的花芽分化、开花、授粉、受精、结果等过程,可采用盆栽模拟试验,对比分析不同浓度铀对植株开花时间、胚胎发育、种子发育、产量和品质等的影响差异,也可以借鉴基因组学、转录组学、蛋白组学和代谢组学等方法探究铀对相关基因表达的影响,进而深入了解铀对植物生殖阶段的影响机理。
第四、在自然条件下,不同种类的植物在同一生态系统中共存,目前铀对植物胁迫的研究大多针对一种植物开展,且多集中于短期试验,而关于铀对植物种群、群落乃至整个生态系统水平上的胁迫效应以及长时间尺度下毒害作用是否会逐代积累的相关研究较少。对于这些问题进行探讨,可以通过大田试验,人为模拟不同铀污染水平的小块样地,构建植物群落,进行对比分析,观察记录铀胁迫下随着时间变化铀富集植物是否会改变群落中建群种和优势种的组成。
第五、受地形、气候等环境因子的影响,我国不同区域土壤类型繁多,且土壤理化性质、微生物组成等均有差异,会进一步影响铀存在价态,导致铀胁迫对超富集植物毒害作用的程度有差异,这对于进一步筛选生物量大、生长周期短、适应当地环境的铀超富集植物也是一个难题。将来的研究中可以利用转基因、细胞杂交和生物诱变等现代生物技术对植物、微生物进行定向改造,以筛选铀超富集植物。
综上所述,前人已在探究铀对植物伤害方面取得了许多重要的研究成果,可以看出铀对植物的伤害是复杂的,涉及多方面的生理代谢反应。但目前还有较多问题未得到有效解决,上述展望方面的研究如果能够取得突破性进展,可以优化和加强植物修复技术的应用,有助于今后在铀污染土壤治理和环境保护方面制定出较为科学、可行的应用方案,为我国环境保护与改善做出更大的贡献。
