高羊茅FaGI基因在拟南芥中异源表达及蛋白互作分析
2023-01-14路雪萍马培杰童伟杨罗文举李亚娇赵德刚王小利
路雪萍 马培杰 童伟杨 罗文举 李亚娇 赵德刚,* 王小利,,*
(1贵州大学生命科学学院/农业生物工程研究院,山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550025;2贵州省农业科学院草业研究所,贵州 贵阳 550006;3贵州大学动物科学学院草业科学系,贵州 贵阳 550025)
植物整个生长发育过程受光周期途径的影响,该途径主要包括光信号的输入途径、中央振荡器和信号输出途径,其中生物钟输出基因GIGANTEA(GI)是光周期途径调控开花的关键基因之一[1]。GI作为植物特异性核蛋白,参与拟南芥(Arabidopsis thaliana)光周期开花调控、昼夜节律控制。GI 受生物钟的调控,同时影响生物钟振荡器核心元件相关基因的表达[2]。在长日照和短日照条件下,GI位点突变影响CIRCADIAN CLOCK ASSOCIATED 1(CCA1)和LATE ELONGATED HYPOCOTYL(LHY)基因的表达[3],同时CCA1和LHY过量表达或者突变都会干扰GI基因的表达,细胞核和细胞质中的GI 蛋白分别正调控和负调控LHY基因的表达,微调生物钟功能[2]。
在开花时间调控方面,1962年GI基因被认为是与开花有关的基因[4],拟南芥gi突变体在长日照和短日照条件下均表现出晚花表型,GI基因过量表达使植物提前开花,表明GI是拟南芥开花促进因子[3]。GI 是生物钟与光周期开花调控因子CO(CONSTANS)之间的中介物,通过上调CO基因的转录,促进植物开花。GI在光周期开花途径中具有多重作用。首先,GI 与ZEITLUPE(ZTL)和LOV KELCH PROTEIN2(LKP2)相互作用,协同FKF1 降解CYCLING ODF FACTOR 2(CDF2)蛋白,GI 还能稳定FKF1 和ZTL 蛋白[5-6]。第二,核GI 蛋白在植物体中与FT 的抑制因子形成复合物,如VEGETATIVE PHASE(SVP)、TEMPRANILLO 1(TEM1)、TEM2[6]。第三,GI 通过miR172 途径间接诱导FT转录,miR172的表达受GI正向调控,受SVP负向调控,miR172 靶向APETALA 2(AP2)相关转录因子SCHLAFM YuTZE(SMZ)、SCHNARCHZAPFEN(SNZ)、TARGET OF EAT1(TOE1)、TOE2 的转录并降低其丰度[7-8]。GI除了参与开花和生物钟调控外,还参与各种分子途径,包括下胚轴伸长、叶绿素积累、淀粉积累、非生物胁迫耐受、光和蔗糖信号传导以及miRNA加工[9]。GI是调控补偿效应的候选基因,能减少高温(>27 ℃)和低温(<12 ℃)环境对昼夜节律功能的伤害,正常温度下GI对昼夜节律无影响,温度的波动调控GI基因转录物的丰度[10]。有研究证明子叶的运动、蒸腾及对下胚轴伸长反应的控制归因于SPINDLY(SPY)和GI的协同作用[11]。在短日照条件下,GI在蔗糖信号传导和生物钟之间发挥作用[12]。在对拟南芥的研究中,脱落酸(abscisic acid,ABA)亚细胞水平在盐、冷和干旱的胁迫下增加。GI在依赖ABA 的干旱逃逸耐受中起作用,干旱胁迫下,WRKY44被GI抑制并与TOE1相互作用,表明GI对盐和冷胁迫耐受性的调节可能由ABA 介导[13]。同样,光依赖的GI介导的气孔开放反应可能ABA是由介导的[14]。
高羊茅(Festuca elataKeng ex E.Alexeev)是主要的冷季型牧草和草坪草,具有易建坪、四季常绿、抗逆性强等优良特性[15]。高羊茅作为牧草,花序和茎秆的形成会导致产量下降;作为草坪草,生长季抑制其生殖枝的形成,对草坪持久性有重大意义[16]。因此,推迟开花和延长营养生长期是目前草类植物主要的育种目标。为明确GI基因在高羊茅生物钟昼夜振荡节律调控与光周期开花应答中的作用机制,本研究在前期FaGI基因表达及启动子分析的[17]基础上,利用酵母双杂交、双分子荧光互补和免疫共沉淀探究FaGI与FaCO的相互作用,以拟南芥(Col-0)、p1300-FaGI 过表达拟南芥植株、拟南芥gi(N694170)为材料进行差异表达基因分析,初步探讨FaGI参与调节光周期的调控网络和分子机制,以期为高羊茅光周期育种提供理论依据。
1 材料与方法
1.1 试验材料
高羊茅(Festuca elataKeng ex E.Alexeev)品种猎狗五号购自百绿草种公司(贵阳),拟南芥(Arabidopsis thaliana)野生型(Col-O,WT)由贵州省草业研究所保存,拟南芥gi(N694170)由AraShare 科技服务中心(福州)馈赠。
1.2 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)分析
选取籽粒饱满均一的高羊茅种子,用75%的酒精浸泡1 min,蒸馏水冲洗3~4 次,再用84 消毒液浸泡2 min,超纯水冲洗3~4 次,置于30 ℃恒温培养室中催芽。待种子自然萌发后,选取长势一致且无病害的幼苗,采用育苗穴盘(上口径60 mm,底部28 mm,深度53 mm)花盆规格高25 cm、直径30 cm,置于光照培养箱给予长日照(long-days,LD)和短日照(short-days,SD)处理,相对湿度60%,温度(22±2)℃。长日照处理条件:光照/黑暗16 h/8 h,短日照处理条件:光照/黑暗8 h/16 h。待播种28 d后,取根、茎和叶片样品,在液氮中迅速研磨成粉,使用Axyprep 试剂盒(爱思进生物技术公司,杭州)按照说明书步骤提取总RNA。利用GoScript 反转录试剂盒(Promega,北京)对总RNA 进行逆转录,按照GoTaqⓇqPCR Master Mix 试剂盒(Promega,北京)说明书进行qRT-PCR 扩增,分析基因的相对表达量。反应体系20.0µL:正、反向引物各0.3µL,cDNA模板2.0µL,ddH2O 7.4µL,SYBR Mix 10.0µL。扩增程序:96 ℃预变性6 min;96 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,45个循环。每个试验进行3次生物学重复,3 个技术重复。以GAPDH为内参基因,根据2-ΔΔCt法计算相对表达量。
1.3 酵母双杂交检测
根据FaGI和FaCO基因的全长和载体图谱,分别设计一对带有EcoRI 和BamHI 酶切位点的引物,构建融合表达载体(pGBKT7-FaGI和pGADT7-FaCO),连接产物转化到大肠杆菌[Escherichia coli(Mig.)Cast.&Chalm.]DH5α 感受态细胞,37 ℃恒温培养箱中培养16~20 h。挑取单克隆进行测序验证其正确性。将pGBKT7-FaGI质粒分别与空AD 质粒、pGADT7-FaCO质粒转化酿酒酵母菌株Y2Hgold,同时设置阳性对照组(pGADT7-T/pGBKT7-P53) 和阴性对照组(pGADT7-T/pGBKT7-lam)。收集转化后酵母细胞,弃上清,加入300 µL 0.9% NaCl 溶液轻轻悬浮酵母细胞,将上述悬浮酵母细胞涂布于选择性的二缺(SD/-Leu/-Trp)和四缺(SD/-Ade/-His/-Leu/-Trp)培养基的平板上,用刮铲涂开至无流动液体,SD/-Leu/-Trp 培养基上长出克隆后,挑取单克隆扩繁后在SD/-Leu/-Trp,SD/-Ade/-His/-Leu/-Trp,SD/-Ade/-His/-Leu/-Trp(x-α-gal)培养基上点板,30 ℃恒温箱培养3~5 d。观察酵母的生长情况。
1.4 双分子荧光互补
将FaGI基因构建至含有N 端黄色荧光蛋白(yellow fluorescent protein,YFP)的pUC-SPYNE载体,构建FaGI-nYFP;同样将FaCO基因构建至含有C 端YFP 的pUC-SPYCE载体上,构建FaCO-cYFP。将连接产物转化到大肠杆菌DH5α 感受态细胞,37 ℃恒温培养过夜。挑取单克隆进行测序验证。挑取阳性单菌落接种至添加利福平和氨苄霉素的Luria-Bertani(LB)液体培养基中,将侵染液从叶片下表皮注射到本氏烟草叶片内。培养72 h 后取样,通过LSM 510 激光共聚焦荧光显微镜(Zeiss,德国)观察黄色荧光蛋白信号。
1.5 免疫共沉淀
以1300-GFP、1300-35S-3*FLAG 为空载,对含有FaGI、FaCO基因的质粒进行扩增,获得该克隆片段,并与酶切的载体通过无缝克隆方法连接,构建FaGI-1300-GFP和FaCO-35S-3*FLAG载体。将连接产物转化到大肠杆菌DH5α 感受态细胞,37 ℃条件下恒温培养过夜。挑取单克隆进行测序验证其正确性。将重组质粒转化到农杆菌感受态细胞GV3101,组合农杆菌混合后,将侵染液从叶片下表皮注射到本氏烟草叶片内。取叶片加入液氮研磨后,加入500 µL 蛋白免疫沉淀(immunoprecipitation,IP)缓冲液,取过滤的50µL上清作为Input对照组(阳性对照),用于共转化的检测。按照考马斯亮蓝染色法(Bradford)测定蛋白质浓度,一般蛋白质浓度控制在5~10 mg·mL-1。加入20 倍体积预冷的TBS(tris buffered saline)缓冲液(50 mmol·L-1Tris-HCl,pH 值7.5;150 mmol·L-1NaCl)以平衡Anti-Flag 亲和凝胶(Anti-FLAG M2 Affinity Gel),将蛋白质加入到已平衡的Anti-FLAG M2 Affinity Gel,4 ℃条件下孵育过夜。加入1 500µL预冷的IP缓冲液洗脱凝胶。加入约40µL 2倍上样缓冲液,100 ℃条件下变性5 min,稍离心,取适量体积进行免疫印迹试验(western blot,WB),分别用商品化FLAG 标签(FLAG-tag)、绿色荧光蛋白(green fluorescent protein,GFP)标签抗体进行检测。
1.6 拟南芥遗传转化
采用同源重组法将FaGI与pCAMBIA1300-35S 载体进行体外连接转化,利用花序浸染法转化拟南芥(Col-0),将其置于光照培养箱长日照条件下常规培养,定期浇水。收获的T0代种子经消毒、洗涤后,均匀平铺在具有潮霉素抗性(50 mg·L-1)的1/2 Murashige and skoog(MS)培养基上,春化48 h 后,将其置于光照培养箱长日照条件下培养。待植株生长10 d左右可将阳性植株移栽到花盆土中筛选T1代植株种子,继续筛选直至得到纯合的FaGI-OE转基因植株。
1.7 RNA 提取和转录组测序
光周期的感知发生在叶片中,为研究拟南芥营养生长期相关的转录变化,取长日照条件下生长的WT、FaGI-OE 和gi拟南芥莲座叶片进行RNA-seq 试验。取3 片叶混样,3 次生物学重复,液氮速冻。将叶片样品分成2 份,1 份用于转录组分析(委托苏州诺米代谢公司完成),1份用于实时荧光定量PCR验证。
1.8 qRT-PCR验证
基于转录组学分析,以长日照条件下WT vs FaGIOE、WT vsgi光周期相关差异表达基因为依据,挑选在3 份材料中显著上调或下调的9 个候选基因进行qRTPCR 验证,引物由擎科生物科技有限公司(重庆)合成(表1)。将反转录后的cDNA 稀释4 倍作为模板,ACTIN为内参,设3 次生物学重复,3 次技术重复,采用2-ΔΔCt方法分析数据。
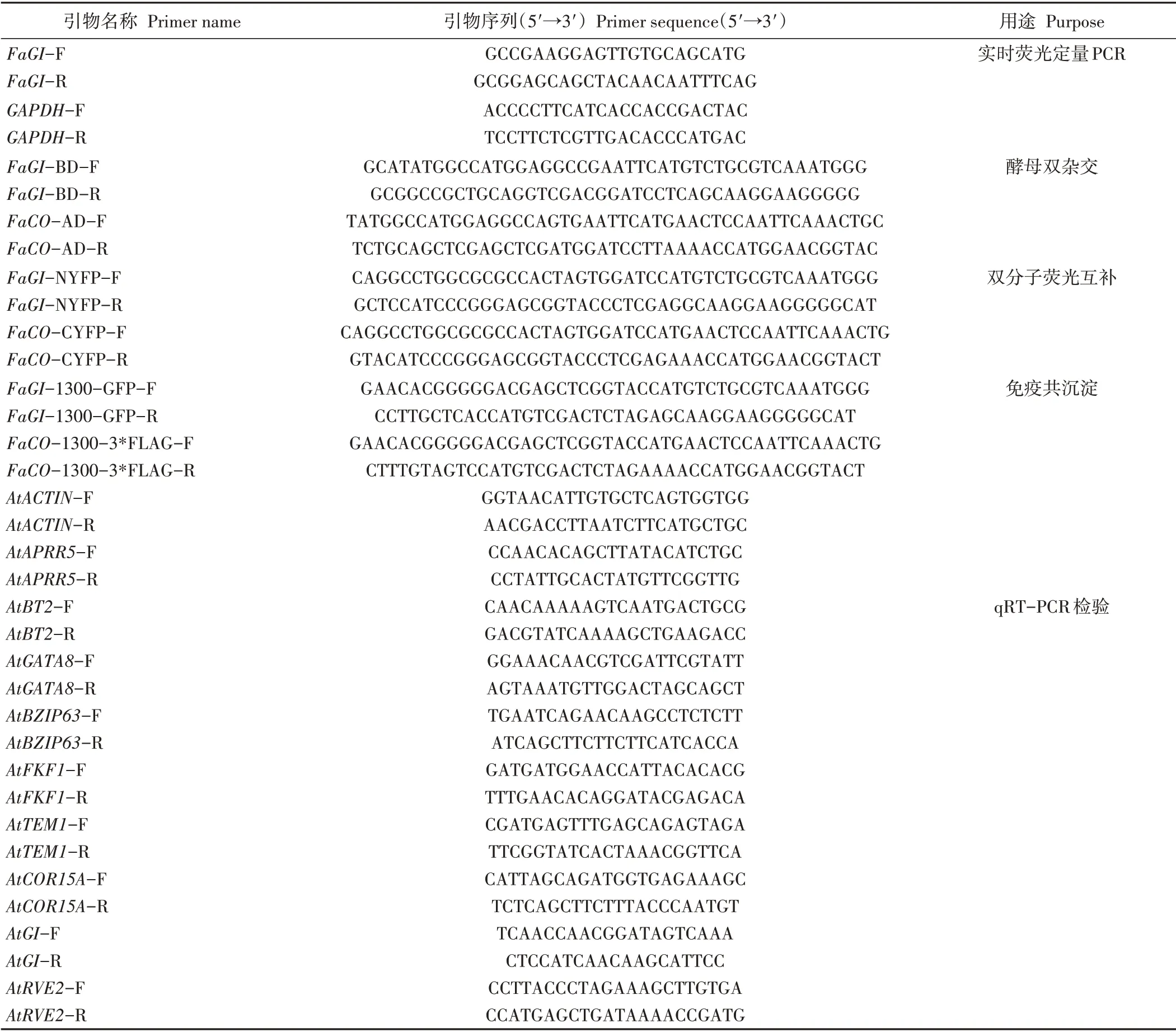
表1 试验所用引物序列Table 1 Primer sequences used in this study
1.9 WT、FaGI-OE和gi的表型鉴定
将FaGI-OE 阳性转基因植株、WT 和gi置于光照培养箱长日照条件下常规培养,定期浇水。观测记录WT、FaGI-OE 和gi植株的表型。当第一个花芽开放时,记录开花天数和莲座叶数。
1.10 数据分析
利用Excel 2010和SPSS 20.0进行数据整理分析。
2 结果与分析
2.1 FaGI基因组织表达模式分析
本研究利用qRT-PCR 检测长日照和短日照条件下FaGI基因在高羊茅不同组织中的表达情况,结果如图1所示。FaGI在根、茎、叶中均有表达,在叶片中相对表达量最高,其次是茎,在根组织中的相对表达量最低。长日照条件下,FaGI在叶中的表达量是茎中的3.9 倍、根的4.3 倍。短日照条件下,FaGI在叶中的表达量是茎中的12.0倍、根的15.0倍,说明FaGI在高羊茅中存在组织差异性表达。
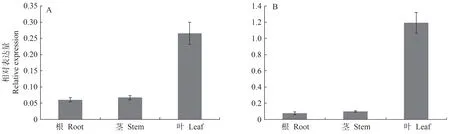
图1 长日照(A)和短日照(B)条件下FaGI基因在高羊茅不同组织的表达量Fig.1 Expression of FaGI gene in different tissues of Festuca arundinacea under long-day(A)and short-day(B)conditions
2.2 蛋白互作
酵母双杂交试验结果显示(图2),阳性对照组、阴性对照组、pGBKT7-FaGI/空载AD、pGBKT7-FaGI/pGADT7-FaCO 共转化Y2Hgold 菌株均在二缺培养基上长出了克隆,说明共转化成功;将SD/-Leu/-Trp培养基上的克隆挑取至SD/-Ade/-His/-Leu/-Trp 平板中培养,发现共转化阳性对照质粒(BD-P53/AD-T)的菌株和试验组pGBKT7-FaGI/pGADT7-FaCO正常长出克隆,而阴性对照组(BD-lam/AD-T)、自激活组(BD-FaGI/AD)均未长出克隆。说明FaGI 和FaCO 存在蛋白互作关系。
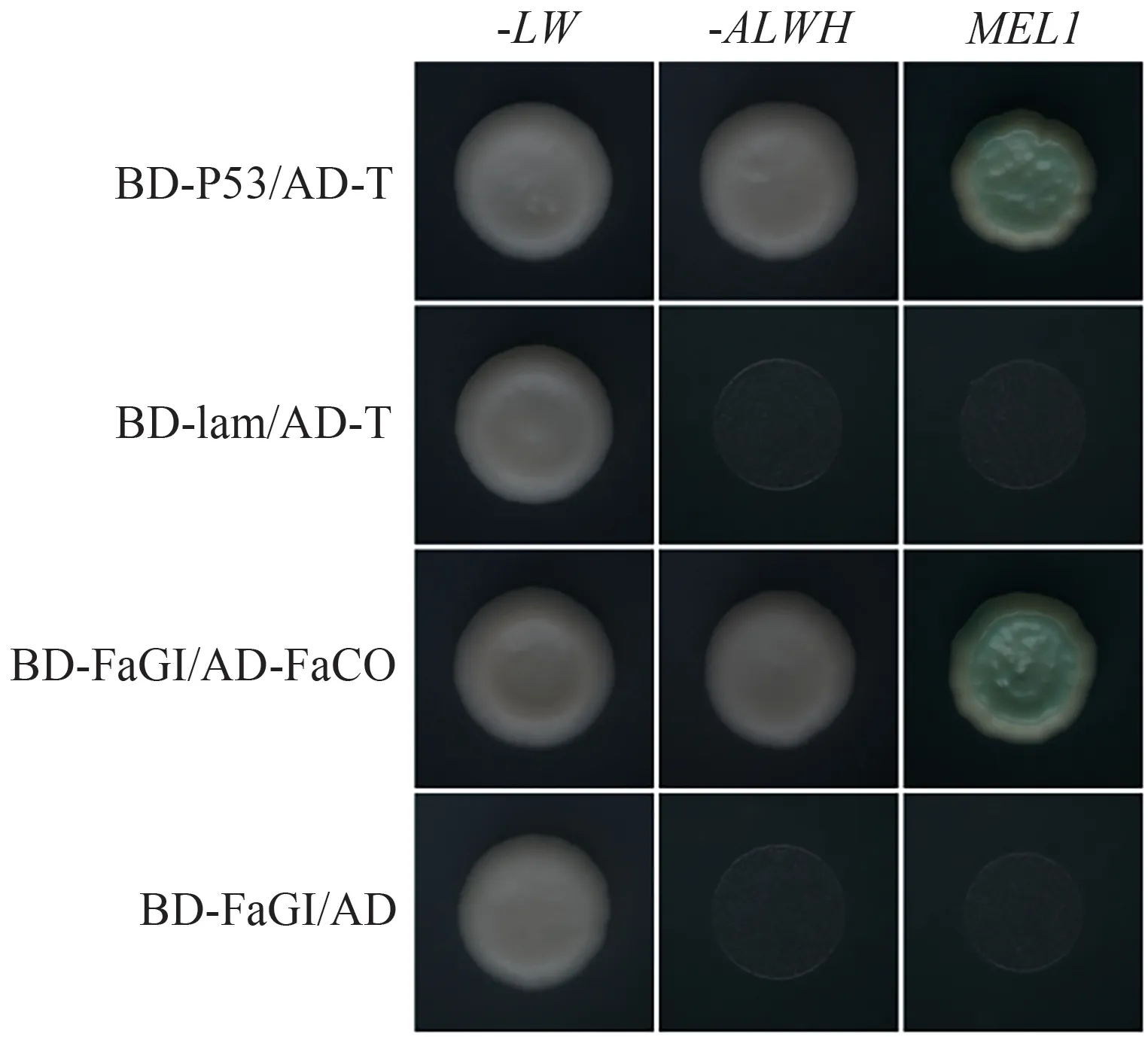
图2 酵母双杂交试验显示FaGI和FaCO相互作用Fig.2 Yeast two-hybrid assay showing the interaction of FaGI with FaCO
为了进一步证实FaGI 与FaCO 蛋白互作关系,在本氏烟草叶片通过瞬时表达,进行基于黄色荧光蛋白(yellow fluorscent protein,YFP)的双分子荧光互补检测,结果如图3所示。FaGI-nYFP/FaCO-cYFP(试验组)、BZlP63-nYFP/BZIP63-cYFP(阳性对照)组合共同转化的烟草下表皮细胞观察到YFP 信号,FaGI-nYFP/35S-cYFP、35S-nYFP/FaCO-cYFP 作为阴性对照并未观察到YFP 信号,仅有核荧光信号。以上结果表明,FaGI和FaCO蛋白存在互作关系。
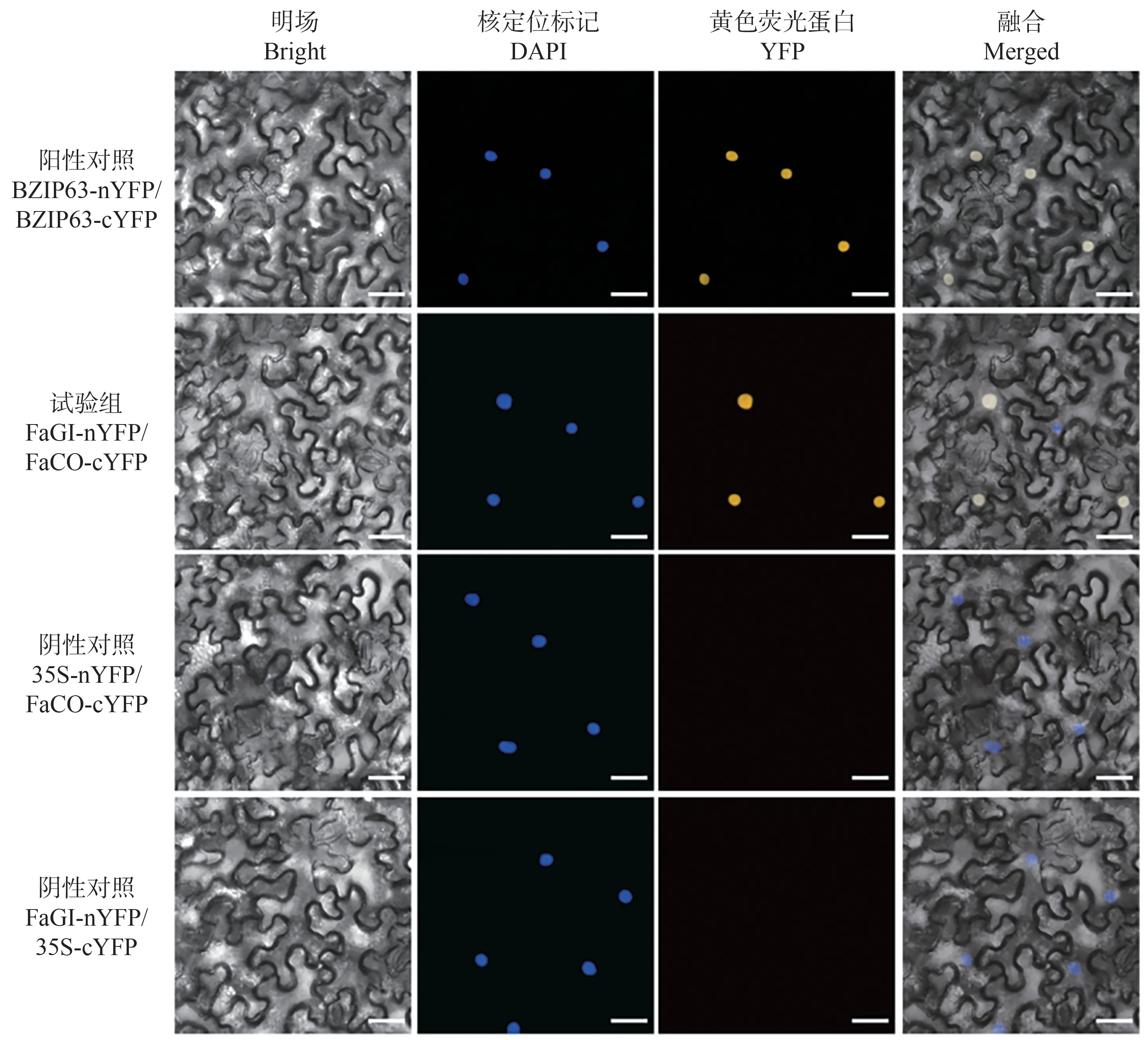
图3 BiFC试验验证FaGI和FaCO互作Fig.3 BiFC assay confirming the interaction of FaGI and FaCO
FaCO 蛋白带有FLAG 标签,FaGI 蛋白带有Myc 标签。将提取的蛋白分成两部分,一份是未经任何处理的Input,另一份蛋白通过合成抗体或转化标签加入对应抗体,称为免疫沉淀(immunoprecipitation,IP)。FLAG 抗体检测结果如图4所示,Input 样本均有明显的条带,说明共转化成功,使用FLAG 抗体对免疫沉淀下来的产物进行WB 检测,发现也有明显的条带,说明IP 成功。GFP 抗体检测结果显示,Input 样本均有明显的条带,说明共转化成功,同时使用GFP 抗体对IP 得到的产物进行WB 检测发现有明显的条带,结果表明FaGI和FaCO有互作。
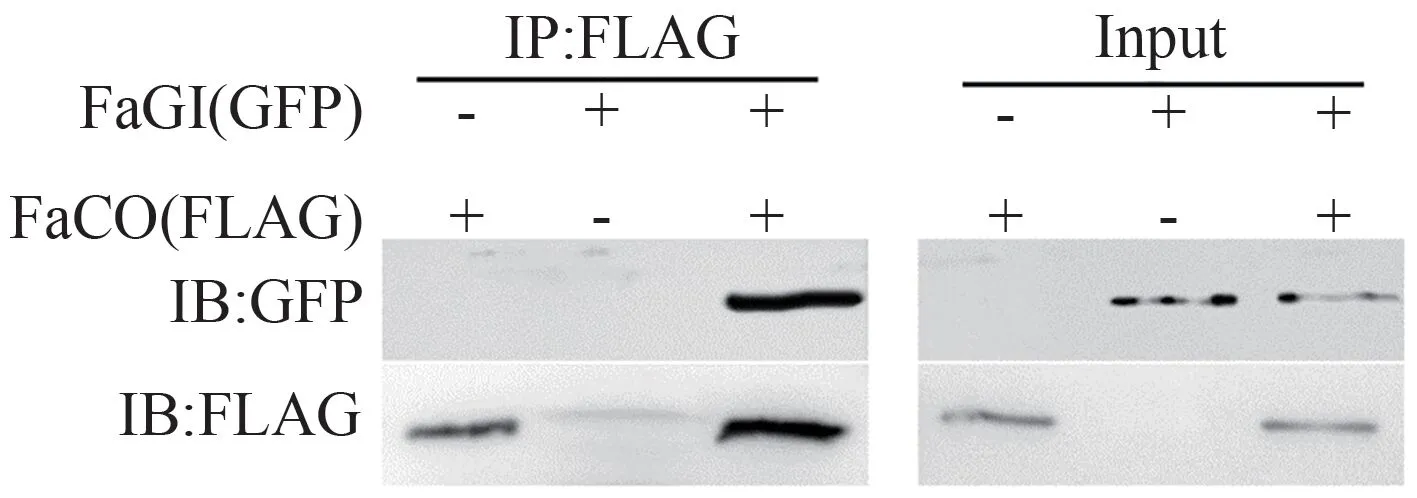
图4 免疫共沉淀验证FaGI和FaCO在烟草叶肉细胞中的相互作用Fig.4 Co-immunoprecipitation assay confirming the interaction of FaGI and FaCO in N.benthamiana tobacco mesophyll cells
2.3 FaGI-OE转基因拟南芥阳性植株的鉴定
将WT 和FaGI-OE 的拟南芥播种在含50 mg·L-1潮霉素的1/2 MS 培养基上,播种7 d 后观察到阳性株会正常发芽、生根、叶片舒展,而非转基因株系WT 逐渐黄化死亡(图5)。以筛选出的潮霉素抗性植株的基因组DNA 为模板,进行潮霉素抗性基因PCR 检测(图6),结果显示,以WT未出现特异性条带,而具有潮霉素抗性植株可扩增到与目的片段大小一致的条带,说明目的基因已整合到拟南芥基因组中。
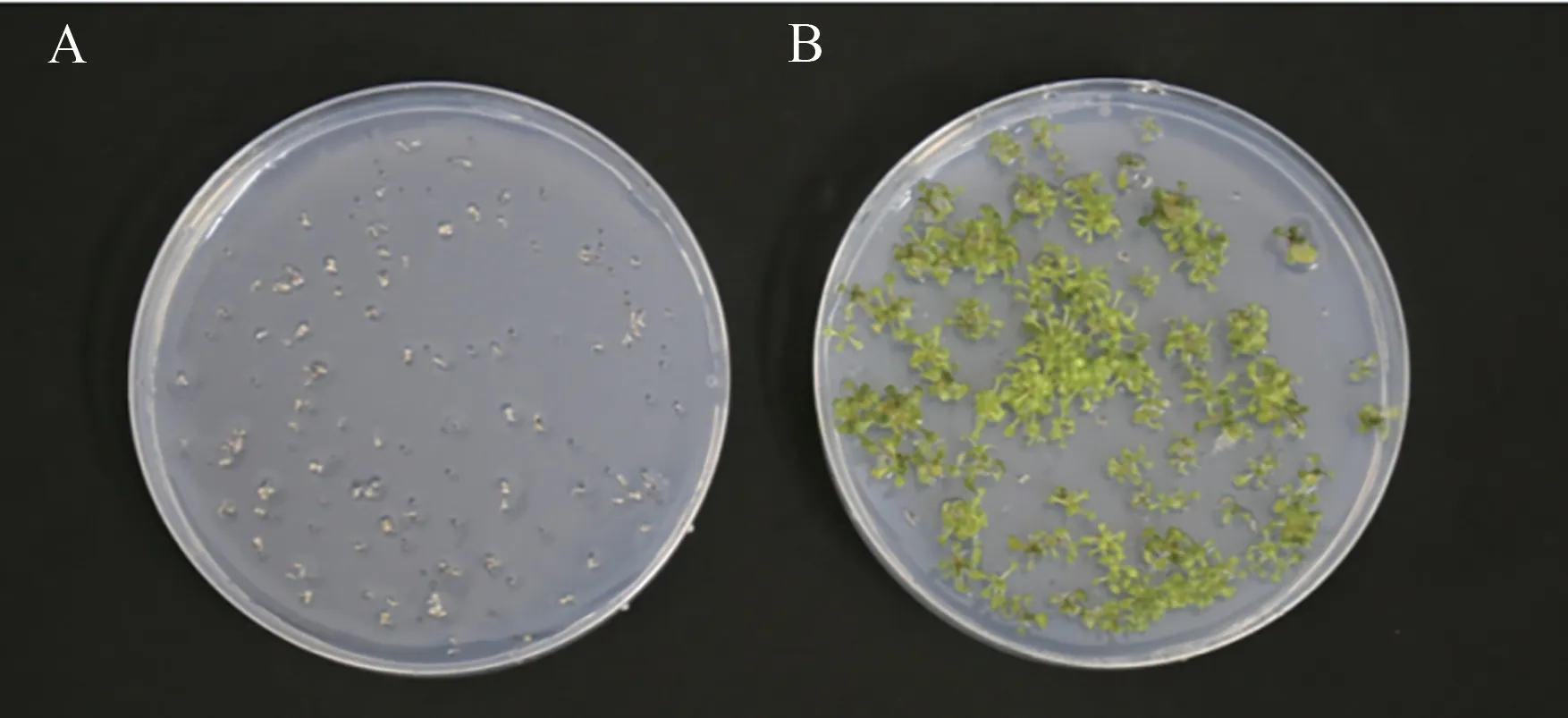
图5 含50 mg·L-1 潮霉素的1/2MS培养基上野生型和转基因的表型差异Fig.5 Phenotypic differences between wild-type and transgenic on 1/2MS medium containing 50 mg·L-1 hygromycin

图6 转基因植株中潮霉素抗性基因的PCR验证Fig.6 PCR validation of hygromycin resistance gene in transgenic plants
2.4 转录组测序数据处理
2.4.1 RNA-seq 序列分析 为明确gi、FaGI-OE 植株在营养生长时期的转录水平变化,对长日照条件下WT、gi和FaGI-OE 株系的植株进行转录组测序。去除低质量下机序列(reads)后,9 个样品均有超过90%的过滤后高质量数据(clean reads)。将clean reads 与拟南芥的基因组数据库(TAIR 10.dna.toplevel.fa)进行比对,9 个样品均有超过97%的唯一序列数目(unique reads)(表2)。以上结果表明,转录组数据稳定可靠,可用于后续分析。
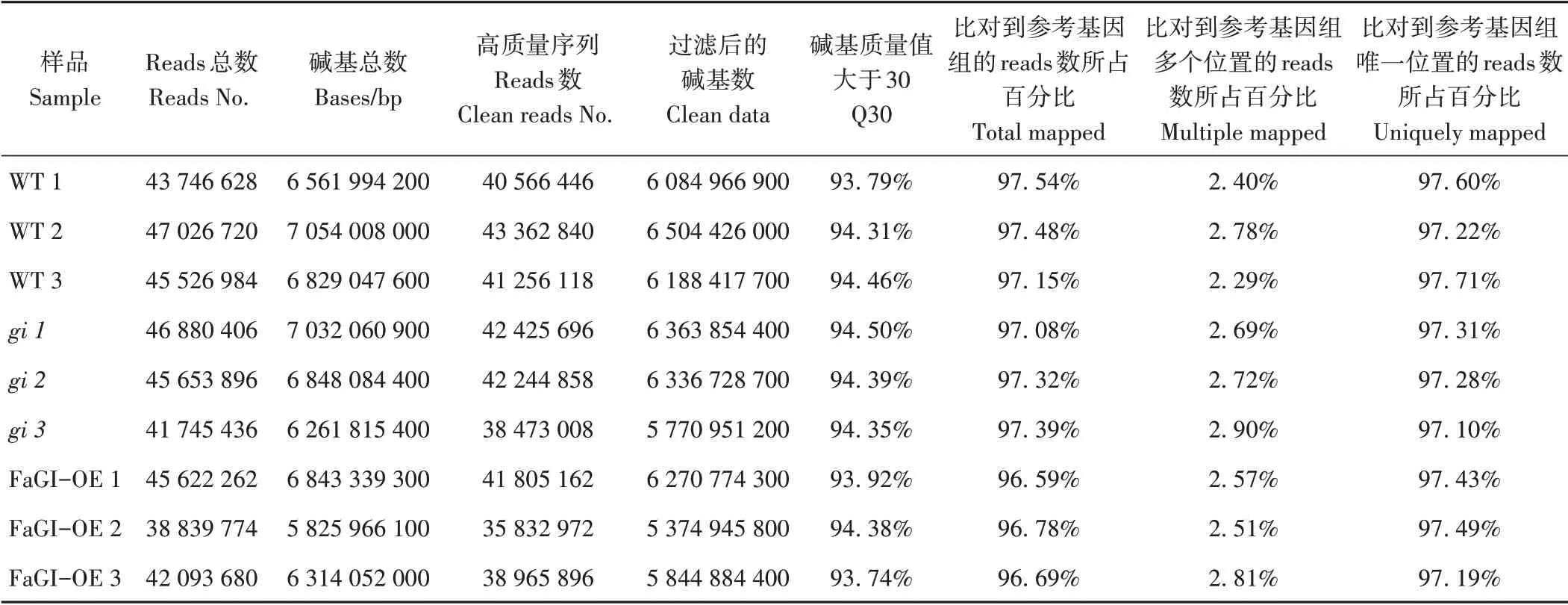
表2 RNA-seq 的通量和质量检测Table 2 Throughput and quality detection of RNA-seq
2.4.2 长日照条件下WT vsgi、WT vs FaGI-OE 差异表达基因比较 火山图可直观展示每个比较组合的差异基因分布情况。为了对同一时期过表达FaGI基因拟南芥、野生型和gi突变体之间差异表达关系进行深入分析,利用Edge R(empirical analysis of DGE in R)软件进行差异表达基因的筛选,以表达差异倍数|log2 Fold Change|>1、P<0.05为筛选条件,筛选出长日照条件下FaGI-OE 与WT、gi与WT 的差异基因,并用火山图对鉴定基因进行差异显著性分析,WT vs FaGI-OE有1 963 个差异表达基因(differential expressed genes,DEGs),其中上调1 387 个,下调576 个;WT vsgi共有92 个DEGs,其中上调28 个,下调64 个(图7、8)。上述结果表明,GI显著影响叶片中的基因表达模式,为研究FaGI的生物学功能提供了理论基础。
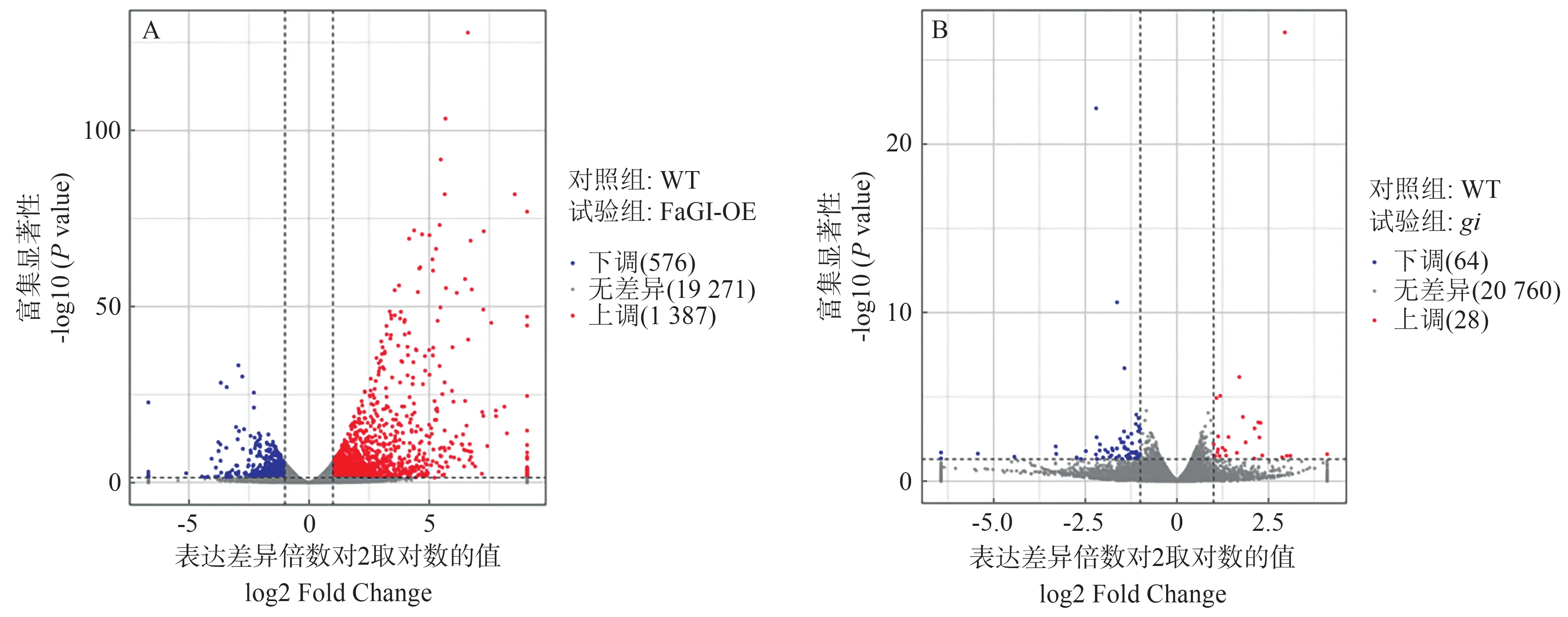
图7 差异基因火山图Fig.7 Differential genes volcano map
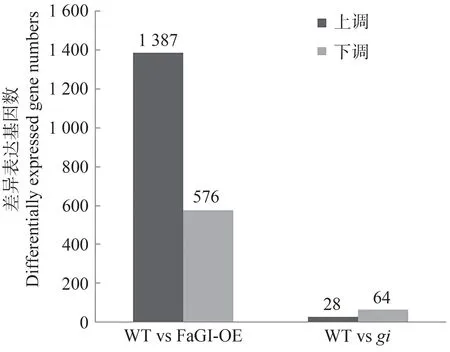
图8 WT、FaGI-OE和gi差异基因表达基因数Fig.8 Number of differentially expressed genes in WT,FaGI-OE and gi
2.4.3 DEGs功能注释与分析 为进一步了解DEGs,用基因本体(gene ontology,GO)数据库对DEGs进行分析,按照细胞组分(cellular component,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP)进行GO 分类,挑选富集最显著的前10 个GO term条目。图9为WT vs FaGI-OE 差异基因的GO 功能富集分析,在生物过程分类中,DEGs 主要富集在响应刺激反应的过程;在细胞组成分类中,DEGs 主要富集在细胞部分、细胞器部分和膜;在分子功能分类中,DEGs主要富集在结合、催化活性等功能。图10为WT vsgiDEGs 的GO 功能富集分析,在细胞组成分类中,DEGs主要富集在植物型-细胞壁、非常规肌球蛋白复合物等部位中。在分子功能分类中,DEGs主要富集在半乳糖结合、木聚糖1,4-β-木糖苷酶活性等功能中。在生物过程分类中,DEGs 主要富集在生殖过程调控、调控胚胎后发育等过程中。

图9 WT vs FaGI-OE差异表达基因GO富集分析Fig.9 GO enrichment analysis of differentially expressed genes in WT vs FaGI-OE
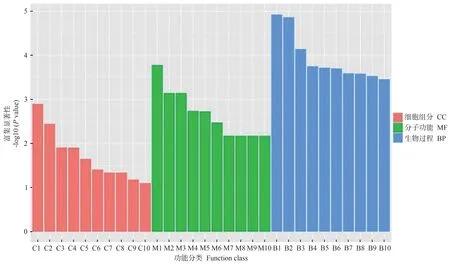
图10 WT vs gi差异表达基因GO富集分析Fig.10 GO enrichment analysis of differentially expressed genes in WT vs gi
2.4.4 DEGs 的京都基因与基因百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析对WT vs FaGI-OE 的DEGs 进行pathway 富集分析,结果如图11、12 所示,这些DEGs 主要涉及植物-病原体相互作用、植物激素信号转导、α-亚麻酸代谢、昼夜节律-植物等通路。其中涉及淀粉和蔗糖代谢通路的DEGs有16个。WT vsgi差异表达基因进行pathway 富集分析发现,这些DEGs主要涉及过氧化物酶体、MAPK信号通路-植物、植物激素信号转导、昼夜节律-植物等通路。说明在拟南芥中过表达FaGI-OE 会影响植物-病原体相互作用、植物激素信号转导、α-亚麻酸代谢、昼夜节律-植物等通路。
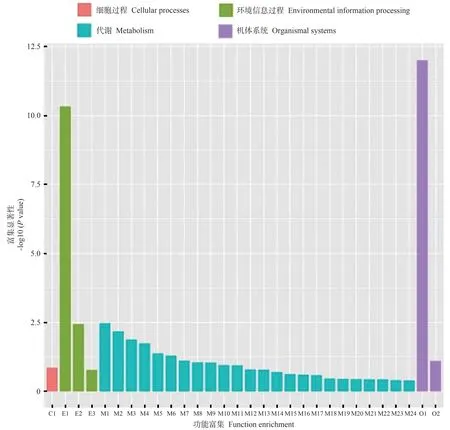
图11 WT vs FaGI-OE差异表达基因KEGG富集分析Fig.11 KEGG enrichment analysis of differentially expressed genes in WT vs FaGI-OE
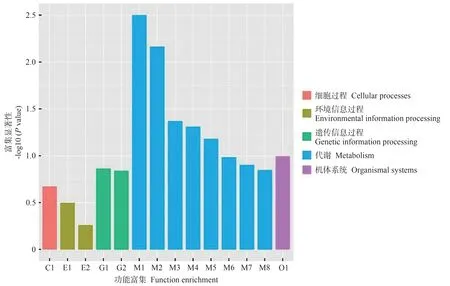
图12 WT vs gi差异表达基因KEGG富集分析Fig.12 KEGG enrichment analysis of differentially expressed genes in WT vs gi
2.4.5 与光周期相关DEGs 的分析 对WT vs FaGIOE 和WT vsgi中的DEGs 进行分析,结果如图13、14所示。WT vs FaGI-OE 中,发现与光周期途径相关上调的DEGs 有EFL3、MYB75、RUP1、ERD7、INVC、RVE8、BT2、GATA8、SMXL2、BZIP63、RVE1、RVE2、TEM1、RAV2、RTFL1、CDF2、SMZ,与光周期相关下调的DEGs有APRR5、ADO3(FKF1)、PRR1、FTIP1;WT vsgi中发现与光周期相关上调的DEGs 有COR15A、MAF5,与光周期相关下调的DEGs有GI、BT2、RVE2。
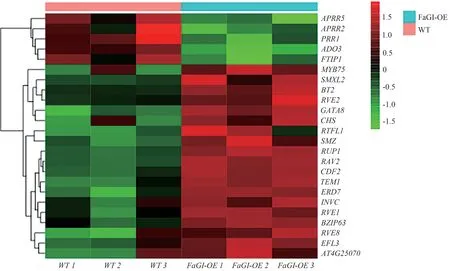
图13 WT vs FaGI-OE的光周期途径相关差异基因热图分析Fig.13 Heatmap analysis of photoperiod pathway-related differential genes in WT vs FaGI-OE
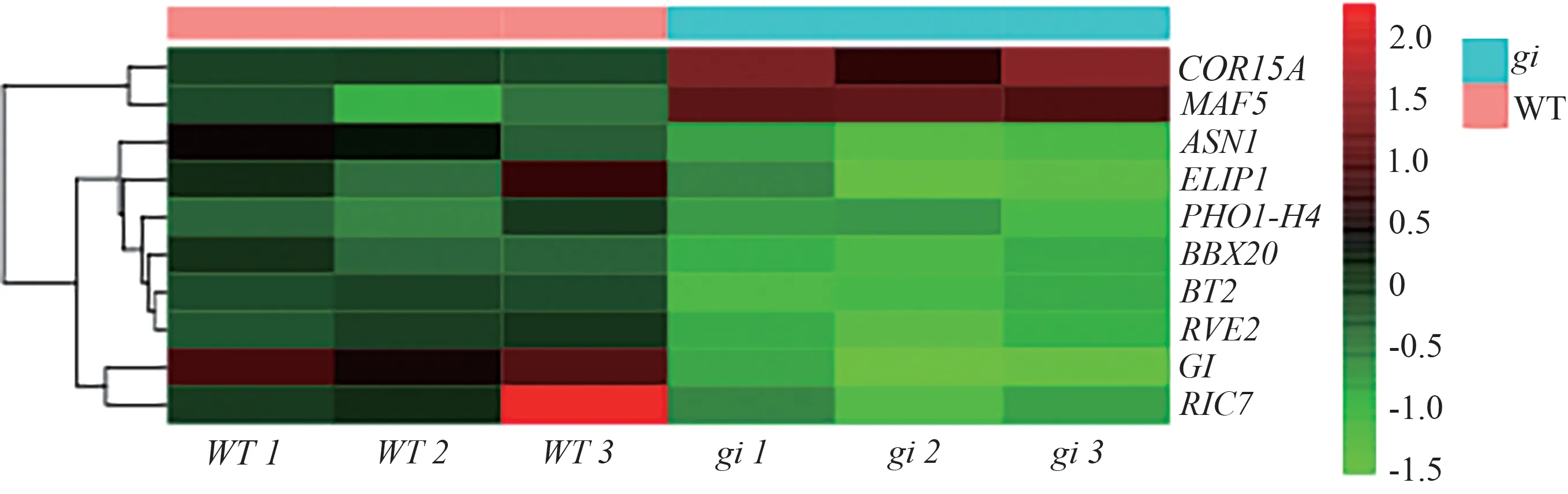
图14 WT vs gi的光周期途径相关差异基因热图分析Fig.14 Heatmap analysis of photoperiod pathway-related differential genes in WT vs gi
2.4.6 植物-病原体相互作用相关差异基因 在植物-病原体相互作用中,GI通过介导SA 信号通路参与拟南芥的疾病耐受性植物WRKY转录因子既可作为植物基础抗病的正调控因子,也可作为负调控因子[18-19]。WT vs FaGI-OE 中,对所有DEGs 进行KEGG 富集,发现共有38 个与植物-病原体相互作用途径相关的DEGs(图15),其中上调基因有37个,下调基因1个;共注释到14个CML基因,7个CPK基因,4个WRKY基因。14个CML基因中,13 个为上调基因,1 个为下调基因;7个CPK基因和4个WRKY基因均上调。
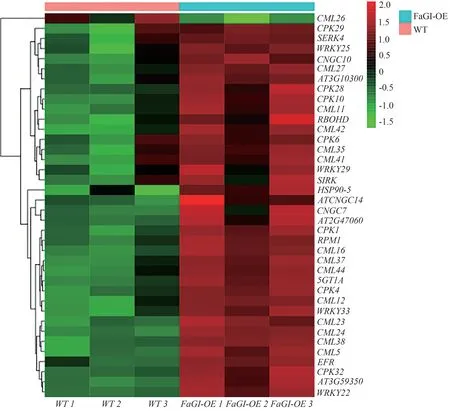
图15 WT vs FaGI-OE的植物-病原体相互作用相关差异基因Fig.15 Differential genes associated with plant-pathogen interactions in WT vs FaGI-OE
2.5 qRT-PCR检验
为了进一步确定转录组数据的可靠性,从DEGs中随机抽取9 个基因进行qRT-PCR 检验(图16)。结果表明,BT2、GATA8、TEM1、BZIP63、RVE2在FaGI-OE中的相对表达量高于WT,APRR5、FKF1 在FaGI-OE中的相对表达量低于WT;COR15A 在gi中的相对表达量高于WT,BT2、GI、RVE2在gi中的相对表达量低于WT。转录组数据和DEGs 数据与定量验证结果相符,进一步表明分析结果的准确性。
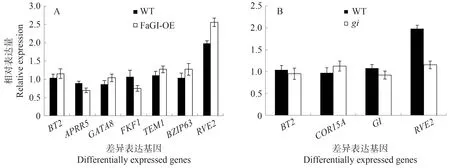
图16 通过qRT-PCR验证RNA-seq数据Fig.16 Validation of RNA-seq data by qRT-PCR
2.6 FaGI基因促进拟南芥开花
以野生型WT(Col-0)拟南芥为对照,对阳性拟南芥植株FaGI-OE 和gi突变体拟南芥植株的花期进行记录,结果如图17所示。长日照条件下,在相同的环境下培养,FaGI-OE植株表现出早花表型,野生型开花时间为27.60 d,FaGI-OE 植株开花时间开花时间为26.46 d,比野生型Col-0 提前约1.24 d,与野生型莲座叶相比,过表达FaGI基因拟南芥莲座叶数量为11,突变体gi属于晚花表型播种52 d后开花,表明FaGI基因促进拟南芥提前开花。
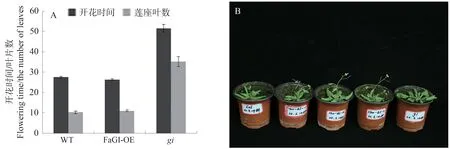
图17 转基因拟南芥的开花时间、莲座叶数量及生长表型Fig.17 Flowering time,number of rosette leaves and growth phenotype in transgenic Arabidopsis
3 讨论
前人研究表明,GI在CO/FT 调节模块中的影响可能发生在多个层面,例如蛋白质-蛋白质或蛋白质-DNA 相互作用[6,20]。GI 与CO 直接相互作用,FKF1、GI和CO可能形成三聚体复合物并稳定CO[21-22]。本研究通过酵母双杂交、双分子荧光互补和免疫共沉淀三种方法,证明FaGI和FaCO在体内和体外互作,推测FaGI在CO/FT模块中有相似的调控机制。
Zhang 等[23]发现野生型拟南芥RVE2基因受到不同光照处理后,其表达模式发生了显著变化,在拟南芥中过表达RVE2可以影响光周期相关基因EPRI、Lhcb和CAT3等表达,使拟南芥开花时间提前,表明RVE2可能是植物光周期调节通路中重要基因之一。此外,其他研究发现,RVE8通过与启动子的晚间元件(evening element,EE)直接结合,促进PRR5和TOC1以及其他晚间基因,包括LUX、ELF4和GI的表达,RVE8基因与PRR5基因可以形成负反馈通路,二者呈相互抑制关系,共同参与影响植物生物钟[24-25]。本研究通过比较WT和FaGI-OE差异表达基因发现,RVE1、RVE2、RVE8均上调,表明FaGI通过影响RVE转录因子调控植物光周期途径和昼夜节律。CDF2被报道是控制花期的CO转录抑制因子,FKF1 可以在蓝光下与GI 结合,GIFKF1 复合体可导致开花抑制子CDF1 及CDF2 的泛素化降解[26]。FT基因在维管束和叶肉细胞表达受体内TEM1和TEM2的抑制[27],GI 蛋白与FT启动子区紧密联系,该区域是FT抑制子TEM1和TEM2的结合位点。GI通过阻止FT抑制子结合FT基因启动子区而中和其对FT基因的抑制作用,或者是影响抑制子的活性和稳定性,来调控FT基因的表达[28]。FTIP1在长日照下能调控拟南芥的开花,过量表达可能会引起FT蛋白转运混乱,被移除韧皮部,无法进入筛管而导致晚花[29]。本研究在比较WT 和FaGI-OE 光周期途径差异表达基因中,发现TEM1、CDF2上调,APRR5、FKF1、PRR1、FTIP1下调,未观察到下游基因CO和FT存在表达差异,这表明在从营养生长过渡到生殖生长的过程中存在其他因素,该结果表明了光周期途径调控的复杂性。
GI涉及植物的许多生理过程,在其他重要的生物学功能中也有报道,例如非生物胁迫、蔗糖代谢和细胞壁沉积[12]。在拟南芥中,GI可以通过SOS 途径负调节耐盐性[2],并通过不依赖CBF 的途径正向调节低温驯化[30]。此外,GI对ABA 依赖性干旱耐受性具有重要意义,并且参与了由miR172-WRKY44 介导的干旱耐受性途径[31]。GI 能够通过稳定DELLA 蛋白来控制赤霉素(gibberellins,GAs)信号,并通过与拟南芥中的EEL蛋白相互作用来调节ABA合成以增强耐旱性[32]。Viana等[33]的研究结果表明bZIP63在能量状态和昼夜节律之间起作用,用以响应淀粉降解和能量压力,通过昼夜循环微调碳利用。在昼夜循环中,bZIP63突变体表现出生长受损、淀粉降解速率发生变化。此外,bZIP63被证明通过参与糖的夹带而直接影响生物钟[34],生物钟则反馈调节bZIP63表达。通过比较WT和FaGI-OE差异表达基因发现bZIP63上调,推测过表达FaGI影响拟南芥淀粉的降解。Pritha 等[35]研究表明,在拟南芥和小麦中,GI可能是斑点病防御的负调节剂,GI表达与拟南芥和小麦对斑点病菌感染的易感性呈正相关。通过转录组分析,WT vs FaGI-OE 差异基因富集在植物-病原体相互作用、激素合成和信号传导、对刺激的反应等相关的生物过程和代谢通路,这说明FaGI参与非生物胁迫、蔗糖代谢、病原体防御等生理过程,也说明FaGI基因功能的多样性。
4 结论
本研究通过酵母双杂交、双分子荧光互补和免疫共沉淀证实了FaGI 和FaCO 在体内和体外存在互作关系,在长日照条件下过表达FaGI基因促进拟南芥开花;转录组学测序数据分析,推测FaGI基因除了参与光周期途径外,还参与非生物胁迫、蔗糖代谢、病原体防御等生理过程。
