牛卵巢膜细胞和大黄体细胞差异表达基因的筛选
2023-01-14范若楠孟金柱杨晓马晓婉肖丽琳王水莲
范若楠孟金柱杨晓马晓婉肖丽琳王水莲
牛卵巢膜细胞和大黄体细胞差异表达基因的筛选
范若楠,孟金柱,杨晓,马晓婉,肖丽琳王水莲*
湖南农业大学 动物医学院, 湖南 长沙 410128
为探索牛卵巢膜细胞(TCs)和大黄体细胞(LLCs)的差异表达基因并揭示其中潜在的生理关系,从NCBI中GEO(GENE EXPRESSION OMNIBUS)数据库中获取GSE83524芯片数据,并利用R软件limma包中的DESeq2进行数据分析,以筛选出TCs和卵巢黄体中LLCs之间的差异性表达基因;使用DAVID软件对上述所获得的差异性表达基因分别进行GO功能富集分析和KEGG信号通路分析;利用String数据库和Cytoscape软件构建了差异表达基因之间的蛋白互作网络(PPI),并通过Cyto-Hubba插件中的MCC算法筛选出连通度最大的前10位的关键基因,结合数据库查找出卵泡发育相关的候选基因。结果显示,经DESeq2分析后,共获得差异性表达基因228个(上调基因143个,下调基因85个);GO功能富集分析结果显示,富集到生物学过程、细胞组分及分子功能的差异表达基因分别占比33.8%、55.7%和10.5%;KEGG信号通路分析共获得18条信号通路,其中,HTLV-I感染通路中基因富集最多(16个);PPI网络互作分析并筛选出了连通度最大的前10位的关键基因;进一步通过数据库查找发现、、、和分别在卵泡发育过程中发挥着重要的作用。本研究结果为进一步探究卵泡膜细胞黄体化以及牛卵泡发育的分子机制奠定基础。
牛; 细胞; 基因表达
卵泡膜细胞(Thecal Cells,TCs)是存在于雌性哺乳动物卵泡中的一种生殖细胞[1]。TCs起源于卵巢中的成纤维样基质细胞[2],可在黄体生成素(Luteinizing Hormone,LH)的刺激下合成雄激素,进一步被转运到颗粒细胞(Granulosa cells, GCs),在卵泡刺激素(Follicle-stimulating hormone,FSH)的协同作用下,将雄激素转化为雌二醇(Estrogen,E2),从而诱导卵母细胞成熟[3]。哺乳动物卵泡成熟并排卵后,会形成一种内分泌腺——黄体(Corpus Luteum,CL),其主要由卵泡TCs和GCs分化形成,CL内的黄体细胞又分为大黄体细胞(large luteal cells, LLCs)和小黄体细胞(small luteal cells, LLCs),在奶牛和绵羊卵巢的研究中发现,LLC和SLC均有分泌孕酮(Progesterone,P)的能力,且LLC的孕酮分泌量是SLC的20倍[4-6],但其具体的调控机制尚不清楚。关于细胞类型特异性受体和类固醇生成酶已有文献报道[7],但是不同细胞类型之间基因表达的差异仍鲜有报道。
洪小曼等[8]对妊娠期前后的母牛进行特异性转录组研究发现,排卵前其体内的CL数量存在显著性增多,并且在TCs中发现许多新的可以调控LH的基因,如在妊娠前后,TCs中的CYP19A1基因表达明显上调。孟金柱等[9]研究了颗粒细胞和黄体细胞的差异基因表达,筛选出5个与GCs增殖和卵泡黄体化相关的差异表达基因。但上述研究主要集中在颗粒细胞和LLCs或TCs之间的关系,尚未存在学者对TCs与LLCs之间的细胞基因差异表达方面的研究。张华[10]等研究显示,在黄体化过程中,卵泡膜细胞会有一个快速增殖过程,在LH的作用下膜细胞与颗粒细胞会失去原有的形态形成黄体,但对于卵泡膜细胞黄体化的机制尚不清楚。因此,本研究基于GEO数据库GSE83524芯片数据,利用生物信息学方法获取LLCs和TCs间的差异表达基因,对卵泡膜细胞黄体化的重要基因进行生物信息学分析,为卵泡膜细胞黄体化机制研究提供理论基础。
1 材料与方法
1.1 芯片数据
本研究中使用的与牛卵泡发育相关的表达谱数据选自GEO数据库(www.ncbi.nlm.nih.gov/geo),并下载了GSE83524芯片数据,其中包含了牛优势卵泡的3个TCs样本和牛黄体的3个LLCs样本。
1.2 差异表达基因筛选
利用R语言中的limma包中的DESeq2进行数据分析,筛选存在于牛卵泡中TCs和卵巢黄体中LLCs之间的差异性表达基因,阈值设定为FPKM≥2,|1b差异倍数|≥1,校正后的<0.01。
1.3 GO及KEGG信号通路分析
使用DAVID在线软件(https://david.ncifcrf.gov/)对上述所获得的TCs和LLCs之间的差异性表达基因进行了GO功能富集分析,将差异表达基因按功能分为生物学过程、细胞组分和分子功能3类,并利用KEGG进行通路分析。
1.4 蛋白相互作用网络(PPI)的构建和关键基因的选取
利用String数据库和Cytoscape软件构建了差异表达基因之间的蛋白互作网络(PPI),利用Cyto-Hubba插件中的MCC算法筛选出连通度最大的前10位的关键基因,并通过Uniprot(https://www.uniprot.org/)及Gene card(https://www.genecards.org/)数据库对上述获取的TCs与LLCs之间的差异表达基因进行功能查找,找出与卵泡发育相关的候选基因。
2 结果与分析
2.1 差异表达基因的筛选
根据R软件中的DESeq2分析结果显示,试验获得了143个上调基因,85个下调基因,共计228个差异表达基因(图1)。
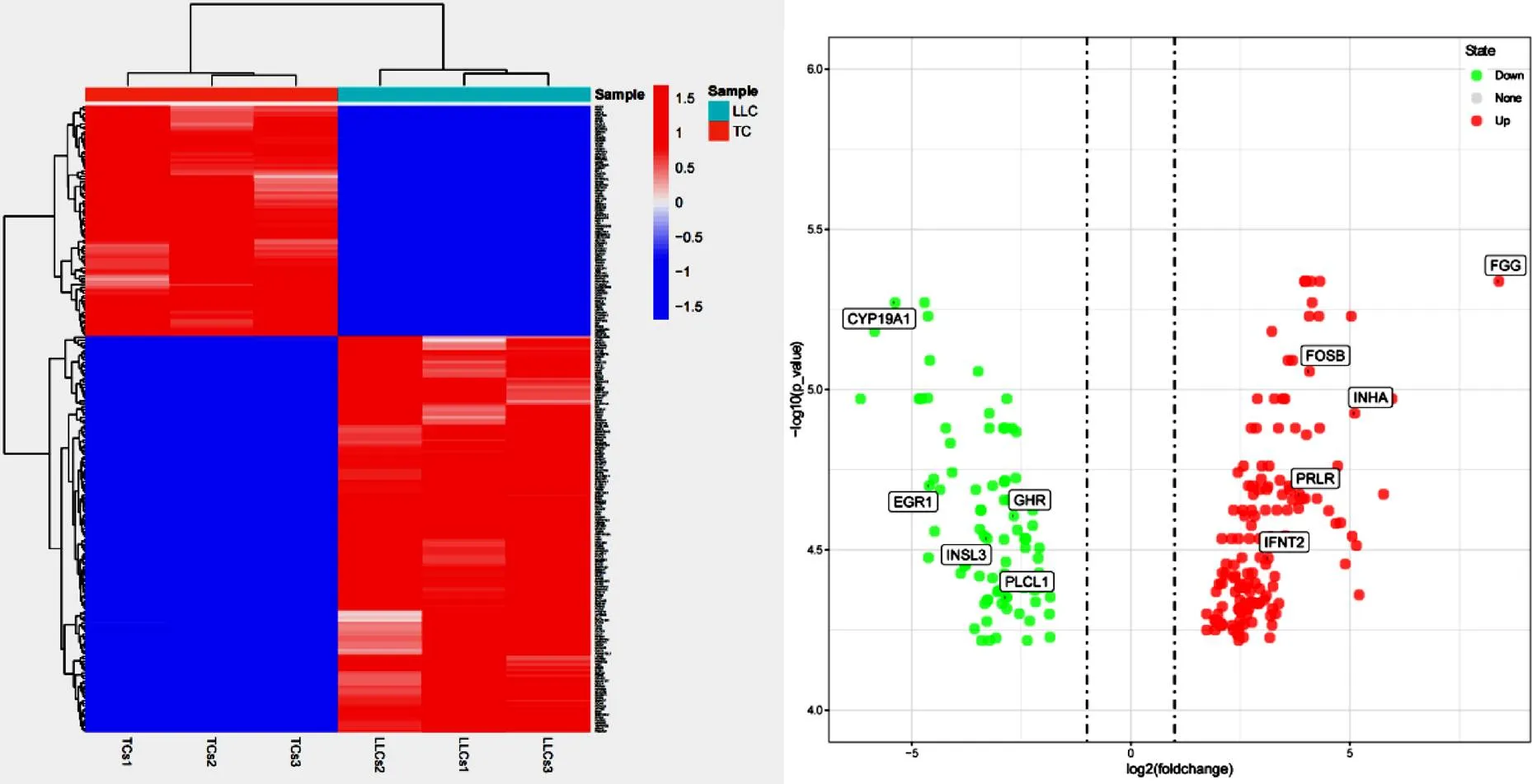
图 1 牛卵巢膜细胞与大黄体细胞差异表达基因层次聚类图和火山图
2.2 差异表达基因GO功能富集分析
通过DAVID软件对TCs和LLCs间228个差异表达基因进行GO功能富集分析结果显示(图2),33.8%的总差异表达基因与生物学过程有关,分别富集在34个组分里,主要与RNA聚合酶II启动子的转录负调控、DNA模板化的转录负调控和细胞增殖调节相关。55.7%总差异表达基因的与细胞组分有关,分别富集在14个组分里,其中细胞质、细胞核和细胞外外分泌体富集的基因最多。10.5%总差异表达基因与分子功能相关,分别富集在10个组分,主要富集在转录因子活性和生长因子活性等功能上,并且其中存在CYP19A1,其可参与类固醇激素的生物合成,在卵泡发育过程中起了至关重要的作用[11]。

图 2牛卵巢膜细胞与大黄体细胞差异表达基因GO功能注释分析
2.3 差异表达基因KEGG信号通路分析
为了获得与卵泡TCs增殖和黄体化相关的信号通路,用DAVID软件对获得的差异表达基因进行KEGG信号通路分析,结果如图3所示,共获得18条信号通路。其中,HTLV-I感染通路上基因富集最多,有16个基因。而参与PI3K/AKT信号通路的13个基因,结合热图分析,有5个基因(NR4A1,TNN,PRLR,IL6,CDKN1A)表达上调,8个基因(GHR,COL1A1,COL1A2,COL6A3,JAK3,PDGFRA,COL3A1)表达下调,其中,已有研究证明PRLR,COL1A1这些基因与卵泡发育相关,通过参与PI3K/AKT信号通路来影响黄体生成以及卵泡发育[12]。

图 3 牛卵巢膜细胞与大黄体细胞差异表达基因KEGG信号通路分析
2.4 PPI网络互作分析
用String软件分析228个差异表达基因的PPI网络互作,利用Cytoscape软件的可视化分析产生的PPI互作数据,并利用MCC算法筛选出连通度最大的前10位的关键基因(图4、图5),即:UBE2C、ANLN、PBK、CENPF、BUB1B、CDKN3、ASPM、KIF11、CDC20、MKI67

图 4 牛卵巢膜细胞与大黄体细胞差异表达基因PPI网路互作分析
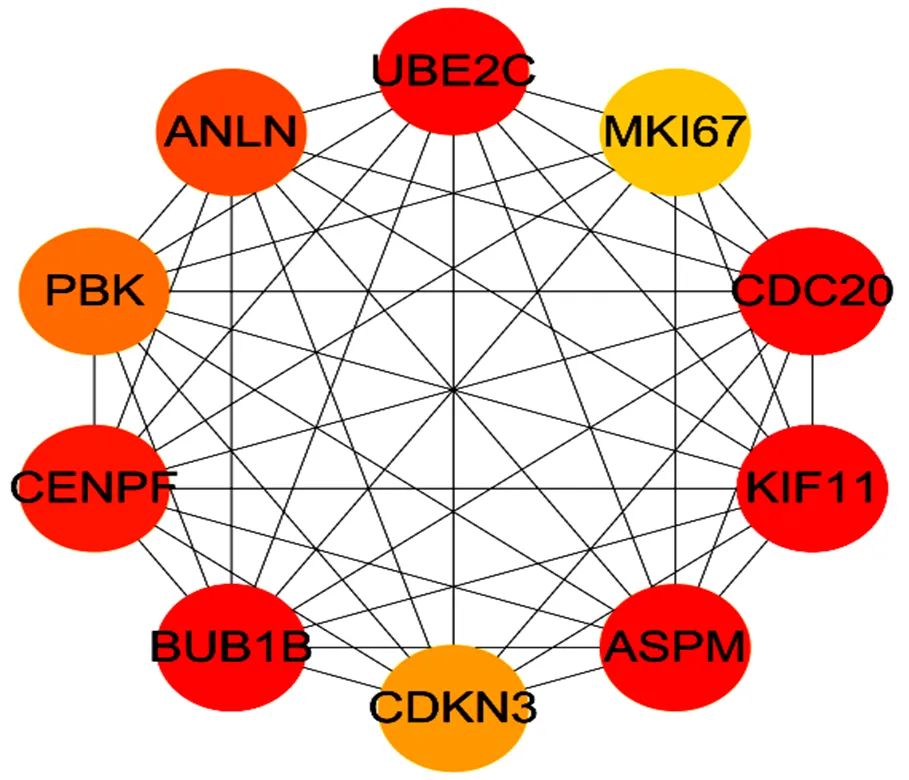
图 5 牛卵巢膜细胞与大黄体细胞关键基因PPI网路互作分析
2.5 卵泡发育相关的候选基因筛选
进一步通过Uniprot和Gene Card等数据库搜索发现、、、、、、、、等基因都在一定程度上在卵泡发育过程中起着关键作用(表1)。

表 1 牛卵泡发育相关候选基因
3 讨论
卵泡是雌性动物中卵母细胞成熟和生长发育的必要环境[13]。CL则是决定哺乳动物成功妊娠的关键内分泌器官[14]。目前对卵泡发育的研究表明,黄体由卵泡分化而来,卵泡中的颗粒细胞和膜细胞分别分化为黄体中的大黄体细胞和小黄体细胞[15]。孟金柱的研究表明在颗粒细胞黄体化过程中PRLR、SPARCL1、INHA、GREB1、CYP19A1五个基因起了重要作用[9],其中PRLR、INHA、GREB1、CYP19A1与本研究结果相同,说明这四个基因无论是在颗粒细胞黄体化或者膜细胞黄体化过程中均有重要作用,但尚未有研究明确表明膜细胞黄体化的机制。
在黄体化过程中,雌激素及雄激素分泌量下降,LH、催乳素(PRL)和生长因子受体的表达升高,其中E2是主要胚胎信号[16],可以促进颗粒细胞的增殖[17],当颗粒细胞分化为LLCs时,大量前列腺素F2α(PGF2α)受体(PTGFR)就会得到表达,抑制垂体分泌LH[9];且已有文献证明PTGFR与卵泡发育密切相关[18]。此外,郭淑华[19]等也发现在黄体化过程中,前列腺素 F2α(PGF2α)的含量会大幅上升。排出的卵子若不能受精形成受精卵,PGF2α就会与LLCs中PTGFR结合,诱导黄体溶解、退化,使卵泡的发育得以继续[20]。参与卵巢功能的基因的表达还包括芳香酶;CYP19A1,芳香酶是参与雄激素转化为雌激素的关键酶,在卵泡生长发育过程中CYP19A1起了关键作用[21]。
本研究利用GEO数据库GSE83524来分析LLCs与TCs的转录组数据,在两种细胞中得到了228个差异表达基因,其中,表达上调的基因有143个,表达下调的基因有85个。CYP19A1,GREB1是筛选出差异倍数最高的前十个基因中与乳腺癌有关的基因,其中有研究表明,GREB1是通过与染色质结合激活雌激素受体α(EstrogenReceptor,ER),对ER介导的转录至关重要,因为它稳定了ER与其他辅因子之间的相互作用,在三种异种移植肿瘤中显示出GREB1-ER相互作用,并使用定向蛋白质-蛋白质方法,发现GREB1-ER相互作用在一半的ER+原发性乳腺癌中[22]。COL1A1也被证明与乳腺癌有关,COL1A1细胞表达可促进乳腺癌转移,是乳腺癌新的预后生物标志物和潜在治疗靶点,特别是在ER+患者中[12]。
PI3K/Akt信号通路与卵巢功能相关,包括原始卵泡募集、颗粒细胞增殖、黄体存活和卵母细胞成熟[23]。本试验分析了GO、KEGG信号通路及PPI网络的相互作用,共有13个基因在此通路中扮演了重要角色。胚胎着床期间的子宫内膜合成的PRL是卵巢调节网络中的一个重要因素,子宫内膜上存在的PRLR可以为胚泡着床提供适宜的微环境,以此来提高子宫内膜容受性,因此,PRL及其受体是胚泡着床和妊娠维持所必须的[24]。
综上所述,已经可以证明、、、和等基因在卵泡膜细胞的黄体化过程中发挥了重要作用。
4 结论
本研究对牛TCs与LLCs之间的差异表达基因进行生物信息学分析,发现和等基因可能在卵泡膜细胞黄体化过程中发挥重要作用,为进一步探究牛卵泡发育的分子机制奠定基础。在后续研究中,需要使用Q-PCR等实验技术来进一步验证,有助于更加深入的分析卵泡发育的分子机制。
[1] 赵园园,吴震洋,安清明,等.牛优势卵泡颗粒细胞与膜细胞中生殖激素合成相关基因的筛选与分析[J].西北农林科 技大学学报(自然科学版),2021,49(7):11-19
[2] 谢光斌,朱磊磊,王勇.卵泡膜细胞与卵巢功能的调控[J].国际妇产科学杂志,2012,39(1):13-17
[3] Perego MC, Morrell BC, Zhang LN,. Developmental and hormonal regulation of ubiquitin-like with plant homeodomain and really interesting new gene finger domains 1 gene expression in ovarian granulosa and theca cells of cattle [J]. Journal of Animal Sscience, 2020,98(7):1-12
[4] Trevisol E, Mogollon HD, Ackermann CL,. Partial luteolysis during early diestrus in cattle downregulates VEGFA expression and reduces large luteal cell and corpus luteum sizesand plasma progesterone concentration [J]. Theriogenology, 2020,158:188-195
[5] 徐靖博.miR-126在牛黄体不同发育时期表达规律及其功能[D].长春:吉林大学,2013
[6] 朱宝长.两种黄体细胞的内分泌功能及其调节[J].中国兽医科技,1988(10):57-59
[7] Romereim SM, Summers AF, Pohlmeier WE. Gene expression profiling of bovine ovarian follicular and luteal cells provides insight into cellular identities and functions [J]. Molecular and Cellular Endocrinology, 2016,439:379-394
[8] Christenson LK, Gunewardena S, Hong X,. Research resource: preovulatory LH surge effects on follicular theca and granulosa transcriptomes [J]. Mol Endocrinol, 2013,27(7):1153-1171
[9] 孟金柱,吴震洋,安清明,等.牛黄体细胞与卵泡颗粒细胞差异基因的筛选[J].中国兽医学报,2021,41(6):1187-1194
[10] 张华.5-HT对离体培养的山羊黄体细胞生长的影响[D].杨凌:西北农林科技大学,2011
[11] 孟金柱.牛卵泡发育相关基因表达的研究[D].太谷:山西农业大学,2014
[12] Liu J, Shen JX, Wu HT,. Collagen 1A1 (COL1A1) promotes metastasis of breast cancer and is a potential therapeutic target [J]. Discovery Medicine, 2018,25(139):211-223
[13] Hummitzsch K, Anderson RA, Wilhelm D,. Stem cells, progenitor cells, and lineage decisions in the ovary [J]. Endocrine Reviews, 2015,36(1):65-91
[14] Kaczynski P, Baryla M, Goryszewska E,. Estradiol-17β regulates expression of luteal DNA methyltransferases and genes involved in the porcine corpus luteum function in vivo [J]. International Journal of Molecular Sciences, 2021,22(7):225-236
[15] 陈静波.牛妊娠期黄体形态结构及卵母细胞体外胚胎生产的研究[D].杨凌:西北农林科技大学,2003
[16] Garverick HA, Polge C, Flint AP. Oestradiol administration raises luteal LH receptor levels in intact and hysterectomized pigs [J]. Journal of Reproduction and Fertility, 1982,66(1):371-377
[17] 苏行,兰刚,胡深强,等.雌二醇对鹅等级卵泡颗粒细胞的效应分析[J].农业生物技术学报,2021,29(11):2166-2176
[18] 李鹏飞,孟金柱,景炅婕,等.转录组测序筛选牛卵泡发育相关基因及其表达差异分析[J].中国农业科学,2018,51(15):187-195
[19] 郭淑华.哺乳动物黄体发生的分子机制[J].潍坊学院学报,2009,9(4):90-95
[20] Chou CH, Meiyou C. The effect of steroid hormones on ovarian follicle development [J]. Vitamins and Hormones, 2018,107:155-175
[21] Serge C, Sonia B, Sophie L,. Reproductive system: aromatase and estrogens [J]. Molecular and Cellular Endocrinology, 2002,193(1):137-143
[22] Hisham M, Clive D, Aurelien A,. Endogenous purification reveals GREB1 as a key estrogen receptor re gulatory factor [J]. Cell Reports, 2013,3(2):342-349
[23] Adhikari D, Liu K. Molecular mechanisms underlying the activation of mammalian primordial follicles [J]. Endocrine Reviews, 2009,30(5):438-464
[24] 程玲慧,曹云霞.催乳素、孕酮、雌二醇及其受体对早期胚胎发育的影响[J].实用妇产科杂志,2011,27(4):307-309
Screening of Differentially Expressed Genes in Ovarian Theca Cells and Large Luteal Cells of Cattle
FAN Ruo-nan, MENG Jing-zhu, YANG Xiao, MA Xiao-wan, XIAO Li-lin, WANG Shui-lian*
410128,
To explore the potential physiological relationship between bovine ovarian theca cells (TCs) and large luteal cells (LLCs), we analyzed the differentially expressed genes between the two cells using bioinformatics. The GSE83524 chip data was obtained from the GEO (GENE EXPRESSION OMNIBUS) database in NCBI. Then, R DESeq2 in R software limma was employed to screen differentially expressed genes between TCs and LLCs from GSE83524 chip data. Next, DAVID software was used to analyze GO function enrichment and KEGG signal pathway of the differentially expressed genes obtained; The protein interaction network (PPI) between differentially expressed genes was constructed using String database and Cytoscape software. Finally, the top 10 key genes with the highest connectivity were screened through the MCC algorithm in the Cyto Hubba plug-in and Candidate genes related to follicular development were found according to the database. The results showed that 228 differentially expressed genes (143 up-regulated genes and 85 down-regulated genes) were obtained through DESeq2 analysis; The results of GO function enrichment analysis showed that the differentially expressed genes of biological processes, cell components and molecular functions accounted for 33.8%, 55.7% and 10.5% respectively; The results of KEGG signal pathway analysis showed that 18 signal pathways were obtained, mainly focusing on HTLV-I infection pathway. Further analysis of the top 10 key genes screened from PPI network interaction analysis showed that PRLR, COL1A1, INHA, GREB1 and CYP19A1 played an important role in follicular development. These results provide a basis for exploring the molecular mechanism of TCs and the development of LLCs.
Bovine; cell; gene expression
S823
A
1000-2324(2022)06-0900-06
2022-10-18
2022-11-07
国家自然科学基金(31672507);湖南省自然科学基金(2020JJ4359);湖南农业大学双一流建设项目(SYL201802017)
范若楠(1999-),女,硕士研究生,主要从事动物生殖方面的研究. E-mail:2291498777@qq.com
Author for correspondence. E-mail:wangshuilian1234@126.com
10.3969/j.issn.1000-2324.2022.06.014
