IC-MS和UHPLC-MS/MS方法测定地表水中丁基黄原酸和苦味酸
2023-01-12温才裕
吴 杰,温才裕,吴 斌
(珠海水务环境控股集团有限公司,广东珠海 519020)
丁基黄原酸盐即黄药,为黄色粉末固状,有刺激性气味,有毒,性质不稳定,在酸性介质中加速分解,易溶于水、丙酮和醇,是有色金属选矿工艺中应用最广的捕集剂之一。残留在选矿水中的丁基黄原酸会使水体呈现异味,对动物的肝脏、肾脏和神经系统造成损伤。
苦味酸即2,4,6-三硝基苯酚,被广泛应用于炸药、染料和皮革等工业生产及医学中收敛剂和杀菌剂的制备。受硝基吸电子效应的影响,苦味酸具有很强的酸性,可经过呼吸道、消化道和皮肤被人体吸收,引起支气管炎和接触性皮炎等。
《地表水环境质量标准》(GB 3838—2002)[1]中规定丁基黄原酸标准限值为0.005 mg/L,苦味酸的标准限值为0.5 mg/L。对丁基黄原酸盐的测定方法有以下几种:分光光度法主要有铜试剂亚铜分光光度法[2]、紫外分光光度法[3],但是灵敏度都比较低,满足不了检测要求;仪器法主要有吹扫捕集气相色谱-质谱法[4]、离子色谱法[5-6]、超高效液相色谱-质谱法[7]、顶空固相微萃取-气相色谱/质谱法[8]、离子色谱-三重四级杆质谱联用法[9]等。苦味酸的检测方法有分光光度法[10]、气相色谱法[11]、吹扫捕集-气相色谱-质谱法[12]、顶空固相微萃取法[13]、液相色谱法[14]、离子色谱法[15]、液相色谱/串联质谱法[16]、离子色谱-串联质谱法[17]。其中,分光光度法、气相色谱法、气相色谱-质谱法、顶空固相微萃取法前处理复杂。
人类活动改变了自然水的性质和组织,导致近年来在全球各地发生了多种多样的水污染事件,而且随着社会的进步和人民生活水平的提高,人类对饮用水的要求也越来越高。因此,水环境健康研究领域受到了人民的广泛关注,相关管理部门更是在不断加大对水资源的监测力度和研究,这也对水质监测技术的发展提出了新的要求。本文建立了直接进样离子色谱-质谱(IC-MS)测定地表水中丁基黄原酸和苦味酸的方法,该方法简便易行、灵敏度高,为自创的方法,国内未见报道。此外,将其与按《水质 丁基黄原酸的测定 液相色谱-三重四极杆串联质谱法》(HJ 1002—2018)[18]、《水质 4种硝基酚类化合物的测定 液相色谱-三重四极杆质谱法》(HJ 1049—2019)[19]建立的超高效液相色谱-串联质谱(UHPLC-MS/MS)法进行对比,比较了2种方法的检出限、准确度和精密度,并用这2种方法同时分析了22份实际水样品中丁基黄原酸和苦味酸的质量浓度。根据试验结果,进而对2种方法的性能和适用性进行了总结归纳。
1 试验部分
1.1 主要仪器
Thermo ICS2100-MSQ离子色谱-质谱仪;Waters Xevo TQ-S Micro超高效液相色谱-串联质谱仪。
1.2 材料与试剂
丁基黄原酸钾(100 mg/L,坛墨);苦味酸(100 mg/L,甲醇中,Bepure®);NaOH溶液(1 mol/L);乙腈(色谱纯);试验用水为Milli-Q所制18.2 MΩ超纯水。
1.3 标准溶液的配制
在纯水里滴加NaOH溶液,配成pH值为9~10的碱溶液。称取适量丁基黄原酸钾,用少量碱溶液溶解后定容,避光保存;称取适量苦味酸直接用超纯水稀释到所需浓度。IC-MS法:取2种标液逐级稀释配制成5、10、50、100、500 μg/L的混合标准系列溶液。UHPLC-MS/MS法:取丁基黄原酸标液逐级稀释配制成0.5、1.0、10.0、20.0、50.0、100.0 μg/L的标准系列溶液,取苦味酸标准液逐级稀释配制成1、5、10、20、50 μg/L的标准系列溶液。标准系列溶液临用现配。
1.4 仪器条件
1.4.1 IC-MS法
(1)色谱条件
色谱柱为AG20柱(2×250 mm);流动相采用KOH淋洗液自动发生装置,梯度洗脱;分析流速为0.4 mL/min;柱后在线加乙腈流速为0.4 mL/min;抑制器电流为50 mA;柱温为30 ℃;进样体积为100 μL。
(2)质谱条件
雾化温度为450 ℃;离子传输管温度为350 ℃;鞘气压力为40 psi(1 psi=6.895 kPa);辅助气压力为3 psi;反吹气压力为0.5 psi;源电压为-3 500 V。
1.4.2 UHPLC-MS/MS法
(1)丁基黄原酸
色谱柱为ACQUITY HSS T3柱,1.8 μm(2.1 mm×100 mm);流动相为氨水、乙腈,梯度洗脱;柱温为40 ℃;进样体积为10 μL;毛细管电压为3.0 kV;质谱源温度为120 ℃;电离方式为电喷雾负离子模式(ESI-);脱溶剂气温度为500 ℃;脱溶剂气流量为1 000 L/h。
(2)苦味酸
色谱柱为ACQUITY HSS T3柱,1.8 μm(2.1 mm×100 mm);流动相为甲酸铵-甲酸、甲醇,梯度洗脱;柱温为40 ℃;进样体积为10 μL;毛细管电压为3.0 kV;质谱源温度为120 ℃;电离方式为电喷雾负离子模式(ESI-);脱溶剂气温度为600 ℃;脱溶剂气流量为1 000 L/h。
1.5 样品预处理
水样中丁基黄原酸盐易分解,在酸性介质中迅速分解生成CS2和相应的醇,而生成的醇可自动催化分解反应。水样采集于棕色玻璃瓶中,向水样中滴加1 mol/L的NaOH溶液调节水样pH值至9~10,于4 ℃避光冷藏保存,1周内测定。样品恢复至室温后测定其pH,若pH有变化,重新用NaOH溶液调节pH值至9~10。样品摇匀,IC-MS法水样直接过样品塞自带的0.45 μm滤芯、UHPLC-MS/MS法水样过0.22 μm的聚偏氟乙烯(PVDF)滤膜后分析。
2 结果与讨论
2.1 条件选择与优化
2.1.1 IC-MS法
(1)色谱条件的选择
试验中发现苦味酸保留能力强,用70 mmol/L的KOH等度洗脱AS20的色谱柱,用时为45.8 min,且峰型严重拖尾。最后选择用AG20保护柱作为分析柱,苦味酸出峰时间缩短,峰型拖尾现象得到很大改善。
(2)质谱条件的选择
丁基黄原酸标准限值低,电导检测器的灵敏度达不到《地表水环境质量标准》(GB 3838—2002)限值(≤0.005 mg/L)要求,故通过自主研究建立了IC-MS法同时检测地表水中丁基黄原酸和苦味酸。本试验对离子色谱柱后、质谱前在线加乙腈与不加乙腈的丁基黄原酸质谱响应值进行了比较。结果表明,离子色谱柱后、质谱前在线加乙腈,丁基黄原酸的响应值提高了一个数量级,而且噪声明显降低。
丁基黄原酸和苦味酸的质谱图如图1~图2所示。
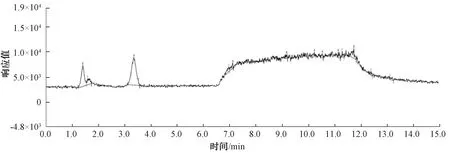
图1 5 μg/L丁基黄原酸(m/z 149)质谱图Fig.1 Mass Spectrum of 5 μg/L Butyl Xanthate(m/z 149)
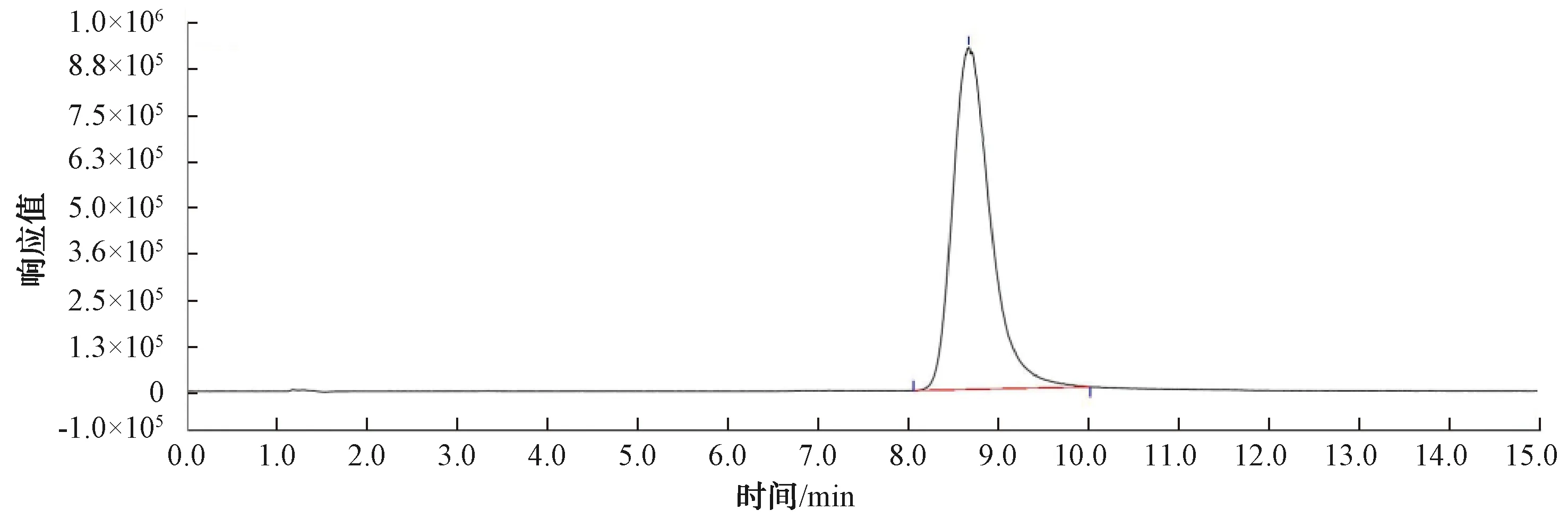
图2 500 μg/L苦味酸(m/z 228)质谱图Fig.2 Mass Spectrum of 500 μg/L Picric Acid(m/z 228)
2.1.2 UHPLC-MS/MS法
根据《水质 丁基黄原酸的测定 液相色谱-三重四极杆串联质谱法》(HJ 1002—2018)和《水质 4种硝基酚类化合物的测定 液相色谱-三重四极杆质谱法》(HJ 1049—2019)2种方法建立了UHPLC-MS/MS法分别测定了水中的丁基黄原酸和苦味酸。由于2种化合物的检测使用不同的流动相和脱溶剂气温度,只能通过设定不同条件分别检测2种有机物,过程比起离子色谱质谱法会比较繁琐,需要用到的试剂种类多。丁基黄原酸和苦味酸的色谱图如图3~图4所示。
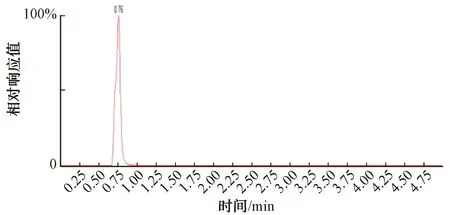
图3 20 μg/L丁基黄原酸色谱图Fig.3 Chromatogram of 20 μg/L Butyl Xanthate
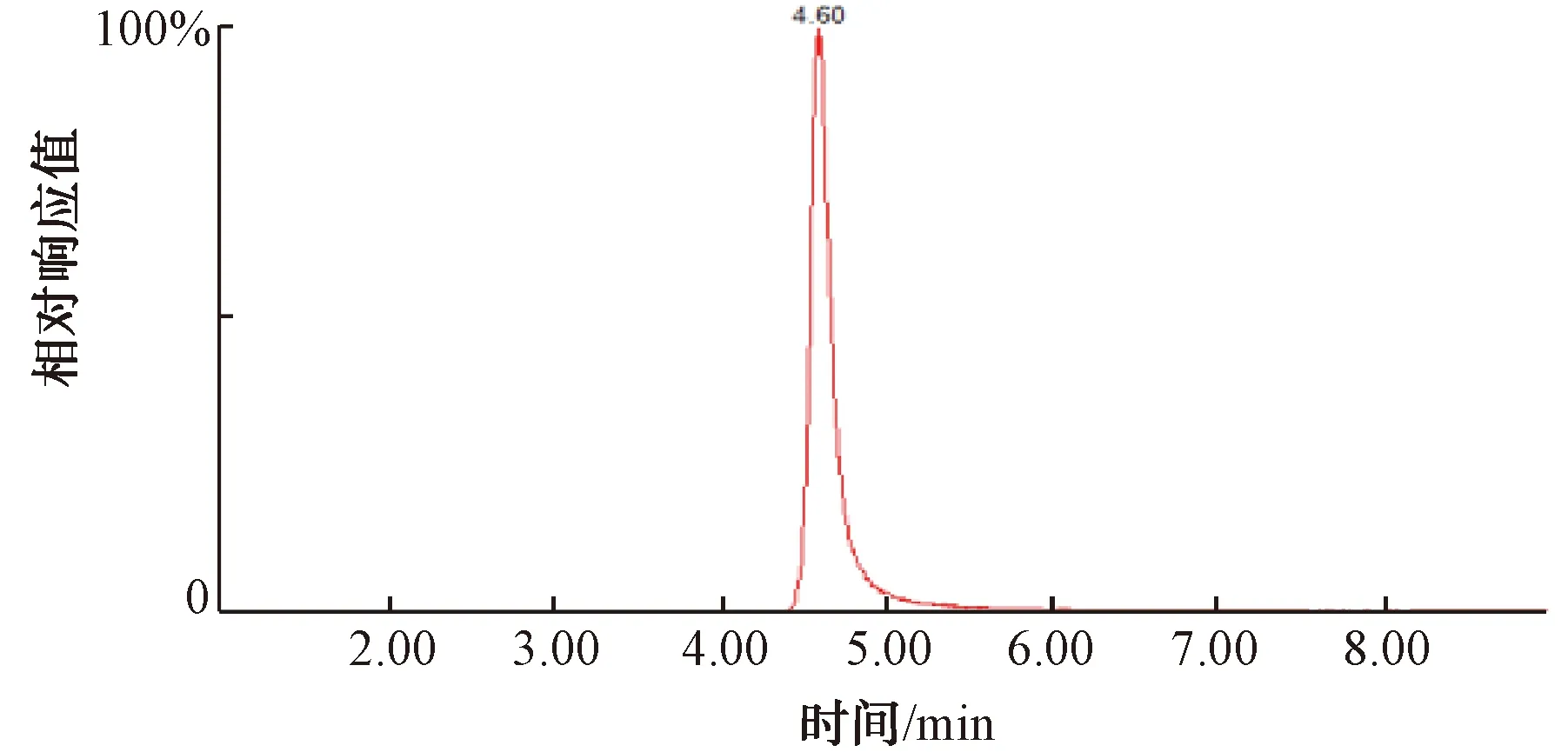
图4 20 μg/L苦味酸色谱图Fig.4 Chromatogram of 20 μg/L Picric Acid
2.2 方法的线性范围与检出限
2.2.1 IC-MS法
丁基黄原酸的标准曲线质量浓度为5~500 μg/L,标准曲线方程为y=233.11x+238.13 (y为面积,x为质量浓度),相关系数r=0.999 9。苦味酸的标准曲线质量浓度为5~500 μg/L,标准曲线方程为y=894.69x+1 878.17,相关系数r=0.999 8。平行测定5 μg/L空白加标样品7次,丁基黄原酸测定结果为4.78、4.92、5.32、5.32、4.70、4.72、5.25 μg/L,苦味酸测定结果为4.95、4.82、5.34、5.22、4.95、4.88、5.26 μg/L,方法的检出限(3.14×SD)分别为0.90、0.65 μg/L。
2.2.2 UHPLC-MS/MS法
丁基黄原酸的标准曲线质量浓度为0.5~100.0 μg/L,标准曲线方程为y= 16 098.2x-1 105.9,相关系数r=0.999 9,平行测定1 μg/L空白加标样品7次,测出结果为0.997、0.968、0.946、0.946、0.961、0.936、0.935 μg/L,方法的检出限为0.07 μg/L。苦味酸的标准曲线质量浓度为1~50 μg/L,标准曲线方程为y=5 115.8x+2 092.3,相关系数r=0.997 7,平行测定2 μg/L空白加标样品7次,测出结果为1.69、1.72、1.70、1.69、1.70、1.68、1.52 μg/L,方法的检出限为0.21 μg/L。
2.3 方法的回收率和精密度
在容量瓶中加入一定体积的丁基黄原酸和苦味酸标液,用实际水样稀释定容,使稀释后的2种物质质量浓度分别为5 μg/L和20 μg/L,用IC-MS法和UHPLC-MS/MS法分别测定,7次测定后的加标回收率及相对标准偏差结果如表1所示。
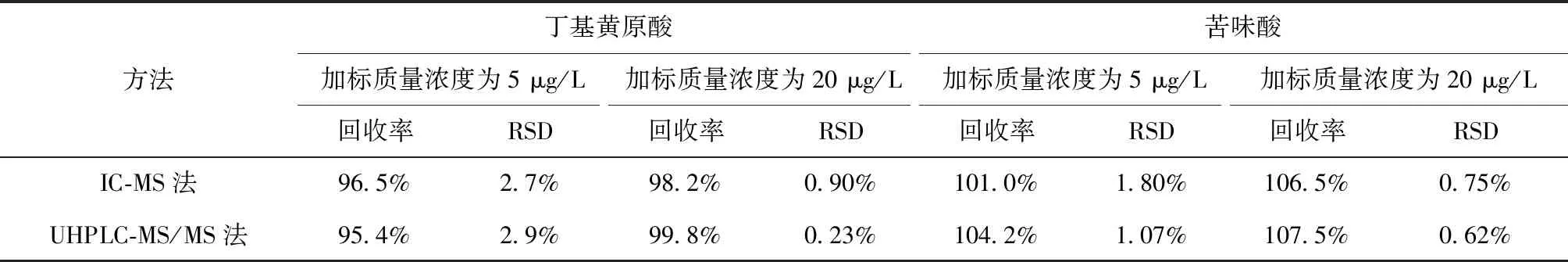
表1 实际水样的加标回收率及相对标准偏差Tab.1 Determination Results of Standard Recoveries of Actual Water Sample and RSDs
表1数据显示,丁基黄原酸的加标回收率在95.4%~99.8%,苦味酸的加标回收率在101.0%~107.5%,7次结果相对标准偏差(RSD)均<5%,能够很好地满足质控要求。试验说明使用这2种方法有较好的回收率且具有较高的精密度,能够很好地满足试验室实际水样的检测要求。
2.4 实际样品测定
本试验采用2种方法同时测定了珠海市水源水22份,样品均未检出丁基黄原酸和苦味酸,2种化合物的质量浓度均远低于地表水环境质量标准规定的限值,说明目前珠海市水源水不存在丁基黄原酸和苦味酸污染。
3 结论
(1)IC-MS法可同时测定地表水中的丁基黄原酸和苦味酸,线性相关系数分别是r=0.999 9 (5~500 μg/L)和r=0.999 8 (5~500 μg/L),检出限分别为0.90 μg/L和0.65 μg/L,实际水样加标回收率分别在96.5%~98.2%和101.0%~106.5%,RSD分别为0.90%~2.70%和0.75%~1.80%。UHPLC-MS/MS法在不同条件下分别测定丁基黄原酸和苦味酸,线性相关系数分别是r=0.999 9(0.5~100.0 μg/L)和r=0.997 7(1~50 μg/L),检出限分别为0.07 μg/L和0.21 μg/L,实际水样加标回收率分别在95.4%~99.8%和104.2%~107.5%,RSD分别为0.23%~2.90%和0.62%~1.07%。由以上数据可以得出2种方法均有较好的准确性和精密度,但从检出限的结果可以看出UHPLC-MS/MS法的检出限相对更低,说明使用UHPLC-MS/MS法检测这2种物质时具有更高的灵敏度。
(2)2种方法的前处理采用过0.45 μm滤芯或0.22 μm滤膜后直接进样测定,简便易行,无需繁杂的前处理过程,简化了样品分析过程中的前处理,使得分析效率得到提高。检测和卫生标准要求均符合GB 3838—2002、HJ 1002—2018和HJ 1049—2019。
(3)本试验采用2种方法同时测定了珠海市水源水22份,结果均未检出,说明珠海市水源水中目前不存在丁基黄原酸和苦味酸2种有机物的污染。
(4)根据GB3838—2002、HJ 1002—2018、HJ 1049—2019中的要求,2种方法均能满足2种有机物的检测要求。虽然UHPLC-MS/MS法的检出限低于IC-MS法,但使用UHPLC-MS/MS测定这2种有机物时需要用到不同的流动相和脱溶剂温度,因此,一次只能测定这2种化合物中的其中一种,2种有机物的测定不能同时进行,需要分2次试验来检测。而IC-MS法则可同时检测这2种物质,不需要更换流动相以及重新设定温度,一次进样就可以解决同时测定2种有机物,测定步骤简单,无须多次重复进样,使用的试剂种类较少,更环保。因此,在要求检测水样中丁基黄原酸和苦味酸2种有机物时,推荐优先使用IC-MS法。
