Folin-Ciocalteu比色法测定澳洲坚果青皮中多酚含量
2023-01-12赵红马尚玄钟涛徐荣付镓榕
赵红,马尚玄,钟涛,徐荣,付镓榕
云南省热带作物科学研究所(景洪 666100)
澳洲坚果(Macadamia spp.)又称夏威夷果,属山龙眼科(Proteaceae),澳洲坚果属(Macadamia F.Muell)常绿乔木果树[1-2]。澳洲坚果主要种植在澳大利亚、中国、美国等30余个国家和地区,我国种植区域主要分布在云南、广西、贵州等省区[3-4]。澳洲坚果富含不饱和脂肪酸、蛋白质、碳水化合物以及钙、磷、铁、B族维生素、抗糙皮病的烟酸和酚类物质等,具有丰富的药用保健价值[5-9]。其中,从澳洲坚果中提取的酚类物质是天然的抗氧化剂,对澳洲坚果果仁防止氧化起一定保护作用,并具有抑菌、助消化、降血脂、抗辐射、抗肿瘤等多种功能[10-12]。随着澳洲坚果附属产品的开发,对澳洲坚果中的酚类物质进行深入研究有利于提高澳洲坚果的附加值。
多酚含量的测定方法有酒石酸亚铁法、高锰酸钾滴定法、Folin-Ciocalteu比色法、普鲁士蓝法及气相、液相色谱法等[13-15]。Folin-Ciocalteu比色法具有操作便捷、成本低廉、准确度高等优点,常用于植物体内的多酚化合物的测定[16-19]。试验采用Folin-Ciocalteu比色法测定澳洲坚果中多酚成分含量,对反应时间、反应温度、Na2CO3浓度、试剂用量等测定条件进行优化,并对该法的稳定性、精密度、重现性等进行试验评价,旨在建立测定澳洲坚果中多酚含量的方法,为澳洲坚果产品的开发和利用提供参考依据。
1 材料与方法
1.1 材料与试剂
澳洲坚果青皮样品:澳洲坚果采摘于云南省景洪市景哈乡云南省热带作物科学研究所澳洲坚果试验基地,清洗后脱下青皮,放置恒温干燥箱中45 ℃烘至恒重,粉碎过筛,取0.9~2.0 mm的青皮粉与0.9 mm以下的青皮粉按1∶1混合,备用。
没食子酸标准品(中国药品生物制品检定所);Folin-Ciocaileu试剂(合肥博美生物科技有限责任公司);无水乙醇、Na2CO3等(国药集团,分析纯)。
1.2 仪器与设备
BGZ-240型电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂);ME204E型电子分析天平[梅特勒-托利多仪器(上海)有限公司];UV-1100型紫外-可见分光光度计(上海美谱达有限公司);HHS型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂)。
1.3 方法
1.3.1 澳洲坚果青皮多酚提取液的制备
准确称取烘干后粉碎过筛的澳洲坚果青皮样品50 g,用60%乙醇溶液按1∶30 g/mL渗漉提取,减压蒸馏后定容至500 mL,取上1 mL清液定容至100 mL,备用。
1.3.2 标准品溶液的配制
准确称取0.100 0 g没食子酸标准品,用50 mL蒸馏水溶解,移至100 mL容量瓶中,定容摇匀,得质量浓度1.00 mg/mL的没食子酸标准储备液。分别移取2,3,4,5,6,7和8 mL标准储备液到100 mL容量瓶中,加蒸馏水至标线定容,得质量浓度分别为20,30,40,50,60,70和80 μg/mL的系列标准溶液,备用。
1.3.3 Folin-Ciocalteu比色法测定条件的优化
1.3.3.1 检测波长的确定
分别准确移取1.0 mL澳洲坚果青皮多酚提取液和1.0 mL 40 μg/mL的没食子酸标准溶液到比色管中,分别加入1 mL 1 mol/L的Folin-Ciocalteu试剂,3 mL 12.5%的Na2CO3溶液,加蒸馏水定容至10 mL,混匀静置在30 ℃水浴条件下反应1 h,用紫外分光光度计在400~800 nm波长范围内进行扫描,绘制光谱曲线,以确定最佳波长。
1.3.3.2 显色时间的确定
准确移取1 mL没食子酸标准溶液到比色管中,加入1 mL 1 mol/L的Folin-Ciocalteu试剂,3 mL 12.5%的Na2CO3溶液,加蒸馏水定容至10 mL,混匀静置在30℃水浴条件下分别反应30,40,50,60,70,80和90 min后,取出测定吸光度,以确定最佳显色时间。
1.3.3.3 Na2CO3浓度的确定
准确移取1 mL没食子酸标准溶液到比色管中,加入1 mL 1 mol/L的Folin-Ciocalteu试剂,分别加入3 mL 5.0%,7.5%,10.0%,12.5%,15.0%,17.5%和20.0%的Na2CO3溶液,加蒸馏水定容至10 mL,混匀静置在30 ℃水浴条件下反应1 h后,取出测定吸光度,以确定Na2CO3溶液的最佳浓度。
1.3.3.4 Na2CO3试剂加入量的确定
准确移取1 mL没食子酸标准溶液到比色管中,加入1 mL 1 mol/L的Folin-Ciocalteu试剂,分别加入1,2,3,4,5,6和7 mL的15% Na2CO3溶液,加蒸馏水定容至10 mL,混匀静置在30 ℃水浴条件下反应1 h后,取出测定吸光度,以确定Na2CO3试剂的最佳用量。
1.3.3.5 显色温度的确定
准确移取1 mL没食子酸标准溶液到比色管中,加入1 mL 1 mol/L的Folin-Ciocalteu试剂,3 mL 15%的Na2CO3溶液,加蒸馏水定容至10 mL,混匀分别静置于20,30,40,50,60,70和80 ℃水浴反应1 h后,取出测定吸光度,以确定最佳显色温度。
1.3.3.6 Folin-Ciocalteu试剂用量的确定
准确移取1 mL没食子酸标准溶液到比色管中,分别加入0.25,0.50,0.75,1.00,1.25,1.50和1.75 mL的1 mol/L Folin-Ciocalteu试剂,3 mL 15%的Na2CO3溶液后,加蒸馏水定容至10 mL,混匀静置于40 ℃水浴锅内,待其反应1 h后,取出测定吸光度,以确定Folin-Ciocalteu试剂最佳用量。
1.3.4 标准曲线的绘制
分别移取1 mL不同浓度的没食子酸标准溶液,以蒸馏水替代样品为空白,采用1.3.3小节的方法确定的最佳测定条件,以没食子酸标准溶液的浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.5 Folin-Ciocalteu比色法的评价
1.3.5.1 稳定性试验
取制备好的澳洲坚果青皮渗漉提取液,按照试验确定的最佳测定条件,在与显示剂反应完全后避光静置0.5,1.0,1.5,2.0,3.0,4.0,5.0和6.0 h后测定吸光度,根据吸光度的变化评价该比色法在一定时间内的稳定性。
1.3.5.2 重现性试验
取5份澳洲坚果青皮样品制备青皮渗漉提取液,按照试验确定的最佳测定条件测定吸光度,并计算多酚含量和相对标准偏差,以评价该比色法的重现性。
1.3.5.3 精密度试验
按照试验确定的最佳测定条件,对同一澳洲坚果青皮渗漉提取液平行测定5次吸光度,计算相对标准偏差,以评价该比色法的精密度。
1.3.5.4 加标回收试验
在6份澳洲坚果青皮渗漉提取液中分别加入0,10,20,30,40和50 μg的没食子酸标准品,测定提取液中的多酚含量,并计算回收率、平均回收率和相对标准偏差,以评价该比色法的准确度和可靠性。
2 结果与分析
2.1 Folin-Ciocalteu比色法检测条件的确定
2.1.1 检测波长的确定
酚类物质与Folin-Ciocalteu试剂反应后,Folin-Ciocalteu试剂中的钨钼酸被还原,使W6+变为W5+,生成蓝色的化合物,通过在400~800 nm范围内测定蓝色化合物的吸收光谱,选出最大吸收波长为检测波长[20-21],不同波长下的检测结果如图1所示。

图1 标准溶液和样品溶液的吸收光谱
结果表明,没食子酸标准溶液、澳洲坚果青皮提取液反应显色后,两者均在762 nm处有最大吸收,因此最佳检测波长为762 nm。
2.1.2 显色时间的确定
提取液中的酚类物质与加入的Folin-Ciocalteu试剂反应需要一定时间,不同反应时间对吸光度的影响如图2所示。

图2 吸光度随显色时间的变化
结果表明,吸光度在60 min内逐渐增大,显色反应较快,在60 min处达到最大值,随后吸光度趋于稳定,说明60 min时反应已基本完全,因此最佳显色时间为60 min。
2.1.3 Na2CO3浓度的确定
Na2CO3溶液是显色反应中的缓冲液,在提供碱性环境的条件下使酚类物质与显色剂反应显蓝色,显色反应对Na2CO3溶液的浓度有一定要求,浓度高低都会影响显色体系的稳定性[22],不同Na2CO3浓度对吸光度的影响如图3所示。
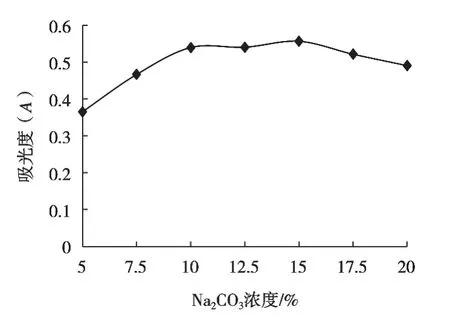
图3 吸光度随Na2CO3浓度的变化
结果表明,随着Na2CO3溶液浓度的增加,吸光度呈先上升后下降趋势,Na2CO3溶液浓度15%时,吸光度达到最大值,因此Na2CO3最佳浓度为15%。
2.1.4 Na2CO3溶液加入量的确定
提取液在碱性的条件下才可以稳定显色,Na2CO3加入量多少将影响提取液碱性的强弱,对提取液显色有很大影响。不同加入量15% Na2CO3溶液对吸光度的影响如图4所示。

图4 吸光度随Na2CO3溶液加入量的变化
结果表明,随着15% Na2CO3溶液加入量的增加,吸光度总体呈先上升后下降趋势,在用量3 mL时达到最大值,这可能是因为初始Na2CO3溶液加入量不足导致显色不完全,而过量的Na2CO3溶液会影响显色体系不稳定也会导致显色不完全[23]。因此15% Na2CO3溶液最佳加入量为3 mL。
2.1.5 显色温度的确定
显色温度的高低会影响有色物质的稳定性和Na2CO3的溶解度,不同显色温度对吸光度的影响如图5所示。

图5 吸光度随反应温度的变化
结果表明,随着温度的升高,吸光度呈现先上升趋势,在40 ℃时吸光度达到最大值,随着反应温度继续升高,吸光度呈下降趋势,这可能是随着反应温度的升高部分生成的有色物质被破坏分解所致[24],因此最佳显色温度为40 ℃。
2.1.6 Folin-Ciocalteu试剂加入量的确定
Folin-Ciocalteu试剂与多酚反应后产生的物质对特定波长的光有最大吸收,所以Folin-Ciocalteu试剂加入量的多少决定着显色反应是否完全[25]。不同Folin-Ciocalteu试剂加入量对吸光度的影响如图6所示。
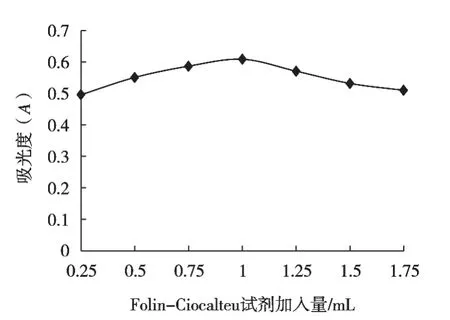
图6 吸光度随Folin-Ciocalteu试剂加入量的变化
结果表明,Folin-Ciocalteu试剂加入量在0.25~1 mL时,显色剂增加吸光度也逐渐增加,加入量达到1 mL时,吸光度达到最大值,之后吸光度缓慢下降,因此Folin-Ciocalteu试剂最佳加入量为1 mL。
2.2 标准曲线的绘制
根据试验方法制作标准曲线,以没食子酸浓度为X轴、吸光度为Y轴建立的标准曲线如图7所示。回归方程式为y=0.012 3x+0.005 9,没食子酸质量浓度在20~80 μg/mL范围内与其吸光度呈现良好的线性关系(R2=0.999 0),该方程可用于澳洲坚果青皮中多酚的定量测定。

图7 标准曲线
2.3 Folin-Ciocalteu法测定澳洲坚果青皮多酚方法学评价
2.3.1 稳定性试验
取制备好的澳洲坚果青皮渗漉提取液,按照最佳测定条件进行稳定性试验,在与显示剂反应完全后避光放置在不同时间后取出测定吸光度见表1。随着时间的延长,吸光度有缓慢上升趋势,但幅度不大,相对偏差为2.05%,说明该方法在一定时间内稳定性较好。
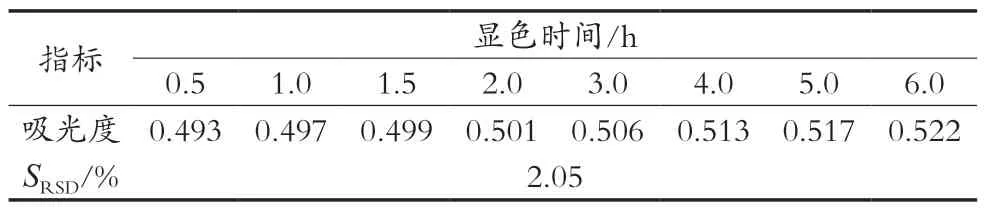
表1 稳定性试验
2.3.2 重现性试验
取5份澳洲坚果青皮样品制备青皮渗漉提取液,用Folin-Ciocalteu比色法测定其多酚含量进行重现性试验,结果见表2。相对标准偏差为0.80%,说明该方法具有较好的重现性。
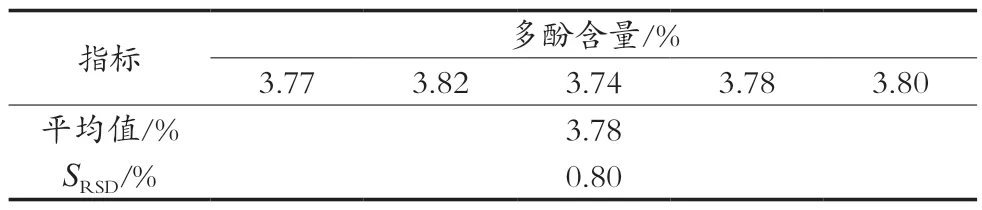
表2 重现性试验
2.3.3 精密度试验
根据最佳测定条件进行精密度试验,对同一澳洲坚果青皮渗漉提取液平行测定5次吸光度,分别为0.504,0.492,0.496,0.495和0.493,相对标准偏差为0.96%。说明该方法具有较高的精密度,能满足澳洲坚果青皮多酚的测定要求。
2.3.4 加标回收率试验
在6份澳洲坚果青皮渗漉提取液中分别加入0,10,20,30,40和50 μg的没食子酸标准品,由表3可知,加标回收试验的最高回收率为102.40%,最低回收率为99.19%,平均回收率为100.65%,相对标准偏差为1.27%。说明完全可用于澳洲坚果青皮多酚的测定。

表3 加标回收率试验
3 结论
澳洲坚果青皮中的酚类成分具有较好的抗氧化活性,在抗衰老、抗炎症等方面可发挥作用[26-27]。试验探究Folin-Ciocalteu比色法测定澳洲坚果青皮中的多酚含量,确定最优检测条件:加入Folin-Ciocalteu试剂1 mL,15%的Na2CO3溶液3 mL,加蒸馏水定容至10 mL后置于40 ℃水浴锅内,待其反应60 min后在762 nm波长处测定吸光度,没食子酸质量浓度在20~80 μg/mL范围内与吸光度呈现良好的线性关系(R2=0.999 0),平均回收率为100.65%,相对标准偏差为1.27%。结果表明该检测方法操作过程简单、便捷,重复性、稳定性好,精密度、回收率高,检测结果准确可靠,可为澳洲坚果研究提供试验参考。
