大豆生长节间响应温度和外源GA诱导的赤霉素途径关键基因分析
2023-01-12齐阳阳窦汝娜赵彩桐李文滨姜振峰
齐阳阳 窦汝娜 赵彩桐 张 帜 李文滨 姜振峰
大豆生长节间响应温度和外源GA诱导的赤霉素途径关键基因分析
齐阳阳 窦汝娜 赵彩桐 张 帜 李文滨 姜振峰*
东北农业大学大豆生物学教育部重点实验室/ 农业农村部东北大豆生物学与遗传育种重点实验室, 黑龙江哈尔滨 150030
为了解大豆节间在不同温度和外源赤霉素(gibberellic acid, GA)诱导条件下的表型变化规律, 分析GA合成重要途径和挖掘调控节间的关键候选基因, 本研究将大豆品种Charleston在培养箱条件和室外盆栽条件种植, 进行不同温度处理和外源GA涂抹处理, 利用徒手切片配合显微照相方法, 分析大豆节间长度和细胞形态变化; 利用液相色谱-质谱联机结合转录组测序方法分析大豆节间GA合成主要通路并挖掘调控节间生长的关键候选基因。结果表明在25℃和30℃条件下, 外源涂抹不同浓度GA可以诱导大豆生长节间伸长, 随着伸长量的增加, 大豆节间都变得纤细。外源GA对细胞作用效果主要为促进伸长, 对宽度影响不明显。高温处理对节间的伸长效果高于低温处理。本研究鉴定到GA2氧化酶基因在大豆生长节间表达和较高含量的GA19和GA53, 及这2种GA下游的GA20 (活性GA前体), 以及这条合成途径的活性GA产物GA3也被检测到都存在于细胞伸长区组织, 说明从GA前体物质到GA53, 再到GA19, 通过GA20最终合成GA3是大豆节间生长的一条重要GA合成通路, 进一步说明GA2氧化酶在大豆节间生长过程中有重要作用。挖掘到某些DELLA、GA和PIF基因家族成员具有组织表达特异性, 为调节大豆节间和株高提供了候选基因。
大豆; 生长节间; GA途径; GA-GID1-DELLA
植物节间长短调控株高的形成, 是植物株型的重要组成部分。节间生长受内外源激素和环境光温信号调控。赤霉素(gibberellic acid, GA)等植物激素通过含量变化和稳态调控植物节间生长[1-2]。光照和温度等环境条件通过光温信号传导途径和植物激素通路耦合共同调控节间生长[1,3]。相关研究促成了以半矮秆水稻和小麦育成及推广为标志的第一次农业“绿色革命”[4-7]。但是相关研究在大豆中进展缓慢。已有研究结果主要是利用群体定位大豆株高和节数QTL[8-11]和赤霉素相关基因过表达[12-15], 定位到的基因不一致而且只能解释部分大豆株高遗传变异。需要继续从多个角度对大豆株高形成规律进行解析,开发适用于育种实践的分子标记, 服务大豆育种需求。
赤霉素(GA)是调控细胞伸长的主要激素, 参与植物各个器官形成过程。GA合成是以牻牛儿基牻牛儿基焦磷酸为起始物质, 经过一串复杂的生化反应, 最终合成具有活性的二萜类化合物GA1、GA3、GA4和GA7的过程[7,16]。促成第一次农业“绿色革命”的基因和都是通过调控农作物节间的GA含量实现的[17-18]。具有生物活性的GA通过与赤霉素受体GID1及转录抑制子DELLA蛋白组成的GA- GID1-DELLA信号传导模块发挥功能。生物活性GA能够与受体GID1结合, 诱导其构象发生变化, 进而招募DELLA蛋白形成GA-GID1-DELLA复合物。随后, DELLA被泛素化进而被蛋白酶体降解[19], 从而激活下游生长发育基因, 调控节间细胞伸长。大豆是典型的由节间组成株高的农作物, 而且大豆的经济性状(豆荚)分布于大豆的各个节位置, 决定大豆的经济产量。因此, 开展大豆节间生长研究更为重要。而针对大豆节间特异表达的GA途径基因研究还未见报道, 开展大豆节间特异表达基因研究能够为调控大豆节间生长提供优良的候选靶标基因, 为大豆株型调控提供理论基础。
光温等环境条件通过影响赤霉素代谢基因的表达, 影响植物节间的GA含量和DELLA水平, 进而调控GA-GID1-DELLA模块的相互作用, 实现节间和株高等植株表型的改变[20-21]。大豆在密植或间套作条件下, 冠层光温条件显著改变大豆节间生长发育, 产生明显避荫反应, 茎秆节间伸长, 细胞壁变薄并且木质化程度降低、茎秆机械强度显著下降; 植株由直立型变为半直立型, 容易徒长倒伏, 难以机械化收获; 而且光合产物分配不合理, 导致籽粒产量降低和品质变劣[22-24]。如何抑制密植条件下大豆避荫徒长并提高茎秆机械强度成为大豆高产稳产的关键问题。赤霉素能够有效调控植物避荫徒长和提高植株茎秆机械强度。但是不同温度条件下大豆节间的GA相关基因表达情况还不明确, 亟须开展相关研究为耐荫抗倒伏大豆新品种培育提供关键候选基因及理论基础。
因此, 本研究利用大豆品种Charleston在培养箱条件和室外盆栽条件种植, 进行不同温度处理和外源GA涂抹处理, 利用徒手切片配合显微照相方法, 分析大豆节间长度和细胞形态变化; 利用液相色谱-质谱联机结合转录组测序方法分析大豆节间GA合成主要通路并挖掘调控节间生长的关键候选基因, 分析关键基因在野生大豆、地方品种和栽培品种间的单倍型变化规律, 试图分析大豆节间生长的基本规律及在温度和外源GA影响下的变化, 明确大豆生长节间主要GA合成通路, 进而筛选到调控大豆节间生长的关键候选基因和候选分子标记, 为大豆半矮秆株型和抗倒伏育种提供理论基础。
1 材料与方法
1.1 试验材料
Charleston由东北农业大学提供。Charleston为有限生长习性, 适合窄行密植栽培, 分枝较多, 抗倒伏性较强[25-26], 但是高密度种植条件导致植株节间明显伸长, 植株抗倒伏性明显降低[27], 是分析大豆主茎相关指标在种植密度影响下变化规律的适合材料。
1.2 试验方法
1.2.1 室内豆苗培养及GA处理 将均匀的大豆种子播种到直径10 cm的营养钵中, 放在25℃和30℃的16 h光照长度的光照培养箱中, 待三出复叶展开后用带毫米刻度的直尺量取第1节间长度, 每个处理3次重复。同时, 配制50、100、250、500和1000 mmol L–1浓度的GA溶液, 将溶液涂抹在第1节间, 24 h后量取节间长度变化和利用LEICA光学显微镜观察表皮细胞, 利用数码相机(Tokyo 108-6290, 日本)照相, 保存图片。
1.2.2 盆栽豆苗培养 在2018年5月20日, 将挑选的整齐健康的种子按20万株km–2和35万株km–2播种到40 cm直径的塑料桶中, 8月5日将处于旺盛生长期的植株顶端第1节、第2节上下2段(中间去除0.5 cm)、第3节取样, 液氮冷冻, 送北京诺禾致源公司进行RNA转录组测序。为比较不同来源数据, 本研究参考任梦露等[28]方法, 将基因表达量作为内参, 计算GA信号转导途径的每个表达基因和的比值。因为GA途径的表达基因均为中低表达量基因, 比值小于1, 因此对比值求–log2对数, 结果数值越高, 该基因表达量越低, 否则该基因表达量较高, 依据此规律对GA信号转导途径各个基因进行分析。
1.2.3 利用液相色谱-质谱联机测定GA含量 称取120 mg在–80℃冷冻的鲜样在液氮中研磨, 然后用甲醇/水溶液(体积比8/2)在4℃下提取。4℃下12,000´离心15 min, 收集上清用氮气吹干, 再用甲醇/水溶液(体积比3/7)溶解等待液相色谱-质谱(Thermal 6500 Triple Quadrupole和Q TRAP MS, 美国)检测[2]。
1.2.4 单倍型分析 本研究将筛选到的差异表达基因在Liu等[29]2020的图形基因组数据库中检索相关基因的单倍型, 分析该基因单倍型在野生大豆、地方品种和栽培品种的分布规律。
1.2.5 数据分析 利用Microsoft Excel 2010软件、Photoshop 6.0软件和ImageJ软件作图和处理数据。
2 结果与分析
2.1 温度对大豆上胚轴伸长有促进作用
为明确温度对大豆生长节间的影响, 本研究测量了30℃ (高温)和25℃ (低温)常温处理的大豆生长节间长度。高温处理前后的节间长度都长于低温条件的长度(图1)。高温处理大豆节间伸长0.36 cm, 而低温只有0.25 cm, 表明高温处理对节间的伸长效果高于低温处理(表1)。
2.2 外源赤霉素显著促进上胚轴伸长
为观察GA对大豆生长节间的直接影响, 本研究利用50、100、250、500和1000 mmol L–1GA3溶液涂抹大豆生长节间, 结果表明, GA能够通过大豆节间表皮进入组织细胞, 参与大豆节间生长发育调控(图2)。不同浓度的外源GA均能有效促进大豆节间伸长, 随着GA浓度的增加, 伸长的效果更为明显(图3)。但是, 随着GA浓度增加, 大豆节间变得逐渐纤细。而且, 温度对大豆节间的伸长效果有明显促进作用。25℃和16 h光照条件下, 大豆节间伸长量由0.4 cm逐渐增加到0.53 cm; 而在30℃和16 h光照条件下, 大豆节间伸长量由0.87 cm逐渐增加到1.18 cm (图3)。

图1 温度升高促进对大豆节间生长
左侧2株为高温处理; 右侧2株低温处理。
Left: two plants grown at 30℃; Right: two plants grown at 25℃.

图2 外源GA促进大豆节间生长
A: 100 mmol L–1GA处理; B: 250 mmol L–1GA处理; C: 对照。
A: 100mmol L–1GA treatment; B: 250mmol L–1GA treatment; C: CK.

表1 不同温度对大豆生长节间的影响

图3 不同浓度GA外源施用对大豆节间生长影响
A: 25℃条件下GA处理; B: 30℃条件下GA处理。0 h: 未进行GA处理节间长度; 24 h: GA处理24 h后节间长度。
A: the internode length of GA treatment at 25℃; B: the internode length of GA treatment at 30℃. 0 h: the internode length before GA treatment; 24 h: the internode length 24 hours after GA treatment.
本课题组前期试验将大豆正在发育的节间细分为靠近上部节的伸长区(elongation zone, EZ)和靠近下部节的成熟区(mature zone, MZ)[2]。本研究选择250 mmol L–1的赤霉素溶液涂抹大豆生长节间, 24 h后测量EZ和MZ的细胞长度和宽度。高低温处理的大豆节间EZ和MZ细胞发育状态明显不同(图4)。
为进一步明确外源GA对大豆生长节间的作用效果, 本研究分析了高低温条件下外源GA对生长节间的伸长区和成熟区表皮细胞的作用(表1)。结果表明, 低温条件下, 大豆生长节间成熟区细胞长度显著高于伸长区, 达到5.06倍; 细胞宽度也有差异, 成熟区细胞宽度是伸长区的1.44倍。高温条件下生长节间的成熟区细胞长度也显著大于伸长区, 达到3.44倍, 而宽度差异不明显。高温条件下的伸长区细胞长度是低温的1.57倍, 宽度为1.16倍。成熟区的差异进一步缩小。高温条件下伸长区细胞和成熟区细胞宽度基本相同, 长度差异显著。表明高低温条件下外源GA对细胞长度影响明显高于细胞宽度(表2和图4)。
2.3 液相色谱-质谱联机检测到上胚轴活性GA
为验证GA对大豆生长节间的作用效果, 本研究利用液相色谱-质谱联机分析了EZ和MZ的不同类型GA含量(表3)。在EZ细胞区域, 检测到5种不同形态的GA存在, 包括有活性的GA3, 而在MZ细胞区域, 只检测到2种GA存在。表明在伸长活跃的EZ区, 促进细胞伸长的GA代谢活动活跃。证明在细胞伸长区有活跃的伸长生命活动, 细胞最终达到成熟区的长度, 和表型测量结果一致(图4和表2)。本研究也鉴定到较高含量的GA19、GA20和GA53都存在于EZ组织(表3), 这条合成途径的活性GA产物GA3也被检测到, 说明从GA前体物质到GA53,再到GA19, 通过GA20最终合成GA3是大豆节间生长的一条重要GA合成通路, 进一步说明GA2氧化酶在大豆节间生长过程中有重要作用。

图4 外源GA处理条件促进不同温度条件下大豆节间伸长区和成熟区细胞响应
A: 高温EZ; B: 高温MZ; C: 低温EZ; D: 低温MZ。
A: EZ grown in 30℃; B: MZ grown at 30℃; C: EZ grown in 25℃; D: MZ grown at 25℃.

表2 外源GA处理不同温度条件下大豆节间EZ和MZ细胞响应情况
EZ: elongation zone; MZ: mature zone.

表3 大豆植株生长节间不同GA含量
EZ: elongation zone; MZ: mature zone.
2.4 大豆株高形成关键时期节间GA相关基因表达分析
为深入分析外源GA和温度差异对大豆生长节间的GA相关基因表达影响, 本研究分析了大豆品种在高低温外源涂抹GA和对照的节间GA调控通路相关基因变化情况(图5)。GA氧化酶和GA含量密切相关。共有7个GA2氧化酶和2个GA3氧化酶基因参与温度对大豆生长节间的调控。但是这些基因表达量均较低。和属于GA2氧化酶家族, 在对应的高温和低温样本中没有检测到表达。表明参与大豆节间生长的GA氧化酶基因较多, 表达模式比较复杂, 给基因定位大豆茎秆发育主效基因带来较大困难。后续的不同密度处理试验节间GA氧化酶基因表达量分析结果也证明了这一点。

图5 节间生长关键基因响应温度和外源GA的表达量变化
HCK: 30℃对照; LCK: 25℃对照; HG: 30℃GA处理; LG: 25℃ GA处理。
HCK: control at 30℃; LCK: control at 25℃; HG: GA treatment at 30℃; LG: GA treatment at 25℃.
DELLA蛋白是GA调控途径的重要因子。共有9个DELLA蛋白基因在大豆生长节间表达, 而且表达模式稳定。所有DELLA蛋白基因在低温对照和外源GA处理条件下表达量较高, 在高温条件下表达量降低。只有表达量在高温条件下升高。共有5个招募DELLA蛋白的赤霉素受体GID1参与大豆节间生长(图5)。这些基因在对照条件下表达量均高于外源GA处理, 表明外源GA处理抑制基因的表达, 从而调控GA信号通路下游基因表达。
上述共有23个GA调控途径关键基因参与大豆节间生长调控, 为调控大豆节间生长提供了关键候选基因, 但是由于基因数量多, 表达量较低, 仅针对少数基因进行调控, 基因表达量变化不大, 而且有较强的基因冗余效应, 因此, 应该针对更多数量基因进行编辑调控, 达到调控节间生长, 最终调节适合株高的目的。PIF基因家族是响应环境温度变化的关键基因。共检测到5个PIF家族基因响应环境温度变化。其中4个在低温条件下高表达, 高温条件表达量降低, 只有对温度不敏感。检测到的5个PIF家族基因对外源GA不敏感, 只有在低温条件下表达量稍有升高。说明检测到的PIF家族基因对环境温度敏感, 可以针对这些基因在不同环境条件下进行调控, 调节大豆节间生长和株高。
大豆在间作条件下由于株高矮, 容易受周围高秆作物遮挡光照, 产生严重避荫反应, 节间明显纤细变长, 导致植株直立性变差, 容易倒伏, 影响产量。北方大豆多数为密植栽培, 在夏季高温旺盛生长季节植株间也会遮光, 单株间竞争生长, 产生类似避荫反应的生长后果。明确上述遮光反应的基因调控通路, 能够为分子辅助育种提供思路。因此, 本研究分析了高低密度栽培条件下大豆生长节间的GA途径关键基因表达量变化。由图6可知, 和不同温度处理及外源GA处理类似, GA氧化酶在不同密度条件下的表达模式不一致。在检测到的6个GA氧化酶基因中, 在高低密度条件下的茎尖第1节间均稳定高表达的基因只有2个(和), 伸长区和成熟区没有在高低密度间稳定表达的GA氧化酶基因; 在第3节间有另外2个基因稳定高表达(和), 表明通过GA氧化酶途径调控大豆节间和株高的难度较高。
DELLA蛋白基因家族和GAI基因家族表达规律明显, 都在高低密度栽培条件下的第3节间高表达, 而且检测到的多数DELLA基因在低密度条件下第2节间的伸长区高表达, 而在高密度的第1节间多数DELLA基因高表达。可以针对这2个基因家族对大豆生长节间进行调控。
高低密度构成的大豆群体小环境温度也有差异。高低密度条件下不同节间大豆PIF家族基因表达模式也证明了这一点。和高低温处理不同, 只有2个PIF基因(和)稳定在第1节间高表达;在第3节间稳定高表达;在第2节间的成熟区稳定高表达。没有检测到在第2节间的伸长区稳定表达的PIF基因。上述稳定表达的PIF基因为有针对性的调控大豆节间和株高提供了关键候选基因。
2.5 GA信号转导关键基因表达组织特异性分析
植物基因具有普遍的一因多效性, 为评价GA信号转导关键基因的组织特异性, 本研究分析了这些基因在SoyBase数据库(www.soybase.org)中的组织表达情况(表4)。GA信号转导基因均为中低表达量基因。和其他研究结果类似, GA信号转导关键基因在大豆中存在多个组织共表达现象。但是也存在茎组织特异表达基因, 如、、和, 可以针对这些基因进行表达量调控, 特异调节大豆节间长度, 最终达到优化株高的效果。但是, 这些基因的表达量都较低, 通过节间调控株高的难度较大。
2.6 GA信号转导关键基因单倍型分析
单倍型分析结合了基因组特征和表型性状, 是将基因组研究成果应用到育种实践, 达到促进大豆分子辅助育种效率的有效措施。本研究分析了节间差异表达基因在大豆图形基因组[29]公布的野生大豆、地方品种和栽培品种的单倍型分布规律。位于中黄13的18号染色体3,369,614~3,372,062区间的、位于10号染色体44,200,887~ 44,203,227区间的、41,057,254~ 41,059,486区间的和39,571,250~ 39,576,081区间的单倍型在野生大豆、大豆地方品种和栽培品种间有明显的变化, 值得进一步分析应用于大豆节间生长调控。
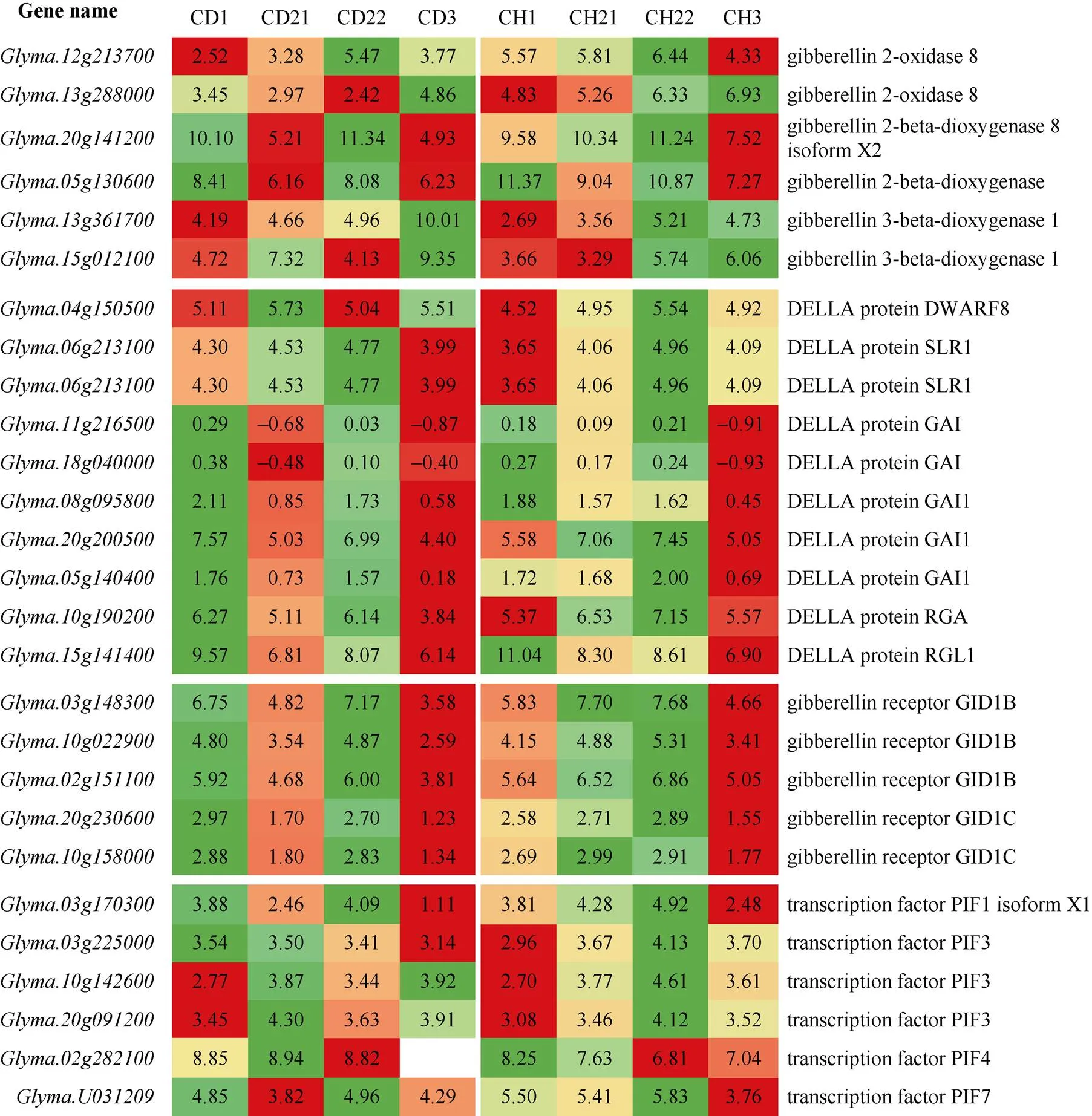
图6 高低密度条件下GA途径关键基因表达量变化
CD1: 低密度茎尖第1节; CD21: 低密度第2节伸长区; CD22: 低密度第2节成熟区; CD3: 低密度第3节; CH1: 高密度茎尖第1节; CH21: 高密度第2节伸长区; CH22: 高密度第2节成熟区; CH3: 高密度第3节。
CD1: the first internode of the apex in low plant density; CD21: the elongation zone of the second internode in low density; CD22: the mature zone of the second internode in low density; CD3: the third internode in low density; CH1: the first internode of the apex in high density; CH21: the elongation zone of the second internode in high density; CH22: the mature zone of the second internode in high density; CH3: the third internode in low density.

表4 GA信号转导关键基因的组织特异表达分析
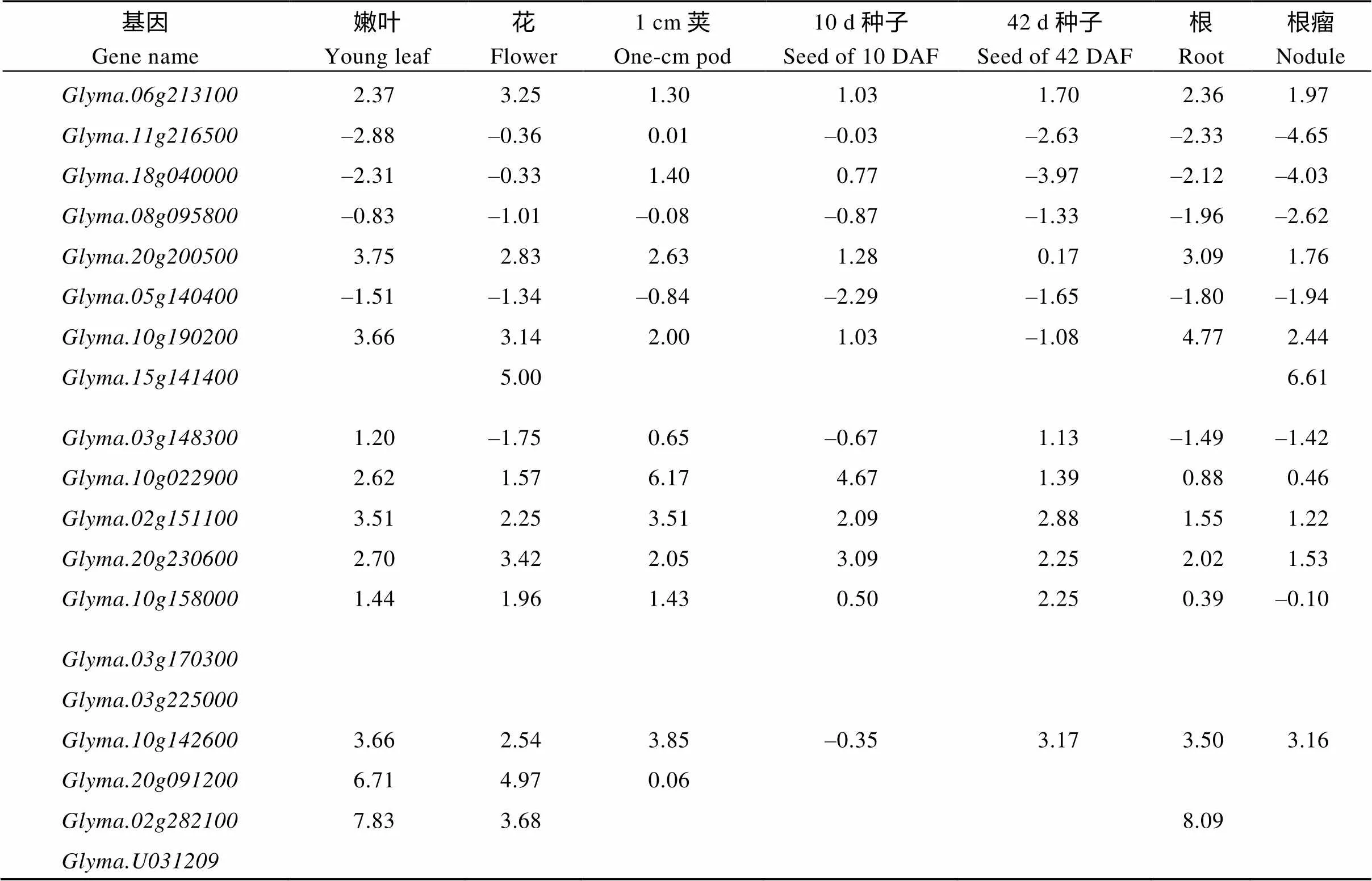
(续表4)
3 讨论
提高大豆产量是我国大豆科研工作的重要内容。在耕地总量有限的前提下, 大豆种植面积不能无限制扩大。因此, 提高大豆单产是提高总产的主要内容, 列入2020年国家1号文件。近年, 我国南方的大豆间作及北方的大豆密植栽培为提高大豆总产做出重要贡献。但是南方大豆间作的避荫反应和北方大豆密植的个体竞争反应均导致大豆节间纤细伸长, 单株直立性变差, 群体容易倒伏, 最终严重影响总产提高, 甚至导致籽粒品质变差, 影响后续豆制品加工[30]。明确大豆节间调控机制, 寻求在不影响其他性状前提下降低大豆节间徒长, 提高大豆直立性, 改善群体抗倒伏性, 最终提高产量和改善品质。抑制节间生长推动了第一次绿色革命获得成功。核心内容就是水稻和小麦节间GA含量氧化酶基因调控[4]。试图为调控大豆节间生长提供关键候选基因。因此, 本研究从大豆节间生长表型着手, 通过分析温度和外源GA对大豆节间细胞伸长区和成熟区表皮细胞影响, 明确温度和外源GA参与大豆节间生长过程, 高温和GA互作对节间伸长促进作用最大。而且大豆的生长节间可以分为细胞EZ和MZ 2个部分[2], MZ是EZ发育的下一个阶段, 温度和外源GA对EZ作用效果最明显(图3和表1), 因此, 针对EZ区段进行调控, 能够获得理想的节间长度。
转录组分析能够获得特定生物学调控途径的全部基因。因此, 本研究对大豆生长节间进行转录组测序, 用以分析大豆节间生长的GA途径关键调控基因表达量变化, 鉴定大豆节间不同发育阶段的特异表达基因。GA-GID1-DELLA复合物是植物GA调控途径的关键节点[19]。组织内活性GA含量高低受GA氧化酶调控。本研究利用液质联机鉴定到大豆生长节间有5种GA存在(表2), 包括已知活性的GA3及无活性的GA15、GA19、GA20和GA53。而在大豆生长节间的EZ组织中也检测到GA3氧化酶基因表达(图5和图6), 表明GA3基因参与大豆节间EZ组织生长发育过程, 调控GA3的生物活性, 进而调节大豆节间伸长。GA2氧化酶通过催化活性GA前体GA9/GA20的形成参与水稻茎基部节间生长发育, 调控半矮秆水稻株高[31]。本研究鉴定到7个(图5)和4个(图6) GA2氧化酶基因在大豆生长节间表达, 同时, 也鉴定到较高含量的GA19和GA53 (表2), 而这2种GA是活性GA前体GA20的中间合成物质, 都存在于EZ组织(表2), 这条合成途径的活性GA产物GA3也被检测到, 说明从GA前体物质到GA53, 再到GA19, 通过GA20最终合成GA3是大豆节间生长的一条重要GA合成通路, 进一步说明GA2氧化酶在大豆节间生长过程中有重要作用。水稻中通过调控基因(编码GA2氧化酶)成功获得了一系列半矮秆水稻突变体[31]。Lyu等[32]证明氧化酶是蓝光调控大豆节间发育的重要靶标基因。本研究在大豆生长节间也鉴定到GA2氧化酶基因存在, 因此, GA2氧化酶基因是调控大豆节间的重要关键候选基因, 为后续半矮秆大豆分子标记开发提供了良好的关键候选基因基础。
DELLA蛋白是植物生长发育的核心元件之一, 参与植物开花、昼夜节律及果实成熟等重要生理过程[19]。DELLA蛋白在植物茎发育过程中也有重要作用。本研究检测到9个(图5)和10个(图6) DELLA蛋白基因参与大豆生长节间调控, 而且这些基因在不同温度及外源GA诱导条件下均有较好的组织表达特异性, 是较好的基因调控候选位点。但是, DELLA蛋白的功能较强, 参与植物多个生命活动进程, 在花、叶片、种子、根中均有较高表达(soybase.org.cn),针对该基因家族进行调控, 可能对其他器官发育也产生明显影响, 最终导致植物生长综合性状变差, 获得的后代材料不能推广到生产。
GID1是GA-GID1-DELLA复合物的关键组分, 对GA调控通路有重要调节作用[21,33]。因此, 本研究也分析了GID1基因家族在大豆生长节间的表达规律(图5和图6)。GID1基因呈现出较好的组织特异性表达规律。在温度处理中, GID1基因表达量均高于外源GA诱导处理; 不同密度条件下, GID1基因在低温条件下的EZ有较高的表达量, 在第3节间表达量也较高, 说明GID1除了参与细胞伸长过程外, 还参与其他生理过程。而在高温条件下, GID1在第1节就表现较高的表达量, 说明高温对节间细胞伸长的促进作用扩展到第1节间。同样的, 低密度条件下的第3节间GID1基因表达量也较高, 再次证明其参与细胞伸长外的其他生理过程。GID1较好组织特异性为通过基因调控途径调节大豆节间长度提供了良好的关键候选基因, 但是因为该基因还参与不再伸长的第3节发育, 因此, 需要进一步明确该基因功能, 评价其作为大豆节间和株高调节基因的可行性。
PIF基因家族和植物温度响应密切相关[34-36]。因此, 本研究也分析了PIF基因家族在大豆生长节间的表达变化情况。共鉴定到5个(图5)和6个(图6) PIF家族基因在大豆生长节间表达。其中, 2个基因(和)在不同温度处理中表达差异明显; PIF基因对外源GA不敏感, 表达量变化不大。而在不同密度条件下, 2个PIF基因(和)在高低密度条件下的第1节间差异表达, 表明这2个基因可能在不同温度条件下通过调节细胞分裂调控节间长度和株高。因为和在不同温度和密度条件下均差异表达, 可以通过高温条件下提高它们的表达量抑制节间细胞伸长, 达到调节大豆节间长度和株高的目的。
4 结论
大豆生长节间受温度和外源GA调节。从GA前体物质到GA53, 再到GA19, 通过GA20最终合成GA3是大豆节间生长的一条重要GA合成通路。GA2氧化酶在大豆节间生长过程中有重要作用。GA-GID1-DELLA复合物在大豆生长节间特异表达, 针对GID1和DELLA基因家族能够筛选到调控大豆节间生长的关键候选基因。
[1] Lyu X, Cheng Q, Qin C, Li Y, Liu B.modulate gibberellin metabolism to regulate soybean shade avoidance in response to reduced blue light., 2020, 14: 298–314.
[2] Jiang Z F, Liu D D, Wang T Q, Liang X L, Cui Y H, Liu Z H, Li W B. Concentration difference of Auxin involved in stem development in soybean., 2020, 19: 952–963.
[3] Shi D B, Jouannet V, Agustí J, Kaul V, Levitsky V, Sanchez P, Mironova V V, Greb T. Tissue-specific transcriptome profiling of theinflorescence stem reveals local cellular signatures., 2021, 33: 200–223.
[4] Hedden P. The genes of the green revolution., 2003, 19: 5–9.
[5] Peng J, Richards D E, Hartley N M, Murphy G P, Devos K M, Flintham J E, Beales J, Fish L J, Worland A J, Pelica F, Sudhakar D, Christou P, Snape J W, Gale M D, Harberd N P. ‘Green revolution’ genes encode mutant gibberellin response modulators., 1999, 400: 256–261.
[6] Sasaki A, Ashikari M, Ueguchi-Tanaka M, Itoh H, Nishimura A, Swapan D, Ishiyama K, Saito T, Kobayashi M, Khush G S. Green revolution: a mutant gibberellin-synthesis gene in rice., 2002, 416: 701–702.
[7] 李毅丹, 单晓辉. 赤霉素代谢调控与绿色革命. 生物技术通报, 38(2): 195–204.
Li Y D, Shan X H. Regulation of gibberellin metabolism and the green revolution., 38(2): 195–204 (in Chinese with English abstract).
[8] Tian Z, Wang X, Lee R, Li Y, Specht J E, Nelson R L, McClean P E, Qiu L, Ma J. Artificial selection for determinate growth habit in soybean., 2010, 107: 8563–8568.
[9] Liu B, Watanabe S, Uchiyama T, Kong F, Kanazawa A, Xia Z, Nagamatsu A, Arai M, Yamada T, Kitamura K, Masuta C, Harada K, Abe J. The soybean stem growth habit gene Dt1 is an ortholog ofTERMINAL FLOWER1., 2010, 153: 198–210.
[10] 张久坤, 齐阳阳, 李立竹, 宁哓霜, 刘志华, 姜振峰, 李文滨. 利用BSA法定位大豆全基因组株高QTL及关键候选基因分析.华北农学报, 2020, 35(增刊1): 1–10.
Zhang J K, Qi Y Y , Li L Z , Ning X S, Liu Z H , Jiang Z F , Li W B. Mapping soybean whole genome plant height QTL and key candidate gene analysis using BSA method., 2020, 35(S1): 1–10 (in Chinese with English abstract).
[11] 于春淼, 张勇, 王好让, 杨兴勇, 董全中, 薛红, 张明明, 李微微, 王磊, 胡凯凤, 谷勇哲, 邱丽娟. 栽培大豆×半野生大豆高密度遗传图谱构建及株高QTL定位. 作物学报, 2022, 48: 1091–1102.
Yu C M, Zhang Y, Wang H R, Yang X Y, Dong Q Z, Xue H, Zhang M M , Li W W, Wang L, Hu K F, Gu Y Z, Qiu L J. High-density genetic map construction of cultivated soybean × semi-wild soybean and QTL mapping of plant height., 2022, 48: 1091–1102 (in Chinese with English abstract).
[12] Chen L Y, Nan H Y, Kong L P, Yue L, Yang H, Zhao Q S, Li H Y, Cheng Q, Lu S J, Kong F J, Liu B H, Dong L D. Soybean AP1 homologs control flowering time and plant height., 2020, 62: 1868–1879.
[13] Yang X, Li X, Shan J M, Li Y H, Zhang Y T, Wang Y H, Li W B, Zhao L. Overexpression ofaccelerates the transition to flowering and increases plant height in soybean., 2021, 12: 667242.
[14] Li Z F, Guo Y, Ou L, Hong H L, Wang J, Liu Z X, Guo B F, Zhang L J, Qiu L J. Identification of the dwarf genein soybean (L.) by combining mapping-by- sequencing and linkage analysis., 2018, 131: 1001–1016.
[15] Cheng Q, Dong L D, Su T, Li T Y, Gan Z R, Nan H Y, Lu S L, Fang C, Kong L P, Li H Y, Hou Z H, Kou K, Tang Y, Lin X Y, Zhao X H, Chen L Y, Liu B H, Kong F J. CRISPR/Cas9- mediated targeted mutagenesis ofgenes alters plant height and internode length in soybean., 2019, 19: 562–572.
[16] Yamaguchi S. Gibberellin metabolism and its regulation., 2008, 59: 225–251.
[17] Radley M. Comparison of endogenous gibberellins and response to applied gibberellin of some dwarf and tall wheat cultivars., 1970, 92: 292–300.
[18] Spielmeyer W, Ellis M H, Chandler P M. Semi-dwarf (), “green revolution” rice, contains a defective gibberellin 20-oxidase gene., 2002, 99: 9043–9048.
[19] Van De Velde K, Ruelens P, Geuten K, Rohde A, Van Der Straeten D. Exploiting DELLA signaling in cereals., 2017, 22: 880–893.
[20] Ueguchi-Tanaka M, Ashikari M, Nakajima M, Itoh H, Katoh E, Kobayashi M, Chow T Y, Hsing Y I, Kitano H, Yamaguchi I, Matsuoka M. GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellin., 2005, 437: 693–698.
[21] Harberd N P, Belfield E, Yasumura Y. The angiosperm gibberellin-GID1-DELLA growth regulatory mechanism: how an “inhibitor of an inhibitor” enables flexible response to fluctuating environments., 2009, 21: 1328–1339.
[22] Franklin K A, Whitelam G C. Phytochromes and shade-avoidance responses in plants., 2005, 96: 169–175.
[23] Liu W G, Jiang T, Zhou X R, Yang W Y. Characteristics of expansins in soybean internodes and responses to shade stress., 2011, 3: 26–34.
[24] 王一, 杨文钰, 张霞, 雍太文, 刘卫国, 苏本营.不同生育时期遮阴对大豆形态性状和产量的影响. 作物学报, 2013, 39: 1871–1879.
Wang Y, Yang W Y, Zhang X, Yong T W, Liu W G, Sun B Y. The effect of shading at different growth periods on the morphological characters and yield of soybean., 2013, 39: 1871–1879 (in Chinese with English abstract).
[25] Cooper R L. Development of short-statured soybean cultivars 1., 1981, 21: 27–131.
[26] Cooper R L. Breeding semidwarf soybeans., 1985, 3: 89–311.
[27] 姜振峰, 赵彩桐, 李佳男, 孙士祥, 刘志华, 李文滨. 不同生长习性大豆株高形成规律分析. 东北农业大学学报, 2019, 50: 33–42.
Jiang Z F, Zhao C T, Li J N, Sun S X, Liu Z H, Li W B. Analysis on the formation law of soybean plant height with different growth habits., 2019, 50: 33–42 (in Chinese with English abstract).
[28] 任梦露, 刘卫国, 刘婷, 杜勇利, 邓榆川, 邹俊林, 袁晋, 杨文钰. 荫蔽胁迫下大豆茎秆形态建成的转录组分析. 作物学报, 2016, 42: 1319–1331.
Ren M L, Liu W G, Liu T, Du Y L, Deng Y C, Zou J L, Yuan J, Yang W Y. Transcriptome analysis of soybean stalk morphogenesis under shade stress., 2016, 42: 1319–1331 (in Chinese with English abstract).
[29] Liu Y, Du H, Li P, Shen Y, Peng H, Liu S, Zhou G, Zhang H, Liu Z, Shi Miao, Huang X, Li Y, Zhang M, Wang Z, Zhu B, Han B, Liang C, Tian Z. Pan-genome of wild and cultivated soybeans., 2020,182: 1–15.
[30] 吴其林, 王竹, 杨文钰. 苗期遮荫对大豆茎秆形态和物质积累的影响. 大豆科学, 2007, 26: 868–872.
Wu Q L, Wang Z, Yang W Y. Effect of shading in seedling stage on soybean stalk morphology and substance accumulation.2007, 26: 868–872 (in Chinese with English abstract).
[31] Liu C, Zheng S, Gui J, Fu C, Yu H, Song D, Shen J, Qin P, Liu X, Han B, Yang Y, Li L. Shortened basal internodes encodes a gibberellin 2-oxidase and contributes to lodging resistance in rice., 2018, 11: 288–299.
[32] Lyu X, Cheng Q, Qin C, Li Y, Xu X, Ji R, Mu R, Li H, Zhao T, Liu J, Zhou Y, Li H, Yang G, Chen Q, Liu B. GmCRY1s modulate gibberellin metabolism to regulate soybean shade avoidance in response to reduced blue light.2021, 14: 298–314.
[33] Yu Z, Duan X, Luo L, Dai S, Ding Z, Xia G. How plant hormones mediate salt stress responses., 2020, 25: 1117–1130.
[34] Jiang B, Shi Y, Peng Y, Dong X, Li H, Dong J, Li J, Gong Z, Thomashow M F, Yang S. Cold-induced CBF-PIF3 interaction enhances freezing tolerance by stabilizing the phyB thermosensor in., 2020, 13: 894–906.
[35] Shi Y, Ding Y, Yang S. Molecular regulation of CBF signaling in cold acclimation., 2018, 23: 623–637.
[36] Jiang B, Shi Y, Zhang X, Xin X, Yang S. PIF3 is a negative regulator of the CBF pathway and freezing tolerance in., 2017, 114: E66695–E6702.
Analysis of key genes involved in GA pathway responding to temperature and exogenous GA related to internode development in soybean
QI Yang-Yang, DOU Ru-Na, ZHAO Cai-Tong, ZHANG Zhi, LI Wen-Bin, and JIANG Zhen-Feng*
Northeast Agricultural University, Key Laboratory of Soybean Biology in Chinese Ministry of Education / Key Laboratory of Soybean Biology and Genetics Breeding of Ministry of Agriculture and Rural Affairs, Harbin 150030, Heilongjiang, China
The objective of this study is to explore the effects of temperature and exogenous GA on the development of soybean internode and the key genes related to gibberellin (GA) signal transduction pathway. The soybean variety ‘Charleston’ was grown in chambers or in pots under outdoor condition, and subjected to the treatments with different temperature and concentration of GA solutions. Phenotype observation, section with hand, LC-MS analysis, and RNA-seq experiments were performed to investigate the internode changes and the genes involved in the GA signal transduction pathway. Different temperature and exogenous GA all induced the internode elongation and the longer the length increased, the slender the internode became. Exogenous GA had an evident elongating effect on the cell length of the internode despite of no effect on the cell width. The internodes grown in 30℃ growth condition were longer than those in 25℃ growth condition. GA2-oxidase, GA19, GA53, GA20, and bioactive GA3 were detected in the elongation zone of soybean internode, suggesting that GA2-oxidase might play an important role in the developmental process of soybean internode. Tissue-specific genes in DELLA, GAI, and PIF gene families could be identified and facilitate the gene selection to regulate the internode growth and plant height from GA signal transduction pathway. Soybean internode was regulated by temperature and exogenous GA. From GA53 to GA19 to GA20 and ultimately to GA3 was an important GA synthesis pathway. GA2-oxidase played an important role on the internode development of soybean. The GA-GID1-DELLA complex was expressed specifically in soybean internode. The candidate genes related to the internode development could be filtered from GID1 and DELLA gene family.
soybean; internode development; GA pathway; GA-GID1-DELLA
10.3724/SP.J.1006.2023.24007
本研究由国家自然科学基金项目(31571693, 32172072), 财政部和农业农村部国家现代农业产业技术体系建设专项(大豆, 重点任务) (CARS-04-04B)和黑龙江省自然科学基金项目(LH2021C025)资助。
This study was supported by the National Natural Science Foundation of China (31571693, 32172072), the China Agriculture Research System of MOF and MARA (Soybean, Key Task) (CARS-04-04B), and the Natural Science Foundation of Heilongjiang Province (LH2021C025).
通信作者(Corresponding author):姜振峰, E-mail: jzhf@neau.edu.cn
E-mail: qyy2022@126.com
2022-01-04;
2022-03-25;
2022-04-20.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220418.1629.034.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
