CRISPR-Cas9基因编辑技术在肿瘤治疗中的研究进展
2023-01-11丁弈丹
丁弈丹,陈 晨
(中国医科大学 a.中国医科大学-贝尔法斯特女王大学联合学院;b.生命科学学院,医学基因组学教研室,国家卫健委细胞生物学重点实验室,教育部医学细胞生物学重点实验室,沈阳 110122)
CRISPR-Cas9基因编辑系统起源于细菌免疫系统,可利用单链向导RNA(single guide RNA,sgRNA)序列和Cas9内切酶进行基因编辑,是一种基于RNA引导核酸内切酶的新型基因组编辑技术[1]。其中,sgRNA由CRISPR RNA(crRNA)和反向活化CRISPR RNA (trans-activating CRISPR RNA,tracrRNA)组成,可结合Cas9蛋白并引导其结合至目标DNA分子上,然后激活Cas9核酸内切酶活性并切割DNA分子制造双链断裂(double-strand breaks,DSB)。细胞在DNA修复过程中通过碱基插入、删除或替换等方式编辑DNA分子,从而将基因敲入或敲除。此外,将Cas9蛋白的核酸酶结构域进行失活改造形成的dCas9可在gRNA引导下结合靶基因,但不具备切割DNA的功能。dCas9可以与转录调节因子形成融合蛋白,将转录激活/抑制因子带到靶基因的启动子区域、调控区域或编码区,实现基因抑制/激活,甚至多重编辑、功能基因组筛选等。因此,除可定向编辑基因组外,CRISPR-Cas9的功能易于扩展,极具应用前景[2-3]。近年来,CRISPR-Cas9技术广泛应用于植物、酵母、秀丽隐杆线虫、果蝇、斑马鱼、小鼠等多种模式生物的基因编辑试验中[4-7]。
癌症是最普遍的致命疾病之一,目前治疗方式主要为手术、化疗、放疗和免疫治疗这四种疗法。恶性肿瘤组织积累了大量基因突变,甚至改变了整个基因组的表观遗传系统。CRISPR-Cas9系统作为广泛使用的基因编辑技术,可有效调节基因表达或纠正基因突变,对于癌症的治疗极具研究和临床应用价值。
早在2016年,CRISPR-Cas9基因编辑技术实现了首次肿瘤治疗的临床应用,将基因编辑后的免疫细胞移植给了一名肺癌晚期患者[8]。2020年,一种名为极快CRISPR(very fast CRISPR,vfCRISPR)的技术诞生,其能够在亚微米和亚秒级实现DSB,在空间、时间和基因组坐标上助力高精度DNA修复的研究[9]。目前,CRISPR-Cas9技术已通过美国国立卫生研究院(National Institutes of Health,NIH)重组DNA咨询委员会批准,在美国进入临床试验[10]。该委员会允许通过NIH招募患者,利用CRISPR技术进行T细胞辅助癌症治疗[11]。类似的基因治疗临床试验在我国也获得了伦理批准[12]。大量临床试验的开展有望建立一种有效的治疗性基因组编辑系统,以应对人类恶性肿瘤。因此,CRISPR基因编辑技术在临床治疗,尤其是癌症治疗上充满前景。本文介绍了CRISPR-Cas9基因编辑系统及其优势,并综述了该系统在抗肿瘤药物开发、肿瘤免疫治疗中的研究及应用进展。
1 CRISPR-Cas9基因编辑系统
1.1 CRISPR-Cas9基因编辑系统的分类
CRISPR-Cas系统与病毒的持续斗争使cas基因得以快速进化[13],这直接导致了CRISPR-Cas系统的多样性,因此很难根据单一标准对其进行分类。2015年,研究人员提出整合“多学科”的分类方法,从特征Cas蛋白、Cas操纵子的组成和Cas蛋白系统发育的角度进行分类。CRISPR-Cas系统的多样性研究在近几年也取得了重大进展。现在已知的CRISPR-Cas系统分为 2个大类,6种类型,33个子亚型,详见表1。

表1 CRISPR-Cas系统的分类及特征 [18-22]Tab.1 Overview of CRISPR-Cas classification and characteristics [18-22]
天然存在的CRISPR系统分为“1类”和“2类”系统[14],其主要区别在于切割DNA或RNA的效应子模块是否具有多亚基复合物。在1类系统(包括I、III、IV型)中,效应器由多个具有不同功能的蛋白质形成的复合物组成,即效应子复合物;而2类系统(包括II、V、VI型)通常依靠单一蛋白执行效应子复合物的所有功能。2类CRISPR系统仅包含单一的功能蛋白,故它是研究靶向DNA或RNA的首选对象。大多2类系统(如II型Cas9和V型Cpf1/Cas12a)已被用于基因编辑,其中,II型Cas9系统被认为是CRISPR-Cas系统的原型,如化脓性链球菌的CRISPR-Cas9系统,目前其生物学机制已基本被研究清楚[15]。
CRISPR系统广泛分布于古细菌(87%)和细菌(50%)的基因中,其中以1类系统最为常见(90%)[16]。区分CRISPR-Cas系统的类型和亚型主要根据的是Cas蛋白和Cas操纵子之间的关系,Cas1和Cas2几乎存在于所有不同类型的CRISPRCas系统中,而Cas3、Cas9和Cas10等特征基因分别对应I、II和III型CRISPR-Cas系统[17]。
1.2 CRISPR-Cas9基因编辑系统的作用机制
CRISPR-Cas9系统的作用机制包括三个阶段:捕获、转录和干扰(图1)[14,23]。在适应阶段,噬菌体入侵、感染原核生物后,其DNA片段“protospacers”被整合到CRISPR基因座的重复序列之间。在转录阶段,CRISPR位点的间隔区在RNA聚合酶的作用下,转录产生CRISPR RNA前体(pre-crRNA),然后pre-crRNA被裂解产生成熟crRNA[24],随后,CRISPR基因座上游的tracrRNA被转录,接着tracrRNA/crRNA复合物被装载至Cas9蛋白上,形成活性核糖核蛋白(active ribonucleoprotein,RNP)复合物。在干扰阶段,当crRNA与其互补序列结合时,RNP复合物被装载至外源DNA上,双链RNA引导Cas9蛋白在DNA上与crRNA间隔序列互补的位点剪切DNA分子,造成DNA DSB[25]。
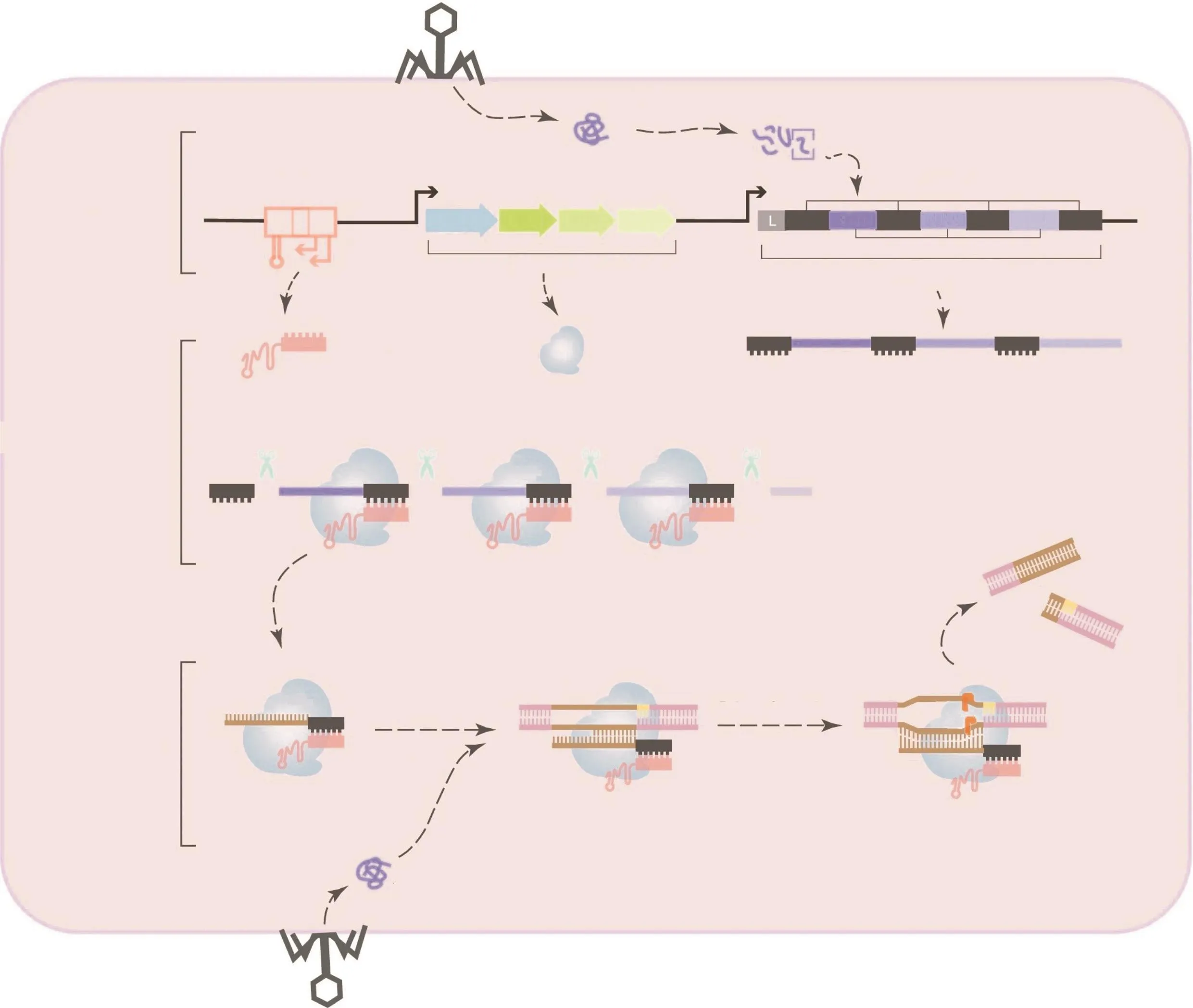
图1 II型CRISPR-Cas9系统的作用机制[23]Fig.1 Mechanism of type II CRISPR-Cas9 system [23]
1.3 CRISPR-Cas9基因编辑系统的优势
作为对抗人类疾病的疗法,基因组编辑技术早已引起广泛关注,主要包括三大类:锌指结构核酸酶(zinc finger nucleases,ZFNs)、转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALENs)和CRISPR-Cas9技术。以上方法均可进行位点特异性基因编辑。ZFNs由非特异性FokI内切酶结构域和锌指蛋白域(zinc finger proteins,ZFP)组成。实现DSB需要成对的ZFNs,且ZFNs只能识别DNA中的核苷酸三联体,导致其结合位点有限。TALENs由转录激活因子样效应子(transcription activator-like effectors,TALEs)和FokI内切酶结构域组成,对DNA序列的识别达到一个重复单元结合一个碱基的程度。由于可以识别单个核苷酸且特异性更高,TALENs比ZFNs更具临床研究价值,但TALENs也因其较大尺寸难以被包装和递送[26]。
CRISPR-Cas9是一种天然存在的RNA引导的核酸内切酶,现已作为一种工具应用于现代分子生物学。该系统与ZFNs和TALENs的一个关键区别在于,后两者是基于蛋白质和DNA结合的,而CRISPR-Cas9系统可使用短RNA序列作为特异性元件来驱动目标位点处DSB的形成。因此,CRISPR-Cas9的应用避免了蛋白质工程开发针对特定DNA靶序列的位点特异性核酸酶的需要,只需要合成一段新的RNA[27]。这使得CRISPR-Cas9基因编辑技术与ZFNs和TALENs相比具有多种优势。首先,CRISPR-Cas9成本更低。其次,CRISPR-Cas9的目标定位取决于核糖核苷酸复合物,与基于蛋白质和DNA结合的ZFNs和TALENs相比,特异性更强。此外,CRISPR-Cas9功能多样且易于扩展,针对目标DNA设计sgRNA相对容易,也能更改编码sgRNA和Cas9的质粒DNA、sgRNA和Cas9 mRNA的组合以及sgRNA和Cas9蛋白的组合;CRISPR-Cas9还可在胚胎中直接进行基因组修饰,可同时引入多个突变[28],也能实现由CRISPR-Cas9与胞苷脱氨酶结合介导的单碱基突变(即胞苷转化为尿嘧啶或鸟嘌呤转化为腺嘌呤)[29]。由此可见,CRISPR-Cas9技术的临床应用更为广泛和易于实现。
2 CRISPR-Cas9基因编辑系统在抗肿瘤药物开发中的研究进展
2.1 利用CRISPR-Cas9系统筛选药物靶标的功能基因
CRISPR系统作为一种高通量基因筛选工具,可在全基因组范围内筛选对表型发挥重要作用的基因[30],可同时分析数百或数千个遗传元件,包括蛋白质编码基因、miRNA、长非编码RNA基因或增强子[26,31-33],已被用于分析与癌症相关的基因以及生物学通路[34]。CRISPR系统在筛选时,若sgRNA靶向基因组中所有遗传元件,则称为全基因组筛选;若仅针对癌基因、肿瘤抑制基因、血管生成基因、转移基因或干性基因等遗传元件,则称为亚基因组筛选。
Cas9核酸酶通过特定的sgRNA将DSB引入组成型外显子,以实现突变。非同源末端连接(nonhomologous end joining,NHEJ)的不完全修复通常会导致DSB位点插入或缺失,从而使sgRNA靶位点突变,并导致基因失活[35]。高通量筛选主要包括两种形式:混合文库筛选(pooled screening)与芯片文库筛选(arrayed screening)。前者将单个或数个基因编辑序列已知的sgRNA列于芯片或多孔板中进行处理;后者则利用计算机设计待筛选sgRNA文库并富集阳性克隆,随后转至宿主细胞以引入各种基因突变,最终通过高通量测序等方法获得结果。相比之下,混合筛选具有成本低、操作简单、可用于体内研究等优势。
CRISPR全基因组筛选法使研究人员能够对整个基因组进行筛选,为药物靶点开发开辟了新的方法[36]。其基本原理为:首先,将Cas9表达盒整合到sgRNA或利用单独质粒来表达Cas9;然后,将sgRNA克隆到慢病毒(lentiviruses,LV)载体中,并用LV感染待检测细胞。sgRNA表达元件可以稳定地整合到基因组上,有效地为每个细胞提供标识,因而可以对混合细胞池进行加药后筛选。利用二代测序(next generation sequencing,NGS)检测LV感染的细胞中sgRNA的表达量,根据sgRNA的相对丰度值可以很容易地从混合细胞池中识别出被富集或被消减的sgRNA,以此确定基因型与药物之间的关系。单细胞CRISPR筛选还能与转录组(RNA-seq)或开放染色质测序(ATAC-seq)相结合,用来破译RNA或染色质与干扰相关的变化[37-39]。
近年来,学者们利用CRISPR筛选系统,在多个肿瘤发生的相关过程中(包括原发性肿瘤生长、耐药性、上皮间质转化、癌症干性、代谢适应、转移等过程)鉴定了标志基因[40-42]。CRISPR全基因组筛选也能用于筛选不同癌症中突变基因及其对应的合成致死基因[43-44]。目前,研究人员已设计出多个Cas12a突变体,并优化了Cas12a和crRNA表达盒,明显增强了其遗传筛选性能[45]。此外,CRISPRa和CRISPRi也可用于全基因组或亚基因组筛选。迄今为止,大多CRISPR筛选已成功用于体外或体内移植模型,利用患者衍生类器官(patient derived organoids,PDO)和人源肿瘤组织异种移植(patient derived xenografts,PDX)模拟患者对治疗方案的特异性反应、转移异质性,从而识别个体化的药物靶点。
2.2 CRISPR-Cas9的递送系统
在利用CRISPR-Cas9系统进行药物靶标基因筛选的过程中,Cas9和sgRNA的递送是决定筛选效率的关键。本文对病毒载体和非病毒载体进行了综述和比较。
2.2.1 病毒载体
利用重组病毒载体可将外源遗传物质转移到细胞中,进而将治疗基因递送至患病组织。在众多病毒载体中,腺相关病毒(adeno-associated virus,AAV)、LV和腺病毒在基因组编辑治疗中发挥着重要作用,已广泛用于临床前模型和临床试验。虽然病毒载体不会引起严重的人类疾病,但其诱导的免疫反应会降低递送效率。此外,病毒载体在将DNA整合到宿主基因组时可能发生脱靶效应和基因突变。上述几种病毒载体的优缺点见表2。
腺病毒是一种双链DNA病毒,直径为80~100 nm,基因组长度为 34~43 kb,最大可装载约 8 kb的外源DNA。目前,随着技术的不断进步,研究者们已研制出不含病毒基因组、可装载37 kb目标DNA的腺病毒载体。腺病毒感染时,其基因组不会整合到宿主细胞的基因组中,因此减少了脱靶效应和插入突变[46]。然而,由于病毒的致病性,腺病毒载体可触发人体的免疫反应,引起中和抗体反应,对随后的载体递送产生不利影响。因此,降低宿主对腺病毒载体的免疫反应可大幅提高该载体的安全性和递送效率。目前,腺病毒载体介导的CRISPR-Cas9基因编辑已应用于若干人类癌症的基因修饰小鼠模型(genetically engineered mouse model,GEMM),包括非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)小鼠模型中Pten基因编辑[47]和染色体重排导致的Eml4-Alk融合癌基因驱动的肺癌小鼠模型等[48]。
AAV由直径约为26 nm的二十面体蛋白外壳和长度约为4.7 kb的单链DNA组成[49]。AAV载体有许多优点,如无致病性、有长期基因表达的能力、感染分裂和非分裂细胞的能力。但AAV用于体内递送CRISPR-Cas9时仍存在缺陷:1)理想AAV的矢量大小为4.1~4.9 kb,尽管AAV可以装载大于其基因组大小的载体,但效率会急剧下降[39],因此,AAV通常不适用于递送大基因序列;2)抗AAV的中和抗体在大多数人群中普遍存在,这会降低治疗效果[50];3)由于Cas9核酸酶的持续表达可能导致脱靶效应,AAV的长期转基因表达存在风险[51]。尽管AAV的量产和应用存在困难,但是研究人员仍在不断探索AAV介导的CRISPR递送。目前,AAV双载系统已成功靶向小鼠大脑中的单个基因或多个基因,并表征基因组修饰对神经元的影响,说明AAV介导的基因组编辑可用于脑内的基因功能研究。此外,AAV介导的基因组编辑也可用于构建癌症动物模型[52],如Platt等[53]通过将单个AAV载体递送到Cas9敲入小鼠体内,诱导p53、LKB1和KRASG12D突变,导致腺癌。
LV属于逆转录病毒家族,含有一个7~12 kb的单链RNA。LV载体可有效转导各种细胞类型,并缩短细胞转染所需的培养时间。与腺病毒或AAV载体相比,LV的细胞毒性和免疫原性较低,且对转导细胞的影响很小[54],有望用作体内递送系统。LV通常将其基因组整合到宿主基因组中,具有较长的转基因表达时间,但是持续表达的Cas9可能会增加脱靶概率,影响高精度基因组编辑[55]。目前,美国食品和药物管理局(Food and Drug Administration,FDA)和欧洲药品管理局已经批准使用LV[56]。
2.2.2 非病毒载体
病毒载体应用于临床的主要瓶颈是安全问题。非病毒载体因其低免疫原性、高生物相容性、高传递性和低生产成本,被探索作为替代方案用于癌症治疗(表2)。

表2 CRISPR-Cas9递送系统的优缺点比较 [23]Tab.2 Advantages and disadvantages of CRISPR-Cas9 delivery systems[23]
脂质纳米颗粒(lipid nanoparticles,LNPs)是由多种疏水性和亲水性成分组成的两性系统,如阳离子、电离脂质、中性脂质(如磷脂或胆固醇)、聚乙二醇等。LNPs作为载体在核酸递送方面具有独特的优势:1)核酸在细胞携带大量阴离子,极不稳定,不易通过细胞膜,所以经阳离子脂质体包裹后可轻易递送到细胞中;2)与传统药物治疗相比,LNPs可防止药物降解、实现靶向给药、降低药物毒性等[57]。临床前试验表明,LNPs可成功递送siRNA与mRNA[58]。2020年,有研究通过在传统LNPs的基础上添补成分,发明了一种选择性器官靶向(selective organ targeting,SORT)策略,可精确改变体内RNA传递的概况并介导组织特异性基因编辑[59]。此策略可使纳米粒子把基因编辑系统传递到特定器官,有望促进基因疗法的发展。
聚合纳米粒子作为高分子材料,具有血液循环时间长、生物利用度高、生物相容性好、可降解等优点。Cas9核糖核蛋白复合体(ribonucleoprotein complex, RNP)是递送sgRNA的传统方法,效率低下,并且易被细胞中的蛋白酶分解。因此,利用由核心蛋白和聚合外壳组成的人工纳米胶囊,可将蛋白质高效递送到细胞中,这为sgRNA的递送和癌症治疗开辟了新途径[60]。2019年,有学者在Cas9 RNP复合物外层合成了谷胱甘肽可裂解共价交联聚合物涂层,随后Cas9 RNP被成功递送至293 T细胞和结直肠癌细胞,表现出较高的基因组编辑活性[61]。多项研究表明,聚合物纳米颗粒在CRISPR基因组编辑精准治疗癌症方面具有广阔的前景。
纳米金(gold nanoparticles,GNPs)具有生物相容性,作为CRISPR-Cas9递送载体可与核酸、脂质或聚合物等多种成分结合,渗透到多种类型的细胞中[62]。调整GNPs的大小、形状、电荷和表面改性可控制GNPs的药代动力学[63]。GNPs在配备Cas9蛋白和sgRNA后,可实现约90%的细胞内递送和约30%的基因编辑,为基因组学研究提供了新方法[26]。但是,GNPs具有免疫刺激作用,其与免疫细胞表面各种受体的相互作用主要取决于表面改性[64]。此外,颗粒表面的电荷和静电场同样会影响免疫反应。因此,GNPs与免疫系统相互作用的机制仍需进一步研究。
3 CRISPR-Cas9基因编辑系统在肿瘤过继性免疫治疗中的应用
传统的癌症治疗方法(例如:手术、放疗、化疗)往往伴随着肿瘤复发或耐药性导致的不良预后,且有明显的副作用,甚至导致死亡。免疫治疗作为第四种疗法,有望为癌症治疗带来革命性的变化[65]。
过继性免疫细胞治疗(adoptive T-cell therapy,ACT)利用自体或同种异体肿瘤特异性T细胞来抵御肿瘤细胞。一般情况下,首先从患者的外周血液中分离出T细胞,并在体外激活,然后通过基因工程表达转基因抗原受体,最后经修饰的T细胞在体外扩增,再输回患者体内。目前主要的两种ACT方法分别是嵌合抗原受体T细胞疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T)和T细胞受体T细胞疗法(T cell receptor T-Cell immunotherapy,TCR-T)。
3.1 CRISPR-Cas9基因编辑系统应用于CAR-T细胞疗法
嵌合抗原受体(chimeric antigen receptor,CAR)是一种重组抗原受体,可改变T淋巴细胞的特异性和功能,从而产生强大的抗肿瘤反应,通常由胞外抗原结合区、跨膜结构区和胞内信号转导区组成,具有一或两个共刺激结构域(图2a)[23,66]。
目前,大多数临床试验使用自体CAR-T细胞,即从患者体内分离的细胞,经过基因编辑表达CAR结构,体外扩增后输回患者体内。此方法不仅价格昂贵,而且患者T细胞的数量和质量可能会严重影响疗效[67]。另外,自体CAR-T细胞疗法的准备过程约为三周,一些急性白血病患者可能会在等待自体CAR-T细胞制备的过程中错失最佳的治疗时机[68]。相比之下,同种异体CAR-T细胞制备简单且成本较低,但存在移植物抗宿主病(graft-versus-host disease,GVHD)与宿主抗移植物反应 (host-versusgraft reaction,HVGR)的问题[69]。CRISPR系统可以提高CAR-T治疗效果。一方面,CRISPR系统编辑CAR-T细胞,即通过敲除内源性TCR位点、免疫检查点蛋白和主要组织相容性复合体I类分子产生通用CAR-T细胞,增强T细胞杀伤,避免GVHD,克服了HVGR,从而提高疗效[70];另一方面,CRISPR系统可引导CAR至TRAC基因座,避免CAR信号转导,并在细胞暴露于抗原后建立有效的CAR内化和重新表达,有效延缓效应T细胞的分化和衰竭[71]。这为利用CRISPR-Cas9提高CAR-T细胞治疗疗效指明了方向。
3.2 CRISPR-Cas9基因编辑系统应用于TCR-T细胞疗法
CAR-T细胞疗法在实体瘤中效果不佳的原因主要是缺乏肿瘤特异性抗原、肿瘤异质性和抑制性免疫肿瘤微环境(tumor micro-environment,TME)。与CAR相比,TCR除了识别细胞表面抗原外,还可以识别细胞内蛋白质。这不仅扩大了T细胞识别肿瘤抗原的范围,而且使TCR可以靶向癌症突变基因组[72]。由此可见,TCR-T细胞疗法具有对抗实体瘤的潜力,但仍面临肿瘤相关抗原(tumor-associated antigens,TAA)的高亲和力TCR的鉴定难题。此外,正常细胞TAA的表达也可能引起治疗相关的严重不良反应。因此,我们需要研发具有最小副作用的高增殖抗肿瘤活性的TCR-T细胞。
外源性TCR引入T细胞,引发的主要问题是:1)由于受体T细胞上存在内源性TCR,引入外源性TCR会形成TCR二聚体(图2b),其具有致病性,并阻碍转基因TCR(transgenic TCR,tgTCR)的表达[73];2)内源性TCR和tgTCR对CD3分子的竞争将进一步限制tgTCR复合物的表达,降低治疗效果,并诱发自身的免疫反应。为解决这些难题,有学者利用CRISPR-Cas9敲除了T细胞中内源性TCR-β,发现可显著增加tgTCR的表达(图2b)及工程T细胞对靶癌细胞的杀伤作用。与标准TCR转导T细胞相比,CRISPR修饰T细胞对抗原的敏感度提高了1 000倍[74]。增加tgTCR的表达可增强T细胞对肿瘤抗原的识别,并抑制多发性骨髓瘤的生长[75]。2020年,第一个I期人体临床试验报道称,为了减少TCR错配并改善抗肿瘤免疫反应,学者利用多重CRISPR-Cas9编辑靶向T细胞中的TRAC、TRBC和PDCD1,并引入合成的癌症特异性TCR转基因(NYESO-1)来识别肿瘤细胞,结果发现,工程T细胞在注入患者体内后可持续存在长达9个月。这初步表明,结合TCR转移和基因组编辑技术有望开发出更有效、更安全的癌症免疫疗法[76]。
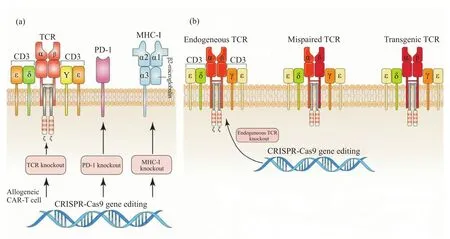
图2 CARs、TCR二聚体的结构及CRISPR-Cas9在CAR-T、TCR-T细胞治疗中的应用[23]Fig.2 The structure of CARs and mixed TCR dimers and the application of CRISPR-Cas9 in CAR-T and TCR-T cell therapy[23]
4 总结与展望
CRISPR系统作为基因编辑工具,为生命科学带来了革命性的变化,为生物系统和人类疾病研究提供了新的强大的工具。在肿瘤机制研究、药物靶点筛选和临床治疗等肿瘤基础和转化医学研究领域中,CRISPR-Cas9基因编辑技术的应用潜力逐步显现[77],但是也存在一定的局限性。
首先,在持续表达Cas9的人类细胞培养物中,脱靶效应很常见[78],但这种情况在体内模型中不太常见。细胞培养物中的脱靶效应高可能是受多种因素变异的影响,如细胞类型、表达水平、转染方法、细胞培养维持、连续核酸酶表达、引导序列、修复事件等。脱靶效应主要由sgRNA导致,因此,sgRNA的合理设计对CRISPR-Cas9基因编辑技术的有效性至关重要。sgRNA诱导DSBs后的修复机制或基因组重排也是CRISPR-Cas9治疗干预中的风险点。虽然CRISPR-Cas9技术可诱导基因组序列的定向突变,但我们对DNA修复机制知之甚少,并且控制方法有限。DSB的修复方式包括NHEJ和同源定向修复(homology-directed repair,HDR),前者容易出错,可能导致突变,后者虽更精确,但发生率非常低[79]。因此,实施CRISPR-Cas治疗方案时,提高HDR有效性并降低NHEJ是修复的关键,以确保基因编辑达到预期结果。
其次,CRISPR-Cas9基因编辑系统的临床转化结果具有不可预测性[80]。主要原因是:1)试验数据分析不足;2)由于大多数有丝分裂后高度分化的细胞只能在体内发挥作用,适用于体外编辑的细胞类型十分有限[81]。因此,在进入临床使用之前需要深入考虑这些局限性。
随着基因组编辑技术的进步,与CRISPR-Cas9治疗人类疾病相关的基因组编辑研究迅速发展。然而,将CRISPR-Cas9应用于危及生命的严重疾病患者仍是一项新兴技术,多数临床试验仅处于I/II期。到目前为止,临床试验一直在关注人类基因组编辑的安全性和有效性,以改善基因组编辑中涉及的分子过程。在人类早期胚胎基因组中,应用治疗性基因编辑技术的伦理争议正在发生改变,这表明科学界正在建立基因编辑法规。总之,CRISPRCas9为人类致命疾病的治疗提供了全新的角度。
