基于NF-κB荧光蛋白报告基因抗肿瘤药物筛选平台的建立
2023-01-11王瑞萍程浩杰黄明敏谭拥军
王瑞萍,程浩杰,余 雳,黄明敏,谭拥军
(湖南大学生物学院,长沙 410082)
近年来,随着恶性肿瘤的发病率逐渐增高[1],癌症成为仅次于心脑血管疾病致死率第二的“杀手”,使人类健康受到严重的危害,因此,抗肿瘤药物的研发迫在眉睫。据统计,目前国际上常见的临床抗肿瘤药物约80余种[2],大致可分为6类:细胞毒类药物[3]、激素类药物[4]、生物反应调节剂[5]、单克隆抗体药物[6]、其他类药物、辅助药。为提高新药的研发速度,降低癌症的死亡率,建立一种高效的药物筛选平台是很有必要的。
目前,药物筛选平台可分为3类:基于靶点的细胞模型[7]、基于表型的细胞模型[8]、抗病毒药物筛选的细胞模型[9]。其中,基于靶点的细胞模型是目前用于药物筛选的主要模型,根据靶点的不同可以分为4类:以受体为靶点的细胞模型、以通道为靶点的细胞模型、以信号通路为靶点的细胞模型、以报告基因和其他类型连用为靶点的细胞模型。事实上,前3种药物筛选细胞模型通常均是与报告基因联用建立起来的,这样可以快速且直观地观察到药物作用于细胞后的变化。
常用的报告基因有5种,分别是荧光素酶(luciferase,Luc)[10]、 氯霉素乙酰转移酶(chloramphenicol acetyltransferase,CAT)[11]、 β-半乳糖苷酶(β-galactosidase,β-gal)[12]、 分泌性人胎盘碱性磷酸酶(secreted alkaline phos-phatase,SEAP)[13]和GFP[14]。这些报告基因在细胞内受到调控后表达量的改变可对应于它们的酶活性或发光强度的改变。对萤火虫荧光素酶和海参荧光素酶而言,检测利用的是它对底物的发光强度;对β-半乳糖苷酶报告基因而言,利用的是它催化底物后的显色反应;对于GFP等荧光蛋白而言,则利用的是它们被激活后特定波长的发光强度。在试验时可根据报告基因质粒的使用方便性、成本及现有条件进行选择。
这些报告基因的工作原理[15]是通过把已确定的顺式调控序列剪接到报告基因上来控制基因的活性。这些反应元件可以对宿主细胞中基因调控和表达的变化起反应,因此就可以直观地报道细胞内与基因表达有关的信号级联。
在细胞中,NF-κB的活性水平与肿瘤的发生发展密切相关[16]。如在乳腺癌、结肠癌、淋巴癌等癌症中,NF-κB的持续性激活可导致与细胞周期相关的蛋白活性异常,如周期蛋白D1(cyclinD1)、周期蛋白依赖激酶Cdk2(cyclin-dependent kinases)、c-myc等[17];其次,持续性激活的NF-κB能提高一些促进肿瘤生长的细胞因子水平,如IL-1β(急性白血病生长因子)、TNF(恶性淋巴肉芽肿瘤、T细胞淋巴癌、神经胶质瘤生长因子)、IL-6(多发性骨髓瘤的生长因子)[18];此外,在肿瘤细胞的生长和组织侵润过程中,NF-κB参与调节新血管生成的相关蛋白的基因表达,如血管内皮细胞生长因子(vascular endothelial growth factor,VEGF),持续性激活的NF-κB能增强VEGF基因的转录[19];最后,NF-κB的持续性激活也能导致细胞的抗凋亡,抵抗化疗药物的诱导凋亡作用[20]。因此,NF-κB是研究抗肿瘤药物的关键靶点之一[21]。
为了高效地筛选出以NF-κB为靶点的抗肿瘤药物,根据报告基因质粒的工作原理,本课题成功构建了pGL6-NF-κB-GFP报告基因质粒,用于指示细胞中NF-κB的转录活性水平,并且使用一线抗癌药物如雷帕霉素[22]、紫杉醇[23]、吉西他滨[24]及本实验室研究开发的多肽类药物M1-20[25]、M1-21[26],验证了该报告基因体系的有效性。
1 材料与方法
1.1 材料
HEK-293T细胞购自美国模式培养物保藏所(American Type Culture Collection,ATCC)。DH5α感受态、pGL6-Enhancer、金牌Mix、GFP抗体、Rabbit二抗购买于碧云天生物技术公司;BamH I、Hind III限制性内切酶购自Thermo fisher;T4 DNA Ligase 购自Ferments公司;PCR引物、1kb Marker购自北京擎科生物技术有限公司;DNA凝胶回收试剂盒、质粒小提试剂盒购自Omega;Dulbecco改良Eagle培养基(Dulbecco’s modified Eagle medium,DMEM)以及胎牛血清(fetal bovine serum,FBS)购自GIBCO公司。
1.2 方法
1.2.1 pGL6-NF-κB-GFP报告基因质粒的构建与鉴定
以实验室保存的pcDNA3.1-Flag-GFP质粒为模板扩增GFP基因。上游引物为AAGCTTATGGTGAGCAAGGGCGAGGA,下游引物为GGATCCTTACTTGTACAGCTCGTCCA。PCR反应体系(50 μL):上游引物 F 2 μL、下游引物 R 2 μL、模板 50 ng(1 μL)、金牌Mix 45 μL。扩增条件为98℃ 2 min、98℃ 10 s、65℃ 10 s、72℃ 10 s、72℃ 5 min,30个循环。将PCR扩增产物做胶回收,随后用BamH I和Hind III限制性内切酶对胶回收产物及pGL6-NF-κB-Luc质粒进行双酶切,用1%的琼脂糖凝胶电泳并回收目的片段,用T4 DNA连接酶22℃、2 h水浴连接,连接后的产物加入50 μL DH5α感受态进行转化、涂板、挑取单克隆、摇菌,送擎科生物有限公司测序,测序正确的菌液进行质粒小提。
1.2.2 报告基因质粒的转染与检测
HEK-293T细胞用体积分数为10%的FBS和1%青霉素-链霉素的DMEM培养基培养,待细胞长满培养皿后,传代到6 cm盘中;细胞密度达到80%~90%时,转染6 μg pGL6-NF-κB-GFP报告基因质粒;12 h后去除培养基,用1×磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗一遍细胞,更换新鲜培养基;待36~48 h后用荧光显微镜观察细胞拍照。然后收集细胞,加300 μL IP(immunol precipitation)细胞裂解液和3 μL蛋白酶抑制剂,冰上裂解20 min,15 000 r/min、4℃离心10 min,取上清,即为细胞中的蛋白;加入5×蛋白电泳上样缓冲液,于100℃金属浴中10 min进行蛋白变性,通过蛋白质印记(Western blot,WB)检测GFP蛋白。
1.2.3 细胞流式分析
将HEK-293T细胞接种于6 cm盘中,待细胞密度达到80%~90%时,转染pGL6-NF-κB-GFP报告基因质粒6 μg;12 h后换新鲜培养基,48 h后用0.5%的胰酶将细胞消化下来,用1×PBS清洗细胞2次,最后用500 μL的1×PBS重新悬浮细胞,用流式细胞仪上机检测表达GFP细胞的比例。
1.2.4 抗肿瘤药物的筛选
将HEK-293T细胞接种于6孔板中,待细胞密度达到80%~90%时,每孔转染pGL6-NF-κB-GFP报告基因质粒3 μg;12 h后换新鲜的培养基,同时,分别加入0.04 μmol的紫杉醇、0.02 μmol的吉西他滨、20 μmol的雷帕霉素、10 μmol的M1-20、10 μmol的M1-21处理细胞24 h,收集细胞进行流式检测,同时收集蛋白,通过WB检测细胞中GFP蛋白表达量的变化。
2 结果与分析
2.1 报告载体的调控模式
报告载体包括最基本的两个部分,即响应序列和报告基因。通过把已确定的顺式调控序列剪接到报告基因上来控制基因的活性,这些反应元件可以对宿主细胞中基因调控和表达的变化起反应,从而就可以直观地报道细胞内与基因表达有关的信号级联(图1)。

图1 报告基因载体工作模式图Fig.1 Shows a pattern of gene vector operation
2.2 NF-κB报告基因质粒的构建
pGL6-NF-κB-GFP报告基因质粒的构建是以pGL6-NF-κB-Luc为载体,酶切去除Luc基因,同时将GFP基因连接在响应序列之后。pGL6-NF-κBGFP报告基因质粒的调控模式及报告序列(图2a、2b)、质粒图谱(图2c)和单克隆测序结果(图2d)证明了质粒构建成功。
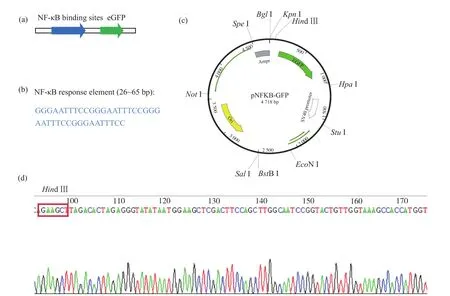
图2 报告基因质粒的构建Fig.2 Construction of the reporting gene plasmid
2.3 pGL6-NF-κB-GFP报告基因质粒的验证
在HEK-293T细胞中转染构建成功的pGL6-NF-κB-GFP报告基因质粒,48 h后在荧光显微镜下观察细胞(图3a),结果显示,细胞呈现绿色荧光,证明报告基因质粒在细胞内可正常表达。同时为进一步证明构建质粒的正确性,收取转染报告基因质粒的细胞蛋白做WB分析(图3b),通过抗体进一步证明GFP基因的表达及所构建的质粒在细胞内可以正常响应。最后,用流式细胞仪对转染的细胞进行定量分析(图3c),结果同样证明了报告基因质粒的正确性。

图3 报告基因质粒的验证Fig.3 Validation of the reported gene plasmid
2.4 pGL6-NF-κB-GFP报告基因体系响应抗肿瘤药物
为证明构建成功的pGL6-NF-κB-GFP报告基因质粒可以做为抗肿瘤药物筛选的工具,在体外培养的HEK-293T细胞中转染pGL6-NF-κB-GFP报告基因质粒,然后使用临床上常用的抗癌药物紫杉醇(0.04 μmol)、吉西他滨(0.02 μmol)、雷帕霉素(20 μmol)、M1-20(10 μmol)、M1-21(10 μmol)处理细胞,进行流式细胞分析(图4a)以及WB检测GFP蛋白的表达量(图4b),探究此类抗肿瘤药物对细胞中NF-κB转录活性的影响。其结果为紫杉醇、吉西他滨、雷帕霉素、M1-20、M1-21均抑制NF-κB的转录活性。该结果证明了报告基因体系可以正常响应抗肿瘤药物。
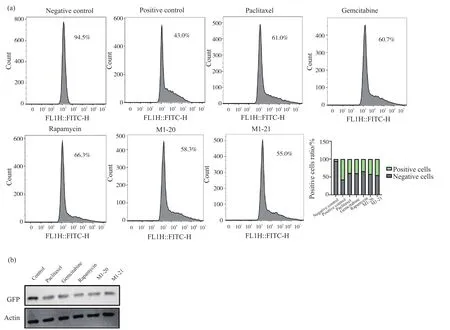
图4 抗肿瘤药物对NF-κB信号通路的影响Fig.4 Effects of antineoplastic drugs on the NF-κB signaling pathway
3 讨论
肿瘤是一种严重危害人类健康的疾病[27]。几十年来,人们一直在开发研究新的药物以期能有效抑制肿瘤的恶性增长。在研究过程中,寻找一种能快速筛选出有效的抗肿瘤药物的有效方法极为重要。现如今,常用的一些筛选体系可以分为生化筛选体系和细胞筛选体系两大类。基于细胞的筛选方法包括细胞活力(cell viability)、报告基因(reporter gene)、第二信使(second messenger)、高通量显微镜筛选(high-throughput microscopy assays)和基于CRISPR/Cas9系统的筛选。而基于报告基因建立的药物筛选平台,应用荧光或化学发光法对报告基因进行检测更简单、更灵敏。如Zlokarnik等[28]在进行转录定量和单一活细胞克隆筛选的研究中,用β内酰胺酶基因作为报告基因,在细胞株转染受体表达后,再转染构建好的NF-κB内酰胺酶质粒。报告基因的表达产物可以水解细胞内的一种跨膜脂蛋白,每一个酶分子可以催化很多底物分子的化学键断裂,从而改变底物分子的共振能。在哺乳动物细胞中,这种变化可以通过胞内颜色由绿到蓝的改变来探测到。报告基因可以实时检测细胞活动和生理化学物质的变化情况,并且具有实时性、可靠性等优点,因此,在植物基因工程、动物基因工程等中也被广泛应用。
用报告基因对候选药物进行筛选,其最大的优点在于整个筛选过程可以直接在存活细胞中进行,不必破碎细胞,报告基因表达的定性定量分析可以简单地通过胞内颜色的变化来探测。如采用不同药物处理细胞,根据报告基因质粒的表达情况判断药物分子对细胞的影响,从而筛选得到有效的药物,或者用同一药物分子处理细胞,检测不同报告基因质粒的表达,判断该药物对细胞中某些信号通路或关键基因表达的影响,进而高效地筛选出抗肿瘤药物。但是报告基因系统也存在一定的缺陷,如这种瞬时转染的方法不能建立稳定筛选的细胞株,每次筛选都要重新转染,此外,对一些难转染的细胞(如原代细胞、不分化的细胞等)会出现转染效率低下及浪费昂贵的转染试剂等问题。
在本文中,我们运用基因工程技术[29],基于pGL6-NF-κB-GFP报告基因质粒,建立了一个抗肿瘤药物筛选平台,并在分子及细胞水平上证明了报告基因体系可以响应药物对细胞的影响,从而实现对抗肿瘤药物的筛选。在之后的研究工作中,我们考虑将这些报告基因质粒构建为稳定的细胞株,建立完整的活细胞示踪体系,从而为研究抗肿瘤药物提供更好的技术体系。
