陆地棉株高相关基因GhGA20ox6 的克隆及功能初探
2023-01-06杨炳磊许好标李黎贝冯震刘林喻树迅
杨炳磊,许好标,李黎贝,冯震,刘林,喻树迅,4*
(1. 浙江农林大学林业与生物技术学院,杭州 311300;2. 浙江农林大学现代农学院,杭州 311300;3.江苏联发纺织股份有限公司,江苏南通 226000;4.中国农业科学院棉花研究所,河南安阳 455000)
赤霉素(Gibberellin,GA)作为植物六大激素之一,是一类四环双萜类植物激素,在植物的种子萌发、根冠伸长、茎伸长、叶片生长、开花结果等过程中都发挥重要作用[1-2]。 在高等植物中,多种酶参与了多步骤酶促反应的赤霉素生物合成和代谢过程,调控这些酶的编码基因能有效地调节赤霉素的合成代谢速率。 参与赤霉素合成代谢的酶有很多种, 其中GA2-氧化酶(GA2-oxidase,GA2ox)是植物GA 降解过程中的关键酶,可以将植物体内具有活性的GA、GA 前体及其中间产物分解失活,从而维持植物体内活性GA 的动态平衡[3-4]。GA3-氧化酶(GA3-oxidase,GA3ox)和GA20- 氧化酶(GA20-oxidase,GA20ox)作为植物活性赤霉素合成代谢途径中的关键酶,催化GA12和GA53转变为具有活性的GA1和GA4。 此外,GA3ox 和GA20ox 还受体内活性GA 的负反馈调节[5-7]。 在植物体内活性GA 信号转导中,赤霉素不敏感矮化基因GID1(gibberellin insensitive dwarf 1) 编码赤霉素受体, 与赤霉素结合使DELLA 蛋白聚集到SCFSLY1复合物上, 从而使DELLA 蛋白被泛素化降解, 激活下游的信号转导,影响植物的生长发育[8]。
植物赤霉素氧化酶家族属于2OG-Fe(Ⅱ)氧化酶亚家族[9-10]。 目前,对模式植物拟南芥(Arabidopsis thaliana) 赤霉素合成与代谢通路的研究已经比较深入,赤霉素代谢途径的相关基因已经被克隆鉴定[11-12]。 前人的研究表明,农作物绿色革命与赤霉素代谢途径的相关基因密切相关[13]。 在植物中,赤霉素能促进茎的伸长和植株增高。 在水稻中,沉默GA20ox 相关基因会影响水稻的茎秆长度,导致水稻出现矮化表型[14]。 Plackett 等[15]在拟南芥沉默GA20ox1、GA20ox2和GA20ox3,发现植株出现矮化现象, 生长发育受到影响。Mauriat 等[16]通过增强山杨幼苗赤霉素相关基因PttGID1.1和PttGID1.3的表达水平,发现这些基因可以促进幼苗体内的活性赤霉素的信号转导,从而促进山杨茎的伸长。 Boonkaew 等[17]对高、矮椰子树(Cocos nuciferaL.)中GA20ox同源基因CnGA20ox1和CnGA20ox2的表达量进行测定,发现在不同株高的植株中GA20ox基因表达量存在显著差异, 推断GA20ox基因影响植株高度。目前,在苹果[18]、荔波连蕊茶[19]、黄瓜[20]、大豆[21]等物种中也有关于赤霉素氧化酶基因的报道,表明GA20ox基因对植物的生长发育存在重要的影响。
株高是作物育种和栽培管理中重要的目标农艺性状之一。 植株过高易倒伏,从而使作物的产量降低; 适当矮化的植株有较强的抗倒伏能力,可提高作物群体的光能利用率,从而提高作物产量[22-24]。 陆地棉(Gossypium hirsutumL.)包含A、D 两个亚基因组,基因组序列已被公布[25-26],可以利用生物信息学方法来分析陆地棉基因的功能。 目前研究发现,棉花GA20ox相关基因能促进体内活性赤霉素GA 的生成,可调节棉花耐盐和耐旱性,并且调控纤维的起始和伸长[27-29],但对其在棉花株高发育中的作用的研究存在空缺。 因此,从分子水平上研究GA20ox 对陆地棉株高的影响具有重要的意义。 本研究从陆地棉标准系TM-1 中克隆到1 个株高相关的基因GhGA20ox6,检测其在陆地棉不同组织中的表达量,通过亚细胞定位、转基因拟南芥表型鉴定,初步分析其在棉花生长发育中的分子功能以及表达模式,为今后对该基因的功能研究及利用奠定基础。
1 材料与方法
1.1 植物材料与处理方式
陆地棉标准系TM-1 种植于浙江农林大学平山基地(杭州市临安区),选取根、茎、叶、顶芽、萼片、开花后30 d 的胚珠、花、雄蕊和雌蕊进行GhGA20ox6的组织特异性表达分析。
选用本氏烟 (Nicotiana benthamiana) 进行GhGA20ox6基因的瞬时表达分析, 材料种植于浙江农林大学人工气候室,环境条件:光照16 h/黑暗8 h,温度22 ℃,相对湿度为50%。
利用哥伦比亚型拟南芥进行遗传转化试验,材料种植于浙江农林大学人工气候室,气候室条件设置:温度25 ℃,光照16 h/ 黑暗8 h,相对湿度为50%。
1.2 载体与所用试剂
转基因表达载体pBI121、pBINGFP4 保存于本实验室。 从上海唯地生物有限公司购入大肠杆菌DH5α 感受态和农杆菌 (Agrobacterium tumefaciens)菌株GV3101 感受态。RNA 提取试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公 司。 载 体pMD18-T、MightyAmp 高 保 真 酶、PrimeScriptTMRT reagent Kit with gDNA Eraser 反转录试剂盒、DNA 片段纯化试剂盒和荧光试剂TB GreenPremix Ex TaqTMII 购 于Takara 公 司(中国大连)。 从上海源叶生物科技有限公司购入2- 吗啉乙磺酸、 乙酰丁香酮和1/2 MS 固体培养基,引物的合成及基因测序由杭州有康生物科技有限公司完成。 本研究所用引物序列见表1。

表1 本研究所用引物序列Table 1 Primer sequences used in this study
1.3 RNA 的提取及cDNA 的合成
使用RNAprep Pure 多糖多酚植物总RNA提取试剂盒提取1.1 中陆地棉TM-1 样品的RNA,通过反转录试剂盒进行反转录,合成cDNA。
1.4 陆地棉GhGA20ox6 基因的克隆
利用已公布的拟南芥和水稻GA20ox 的蛋白序列作为参照,从CottonFGD(https://cottonfgd.org/)下载陆地棉全基因组数据库,构建本地Blast 数据库,搜索得到13 个候选基因;根据已公布的陆地棉转录组数据库分析得到在茎中表达量较高的GhGA20ox6基因, 通过GhGA20ox6-F和GhGA20ox6-R 这对引物, 从TM-1 茎中扩增GhGA20ox6的编码序列, 将得到的片段连接到pMD18-T 载体, 重组质粒转化到大肠杆菌DH5α, 保存测序正确的单克隆菌液以供后续试验使用。
1.5 GhGA20ox6 的生物信息学分析
利用MEGA 5.0 软件,采用邻接法构建系统进化树[30],自展值设为1 000,其他参数为默认值。利用ExPASy[31](https://web.expasy.org/protparam/)在线分析网站预测GhGA20ox6 蛋白的理化性质,包括蛋白质序列的长度、等电点以及分子质量。 将目的基因编码的氨基酸序列利用DNA MAN 进行序列比对分析。 利用SMART 在线网站(https://smart.embl-heidelberg.de/)预测GhGA20ox6 的保守结构域。
1.6 GhGA20ox6 的表达分析
1.7 GhGA20ox6 蛋白的亚细胞定位
利用引物GhGA20ox6-SF 和GhGA20ox6-SR 将目的基因片段连接到带有绿色荧光蛋白(green fluorescence protein,GFP)基因的载体上,将构建好的过表达载体35S::GhGA20ox6-GFP转化农杆菌菌株GV3101。 根据本氏烟草瞬时转化法[32],将农杆菌菌液注射到培养20 d 的烟草叶片中,然后在黑暗条件下培养24 h,恢复光照继续培养48 h,在LSM880 共聚焦显微镜(蔡司公司,德国)下观察烟草叶片细胞中的GFP 信号[33]。
1.8 转基因拟南芥阳性植株筛选
将1.7 中的GV3101 农杆菌菌液在28 ℃下培养至600 nm 处的吸光值(OD600)为1.2~1.6,5 000 r·min-1离心10 min 收集菌体,利用0.02%(体积分数) 的Silwet-77 渗透液重悬至OD600为0.9,通过农杆菌蘸花法[34]侵染去掉结荚角果的拟南芥45~60 s,暗处理培养24 h,培养拟南芥至成熟,收获T0种子。 在超净工作台中,将种子种植于含有卡那霉素的1/2 MS 固体培养基上,放置于4 ℃培养箱春化48 h,然后取出放置于人工气候室(光照16 h/ 黑暗8 h),保证拟南芥正常生长,待到长出真叶后移栽到土壤。 生长2 周后提取DNA 检测阳性植株。重复上述种植操作,直至筛选到T3纯合单株, 选择3 个独立转基因株系L1、L2 和L3, 移苗后18 d 和30 d 对这3 个株系进行表型鉴定。 移苗后18 d,取转基因拟南芥茎部用于检测分析GhGA20ox6下游基因GID1a、GID1b和GID1c的表达。
2 结果与分析
2.1 GhGA20ox6 基因的序列分析
GhGA20ox6位于D 亚组9 号染色体上,开放阅读框长度为1 155 bp, 编码384 个氨基酸残基,包括2 个内含子和3 个外显子。 GhGA20ox6蛋白包含1 个DIOX_N 结构域(位于第63~172氨基酸)和1 个2OG-Fe(Ⅱ)氧化酶结构域(位于第228~323 氨基酸,图1)。利用ExPASy 在线软件预测GhGA20ox6 蛋白的分子质量为42.32 ku,等电点为6.37。 筛选鉴定出13 个陆地棉GhGA20ox基因,系统发育分析发现GhGA20ox6与GhGA20ox5、GhGA20ox8、GhGA20ox13所编码的氨基酸序列具有较高相似性,位于同一个分支上(图2)。对这13 个候选基因编码的氨基酸序列分析发现,其编码产物均有与GA 底物结合的高度保守基序LPWKET,其中7 个编码产物有与结合2- 酮戊二酸相关的保守基序NYYPXCQKP(图3)[35]。

图1 GhGA20ox6 结构域分析Fig. 1 Conserved domains of GhGA20ox6

图2 陆地棉、水稻和拟南芥GA20ox 的系统进化树Fig. 2 Phylogenetic tree of GA20ox in upland cotton, rice and A. thaliana

图3 13 个陆地棉GA20ox 的氨基酸序列比对分析Fig. 3 The amino acid sequences alignment of 13 GA20ox in upland cotton
2.2 GhGA20ox6 基因的空间表达模式分析
进一步研究GhGA20ox6的组织表达特异性发现,GhGA20ox6在茎中优势表达,而在胚珠与花中的表达量较低(图4),据此推测GhGA20ox6在茎的生长发育过程中发挥功能。
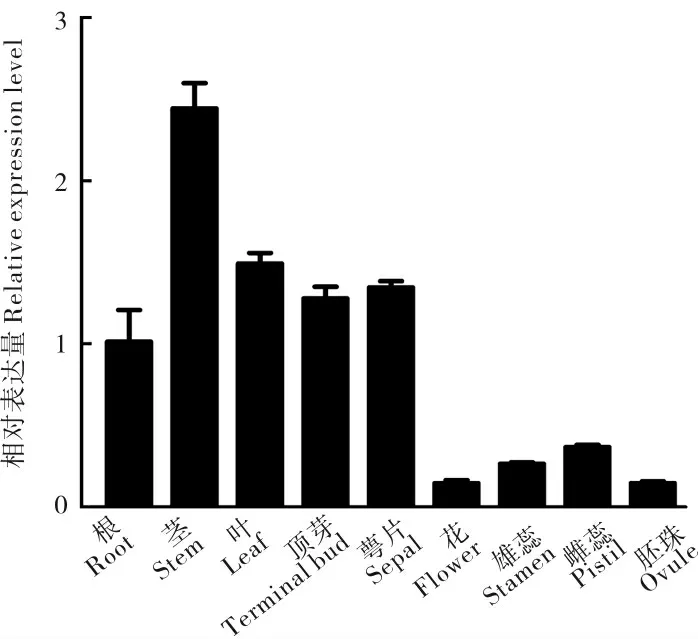
图4 GhGA20ox6 基因在陆地棉不同器官中的相对表达量Fig. 4 Relative expression levels of GhGA20ox6 in different organs in upland cotton
2.3 GhGA20ox6 蛋白亚细胞定位分析
在WoLF PSORT(https://wolfpsort.hgc.jp/)在线软件上进行GhGA20ox6 蛋白亚细胞定位预测,结果显示其定位在细胞膜。 在本氏烟叶片细胞中瞬时表达GhGA20ox6 与GFP (绿色荧光蛋白,green fluorescent protein)融合蛋白,结果显示仅细胞膜有明亮的绿色分布(图5 A~C),而单独表达GFP 蛋白的细胞中绿色荧光在细胞膜与细胞核均有分布(图5 D~F),表明GhGA20ox6 蛋白是1个膜定位蛋白。

图5 GhGA20ox6 在本氏烟中的亚细胞定位Fig. 5 Subcellular localization of GhGA20ox6 in N. benthamiana
2.4 GhGA20ox6 基因在拟南芥中的功能验证
同时种植野生型和3 个T3转基因拟南芥株系(每个株系各50 株),发现野生型拟南芥在移苗后22 d 开始抽薹, 平均抽薹时间为移苗后25 d; 转GhGA20ox6基因拟南芥在移苗后18 d开始抽薹,平均抽薹时间为移苗后20 d,早于野生型(图6 和表2)。 转GhGA20ox6基因拟南芥株系的平均株高约为31 cm, 极显著高于野生型拟南芥(24 cm),莲座叶数量也极显著增加(表2)。GhGA20ox6和GID1基因在茎中的表达检测结果(图7)显示:转基因拟南芥中的GhGA20ox6高水平表达,符合35S 启动子驱动外源基因转入的情况;相对于野生型,转基因拟南芥中GID1a、GID1b、GID1c基因的表达量也均极显著上升。说明GhGA20ox6基因可增强GID1基因的表达,促进茎的生长。

图6 野生型拟南芥和转GhGA20ox6 基因拟南芥的表型Fig. 6 Phenotypes of wild type and transgenic%Arabidopsis

图7 转基因拟南芥中GhGA20ox6 和GID1 基因的表达水平Fig. 7 Expression level of GhGA20ox6 and GID1%genes in transgenic Arabidopsis%lines
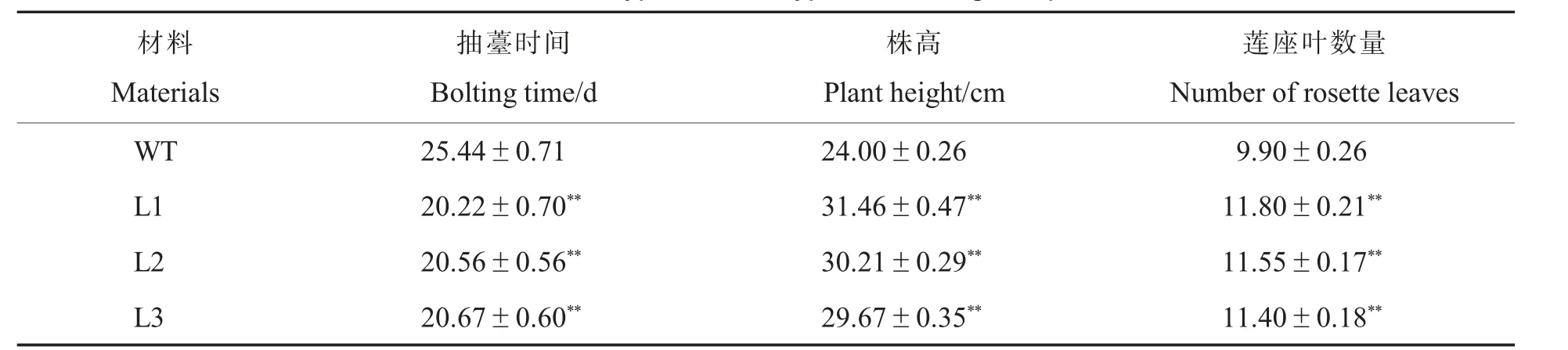
表2 野生型和转基因拟南芥相关表型Table 2 Phenotypes of wild type and transgenic plants
3 讨论
GA20ox 对植物的生长发育和环境适应性起着重要的作用,是植物体内活性赤霉素合成的关键酶。 GA20ox 具有2OG-Fe(Ⅱ)氧化酶结构域,属于2OG-Fe(Ⅱ)双加氧酶[36]。 GA20ox 在赤霉素合成的第三阶段发挥作用,催化C20-GA 分子生成C19-GA 分子, 经过13- 羟基化以及13- 非羟基化这2 个途径生成GA5和GA12, 然后通过赤霉素信号转导调控植物的生长发育[37]。目前,在白毛杨[38]、水稻[14]等物种中关于过表达GA20ox使转基因植株变高的研究较多,表明GA20ox 能促进细胞伸长以及茎的生长。
拟南芥ga5突变体由于缺失AtGA20ox基因出现半矮化的表型[39]。 过表达AtGA20ox基因可以提高拟南芥中活性赤霉素的含量, 使植株变高、开花提前[40]。 Monna 等[41]通过图位克隆方法,发现水稻半矮化基因(semi-dwarfing gene)sd1(OsGA20ox2)编码GA20ox,水稻sd1突 变 体 呈现矮化表型。GhGA20ox6基因与OsGA20ox2基因的同源性较高, 推测可能行使相同的功能。本研究通过从陆地棉材料TM-1 中克隆得到1 个赤霉素氧化酶基因GhGA20ox6, 利用本地blast找到13 个GA20ox基因,经过多重序列比对,发现GhGA20ox6 蛋白序列具有与GA 底物结合的高度保守基序、与结合2-酮戊二酸有关的保守序列, 并且GhGA20ox6基因在TM-1 不同器官中的表达量差异较明显,在茎中表达量较高,推测GhGA20ox6基因主要在茎中发挥功能。
目前,GA20ox基因对纤维生长发育的影响研究报道较多,GhGA20ox1的过表达能促进棉花体内赤霉素的合成,影响赤霉素的信号转导过程,进而促进棉花纤维的伸长,对纤维的品质改良有现实意义。 Xiao 等[42]通过测定陆地棉突变体中GhGA20ox1以及GhGA20ox2的表达量发现,其在胚珠中的表达量较高,推测这2 个基因影响纤维发育的起始阶段。 López-Cristoffanini 等[43]研究水稻ga20ox突变体发现, 突变体节间的活性GA 水平明显低于正常型,导致节间长度缩短。棉花GA20ox基因对棉花株高性状的内在机理尚不明确,为进一步探究GhGA2ox6对陆地棉生长的影响,本研究通过转基因拟南芥试验,发现GhGA20ox6表达量的上升, 导致下游赤霉素受体基因GID1的表达量也上升, 株高增加, 推测GhGA20ox6参与棉花茎的生长发育,影响株高,为进一步研究赤霉素调控棉花株高提供了初步依据。
4 结论
从陆地棉材料TM-1 茎中克隆得到Gh-GA20ox6,编码产物定位于细胞膜,在TM-1 茎中优势表达,异源过表达该基因能显著提高拟南芥株高。GhGA20ox6还能促进转基因拟南芥中赤霉素受体基因GID1的表达, 推测GhGA20ox6对株高性状具有重要作用。 至于赤霉素信号转导途径如何调控植物株高的分子机制,有待于进一步研究。
