氨氮浓度对金鱼藻生长及生理指标的影响
2023-01-05黄晓丽王慧博窦乾明霍堂斌
黄晓丽,王慧博,窦乾明,霍堂斌
(中国水产科学研究院黑龙江水产研究所,黑龙江流域渔业生态省野外科学观测研究站,黑龙江 哈尔滨 150070)
由于我国人口增长、工业和农业的飞速发展,大量外源性氮的输入,湖泊水体氮素过剩与氮素污染问题日益突出[1,2],水体富营养化和区域环境恶化等已威胁到农业灌溉用水,甚至居民饮用水的安全[3]。水体中过量的氮素可通过水生植物吸收或利用、根系微生物作用等方式加以去除[4,5]。沉水植物能吸收氮素,根系还能控制底泥中营养物质的释放,在缓解和消除湖泊氮素污染中发挥重要作用[4,6]。恢复和重建沉水植物群落是当前国际上应用较为广泛的富营养化水体原位生态修复技术[7]。因此,研究氮素对沉水植物的影响对于深入理解富营养化水体氮素去除机理具有重要意义。
沉水植物可有效去除氨氮并吸收利用氨氮(NH4+-N)与硝酸盐氮(NO3--N)合成自身细胞物质[8,9]。对此已进行了相关的研究,证实其去除效率随氮负荷的升高而下降,且较高的氮素浓度对沉水植物有胁迫作用[10,11]。高浓度NH4+-N 均显著影响沉水植物的生长速率、光合作用速率,导致叶绿素含量下降,体内活性氧或自由基超出抗氧化系统的清除能力,抗氧化酶活性异常,膜质过氧化伤害[8,12,13]。
金鱼藻(Ceratophyllum demersum L.)是一种全世界分布广泛的沉水植物,也是淡水湖泊的常见优势种。金鱼藻无根系,可通过改良的叶子附着在底泥上生长,因其对水质变化反应敏感,且常出现在中等至高度富营养化的湖泊中,被认为是触发浅水湖泊稳态转换的先锋种之一[9,14,15]。目前,关于NH4+-N 对金鱼藻的生长、水质净化效率、氮素吸收能力、生理指标变化等影响已有研究[9,14-17],但多为结合pH、磷、NO3--N 等复合污染条件下开展,部分研究仅为短期实验,且测定的生理指标较为单一。关于NH4+-N 对金鱼藻生长、生理指标及相应氮素去除效率的综合研究还鲜有报道。本研究采用静态水培法,考察不同NH4+-N 浓度下金鱼藻的生长状况,监测水溶液中3 种无机氮浓度的梯度变化,分析培养前后金鱼藻体内的蛋白含量、叶绿素浓度、植物可溶性糖和脯氨酸含量的变化,旨在为富营养化水体修复提供科学依据。
1 材料与方法
1.1 材料
实验用金鱼藻采自广东省中山市小榄镇绿森园艺培育池塘,在无污染物的温室条件下不加氮的营养液中培养一周以上。选取生长良好、长势一致的水培植株,径高(15.62±3.43)cm,用去离子水洗净,然后移入实验玻璃缸开始实验,每个玻璃缸中金鱼藻的初始生物量为35 g,用陶瓷环和海绵固定。
仪器与试剂有:TU-1901 型紫外可见光分光光度计(北京普析通用公司);PHS-25 型pH 计(上海精密科学仪器有限公司雷磁仪器厂);GFL-70 烘箱(天津市莱玻特瑞仪器设备有限公司);FA2104B 电子天平(上海精密仪器仪表有限公司)。NH4+-N、NO3--N 和亚硝酸盐氮(NO2--N)标准品均购自国家标准物质研究中心。硫酸铵、霍格兰氏营养液配制和三种无机氮分析实验所用的试剂均为分析纯,购自国药化学试剂有限公司。蛋白含量、叶绿素浓度、植物可溶性糖和脯氨酸含量测定试剂盒购自南京建成生物工程研究所。
1.2 方法
实验容器为长35 cm、宽15 cm、高25 cm 的玻璃缸。NH4+-N 浓度设置2.00 mg·L-1、4.00 mg·L-1、8.00 mg·L-1、16.00 mg·L-1和20.00 mg·L-15 个梯度(EG 1~EG 5)。在玻璃缸中加入10.0 L 含不同浓度NH4+-N 的霍格兰氏培养液中,总磷浓度均为0.5 mg·L-1,移入经过预培养的金鱼藻。实验期间水温为(25±1.0)℃,各实验组营养液初始pH 为7.25±0.37。实验开始后每天测定培养液的pH,利用0.01 mol/L 的HCl 和NaOH 溶液调节pH 在7.00~7.50 范围内。利用专业的水草灯补光,白日光照强度为40~60 μmol·m-2·s-1,补光时间为12 h,晚上不照明。实验设置不加植物无NH4+-N 的溶液空白(BC),对比分析金鱼藻对水溶液中NH4+-N 的去除情况;设置不加NH4+-N 只加植物的对照组(PC),对比金鱼藻在有无NH4+-N 条件下的生长状况,每个处理组设3 个平行。每24 h 向各处理组补充自来水并混合均匀,保持培养液体积不变。实验过程中,分别在培养的第1 d、2 d、5 d、7 d、9 d、12 d、14 d、16 d、19 d 和21 d 上午8:00~9:00,采集水体样品,测定水体中NH4+-N、NO2--N 和NO3--N 的浓度,比较金鱼藻对NH4+-N 的去除效果。在培养第1 d 和第21 d,测定金鱼藻的生物量,然后取一部分用去离子水冲洗干净,吸干表面水分,剪碎后取样测定蛋白含量、叶绿素浓度、植物可溶性糖和脯氨酸含量。所有分析指标测定3 次平行取平均值。
根据《水和废水监测分析方法(第四版)》中规定的方法测定水体中三种无机氮的浓度。采用纳氏试剂分光光度法测定NH4+-N 浓度,采用N-(1-萘基)-乙二胺分光光度法测定NO2--N 浓度,采用分光光度法测定NO3--N 浓度,利用pH 计测定溶液的pH。
金鱼藻生物量测定方法:培养前后,用去离子水冲洗干净金鱼藻,吸干水分后,称取湿重(Wet weight,ww)。取部分样品,在105℃下烘干,测定金鱼藻的含水率,以计算干重(Dry weight,dw)。金鱼藻中蛋白含量、叶绿素浓度、植物可溶性糖和脯氨酸含量均采用南京建成生物工程研究所生产的试剂盒测定,蛋白含量为10%组织匀浆蛋白浓度,单位为gprot·L-1,叶绿素浓度单位为mg·g-1ww,植物可溶性糖和脯氨酸以μg·g-1ww为单位。
1.3 数据统计与分析
数据采用平均值±标准差表示,利用Microsoft Excel 2016 软件处理数据、作图;采用SPSS 软件(25.0 版,SPSS Inc.)对所测数据分别进行正态检验和方差齐性分析。对金鱼藻生物量、水中三种无机氮含量、金鱼藻生理指标的相关参数,以NH4+-N 浓度为控制因子进行单因素方差分析,如果处理间有显著差异,进一步利用Turkey HSD 法进行多重比较。利用独立样本t-检验分析两个不同处理组的差异显著性。以P<0.05 为差异显著水平,P<0.01 为差异极显著水平。
2 结果与分析
2.1 金鱼藻在不同浓度NH4+-N 溶液中的生长情况
在21 d 的培养中,不含NH4+-N 的对照组金鱼藻能够正常生长,但有部分叶片脱落;在不同NH4+-N 浓度溶液中金鱼藻长势良好,生长旺盛,无叶片枯黄或死亡现象。各浓度组中金鱼藻的总生物量均有增加(图1)。在2.00 mg·L-1浓度组中总生物量增长最高,湿重增加23.86 g,干重增加0.45 g;其次为4.00 mg·L-1和8.00 mg·L-1浓度组,总生物量的增加量按干重计分别为0.27 g 和0.22 g,按湿重计分别为9.01 g 和16.28 g;最小值出现在20.00 mg·L-1浓度组,干重增长量仅为0.073 g,湿重增长量为11.03 g。
培养21 d 时,不同浓度的NH4+-N 溶液培养下金鱼藻的总生物量增长量具有极显著性差异(P<0.0001)(图1)。在2.00 mg·L-1NH4+-N 浓度下,金鱼藻总生物量增长量显著高于对照组和8.00~20.00 mg·L-1NH4+-N 浓度组(P<0.05)。在4.00mg·L-1NH4+-N 浓度下,金鱼藻总生物量增长量均显著高于8.00~20.00 mg·L-1NH4+-N 浓度组(P<0.05)。较高浓度NH4+-N(16~20 mg·L-1)抑制了金鱼藻的生长,总生物量增长量均低于对照组,但差异不显著(P>0.05)。
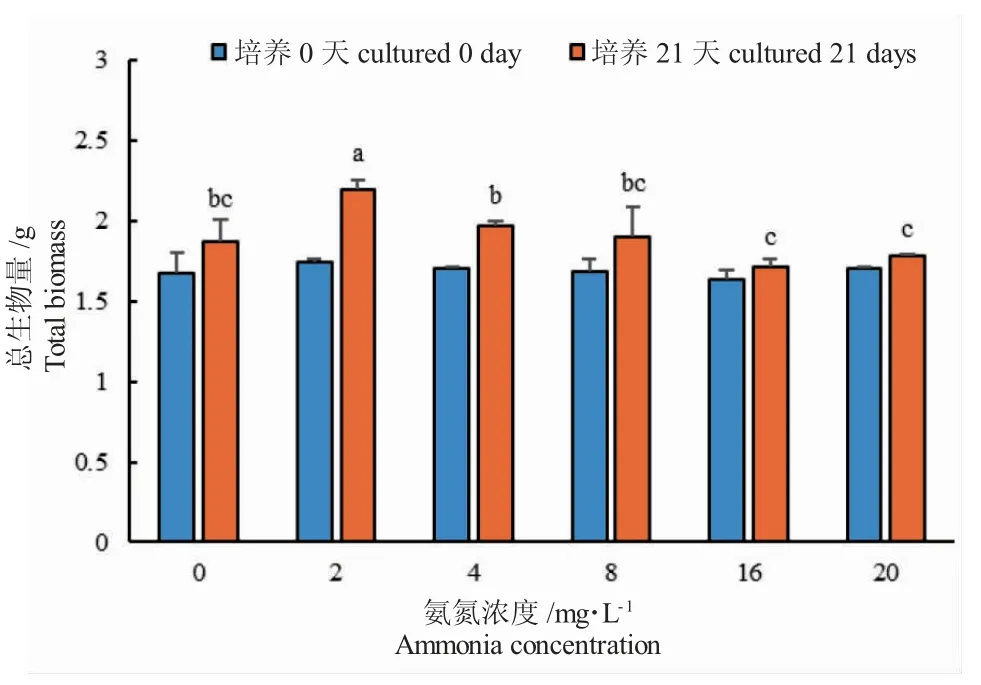
图1 不同NH4+-N 浓度培养下金鱼藻总生物量变化Fig.1 Total biomass of hornwort C.demersum exposed to different ammonia concentrations
2.2 金鱼藻对水溶液中NH4+-N 的去除
在培养期间,溶液空白(BC)中NH4+-N 浓度变化不大(0.018~0.25 mg·L-1),可能为配置溶液过程中带入的NH4+-N;对照组(EC)中NH4+-N 浓度略低于溶液空白(BC)且偶尔有波动(0.0041~0.24 mg·L-1)。总体而言,不同处理组中的NH4+-N 浓度均随培养时间延长而下降。经过21 d 的培养(图2),金鱼藻对不同处理组(2.00~20 mg·L-1)中NH4+-N 的平均去除率分别为97.96%、99.30%、81.44%、57.46%和47.21%。随着水溶液中NH4+-N 浓度的增加,金鱼藻对NH4+-N 的平均去除率逐渐降低(图2)。在2.00 mg·L-1、4.00 mg·L-1和8.00 mg·L-1NH4+-N 浓度下,金鱼藻对NH4+-N 的平均去除率达到80%的时间分别为9 d、14 d 和21 d。在16.00 mg·L-1浓度下,金鱼藻对NH4+-N 的去除率显著降低(P<0.05),当溶液浓度达到20 mg·L-1时,去除率仅为47.21%。
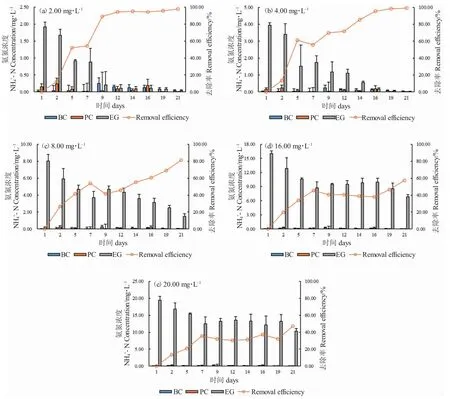
图2 金鱼藻培养水溶液中NH4+-N 的去除效率Fig.2 Removal efficiency of NH4+-N in the water with hornwort C.demersum cultivation
2.3 水溶液中NO3--N 和NO2--N 浓度的变化
溶液空白(BC)和对照组(EC)中NO3--N 和NO2--N 浓度均呈波动变化,数值范围分别为0.19~0.72 mg·L-1和0.019~0.74 mg·L-1(图3-a)。因在配制溶液过程中未加入NO3--N 和NO2--N,因此,溶液中测到的NO3--N 和NO2--N 可能为初始配置溶液时带入,或是由NH4+-N 转化而来。各处理组中NO3--N 浓度整体呈先升高后降低的趋势,最高平均值出现在16 mg·L-1条件下第14 d,为1.88 mg·L-1。随着NH4+-N 浓度的升高,水体中的NO3--N 累积的浓度也随之增加。在培养2~14 d 后,高浓度NH4+-N(16~20 mg·L-1)组的NO3--N 浓度显著高于溶液空白、对照组和低浓度组(2~4 mg·L-1)。
各处理组和对照组的NO2--N 浓度变化趋势差异显著,溶液空白(BC)和对照组(EC)中NO2--N 平均含量均低于0.5 mg·L-1(图3-b)。在培养5 d 时,部分处理组中NO2--N 显著升高,最大值达2.13 mg·L-1。在培养的21 d 内,与NO3--N 相似,各处理组中NO2--N 浓度整体也呈先升高后降低的趋势。不同浓度组累积NO2--N 最高浓度出现的时间无明显规律。金鱼藻能够促进水体NO3--N 和NO2--N 的去除,在16 d 时,各处理组中NO3--N 和NO2--N 均显著下降。结合NH4+-N 去除情况分析,在同一处理组,NH4+-N 的去除量大于NO3--N 和NO2--N 之和,表明金鱼藻能够吸收利用NH4+-N 维持生长。
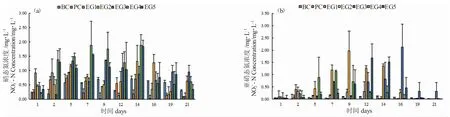
图3 金鱼藻培养水溶液中NO3--N 和NO2--N 浓度的变化Fig.3 The changes in NO2--N and NO3--N concentrations in the culture water of hornwort C.demersum
2.4 金鱼藻生理指标的变化
培养21 d 时对照组(EC)和各处理组的叶绿素含量、植物可溶性糖含量和脯氨酸含量均显著增加(P<0.05)(表1)。与培养前相比,培养21 d 各处理组中金鱼藻的10%组织匀浆蛋白浓度显著增加,而对照组的蛋白浓度显著降低。各处理组之间,随着NH4+-N 浓度的增加,金鱼藻的10%组织匀浆蛋白浓度、叶绿素a、总叶绿素、植物可溶性糖和脯氨酸含量均逐渐降低,最大值均出现在2.00 mg·L-1浓度组(表1)。不同浓度NH4+-N 对金鱼藻生理指标的影响存在一定的差异。2.00 mg·L-1浓度组的各项指标显著高于对照组与其他浓度组(P<0.05)。高NH4+-N浓度(16~20 mg·L-1)组的叶绿素a、总叶绿素、植物可溶性糖和脯氨酸含量显著低于其他浓度组(P<0.05),两者之间无显著性差异。较高NH4+-N 浓度对叶绿素含量影响较大,大于8.00 mg·L-1时,三种叶绿素浓度均低于对照组。
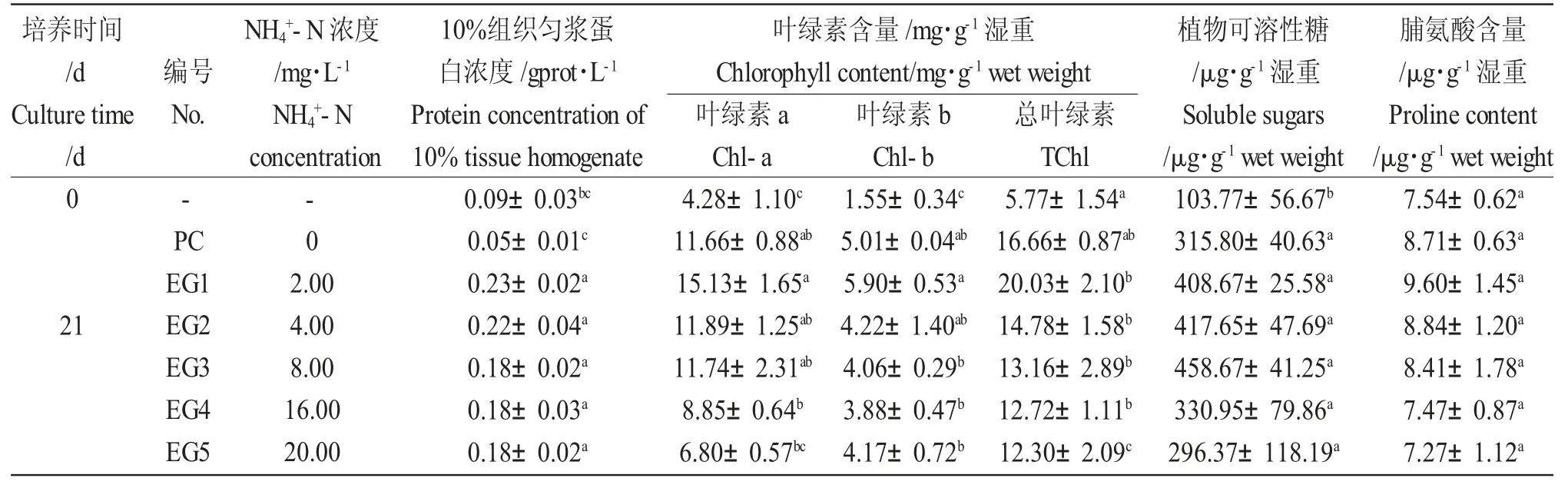
表1 不同浓度NH4+-N 溶液中金鱼藻生理指标的变化Tab.1 Changes in physiological indices in culture water of hornwort C.demersum exposed to different NH4+-N concentrations
3 讨论
金鱼藻在0~20 mg·L-1的NH4+-N 溶液中能正常生长,外观无明显变化。低浓度(<4.00 mg·L-1)的NH4+-N 促进了金鱼藻的生长,总生物量增长量、可溶性蛋白、叶绿素a、植物可溶性糖和脯氨酸含量均高于无NH4+-N 的对照组,且变化趋势相同。这表明在低浓度NH4+-N 胁迫下,金鱼藻的生长不受影响,能够利用NH4+-N 合成自身细胞物质[18,19]。这一结果与前人研究结论相似,在低浓度NH4+-N 培养下,金鱼藻可溶性蛋白、总氮的含量增加[20],促进金鱼藻片段萌发[15]。氮素是沉水植物生长的必需营养元素之一,是合成植物生理代谢活动中蛋白质、叶绿素、核酸等有机化合物的重要组分。对于有根的沉水植物,可以通过根和茎叶从水体和底泥中吸收养分[21],对营养物质的同化作用取决于周围水体和底泥中营养元素的可利用性。金鱼藻无根,营养吸收主要依赖于叶片[22]。其叶生物量比率高,叶裂片呈细丝状,表皮较薄或缺失等,均利于其与周围水体进行物质交换[22,23]。本研究结果证实,金鱼藻在无NH4+-N 的贫营养条件下仍然可以累积生物量,这可能有赖于其较高的叶生物量比率获取更多光照。
金鱼藻吸收利用水体中的氮素,实现了对水体的净化[9,23,24]。本实验中,低浓度组(<4.00 mg·L-1)的NH4+-N 去除效率显著高于其他组,结合植物生物量变化,表明金鱼藻去除NH4+-N 的能力与植物的生长状况密切相关。在相同NH4+-N 浓度条件下,金鱼藻总生物量增长越大,相应的NH4+-N 去除效率越高。考虑到本研究未添加抑菌剂,实验体系内可能存在微生物的作用,如氨氧化微生物将NH4+-N 转化为NO3--N 和NO2--N。在同一处理组中,NH4+-N的最终去除量远大于NO3--N 和NO2--N 之和,结合溶液空白中两者浓度的波动变化,表明微生物对氮素去除贡献率相对较小,金鱼藻仍起主导作用。
本研究中,低浓度(2.00~4.00 mg·L-1)的NH4+-N溶液促进了金鱼藻的生长,但随着NH4+-N 实验浓度的升高,金鱼藻的生长量逐渐降低,生长受到抑制。已有研究表明,NH4+-N 在10.00 mg·L-1浓度时(pH7)抑制了金鱼藻生长,生物量下降[25]。水体中的NH4+-N 有两种形式,分别是非离子氨(NH3)和离子态氨(NH4+)。研究表明,NH3对金鱼藻起主要胁迫作用[26],0.41 mg·L-1NH3即可明显抑制金鱼藻的生长,其耐受范围大约为0.683~0.820 mg·L-1。高含量NH3会降低金鱼藻生长速率光合速率和SOD 活性,膜脂过氧化程度增加,且存在较强的剂量-效应和时间-效应关系[25,26]。水体中NH3的浓度主要受水体pH的影响,因此金鱼藻对NH4+-N 的耐受力与水体pH相关。在本研究中,实验过程NH4+-N 溶液pH 控制在7.25±0.37,各处理组NH3浓度均在可耐受范围内,这可能是金鱼藻仍可正常生长,在较高NH4+-N胁迫下(16.00~20.00 mg·L-1)生物量仍然有所增长,且有一定氮素去除能力的原因。这一结果证实了在pH 适宜的条件下,金鱼藻能够长期耐受超富营养水平(20.00 mg·L-1)的氮胁迫。
综上所述,本研究结果表明:
(1)低浓度(2.00~4.00 mg·L-1)NH4+-N 溶液能够促进金鱼藻的生长,总生物量增长量、可溶性蛋白、叶绿素a、植物可溶性糖和脯氨酸含量均有所增加。较高NH4+-N 胁迫下(16.00~20.00 mg·L-1),金鱼藻的生长量和生理指标显著降低,生长受到抑制。
(2)随着水溶液中NH4+-N 浓度的提高(2.00~20.00 mg·L-1),金鱼藻对NH4+-N 的平均去除率逐渐降低,不同处理下分别为97.96%、99.30%、81.44%、57.46%和47.21%。金鱼藻去除NH4+-N 的能力与生长状况密切相关。
