ATF6/CHOP信号通路对减毒牛结核分枝杆菌感染的THP-1细胞焦亡的调控作用*
2023-01-05马伯利刘悦阳聂雪伊李梦媛徐金瑞
马伯利,刘悦阳,聂雪伊,李梦媛,杨 易,徐金瑞
(宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏银川750021)
结核病(tuberculosis)是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的一种慢性呼吸道传染病[1],中国结核病患者数量排名位于全球前列,结核病和艾滋病双重感染[2]和耐药结核病[3]的出现是造成人类结核病死亡的重要原因,Mtb能够在宿主体内进入潜伏状态。巨噬细胞是阻止Mtb入侵肺正常细胞的首要宿主免疫细胞[4]。Mtb被巨噬细胞吞噬后,可以分泌毒力因子与膜上的丝氨酸蛋白酶阻止蛋白酶G结合,进而调控巨噬细胞焦亡(pyroptosis),逃逸固有免疫的清除。Mtb分泌的EST12(12 kD early secreted antigen target)蛋白可激活核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)-caspase-1/11-消皮素D(gasdermin D,GSDMD)-白细胞介素1β(interleukin 1β,IL-1β)介导巨噬细胞焦亡[5];Mtb早期分泌性靶抗原分泌系统1分泌的ESAT-6等蛋白导致宿主细胞质膜损伤,促进K+外流,进而释放IL-1β和IL-18等炎症因子并引发细胞焦亡[6]。牛型结核分枝杆菌减毒株(即卡介苗,Bacillus Calmette-Guérin,BCG)感染巨噬细胞可以诱导NLRP3炎症小体表达及IL-1β和IL-18释放[7],且NLRP3炎症小体、IL-1β和IL-18与巨噬细胞焦亡有密切关系[8]。
已有研究表明,内质网应激对BCG诱导巨噬细胞焦亡具有重要的调控作用,但是内质网应激3条通路——蛋白激酶R样内质网激酶(protein kinase Rlike endoplasmic reticulum kinase,PERK)、肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α)和转录激活因子6(activating transcription factor 6,ATF6)[9]各自在BCG诱导巨噬细胞焦亡中发挥的作用尚未见报道。大量文献研究显示,ATF6通路在炎症反应[10]、细胞凋亡[11]、自噬[12]及肿瘤细胞增殖[13]等方面具有重要调控作用。基于以上研究背景,本研究采用siRNA敲减ATF6和CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)表达,经BCG感染THP-1细胞,采用Western blot检测NLRP3炎症小体相关蛋白、GSDMD的N端片段(N-terminal fragment of GSDMD,GSDMDN)、IL-1β p17及IL-18 p22蛋白的表达,采用CCK-8法检测细胞活力,采用免疫荧光检测GSDMD蛋白在细胞中的表达。本研究旨在揭示ATF6/CHOP信号通路在BCG诱导巨噬细胞焦亡中的作用,为深入研究内质网应激在结核分枝杆菌与宿主巨噬细胞互作中的调控作用提供参考资料。
材料和方法
1 细胞、试剂和仪器
人单核巨噬细胞THP-1购自中国科学院细胞库;BCG购自成都生物制品研究所;RPMI-1640培养液和胎牛血清购自Gibco;佛波酯和Protease Inhibitor Cocktail购自Sigma-Aldrich;ATF6和CHOP干扰序列(表1)及GP-transfect-Mate购自上海吉玛制药有限公司;BCA蛋白定量检测试剂盒购自江苏凯基生物技术有限公司;蛋白提取试剂M-PER™购自Thermo Fisher Scientific;β-巯基乙醇购自北京索莱宝科技有限公司;兔源β-actin、CHOP和GSDMD多克隆抗体,FITC偶联的羊抗兔IgG,荧光素偶联的羊抗兔IgG购自Proteintech;兔源GSDMD、含caspase募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck
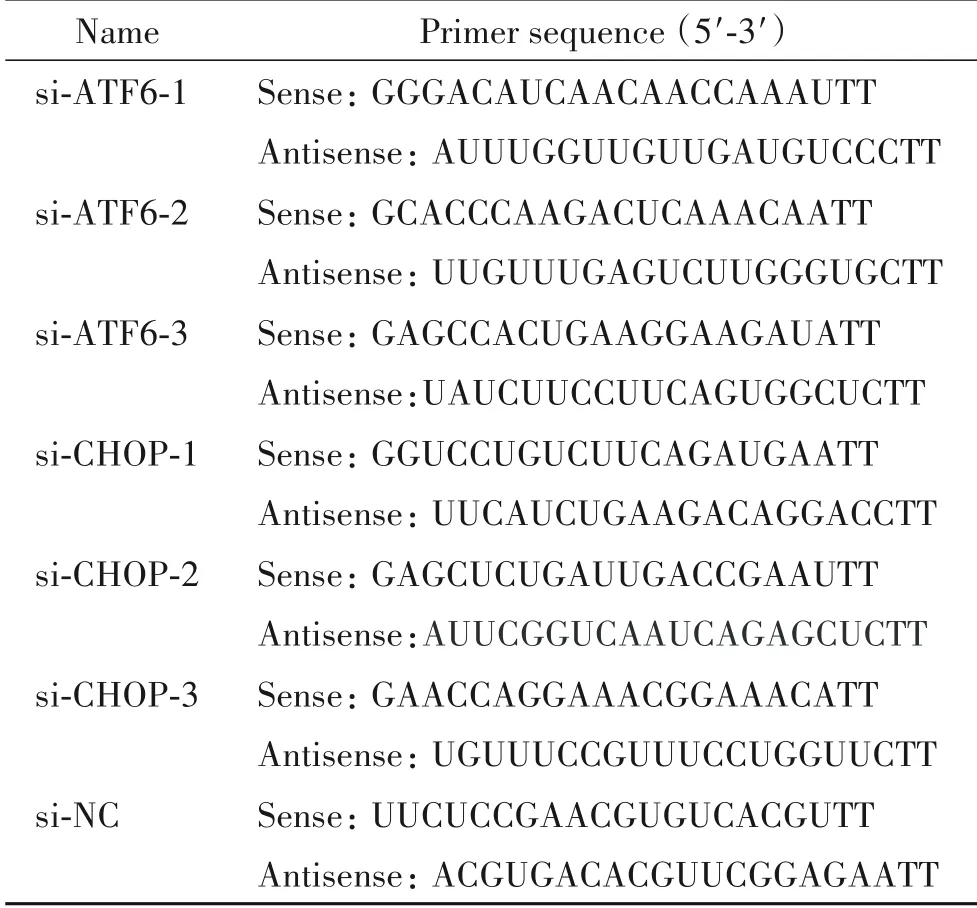
表1 siRNA所用引物信息Table 1.The primer information of siRNA
like protein containing a caspase recruitment domain,ASC)、caspase-1、NLRP3、IL-1β和IL-18单克隆抗体购自Cell Signaling Technology;兔源ATF6和cleaved caspase-1兔源多克隆抗体购自Affinity;CCK-8试剂盒购自北京爱必信生物科技有限公司。细胞计数仪购自Bio-Rad;光学显微镜购自Motic;Amersham™Imager 600自动化学发光成像仪购自GE;Enspire荧光酶标仪购自PerkinElmer;NanoDrop 8000和荧光共聚焦显微镜购自Thermo Fisher Scientific。
2 主要方法
2.1 细胞培养用含10%胎牛血清的RPMI-1640培养液于37℃、5% CO2的恒温培养箱中培养,将处于对数生长期的THP-1细胞按照每孔1×106个接种于6孔板中,并加入50 μg/L佛波酯诱导THP-1细胞为巨噬细胞,用于后续实验。
2.2 BCG培养配制含0.2% Tween-80的H7N9培养液,110℃、30 min高压灭菌后,加入10%的ADC enrichment增菌剂。将BCG接种至7H9培养液中,在无菌细胞培养箱中继续培养。BCG浓度通过Nano-Drop 8000测定600 nm的吸光度(absorbance,A)。BCG菌浓度计算方法:当A600=0.01时,表示BCG的菌浓度为1×1010L-1。
2.3 细胞转染将对数生长期的THP-1细胞(1×106个)接种于6孔板中,细胞生长密度至80%~90%时,根据上海吉玛制药有限公司siRNA说明书分别转染阴性对照si-NC、si-ATF6及si-CHOP。
2.4 BCG感染及分组设置si-NC组、si-NC+BCG组、si-ATF6+BCG组和si-CHOP+BCG组。si-NC组细胞转染干扰si-NC 24 h后正常培养;si-NC+BCG组细胞用GP-transfect-Mate转染试剂转染si-NC 24 h后,以感染复数为10∶1的BCG感染24 h(感染复数的计算参照Zheng等[14]的方法);si-ATF6+BCG组细胞用GP-transfect-Mate转染试剂转染si-ATF6 24 h后,以感染复数为10∶1的BCG感染24 h;si-CHOP+BCG组细胞用GP-transfect-Mate转染试剂转染si-CHOP 24 h后,以感染复数为10∶1的BCG感染24 h。BCG感染24 h后,提取细胞总蛋白进行Western blot实验。
2.5 Western blot实验使用含EDTA和磷酸酶抑制剂的RIPA裂解液提取细胞总蛋白,BCA试剂盒检测蛋白浓度,进行SDS-PAGE分离,将蛋白转印至PVDF膜上,用5%脱脂乳粉室温封闭1 h,分别过夜孵 育β-actin(1∶3 000)、NLRP3(1∶1 000)、ASC(1∶1 000)、pro-caspase-1(1∶1 000)、caspase-1 p20(1∶1 000)、IL-1β(1∶1 000)、IL-18(1∶1 000)、ATF6(1∶1 000)、CHOP(1∶1 000)和GSDMD(1∶1 000)蛋白抗体,用TBST洗涤6次,每次5 min,用荧光素偶联的羊抗兔IgG(1∶3 000)室温孵育1 h,TBST洗涤3次,每次10 min。用Amersham™Imager 600仪器对蛋白表达量进行检测,使用Image-Pro Plus 6.0软件计算相关蛋白灰度值。
2.6 免疫荧光染色将按照2.1和2.3处理后的细胞使用PBS洗3遍,以4%多聚甲醛/PBS(pH 7.4)室温固定20 min。0.1% Triton X-100通透20 min,5%驴血清蛋白封闭,抗GSDMD多克隆抗体(Proteintech,1∶250)孵育过夜。次日,37℃避光孵育FITC偶联的荧光Ⅱ抗,DAPI染色,封片,用荧光共聚焦显微镜拍照。应用Image-Pro Plus 6.0专业图像分析软件分析各实验组的荧光图片灰度值。
2.7 CCK-8法检测细胞活力将THP-1细胞按照每孔104个接种至96孔板中,细胞培养液孔作为空白对照,每组样本均设置3个复孔,按照2.1和2.3方法处理后,每孔加入10 μL CCK-8溶液,室温3 h后,按照说明书要求,使用酶标仪于450 nm处检测细胞A值,建立标准曲线,计算细胞活力。实验重复3次。
3 统计学处理
使用GraphPad Prism 9.0软件处理数据。数据均采用均数±标准差(mean±SD)表示。多组间比较使用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 BCG感 染THP-1细 胞 后GSDMD-N、cleaved ATF6及CHOP蛋白的表达
Western blot结果显示,GSDMD-N、cleaved ATF6和CHOP蛋白的表达随BCG感染时间的延长逐渐升高,GSDMD-N蛋白24 h达到最高,显著高于0 h(P<0.01),而CHOP和cleaved ATF6蛋白在48 h达到最高,显著高于0 h(P<0.01),见图1。
2 敲减ATF6对BCG感染的THP-1细胞NLRP3炎症小体活化的作用
Western blot结果显示,与si-NC组相比,si-NC+BCG组cleaved ATF6、CHOP、NLRP3、ASC、pro-caspase-1、caspase-1 p20、IL-1β p17及IL-18 p22表达显著升高(P<0.01);与si-NC+BCG组相比,si-ATF6+BCG组cleaved ATF6、CHOP、NLRP3、ASC、pro-caspase-1、caspase-1 p20、IL-1β p17及IL-18 p22表达均显著下调(P<0.01),见图2。

Figure 1.The protein levels of GSDMD-N,cleaved ATF6 and CHOP in THP-1 cells of each group.Mean±SD.n=3.**P<0.01 vs 0 h.图1各组细胞中GSDMD-N、cleaved ATF6及CHOP蛋白水平

Figure 2.The protein levels of cleaved ATF6,CHOP,NLRP3,ASC,pro-caspase-1,caspase-1 p20,IL-1β p17 and IL-18 p22 in THP-1 cells of each group.Mean±SD.n=3.**P<0.01 vs si-NC group;##P<0.01 vs si-NC+BCG group.图2各组细胞中cleaved ATF6、CHOP、NLRP3、ASC、pro-caspase-1、caspase-1 p20、IL-1β p17及IL-18 p22蛋白的表达
3 敲减ATF6对BCG感染的THP-1细胞焦亡的作用
Western blot检测结果显示,与si-NC组相比,si-NC+BCG组GSDMD-N蛋白表达显著升高(P<0.01);敲 减ATF6后,si-ATF6+BCG组GSDMD-N蛋白表 达较si-NC+BCG组显著下调(P<0.01),见图3A。CCK-8实验结果表明,与si-NC组相比,si-NC+BCG组细胞活力显著下调(P<0.01);敲减ATF6后,si-ATF6+BCG组细胞活力与si-NC+BCG组相比显著上调(P<0.01),见图3B。免疫荧光染色结果显示,si-NC+BCG组的GSDMD蛋白表达量显著高于si-NC组(P<0.01),si-ATF6+BCG组GSDMD蛋白表达量显著低于si-NC+BCG组(P<0.01),见图3C。
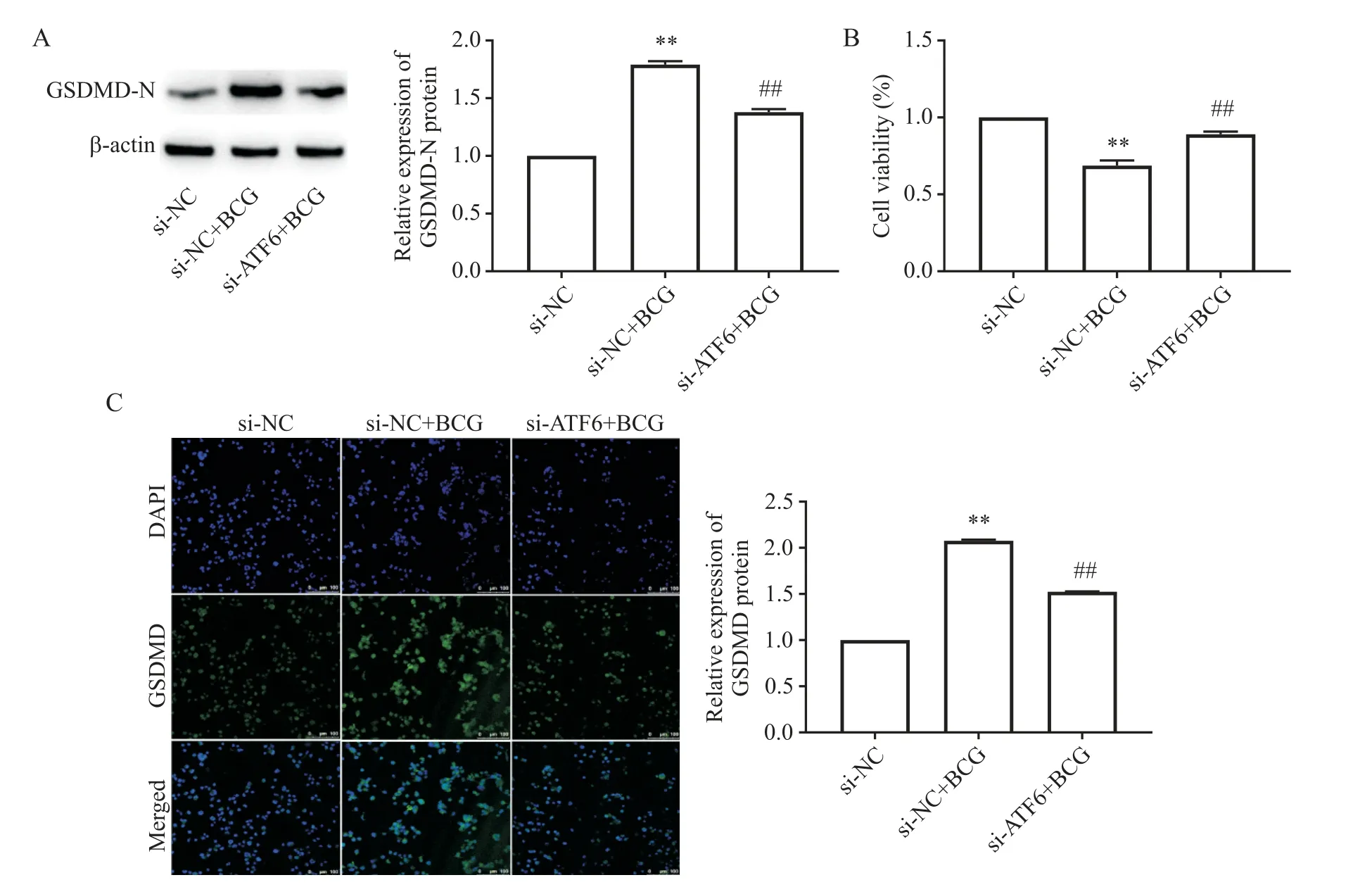
Figure 3.Pyroptosis of THP-1 cells infected with BCG after knockdown of ATF6.A:GSDMD-N protein expression in THP-1 cells of each group;B:the cell viability was determined by the CCK-8 assay;C:immunofluorescence of GSDMD protein in THP-1 cells(scale bar=100 μm).GSDMD was labeled by green fluorescent antibody;blue fluorescence labeled nuclei.Mean±SD.n=3.**P<0.01 vs si-NC group;##P<0.01 vs si-NC+BCG group.图3敲减ATF6后BCG感染的THP-1细胞的焦亡情况
4 敲减CHOP对BCG感染的THP-1细胞NLRP3炎症小体活化的作用
Western blot结果显示,与si-NC组相比,si-NC+BCG组CHOP、NLRP3、ASC、pro-caspase-1、caspase-1 p20、IL-1β p17及IL-18 p22表达显著升高(P<0.01);与si-NC+BCG组 相 比,si-CHOP+BCG组CHOP、NLRP3、ASC、pro-caspase-1、caspase-1 p20、IL-1β p17及IL-18 p22表达均显著下调(P<0.01),见图4。
5 敲减CHOP对BCG感染的THP-1细胞焦亡的作用
Western blot结果显示,与si-NC组相比,si-NC+BCG组GSDMD-N蛋白表达显著升高(P<0.01);敲减CHOP后,si-CHOP+BCG组GSDMD-N蛋白表达较si-NC+BCG组显著下调(P<0.01),见图5A。CCK-8实验结果表明,与si-NC组相比,si-NC+BCG组细胞活力显著降低(P<0.01);敲减CHOP后,si-CHOP+BCG组细胞活力显著高于si-NC+BCG组(P<0.01),见图5B。免疫荧光染色结果显示,si-NC+BCG组的GSDMD蛋白表达量极显著高于si-NC组(P<0.01),si-CHOP+BCG组GSDMD蛋白表达量显著低于si-NC+BCG组(P<0.01),见图5C。
讨 论
Figure 4.The protein levels of CHOP,NLRP3,ASC,pro-caspase-1,caspase-1 p20,IL-1β p17,and IL-18 p22 in THP-1 cells of each group.Mean±SD.n=3.**P<0.01 vs si-NC group;##P<0.01 vs si-NC+BCG group.图4各组细胞中CHOP、NLRP3、ASC、pro-caspase-1、caspase-1 p20、IL-1β p17及IL-18 p22蛋白的表达
结核病是一种由Mtb引起的慢性传染病,由于传染范围广、感染人数多以及死亡病例多的原因,使得结核病成为一个全球性健康问题。当Mtb被肺泡巨噬细胞吞噬,巨噬细胞通过清除细菌和调节炎症反应阻止Mtb入侵巨噬细胞[4,15]。Mtb通过细胞表面Toll样受体(Toll-like receptors,TLRs)、核甘酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors,NLRs)、C型凝集素受体(C-type lectin receptor,CLR)、甘露糖受体(mannose receptor)受体及信号通路调控巨噬细胞凋亡、自噬及焦亡发生[16-18]。Mtb与巨噬细胞作用机制复杂,阐明结核分枝杆菌与巨噬细胞相互作用机制对于治疗结核病具有重要意义。
细胞焦亡是一种程序性细胞死亡方式[19]。当巨噬细胞内模式识别受体(pattern recognition receptor,PRR)受到Mtb刺激后,促进NLRP3炎症小体的组装,NLRP3炎症小体进一步激活caspase-1,切割GSDMD,使其成为有成孔活性的GSDMD-N,并导致细胞膜穿孔,破坏细胞的完整性,引起细胞内渗透压改变而最终肿胀、破裂[20]。有文献报道,Mtb可通过激活核因子κB(nuclear factor-κB,NF-κB)信号促进巨噬细胞促炎细胞因子的产生,以caspase-1/NLRP3/GSDMD依赖性方式诱导细胞焦亡[21-22];Mtb通过激活IL-1β的释放引发细胞焦亡,促进Mtb逃逸至邻近细胞[23]。本研究中,Western blot结果显示,BCG感染的THP-1细胞GSDMD-N蛋白表达水平随感染时间逐渐上升,引起THP-1细胞焦亡,这与聂雪伊等[24]的研究结果一致,进一步证实Mtb感染可导致巨噬细胞发生焦亡。

Figure 5.Pyroptosis of THP-1 cells infected with BCG after knockdown of CHOP.A:GSDMD-N protein expression in THP-1 cells of each group;B:the cell viability was determined by the CCK-8 assay;C:immunofluorescence of GSDMD protein in THP-1 cells(scale bar=100 μm).GSDMD was labeled by green fluorescent antibody;blue fluorescence labeled nuclei.Mean±SD.n=3.**P<0.01 vs si-NC group;##P<0.01 vs si-NC+BCG group.图5敲减CHOP经BCG感染的THP-1细胞焦亡检测
当Mtb感染巨噬细胞时,巨噬细胞内环境稳态发生改变可扰乱内质网功能则引发内质网应激,内质网应激持续活化会引发炎症和细胞凋亡[25]。Mtb感染巨噬细胞能引起内质网应激标志性分子CHOP、ATF3、磷酸化真核起始因子2α(phosphorylated eukaryotic initiation factor 2α,p-eIF2α)及p-IRE1α在巨噬细胞中表达升高[26],进而激活细胞凋亡[27-28]。聂雪伊等研究表明,BCG感染可激活内质网应激并引起巨噬细胞焦亡[24]。Li等[29]的研究表明,抑制内质网应激减弱了Mtb感染诱导的巨噬细胞焦亡。尽管已有研究证实内质网应激在结核菌感染巨噬细胞焦亡中发挥调控作用,但内质网应激3条信号通路各自在Mtb感染巨噬细胞焦亡中发挥怎样的作用尚未有文献报道。本研究结果显示,BCG感染引起巨噬细胞焦亡和ATF6/CHOP信号通路激活,而在敲减ATF6和CHOP后,BCG感染的THP-1细胞焦亡水平下降,表明ATF6/CHOP信号通路参与调控BCG感染的THP-1细胞焦亡。
综上所述,本研究首次证实ATF6-CHOP信号通路可以介导BCG感染的THP-1细胞焦亡,进而发挥对炎症反应的调控作用。本研究结果为结核病的发病机制研究提供了参考资料。
