组蛋白脱乙酰酶激动剂ITSA-1通过抑制胶质细胞激活减轻心肺复苏后大鼠脑损伤*
2023-01-05张晨禹詹浩洪魏红艳周大旺胡春林
张晨禹,詹浩洪,魏红艳,周大旺,张 强,黎 博,胡春林△
(1中山大学附属第一医院急诊科,广东 广州 510080;2中山大学附属第一医院卫生部辅助循环重点实验室,广东 广州 510080;3中山大学附属第一医院重症医学科,广东 广州 510080;4中山大学附属第七医院急诊与灾难医学中心,广东 深圳 510107)
心脏停搏(cardiac arrest,CA)是指心脏机械活动停止,循环体征消失,是患者死亡的主要原因之一,每年造成死亡人数超55万人[1]。当患者自主循环恢复(restoration of spontaneous circulation,ROSC)后大多会发生心脏停搏后综合征(post-cardiac arrest syndrome,PCAS),主要包括脑损伤、心功能障碍、全身缺血/再灌注损伤以及致病诱因持续存在的病理生理过程[2]。胶质细胞是中枢神经系统中最丰富的细胞类型之一,在脑缺血再灌注损伤过程中,胶质细胞激活扮演着重要角色,如星形胶质细胞的激活可导致促炎细胞因子释放,小胶质细胞极化后加重了局部的炎症损伤。胶质细胞激活后会产生大量活性氧(reactive oxygen species,ROS),诱导神经元发生氧化应激并凋亡。因此,抑制胶质细胞激活可能对CA后脑损伤发挥保护作用。
组蛋白乙酰化修饰在心脏疾病的基因转录和翻译中发挥重要作用[3]。研究表明,胶质细胞激活伴随组蛋白的高乙酰化,而组蛋白脱乙酰酶(histone deacetylase,HADC)通过下调Toll样受体活性、减少核苷酸结合寡聚化结构域样受体蛋白3(nucleotide
因此,本研究旨在探讨组蛋白去乙酰转移酶激动剂ITSA-1是否能够有效抑制大鼠CA后脑胶质细胞过度活化,减轻大鼠心肺复苏后炎症反应及神经元损伤,为防治复苏后脑损伤提供参考。
材料和方法
1 动物
30只SPF级4月龄Wistar雄性大鼠,体重约370~420 g,购自南方医科大学实验动物中心,许可证号为SYXK(粤)2019-0209。所有大鼠均可自由进食饮水,安静环境饲养且12 h光照昼夜交替,环境温度25℃,湿度50%定期更换饲料。本实验经中山大学动物研究委员会批准(SYSU-IACUC-2021-000081),动物实验方案符合国家卫生研究院实验动物护理和使用指南。
2 主要试剂和仪器
ITSA-1(HY-100508)购 自MedChemExpress;抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体(60190)和抗离子钙结合接头分子1(ionized calcium binding adaptor molecule-1,Iba-1)单克隆抗体(26177)购自武汉三鹰生物技术有限公司;抗pan-acetylation抗体(66289)购自Proteintech;抗caspase-3抗体(9662S)、抗Bcl-2抗体(2762)、抗Bax抗体(2772)、抗cleaved caspase-3抗体(9661S)和抗GAPDH抗体(5174)购自上海赛信通生物试剂有限公司;大鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒(JER-06)和大鼠白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒(JER-01)购自安徽巧伊生物科技有限公司;苏木精-伊 红(hematoxylin-eosin,HE)染 色 试 剂 盒(BPDL001)和Nissl染色试剂盒(BP-DL301)购自南京森贝伽生物科技有限公司。小动物呼吸机(R415)购自深圳瑞沃德生命科技有限公司;多参数便携式心电监护仪(GS20)购自深圳飞利浦金科威实业有限公司。
3 主要方法
3.1 动物模型制备及分组给药模型制备具体见参考文献[6-8]。大鼠禁食过夜后,通过腹膜注射3%戊巴比妥钠(45 mg/kg)进行麻醉。气管插入14G导管,连接小动物呼吸机进行机械通气。分离双侧股动静脉,使用留置针穿刺右测股动脉监测动脉血压,左测股静脉注射给药。连接心电监护仪连续记录血压、心率、呼吸频率等参数。通过静脉注射维库溴铵(0.1 mg/kg)以阻断呼吸,同时封闭气管插管。由于缺氧,动物的血压逐渐下降。当平均动脉压(mean arterial pressure,MAP)低于30 mmHg时,定义为CA。本实验CA持续时间为12 min,待大鼠CA持续时间到达后,恢复机械通气(潮气量8 mL/kg,呼吸频率60 min-1),静脉注射肾上腺素(每3 min注射20 μg/kg)和碳酸氢钠(1.0 mL/kg),并使用按压装置进行胸外按压,具体标准为200 min-1的频率及胸廓前后径1/3的深度。当发生室上性节律且MAP高于60 mmHg持续15 min以上时视为ROSC。若基础生命支持(basic life support,BLS)持续10 min后仍未达到ROSC则定义为失败。本实验30只大鼠共分为假手术(sham)组、模型(model)组和ITSA-1处理组(ITSA组),每组各10只。其中sham组10只大鼠在注射维库溴铵的同时进行机械通气,而model组和ITSA组大鼠CA 12 min后进行心肺复苏,建立CA模型。在本实验过程中,大鼠ROSC 3 h后肌松药物已失效,此时撤去呼吸机,改为自主呼吸。
3.2 生存研究及生理参数记录心电监护仪持续记录大鼠血压并绘制折线图。记录所有大鼠ROSC后72 h内的生存状态,并绘制Kaplan-Meier生存曲线。
3.3 神经功能评估各组动物在术后清醒自主活动情况下,参照神经功能缺损评分(neurological deficit score,NDS)量表评价大鼠神经功能恢复情况[9],评分主要包括清醒、脑干功能、运动功能评估、感觉功能评估、运动行为、行为和癫痫发作7个方面。评测由独立研究人员分别在ROSC后24、48和72 h三个时点评估神经功能。不同时点的总分作为独立评价指标,其中0分对应脑死亡,80分对应神经功能正常,以72 h的总体NDS评分作为神经功能结局的主要终点。
3.4 海马组织切片HE染色和Nissl染色在ROSC后72 h,深度麻醉处死大鼠,开颅收集大脑。使用4%多聚甲醛灌注固定、脱水并包埋在石蜡中。然后使用标准HE和Nissl染色试剂盒进行染色,使用二甲苯将切片透明化,干燥切片,最后使用中性树胶封片。所有切片统一在20倍光学显微镜下进行观察,并随机选取5个海马CA1区的视野,观察比较切片中细胞的排列层次,对染色阳性细胞进行计数。在HE染色中,凋亡的神经元会表现出核固缩、核破裂以及空泡化;在Nissl染色中,存活的神经元具有较强的蛋白合成功能,呈现深蓝色,凋亡的神经元无法合成蛋白质,故而Nissl小体数量少且着色淡。
3.5 免疫组织化学染色常规切片脱蜡、水化,后使用PBS洗涤3遍,每次5 min。将0.01%柠檬酸钠缓冲液覆盖在切片上孵育5 min,进行抗原修复,洗涤3遍后将3%过氧化氢覆盖在切片上孵育5 min,依次封闭,清洗,滴加Ⅰ抗(GFAP或Iba-1抗体,1∶100),将切片4°C下孵育过夜,次日滴加适量生物素标记Ⅱ抗工作液,最后在显微镜下观察显色情况,于20倍镜下拍照并计数。通过免疫组织化学染色在各组中检测GFAP和Iba-1的表达。其中免疫组化染色阳性细胞呈棕黄色,颜色越深提示该蛋白表达量越多。
对断路器声音异常或果然现象的处理,长时间维修断路器的经验让我们了解到对断路器该现象检修应当按照一问、二试、三摸的步骤进行。一问,检修人员应当向运行人员进行详细的询问,依据询问结果对断路器出现故障进行初步判断,然后备起检修所需要的用品,制定检修策略。二试,通过分合动作试压使断路器处于工作状态,通过观察寻找故障可能出现的地点,通过综合判断,可以快速的对引起故障的原因以及故障地点做出准确判断,提高了工作效率。三摸,当断路器出现过热现象时,检修人员可以通过触摸发现断路器故障,并对故障可能发生的地点进行初步判断。进而对断路器的故障进行处理。
3.6 大鼠海马组织TNF-α和IL-1β含量的测定促炎因子(如细胞因子IL-1β和TNF-α)通常与胶质细胞激活密切相关,涉及多种神经退行性疾病。为评估乙酰化对ROSC后神经炎症的影响,采用ELISA检测海马组织炎症因子IL-1β和TNF-α的水平。分离大鼠海马组织,在含有蛋白酶抑制剂和的裂解液中研磨,提取蛋白上清,并根据制造商的说明,定量分析炎症因子浓度。
3.7 Western blot检测大鼠海马组织凋亡相关蛋白的含量具体操作方法见参考文献[10],取各组大鼠海马组织,RIPA裂解法提取总蛋白,取20 μg每孔上样,进行电泳并转膜,室温下5%脱脂牛奶封闭,分别加入各Ⅰ抗中孵育过夜,次日使用TBST洗后加入山羊抗兔Ⅱ抗孵育,最后在成像系统中观察条带并拍照,结果使用ImageJ软件灰度分析。
4 统计学处理
使用SPSS 21.0统计分析软件进行数据分析。所有数值均采用均数±标准差(mean±SD)进行描述。对数据进行正态分布检验,满足正态分布的数据采用单因素方差分析,不满足则采用秩和检验。以P<0.05为差异有统计学意义。
结 果
1 ITSA-1促进CA后大鼠恢复自主循环
在诱导CA前,3组大鼠的体重、心率和血流动力学参数差异无统计学意义;sham组10只大鼠由于在注射肌松药的同时进行机械通气,故未发生CA,无心肺复苏相关数据,而model组和ITSA组中所有大鼠均成功诱导CA,诱发CA的时间分别为(327.30±17.34)s和(322.60±16.87)s(P<0.05);ITSA组大鼠心电静止(pulseless electrical activity,PEA)时间显著 短 于model组,分 别 为(195.70±40.95)s和(245.80±64.52)s(P<0.05);在BLS方面,model组大鼠复苏成功需(268.70±54.47)s,而ITSA组大鼠仅需(180.80±18.87)s,ITSA组大鼠BLS时间显著短于model组(P<0.05);此外,model组大鼠复苏成功需使用肾上腺素(1.28±0.45)μg,而ITSA组大鼠仅需要(0.66±0.31)μg,用量显著少于model组(P<0.01),见表1。
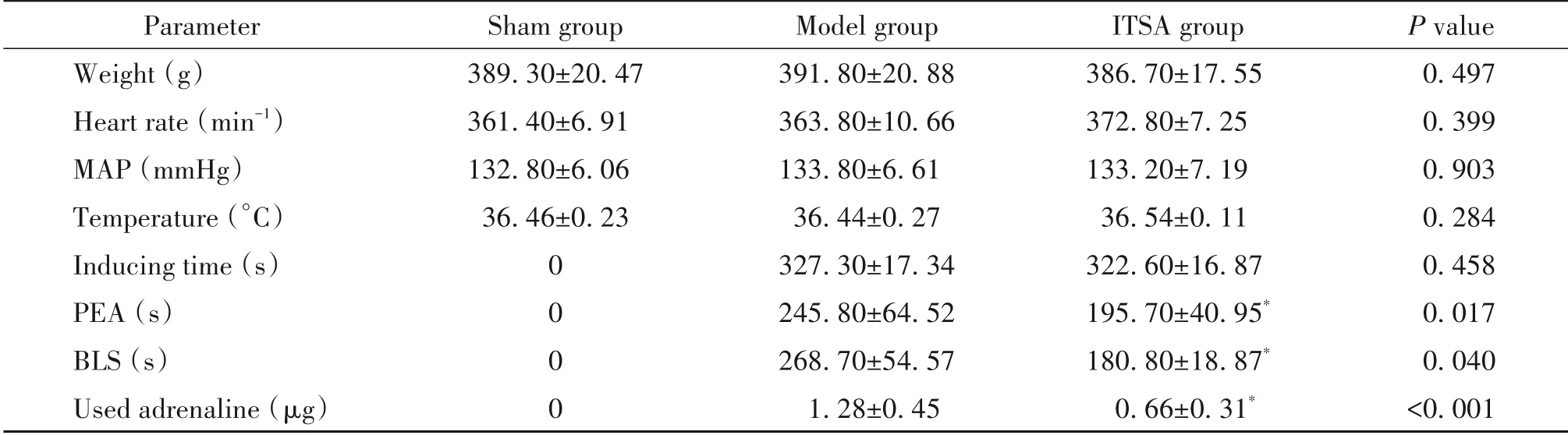
表1 各组大鼠生理参数和心肺复苏参数Table 1.The physiological parameters and cardiopulmonary resuscitation parameters of rats in each group(n=10)
2 ITSA-1提高ROSC后大鼠72 h生存率
术后结果显示,sham组大鼠全过程中血压维持在正常范围内,并无大幅起落;而另外两组重血压均有显著变化,随着肌松药物注射之后,两组大鼠的血压均发生逐渐降低,降至电机械分离后维持在低位。但ITSA组大鼠的血压在基础生命支持期间能够更快上升,上升后较长时间高于model组,见图1。
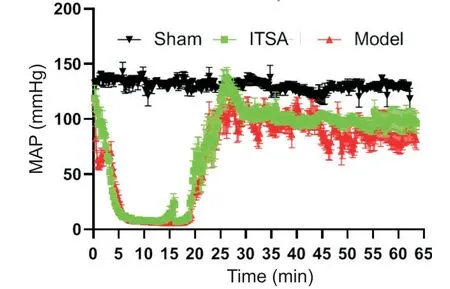
Figure 1.Representative traces of mean arterial pressure(MAP)for 60 min after cardiac arrest..图1心脏停搏后各组大鼠血压波动曲线图
图2 显示术后72 h Kaplan-Meier生存曲线的结果,sham组大鼠没有发生死亡事件,均为存活状态;model组大鼠术后72 h共死亡5只,而ITSA组大鼠死亡3只,死亡时间大多发生在术后24 h内。ITSA组大鼠72 h存活率为70%,显着高于model组的50%(P=0.02)。
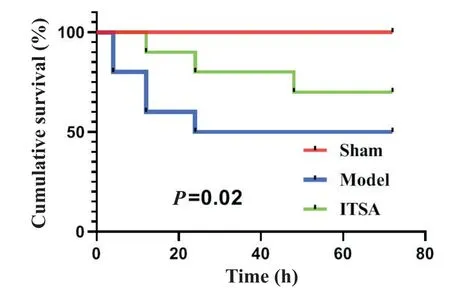
Figure 2.ITSA-1 increased the 72 h survival rate of mice after ROSC.图2 ITSA-1提高了大鼠ROSC后72 h存活率
3 ITSA-1改善ROSC后大鼠NDS评分
我们使用NDS评估CA后的神经功能,如图3所示,sham组大鼠全程均未检测到神经功能缺损症状,而ITSA组ROSC后24 h的评分为41.20±7.46,显著好于model组的16.10±6.65(P<0.05);ROSC后48 h,ITSA组的评分为43.00±9.49,显著好于model组的17.20±7.09;ROSC后72 h,ITSA组的评分 为48.60±10.71,优 于model组 的23.40±9.57(P<0.05)。
4 ITSA-1促进ROSC后大鼠海马CA1区神经元细胞存活
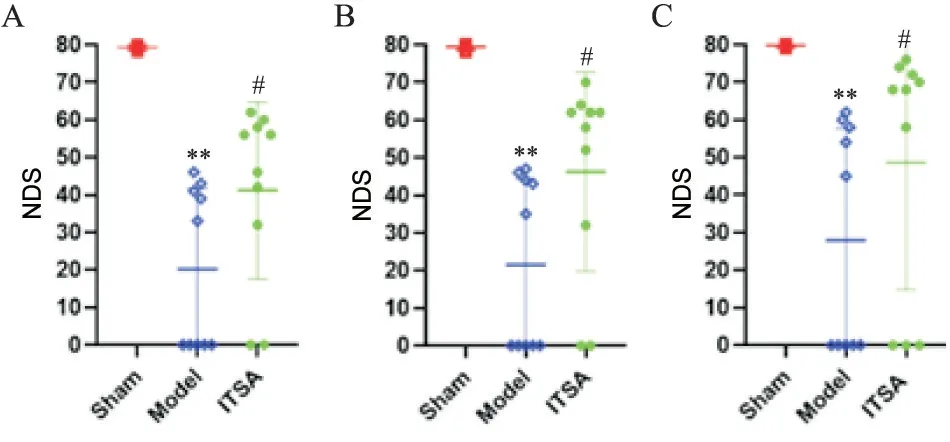
Figure 3.ITSA-1 improved neurological function in rats 24,48 and 72 h after ROSC.A:the neurological deficit score(NDS)of rats in each group 24 h after ROSC;B:the NDS of rats in each group 48 h after ROSC;C:the NDS of rats in each group 72 h after ROSC.Mean±SD.n=10.**P<0.01 vs sham group;#P<0.05 vs model group.图3 ITSA-1改善大鼠ROSC后24、48和72 h的神经功能
图4 A显示,HE染色中sham组海马CA1区神经元排列整齐,纤维结构正常,核染色较浅,细胞轮廓清晰,分布较均匀;model组神经元排列紊乱,分布不均,层数减少且并观察到大量神经元坏死,核固缩和空泡形成,失去典型的多边形形状;而给予ITSA处理可减轻这些病理性损伤,减少大脑神经元的核固缩和空泡形成。
Nissl染色用于显示神经细胞中的Nissl小体,可以反映神经细胞中蛋白质合成的强度,评估神经元存活的数量。如图4B所示,sham组海马CA1区中神经元排列整齐致密形态正常,细胞核可见,胞质着色均匀,可以观察到大量深蓝色颗粒状的Nissl小体;与sham组相比,model组中正常神经元数量显著减少,着色浅淡不均匀,排列极不规则,存活神经元数量显著减少;与model组相比,ITSA组中分布相对较多的Nissl小体,正常神经元比例增多,胞质着色较深,神经元存活数量有所增加。
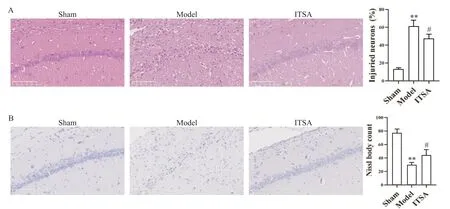
Figure 4.ITSA-1 increased neuronal survival in rat hippocampal CA1 area after ROSC.A:representative images of HE staining in sham group,model group and ITSA group,and quantitative analysis of injured neurons;B:representative images of Nissl staining in sham group,model group and ITSA group,and quantitative analysis of Nissl body.The scale bar=100 μm.Mean±SD.n=5.**P<0.01 vs sham group;#P<0.05 vs model group.图4 ITSA-1增加ROSC后大鼠海马CA1区神经元存活
5 ITSA-1减少ROSC后大鼠海马CA1区胶质细胞浸润
免疫组化染色结果如图5所示,sham组中星形胶质细胞标志物GFAP和小胶质细胞标志物Iba-1散在分布于海马CA1区内,呈静息形态,胞体较小;而model组中可见海马CA1区内GFAP和Iba-1的免疫反应性显著增加,细胞体增大,突触短而厚;与model组比较,ITSA组海马CA1区内GFAP和Iba-1的免疫反应性显著减弱,胞体较小。
6 ITSA-1减少ROSC后大鼠海马组织TNF-α和IL-1β的含量
各组大鼠ROSC后海马组织TNF-α和IL-1β的含量如图6所示,与sham组比较,model组大鼠海马组织中TNF-α和IL-1β水平均显著升高(P<0.05);而与model组比较,ITSA组海马组织中TNF-α和IL-1β的表达量显著降低(P<0.05)。
7 ITSA-1降低ROSC后大鼠海马广谱乙酰化水平及凋亡相关蛋白caspase-3、Bax和cleaved caspase-3水平

Figure 5.ITSA-1 inhibited the activation of astrocytes and microglia in rat hippocampal CA1 area after ROSC.A:representative images of immunohistochemical staining of GFAP in sham group,model group and ITSA group,and quantitative analysis of GFAP positive cells in CA1 region;B:representative images of immunohistochemical staining of Iba-1 in sham group,model group and ITSA group,and quantitative analysis of Iba-1 positive cells in CA1 region.The scale bar=100 μm.Mean±SD.n=5.**P<0.01 vs sham group;##P<01 vs model group.图5 ITSA-1抑制ROSC后大鼠海马CA1区星形胶质细胞和小胶质细胞的激活
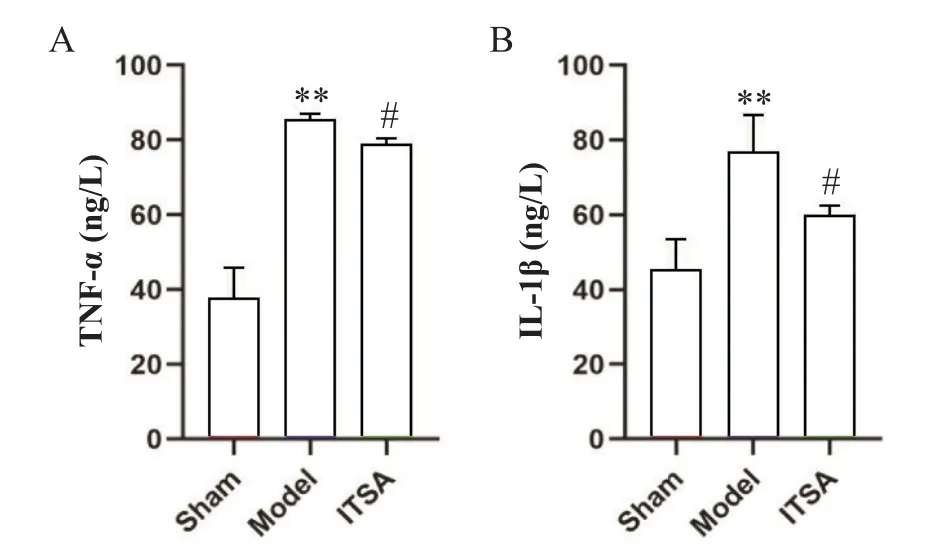
Figure 6.ITSA-1 reduced the levels of TNF-α(A)and IL-1β(B)in hippocampus of rats after ROSC.Mean±SD.n=5.**P<0.01 vs sham group;#P<0.05 vs model group.图6 ITSA-1降低ROSC后大鼠海马组织TNF-α和IL-1β水平
各组大鼠ROSC后海马组织广谱乙酰化水平及凋亡相关蛋白的表达量如图7所示。Western blot结果显示,大鼠CA后脑组织广谱乙酰化蛋白的表达量显著增加,而给予激动剂药物ITSA-1能够显著减少脑组织蛋白的广谱乙酰化(P<0.05)。此外,与sham组相比,model组大鼠海马组织中caspase-3、Bax和cleaved caspase-3蛋白水平显著升高,抗凋亡蛋白Bcl-2的表达量显著减少(P<0.01);与model组比较,ITSA组大鼠海马组织中促凋亡蛋白的表达量显著降低(P<0.05),而抗凋亡蛋白Bcl-2的表达量改变不显著。
讨 论
CA主要的损伤机制是全身多器官的缺血再灌注,停搏的持续时间决定了原发性损伤,而ROSC后的再灌注过程往往会造成更为严重的继发性损伤,其中炎症因子的释放及炎症级联反应的瀑布式激活,是造成神经元损害的主要原因[11-12]。神经胶质细胞是神经系统中的非神经元细胞,对大脑的正常发育和功能至关重要。在脑缺血再灌注损伤过程中,胶质细胞激活对大脑炎症反应的调控发挥着重要作用。Campanella等[13]在对大鼠脑梗组织进行流式细胞鉴定时,观察到有大量胶质细胞激活,这会诱发单核细胞、中性粒细胞和T细胞浸润,进一步加剧脑组织中的炎症反应,使神经功能恶化。在大脑缺血再灌注损伤中,星形胶质细胞通过上调糖酵解能力来抵抗缺氧,随后导致谷氨酰胺及炎症因子的释放量显著增加,同时还会通过缝隙连接向其他健康组织发送促凋亡信号,进而激活小胶质细胞[14]。在缺氧的情况下,小胶质细胞会从静息态转变为M1极化,激活信号级联链,释放各种炎症因子。如果能够有效抑制缺氧后神经系统中胶质细胞活化,则可抑制脑缺血再灌注损伤后的神经炎症反应,减少神经元损伤。
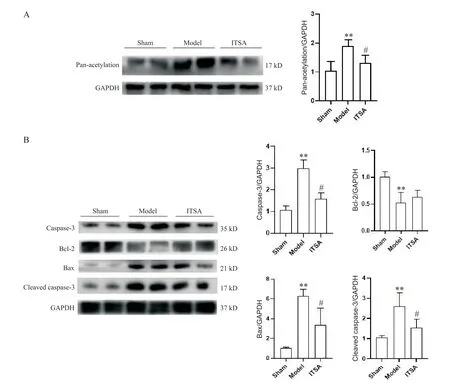
Figure 7.ITSA-1 inhibited the levels of pan-acetylation and apoptosis-related proteins in the hippocampus of rats after ROSC.A:representative image and quantitative analysis of pan-acetylation in the hippocampus of rats after ROSC;B:caspase-3,Bcl-2,Bax and cleaved caspase-3 protein levels in the hippocampus of rats after ROSC.Mean±SD.n=3.**P<0.01 vs sham group;#P<0.05 vs model group.图7 ITSA-1抑制ROSC后大鼠海马广谱乙酰化及caspase-3、Bax和cleaved caspase-3水平
组蛋白乙酰化修饰在再灌注期间发挥什么作用,是否通过对基因转录、能量平衡和氧化应激的影响从而调节。以往HDAC通路在生物体进化过程中偏向保守,且在缺血缺氧损伤以及氧化应激等条件下,维持细胞生存发挥着重要作用。适当的激活HDAC能够延长寿命,帮助细胞在恶劣条件下增强适应力,调控自噬改善能量代谢,抑制应激相关性炎症。在慢性缺氧过程中HDAC的活性会显著降低,从而导致组蛋白高度乙酰化,进而激活基因转录[15-16]。目前研究表明小分子药物ITSA-1能减少组蛋白乙酰化,从而阻止促炎基因的转录激活,减少炎症因子等损伤物质的释放[17]。但其在神经系统中的作用尚未见报道。我们的研究结果证实,ROSC后星形胶质细胞及小胶质细胞被激活,脑中炎症因子释放显著增加,而给予ITSA-1处理能够逆转这些改变,提示大脑中高水平的组蛋白乙酰化状态可能是大鼠心肺复苏后脑损伤的重要原因。
本研究通过维库溴铵诱导窒息建立大鼠CA模型,模拟患者不可除颤型CA的病理生理学机制,研究证明HDAC激动剂ITSA-1可有效减轻大鼠复苏后脑损伤。通过观察心脏电生理变化、复苏后神经功能评分、脑组织结构变化、炎症因子及凋亡基因改变程度评价大鼠的再灌注损伤。研究结果显示ITSA-1在CA疾病中发挥了保护的作用,能够减轻大鼠ROSC后脑损伤,提高存活率,抑制炎症因子的释放,减少神经元的凋亡。相较model组,ITSA组PEA时间持续更短,自主循环恢复更快,所需要的肾上腺素剂量更少。由于神经元的缺氧损伤通常会伴随着星型胶质细胞、小胶质细胞及巨噬细胞的激活,增生后会清理凋亡神经元。本研究通过免疫组织化学染色在各组中检测GFAP和Iba-1的表达。检测到大鼠脑星形胶质细胞和小胶质细胞显著激活。而ITSA-1可能抑制ROSC后早期的炎症反应,减少了星形胶质细胞和小胶质细胞的进一步激活,发挥保护作用。潜在机制可能与其激活HDAC蛋白酶活性,减少组蛋白乙酰化,抑制ROSC后脑胶质细胞增生,减少脑组织炎症细胞浸润,减轻炎症反应,这为大鼠CA心肺复苏后脑损伤的药物防治提供了参考。
