芦荟多糖对D-半乳糖致HepG2细胞氧化损伤的保护作用
2023-01-03赵悦竹张屿楠李敬双
赵悦竹,金 鑫,张屿楠,李敬双,于 洋,
(1.锦州医科大学食品与健康学院,辽宁锦州 121001;
2.锦州医科大学畜牧兽医学院,辽宁锦州 121001)
近代以来大量研究发现,生物体有着应对细胞正常代谢活动产生的活性氧(reactive oxygen species,ROS)、活性氮等自由基的一套调节系统,且涉及到多种信号通路间的协同作用。当外界刺激导致ROS过度积累至超过机体的调节能力时,有害物质引起抗氧化通路上的某些蛋白表达下调,导致细胞内抗氧化防御系统失衡,此时即表现为氧化应激状态[1]。氧化应激与多种疾病的形成有关,如缺血性脑卒中[2]、阿尔茨海默病[3]、糖尿病[4]等,并在引起人体炎症反应和衰老中起重要作用[5]。因此,保护机体免受氧化应激损伤依旧是当下研究的热点。
芦荟多糖(aloe polysaccharide,AP)是从芦荟中提取的天然多糖类化合物,具有增强免疫[6]、促进癌细胞自噬[7]、抗炎[8]等多种药理作用。已有研究显示,芦荟多糖能下调黄曲霉毒素B1代谢活化酶细胞色素P4501A2和3A的表达,减轻黄曲霉毒素B1造成的肝脏损伤[9];通过下调结肠组织中OX40、OX40L蛋白表达水平,减弱炎症性肠病小鼠免疫功能过度激活而实现对炎症性肠病的治疗作用[10]。
刘泽鑫等[11]通过测定芦荟多糖清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]和超氧阴离子等的能力,得出芦荟多糖具有体外抗氧化活性的结论;张晓林等[12]通过腹腔注射四氯化碳构建小鼠肝损伤模型,中华芦荟多糖能起到提高血清丙氨酸氨基转移酶等相关酶活力,减轻小鼠急性肝损伤程度的作用。但有关芦荟多糖对细胞抗氧化作用的具体机制尚缺乏深入系统性的研究,本研究通过测定氧化应激损伤的HepG2细胞存活率、抗氧化酶活力、丙二醛(malondialdehyde,MDA)含量和相关基因的表达水平,探讨芦荟多糖对D-半乳糖致细胞氧化损伤的保护作用,为芦荟多糖的应用提供理论和实验依据。
1 材料与方法
1.1 材料与仪器
芦荟多糖、维生素C(Vitamin C,VC) UV≥98%,源叶生物科技有限公司;D-半乳糖(D-galactose,Dgal) 生物技术级,麦克林生化科技有限公司;人肝癌细胞株HepG2 锦州医科大学生命科学院保存;DMEM(dulbecco’s modified eagle medium)高糖培养基、磷酸盐缓冲液(phosphate buffered solution,PBS)、胰蛋白酶消化液、青-链霉素混合液、二甲基亚砜(dimethyl sulfoxide,DMSO) 北京索莱宝科技有限公司;胎牛血清(fetal bovine serum,FBS) 赛默飞世尔科技有限公司;细胞增殖与毒性检测(Cell Counting Kit-8,CCK-8)试剂盒、总RNA抽提试剂(Trizol)
碧云天生物技术研究所;人丙二醛酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒、人总抗氧化能力(total antioxidant capacity,TAOC)ELISA试剂盒 上海酶联生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)试剂盒 上海碧云天生物技术有限公司;TaKaRa逆转录试剂盒、TB Green™ Premix Ex Taq™ II试剂盒 大连宝生物工程有限公司。
HR40-B2型生物安全柜 青岛海尔特种电器有限公司;Read Max1500型光吸收全波长酶标仪 上海闪谱生物科技有限公司;Olympus BX53倒置光学显微镜 日本Olympus公司;3H12RI智能高速冷冻离心机 湖南赫西仪器装备有限公司;CB-S 170二氧化碳恒温培养箱 德国Binder公司;JY88-IIN超声波细胞粉碎仪 宁波新芝生物科技股份有限公司;Mastercyler ep realplex4型实时荧光定量PCR仪、BioPhotometer plus型蛋白核酸分析仪 德国Eppendorf公司;Tanon 2500全自动凝胶成像系统 中国天能科技有限公司。
1.2 实验方法
1.2.1 HepG2细胞培养 根据Juan等[13]的实验方法,以含10% FBS、1%青-链霉素双抗混合液的DMEM高糖培养基为完全培养基,37 ℃、5% CO2为常规条件培养HepG2细胞。当细胞密度达到85%时,PBS洗去破碎的细胞与代谢产物,胰酶收集细胞并按1:3比例传代。剩余细胞均匀混合至含10% DMSO的FBS中,-80 ℃或液氮条件下冻存。
1.2.2 CCK-8法测定芦荟多糖安全浓度范围 CCK-8溶液可以通过与活细胞线粒体中的脱氢酶发生还原反应生成橙黄色物质,使细胞数目与颜色呈线性关系[14]。选择处于对数生长期的HepG2细胞,以密度为5×104个/mL接种于96孔细胞培养板中,每孔100 μL。在37 ℃、5% CO2条件下培养24 h,倒置显微镜下观察细胞充分贴壁后,弃去培养基,用pH调节至7.2~7.4,浓度为0.01 mol/L的PBS漂洗1~2次,并进行分组:芦荟多糖组加入100 μL含芦荟多糖(终浓度分别为12.5、25、50、100、200、400 μg/mL)的DMEM完全培养基;对照组予以等体积完全培养基。于37 ℃、5% CO2条件下与细胞共培养20 h后,每孔加入10 μL CCK-8溶液,常规孵育2 h,按说明书检测各孔在波长为450 nm时的吸光度(OD)值,并计算细胞存活率。每浓度组设五个复孔。

1.2.3 HepG2细胞氧化应激模型的建立 以含1%青-链霉素双抗混合液的DMEM高糖培养基为无血清培养基,按1.2.2的方法,将细胞以5×104个/mL接种到96孔板中,每孔100 μL。常规培养24 h后,更换为100 μL含D-gal(终浓度为50、100、200、400 mmol/L)的无血清培养基,对照组予以等体积无血清培养基,分别诱导12、24、36 h,CCK-8法检测细胞存活率。每浓度组设五个复孔。
1.2.4 芦荟多糖对氧化应激损伤细胞存活率的影响
按1.2.2的方法,将细胞以5×104个/mL接种于96孔板中,每孔100 μL。实验分组为:对照组、D-gal模型组、VC阳性组、芦荟多糖低、中、高浓度保护组,每组设五个复孔。
细胞常规培养24 h至完全贴壁后弃去培养基,VC阳性组加入终浓度为100 μg/mL的含VC完全培养基,芦荟多糖保护组每孔加入100 μL终浓度为25、50、100 μg/mL的含芦荟多糖完全培养基;对照组与模型组予以等体积完全培养基,常规条件下与细胞共培养20 h。弃去培养基,除对照组外,每孔各加入D-gal浓度为200 mmol/L的无血清培养基100 μL,诱导24 h;对照组加入等体积的无血清培养基,CCK-8法检测细胞存活率。
1.2.5 细胞抗氧化酶活力、T-AOC水平及MDA含量测定 酶联免疫分析(ELISA)法是通过抗原-抗体-酶标抗体复合物在辣根过氧化物酶的催化下发生显色反应的免疫学分析方法,相比传统方法灵敏度更高。采用ELISA法检测细胞中T-AOC、MDA含量,能更好地排除其他条件干扰,较真实地反映出待测值水平。
SOD活性检测采用WST-8比色法[15],基于甲臢染料的显色反应检测细胞中SOD酶活性;CAT酶可以催化过氧化氢产生水和氧气,通过计算其在单位时间内催化产物生成量,可确定细胞中CAT活力[16];GPx能特异性催化有机过氧化物试剂与还原型谷胱甘肽反应生成黄色产物TNB,定量检测GPx酶活力。
参考Wang等[17]的方法,将细胞以1×106个/mL浓度接种于6孔板中,每孔1 mL。铺板后十字摇匀,常规培养细胞24 h。镜下观察细胞充分贴壁后,移除旧培养基,PBS漂洗2次,按照1.2.4的方法进行分组和给药,每孔1 mL。D-gal诱导结束后,收集每孔培养上清液,4000 r/min条件下离心10 min,弃去沉淀,按说明书操作测定细胞培养上清液中MDA水平。
取出上清液后,每孔加适量PBS洗1~2次。用无菌刮刀轻柔刮下孔板底部的细胞,加入1 mL预冷的PBS,混匀后置于超声波细胞粉碎仪中,超声功率200 W,超声时间5 s,间隔10 s,重复30次。镜下观察细胞破碎效果,取充分裂解后的细胞匀浆,4000 r/min条件下离心10 min,收集上清液,分别按说明书操作检测细胞中SOD、CAT、GPx、T-AOC水平。实验设五组平行。
1.2.6 实时荧光定量PCR检测细胞Keap1、Nrf2、NQO1和HO-1的mRNA表达量 将细胞以1×106个/mL接种于6孔板中,每孔1 mL。十字摇匀后,常规培养细胞24 h,按照1.2.4的方法进行分组与给药,每孔1 mL。D-gal造模结束后弃去培养基,胰酶消化、收集细胞于无RNA酶EP管中,加入PBS吹匀,离心1~2次洗净胰酶。采用Trizol法提取细胞总RNA,核酸蛋白分析仪测定RNA纯度和浓度。RNA纯度A260/280在1.8~2.1之间,浓度用无RNA酶水调整至400~600 ng/μL。
按照TaKaRa逆转录试剂盒与TB Green嵌合荧光法实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)试剂盒说明书配制反应体系。逆转录体系为20 μL,37 ℃,15 min;85 ℃,5 s。PCR体系为25 μL,95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,循环40次。参考潘聪等[18]的引物设计(见表1),GAPDH作为内参,2-ΔΔCt法计算mRNA的相对表达水平,琼脂糖凝胶电泳检测扩增产物[19]。

表 1 引物序列Table 1 Primer sequence
1.3 数据处理
2 结果与分析
2.1 芦荟多糖的安全浓度范围
细胞存活率是衡量细胞损伤程度的直观指标之一。实验通过CCK-8法测定不同浓度芦荟多糖共培养条件下HepG2细胞的存活率,从而分析药物对细胞的毒性作用,确定芦荟多糖对HepG2细胞的安全浓度范围。实验结果如图1所示,在12.5~400 μg/mL范围内,HepG2细胞的存活率均≥90%;当质量浓度小于400 μg/mL时,芦荟多糖处理组与对照组之间的差异不显著(P>0.05),即此时芦荟多糖对细胞无明显毒性作用。综合考虑,选择质量浓度为25、50、100 μg/mL的芦荟多糖作为低、中、高浓度组来进行后续实验。

图 1 芦荟多糖对HepG2细胞存活率的影响Fig.1 Effects of aloe polysaccharide on the survival rate of HepG2
2.2 HepG2细胞氧化应激模型的建立
D-半乳糖(D-galactose,D-gal)是一种稳定性较高的六碳醛糖,在机体中通过半乳糖氧化酶进行代谢。当D-gal大量堆积于细胞时,会导致细胞糖代谢异常[20],进而引起细胞肿胀、坏死,破坏机体抗氧化防御系统,致使细胞产生氧化应激现象。
HepG2细胞存活率与D-gal浓度、诱导时间的关系如图2所示。随着D-gal浓度增大和诱导时间延长,细胞存活率表现出下降趋势,其中,400 mmol/L浓度组的细胞存活率均在60%以下,表明通过Dgal诱导细胞建立氧化应激模型的方法具有可行性。通常情况下,细胞用作构建损伤模型时的存活率应在50%~70%之间,此时既达到损伤要求,又不会对细胞造成不可逆伤害[21]。结果表明,当D-gal浓度为200 mmol/L、诱导时间为24 h时,细胞存活率降至66.92%±3.70%,处于构建模型的适宜范围之内。由此选择D-gal诱导条件为200 mmol/L,24 h。

图 2 D-gal对HepG2细胞存活率的影响Fig.2 Effects of D-gal on the survival rate of HepG2 cells
2.3 芦荟多糖对氧化应激损伤细胞存活率的影响
实验结果如图3所示。D-gal诱导后的细胞存活率降至63.68%±2.64%,与对照组相比有极显著差异(P<0.01),且处于构建损伤模型的存活率范围内,可视为造模成功。芦荟多糖低、中、高浓度组细胞存活率分别为70.27%±4.43%、75.26%±3.49%、82.74%±4.06%,与模型组相比均有显著提高(P<0.05),且细胞存活率与芦荟多糖浓度呈正相关,其中终浓度50、100 μg/mL的芦荟多糖处理组表现为极显著(P<0.01)。维生素C作为天然抗氧化剂,可以清除人体内过氧化自由基、猝灭单线态氧,减轻机体氧化损伤,并参与修复受损的组织细胞[22]。以VC为阳性参照组,中、高浓度的芦荟多糖组细胞存活率与其没有显著性差异(P>0.05),体现了相近的保护作用。实验结果表明,三个浓度组的芦荟多糖预保护处理均能显著提高氧化应激损伤的细胞存活率(P<0.05)。

图 3 芦荟多糖对氧化应激损伤细胞存活率的影响Fig.3 Effect of aloe polysaccharide on cell survival rate of oxidative stress injury
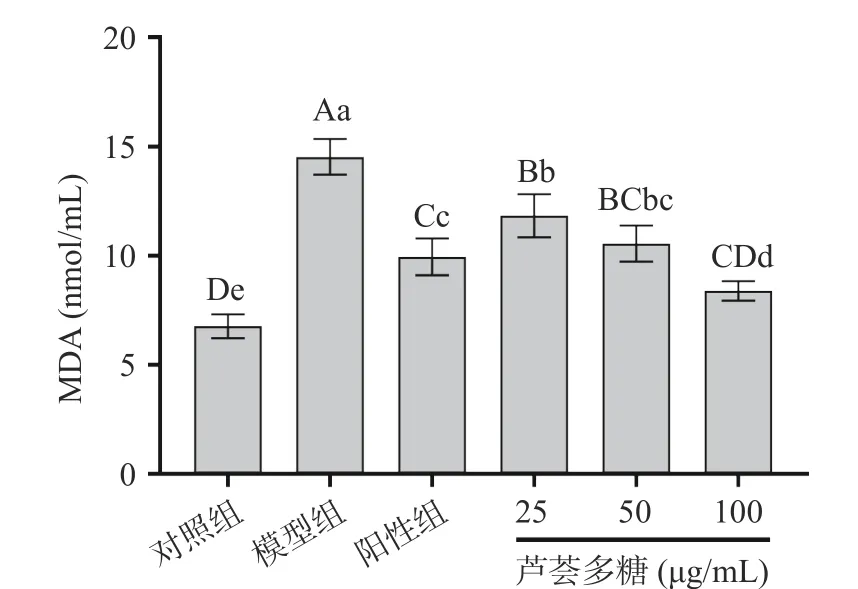
图 4 芦荟多糖对氧化应激损伤细胞MDA含量的影响Fig.4 Effect of aloe polysaccharide on MDA content in oxidative stress induced injury cells
2.4 芦荟多糖对HepG2细胞抗氧化能力的影响
2.4.1 细胞上清液MDA含量测定 MDA是由ROS作用于细胞膜发生链式反应,引起脂质过氧化而产生的有毒物质,其过量积累会破坏细胞膜结构导致细胞质溢出,损害细胞功能[23]。因此,可通过MDA含量检测细胞受氧化损伤程度[24]。如图4所示,D-gal模型组细胞培养上清液中MDA含量为(14.53±0.82)nmol/mL,与对照组(6.78±0.55)nmol/mL相比有极显著增加(P<0.01)。在实验组中,细胞经过25~100 μg/mL芦荟多糖的预保护处理,MDA的含量均较模型组显著降低(P<0.05),分别为(11.83±0.99)、(10.56±0.82)、(8.39±0.45)nmol/mL,表明芦荟多糖可以在一定程度上缓解ROS对细胞造成的损伤,且其保护作用随浓度的增高而逐渐加大,其中高浓度组的芦荟多糖处理较VC组(9.95±0.84 nmol/mL)效果更显著(P<0.05)。
2.4.2 细胞抗氧化酶系活力测定 ROS由过氧化氢、超氧阴离子、羟基自由基、单线态氧等组成,炎症反应、冷热应激、衰老、紫外线、过量摄入酒精等内外界因素都会导致细胞内ROS大量积累。清除ROS是保护生物体减轻氧化应激损伤的重要途径,在人体中主要靠抗氧化酶系来实现。SOD、CAT、GPx属于常见的抗氧化酶类,参与组成生物对氧化损伤的防御体系,降低ROS对细胞的侵害[25-26]。实验通过检测HepG2细胞中三种酶活力的变化,来初步评价芦荟多糖的抗氧化能力。结果见表2。
D-gal造模后,三种酶活力均较正常细胞极显著降低(P<0.01),D-gal对细胞抗氧化酶活性起明显抑制作用。与模型组相比,中、高浓度芦荟多糖处理组细胞中三种酶的活力水平均显著增强(P<0.05),其中,SOD、GPx活力上升趋势与芦荟多糖呈浓度依赖关系。在25 μg/mL的芦荟多糖处理组中,GPx活力与模型组相比显著升高(P<0.05),SOD、CAT活性虽有所提高但差异不显著(P>0.05)。当芦荟多糖浓度为100 μg/mL时,细胞中SOD的活性显著高于VC阳性组(P<0.05)。以上结果表明,芦荟多糖能增强氧化应激条件下HepG2细胞中SOD、CAT、GPx的活性,作用效果与其浓度呈正相关。
2.4.3 细胞总抗氧化能力 总抗氧化能力(T-AOC)代表能够平衡细胞内氧化还原状态的各种抗氧化活性物质和酶系的总体水平,通常用来综合评价生物抵御氧化应激损伤的能力[27]。由表2可知,D-gal诱导的HepG2细胞总抗氧化能力极显著降低(P<0.01)。经过芦荟多糖三个浓度组的预保护处理后,细胞中T-AOC显著提高,与模型组相比表现为极显著(P<0.01),其中,100 μg/mL的芦荟多糖组总抗氧化能力提升幅度最大,和VC组得到了近似结果。
结合2.3结果分析,各组细胞存活率的变化趋势与2.4.2实验结果一致,其原理可能为芦荟多糖在一定程度上提高了细胞中SOD、CAT、GPx等抗氧化酶活力,从而起到增强细胞应对外界氧化损伤的能力,减少细胞的死亡数量。
2.5 芦荟多糖对细胞Keap1、Nrf2、NQO1和HO-1的mRNA表达水平的影响

表 2 HepG2细胞中SOD、CAT、GPx、T-AOC水平Table 2 SOD, CAT, GPx, T-AOC levels in HepG2 cells
核因子E2相关因子2(Nuclear factor E2 related factor 2,Nrf2)是在机体抵御氧化应激损伤时起重要作用的一种转录调节因子,对位于其下游靶基因的表达起活化作用。在机体内氧化还原处于平衡状态时,Nrf2在胞浆中被Kelch样ECH相关蛋白1(Kelchlike ECH-associated protein 1,Keap1)的相互作用所结合,与cullin 3(CUL3)/RBX E3泛素连接酶形成复合体,最终导致Nrf2蛋白酶体降解[28]。当平衡被打破后,氧化应激导致Keap1构象发生变化,Nrf2泛素化中止的同时半衰期延长,转移至细胞核中与抗氧化反应原件(antioxident responsed element,ARE)结合[29],并激活下游醌氧化还原酶1(Quinone oxidoreductase 1,NQO1)、血红素加氧酶-1(Hemeoxygenase1,HO-1)、谷胱甘肽S-转移酶[30]等Ⅱ相解毒酶基因的表达。
Keap1/Nrf2是调节人体氧化失衡、降低炎症反应、提高线粒体功能[31]的重要通路,在细胞抗氧化损伤、维持内环境稳态的过程中起着必不可少的作用。通过qRT-PCR测定HepG2细胞中Keap1、Nrf2、NQO1和HO-1基因的表达量,可以进一步明确芦荟多糖对HepG2细胞氧化应激损伤的保护作用途径。实验结果见表3及图5。

图 5 HepG2细胞Keap1、Nrf2、NQO1、HO-1的相对表达量Fig.5 Relative expression of Keap1, Nrf2, NQO1 and HO-1 in HepG2 cells
D-gal处理后,HepG2细胞Nrf2、NQO1、HO-1mRNA表达水平显著降低(P<0.05)。与D-gal模型组相比,芦荟多糖处理后的细胞Keap1基因表达水平极显著降低(P<0.01),当芦荟多糖的质量浓度为50、100 μg/mL时,Keap1表达与对照组间无显著差异(P>0.05);细胞中Nrf2、NQO1和HO-1的mRNA表达水平与模型组相比均显著提高(P<0.05),并与芦荟多糖浓度呈正相关,其中,芦荟多糖高浓度组的Nrf2和NQO1表达水平显著高于VC阳性组(P<0.05)。结果表明,D-gal会抑制Nrf2及下游蛋白的mRNA表达,而芦荟多糖可以有效缓解D-gal造成的Nrf2抑制作用,减轻细胞氧化损伤程度。

表 3 HepG2细胞Keap1、Nrf2、NQO1、HO-1的相对表达量Table 3 Relative expression of Keap1, Nrf2, NQO1 and HO-1 in HepG2 cells
3 讨论与结论
实验结果表明:芦荟多糖在12.5~400 μg/mL范围内对HepG2细胞无毒性作用;在D-gal浓度为200 mmol/L,诱导时间24 h条件下,通过25、50、100 μg/mL三个浓度的芦荟多糖预保护处理,可以不同程度地提高氧化损伤细胞的存活率,减少细胞MDA的生成量,提高细胞SOD、CAT、GPx活力和T-AOC水平,浓度依赖性地上调Nrf2、NQO1、HO-1基因的表达并降低Keap1的表达。由此可以推断,芦荟多糖能负向调节Keap1的表达以抑制Nrf2泛素化降解,提高NQO1、HO-1的转录水平,增强细胞抗氧化酶系活性并调控细胞氧化还原系统,以达到减轻细胞氧化损伤程度、提高细胞抗氧化能力的效果。
本研究通过构建D-gal诱导的体外损伤模型,证明了芦荟多糖对氧化应激损伤的HepG2细胞有保护作用,其机制可能与降低Keap1的表达水平从而抑制Keap1-CUL3/RBX E3复合体间的相互作用,激活Nrf2在细胞质的合成和核积累,启动下游ARE调控的抗氧化代谢途径中NQO1、HO-1等Ⅱ相解毒酶和包括SOD、CAT、GPx在内的抗氧化酶系基因转录有关。Nrf2作为生物体抵御外源性刺激的核心转录因子,除了Keap1蛋白发挥主要调控功能外,其磷酸化活化与蛋白激酶C(protein Kinase C,PKC)、胞内磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)等多种信号通路分子也存在相关性[32]。李建学[33]的研究结果表明,芦荟多糖能促进PKC蛋白的表达及磷酸化,引起丝裂原活化蛋白激酶反应以促进创面愈合。在细胞应对氧化应激损伤的调节过程中,PKC介导的Nrf2磷酸化修饰在Nrf2核易位过程中起重要作用[34],由此可以猜测,芦荟多糖对Nrf2的激活效应不仅体现在Keap1/Nrf2通路上,可能还涉及到PKC/Nrf2/HO-1等信号通路间的级联调控作用。
目前关于芦荟多糖的提取方式正不断优化,分离纯化水平进一步提升,芦荟多糖在食品行业中的应用有广阔前景。本研究对于将芦荟多糖作为功能性成分进行食品新产品的研发,提供了一定的理论依据和参考价值。然而,功能因子在生物体内的调节途径较为复杂,影响因素更多,因此对于芦荟多糖在体内发挥抗氧化作用的机制以及与信号通路间的调控关系,还需进行更深入的研究。
