慢性哮喘小鼠气道重塑情况观察及发生机制探讨
2023-01-03卢卫红吴湘涛李多多邓翔张星亮徐亚利李树军冯冲
卢卫红,吴湘涛,李多多,邓翔,张星亮,徐亚利,李树军,冯冲
1 新乡医学院第一附属医院儿科,河南新乡 453100;2 广东医科大学附属医院儿科;3 深圳市儿童医院儿研所;4 合肥学院生物食品与环境学院
哮喘是儿童常见的慢性呼吸道疾患,患病率约3%,近年发病率呈持续上升趋势[1]。哮喘的长期反复发作容易导致气道特异性高反应性、气道壁炎症、气道平滑肌增生和肥大等[2-5]。微小RNA(miRNA)是一类内源性的非编码RNA,在调节过敏性疾病(比如哮喘)的发生发展过程中对气道平滑肌的病理改变有重要作用[6],但是其发挥作用的具体分子机制有待深入研究[7-10]。研究[11]显示,自噬相关基因Atg5某些SNP位点与儿童哮喘相关。从自噬寻找哮喘治疗靶点是一个新的研究领域,但自噬与气道平滑肌和成纤维细胞的生理学等问题还需要进一步研究[11-13]。我们前期报道了 miR-3162-3p 首个靶蛋白为β-catenin 蛋白,并在急性哮喘小鼠模型上证明内源性 miR-3162-3p 降低肺组织 β-catenin 蛋白[14]。有文献[11]报道,Wnt/β-catenin 通路和自噬信号存在相关性。因此,我们猜测miR-3162-3p/β-catenin 有可能通过调控自噬信号影响哮喘气道平滑肌肥大增厚。2020 年3—12 月,我们观察了慢性哮喘小鼠气道重塑情况,并探讨其机制。
1 材料与方法
1.1 实验动物及主要试剂、仪器 6~8周龄SPF级雌性BALB/c小鼠25只,体质量(20± 2)g,购买于广东省医学实验动物中心,在通风良好清洁的动物房中适应饲养3 d,温度23~26 ℃,相对湿度52%~57%,明暗各半交替循环,自由饮水进食。鼠源βcatenin 单克隆抗体(ab32572,Abcam),鼠源β-actin多克隆抗体(4967S,CST),兔源LC3B-Ⅰ/Ⅱ单克隆抗体(12741,CST),HRP 标记山羊抗鼠 IgG(H+L)(E03012002,Earthox),HRP 标 记 山 羊 抗 兔 IgG(H+L)(A0208,碧云天),Goat Anti-rabbit IgG/ Alexa 488(4412S,CST),TGF-β1(240-B,CST),Tween 20(Amresco),鸡卵清蛋白OVA(Grade V,Sigma),乙酰甲胆碱(Grade V,Sigma),DMEM 高糖培养基(Thermo Fisher Scientific),胎牛血清(16000-044)购于美国Gibco 公司。PageRuler Prest Protein Ladder(26616,Fermentas),miRNA mimics[百奥生物技术(南通)有限公司],BeyoECL Plus(P0018M,碧云天),Lipo 3000(L3000075,Life Technologies),miRNA RT-PCR Kit(RR716)和 Mir-X ™ miRNA First Strand Synthesis Ki(t638313)购于TAKARA,马松三色染色试剂盒(G1340)购于北京索莱宝科技有限公司。引物合成及测序服务均有华大基因公司提供。BUXCO 无创动物肺功能仪购于美国Buxco 公司,KYWH1004 型雾化器购于佛山凯亚医疗科技有限公司,LightCycler® 480Ⅱ荧光定量PCR 系统购于美国罗氏公司,BioPhotometer 分光光度计仪购于德国 Eppendorf 公司,Biolmaging system 凝胶成像系统购于美国UVP 公司,TCS SPF5 Ⅱ徕卡激光共聚焦显微镜购于徕卡公司,蛋白垂直电泳仪购于Bio-Rad 仪器厂。
1.2 小鼠分组、哮喘模型制备及模型制备成功判定 取小鼠16 只,并随机分为哮喘组和对照组(各8 只)。哮喘组于第0 和7 天腹腔注射致敏液(含25 μg 的 OVA,1 mg 佐剂明矾,溶于 0.2 mL 的 PBS,现配现用),第2 至12 周用激发液(125 mg 的 OVA溶于5 mL 的PBS,现配现用)雾化激发,每2 周2次,连续2 d,每次30 min。对照组采用PBS 替代致敏液和激化液。模型制备成功判定:①小鼠肺功能检测:两组小鼠均在末次激发后24 h 进行肺功能检测。将4 只清醒状态小鼠分别放进Buxco 无创肺功能仪中,测定基础值,包括呼吸频率(F)、潮气量(TV)、每分钟通气量(MV)、吸气时间(Ti)、呼气时间(TE)、吸气峰流速(PIF)、呼气峰流速(PEF)、呼吸 间 歇(Pause)和 PenH 值(PenH=Pause×PEF/PIF)。PenH 主要反映了气道阻力。小鼠雾化吸入不同浓度的乙酰甲胆碱溶液(0、3.12、6.25、12.50、25.00 mg/mL),每次雾化2 min,反应、记录时间为3 min,恢复时间为1 min。计算小鼠的PenH,方法参照文献[14-15]。与对照组相比,哮喘组 PenH 显著升高,提示气道呈高反应状态。②小鼠肺泡灌洗液(BALF)中细胞总数及细胞分类计数:将哮喘组和对照组小鼠仰卧位固定在小动物手术台上,剪开颈部和胸部中间皮肤和肌肉暴露气管和胸廓。采用眼科手术剪将肺与膈肌及相关黏连完全剥离,结扎左肺支气管根部(支气管分叉处附近)和气管远心端,剪取左肺用于小鼠肺支气管厚度和胶原沉积检测。用静脉留置针插入右肺相通的气管内约0.2 cm 后拔针芯,同时向前推进留置针软管约0.3~0.4 cm 处固定。注射器抽取0.5 mL 生理盐水缓慢注入右肺,待肺组织膨胀后数秒后回抽,灌洗3 次,每次回收率不低于80%。将收集好的BALF 在 4 ℃和800 g的条件下离心5 min 弃上清,用100 μL 生理盐水充分重悬混匀细胞团,取混匀的重悬液10 μL 滴入血球计数板,于低倍镜下计数(四角大方格,每大方格又分16个小方格),细胞悬液细胞数/mL=(4 个大格细胞总数/4)×104。将 50 μL 的BALF 细胞重悬液在玻片上涂片,立即热风干,约30 min 后进行瑞氏—吉萨姆染色,计算细胞分类。方法参照文献[14-15]。收集BALF 进行白细胞总数和分类计数,与正常组相比,哮喘组总细胞数量增加了近6倍,嗜酸性粒细胞的百分含量显著升高,但是淋巴细胞的百分含量明显下降。气道反应性和BALF细胞计数的结果提示,OVA-慢性哮喘小鼠模型构建成功。
1.3 小鼠肺支气管厚度和胶原沉积的检测 取“1.2”实验剪取好的两组(各6 只)小鼠左侧肺叶中部,置于4%多聚甲醛溶液中固定。脱水透明和浸蜡包埋后进行连续切片(厚度约3 μm)、烤片、染色、洗片、封片等操作,采用马松三色染色试剂盒。在倒置光镜下观察肺组织病理学形态,随机选择5 个直径100~200 μm 的支气管横截面,并通过图像采集系统获取图像。使用图像分析软件Image-pro Plus 6.0测量基底膜周长(Pbm)、平滑肌面积(Wam)和基底膜下胶原面积(Wcol)。计算平滑肌层厚度(Wam/Pbm,μm2/μm)和基底膜下胶原沉积厚度(Wcol/Pbm,μm2/μm)。
1.4 小鼠肺组织miR-3162-3p、β-catenin、LC3B-Ⅱ/Ⅰ蛋白检测 ①miR-3162-3p:采用qRT-PCR法。取每组小鼠(各3只)右肺组织20~30 mg,液氮研磨,然后采用天根公司 miRcute miRNA Isolation kit(DP501)试剂盒提取小鼠肺组织的microRNA。采用TaKaRa公司的 SYBR® PrimeScript ™ miRNA RT-PCR Kit(RR716)试剂盒进行miR-3162-3p 的逆转录和实时荧光定量PCR。miR-3162-3p:5’-UCCCUACCCCUCCACUCCCCA-3’,5’-CTACCCCTCCACTCCCCAAAA-3’,RNU6B:5’-GGAACGATACAGAGAAGATTAGC-3’,5’-TGGAACGCTTCACGAATTTGCG-3’。Light-Cycler 480Ⅱ扩增仪进行实时荧光定量PCR 和数据分析。采用2-ΔΔCt值相对定量法计算目标基因的转录水平。方法参照文献[14]。②β-catenin、LC3B-Ⅱ/Ⅰ蛋白:采用Western blot 法。取每组小鼠(各3 只)左肺中下叶组织100 mg,用预冷的PBS 洗涤肺组织后置于预冷的研钵内(后续步骤均在冰上完成),加适量液氮,充分研磨后采用移液枪吸取肺组织匀浆至1 mL 的EP 管内。对于小鼠气道平滑肌细胞,各组收集一个6 孔板细胞,弃培养基后加入PBS 冲洗3次。加适量RIPA 蛋白裂解液及蛋白抑制剂,静置20 min 充分裂解组织和细胞后于4 ℃环境下以13 000 g 条件离心10 min,保留上清液,采用BCA 蛋白浓度测定试剂盒测量上清液中总蛋白浓度。取30 μg总蛋白的上清液加入适量缓冲液煮沸5 min后上样,采用10%SDS-PAGE 进行分离,然后采用PVDF 膜湿 转 ,5% 脱 脂奶 粉室 温封 闭 1 h,加入LC3B-Ⅱ/Ⅰ一抗(1∶1 000)或者 β-catenin 一抗(1∶3 000)于4 ℃孵育过夜,TBST洗膜后采用相应种属HRP 标记的二抗(1∶2 000)在室温下反应 2 h,ECL 化学发光法在暗室曝光。以β-actin(1∶3 000)作为内参。实验重复3 次。采用Image J 图像分析软件采集信号和灰度扫描。
1.5 小鼠气道平滑肌细胞分组、miR-3162-3p mimic转染及LC3B-Ⅱ/Ⅰ蛋白检测 断颈法处死小鼠(每组5 只),在75%酒精中浸泡2 min,快速分离气管,放入D-Hanks 液(含100 U/mL 青链霉素)中,在超净台内去净气管外周组织后纵切气管,小心去除内外膜,使用眼科剪将气管剪成约1 mm3小组织块,贴在25 mL 培养瓶底,加入 2 mL 高糖 DMEM 培养基(含20%胎牛血清),不使培养液接触组织块。倒置培养瓶,37 ℃和5%CO2培养箱中静置约3 h。组织块将近干涸时缓慢再次倒置培养瓶,使得培养液刚好覆盖组织块表面,静置培养3 d 后添加培养液至5 mL,在第6天换液,此后每3天换1次液。在光学显微镜下观察组织块边缘细胞逐渐汇合达80%即可进行首次传代。弃培养基后2 mL 的D-Hanks 液清洗3次,加入0.25%胰酶消化,显微镜下细胞边缘透亮且胞质回缩后加入15%胎牛血清的培养基终止消化,吹打成单细胞悬液铺板接种。采用差速贴壁法去除成纤维细胞。含有10%胎牛血清、终浓度100 U/mL 的青霉素、100 μg/mL 链霉素的 DMEM 培养基,置于37 ℃、5%CO2,饱和湿度的恒温培养箱中培养,每隔2 d 换液,细胞长势良好时每3 d 传代1次,以上细胞原代培养参照文献[16]。当细胞处于对数生长期,分成两组,对照组加入PBS,Mimic 组转染 miR-3162-3p mimic(5'-UCCCUACCCCUCCACUC CCCA-3',5'-UGGGGAGUGGAGGGGUAGGGA-3'),各组在6 孔板中铺入细胞。24 h 后,再添加TGF-β1(2 ng/mL)孵育24 h。小鼠气道平滑肌细胞LC3B-Ⅱ/Ⅰ蛋白表达和分布检测:采用免疫荧光实验检测。将小鼠气道平滑肌细胞以5×104的密度铺于底部有玻片的6 孔细胞板,干扰处理24 h 后,采用PBS冲洗细胞,4%多聚甲醛固定,1%Triton 通透细胞膜,LC3B-Ⅱ/Ⅰ一抗孵育12 h,孵育Alexa 488 标记的兔IgG 抗体。采用DAPI 重新固定细胞核,并通过共聚焦成像。参照文献[17]方法。
1.6 统计学方法 采用SPSS17.0 统计软件。符合正态分布的计量资料以表示,组间比较采用双样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组小鼠肺支气管厚度变化及支气管平滑肌厚度、基底膜下胶原沉积厚度比较 两组小鼠支气管厚度变化见图1,由图1可知,对照组马松三色染色结果显示肺泡间隔匀称、支气管结构清晰正常;哮喘组肺组织结构不均匀,偶见支气管上皮细胞疏散,哮喘组的支气管平滑肌肌层肥厚,上皮下纤维化明显增多,基底膜增厚,支气管周围蓝色胶原沉积加重。哮喘组、对照组支气管平滑肌厚度分别为(11.120 0±0.342 7)、(4.110 0 ± 0.202 9)μm2/μm,基底膜下胶原沉积厚度分别为(39.130 0 ± 1.072 0)、(14.100 0 ±0.444 7)μm2/μm,两组比较,P均<0.05。
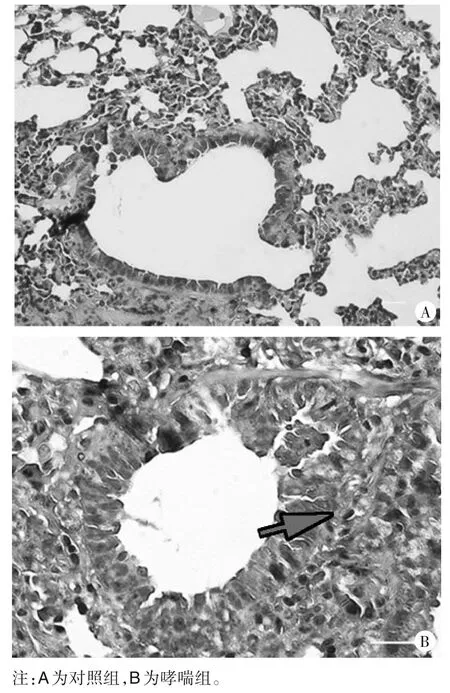
图1 两组小鼠支气管厚度、基底膜下胶原沉积厚度变化(马松三色染色,×200)
2.2 两组小鼠肺组织miR-3162-3p、β-catenin 蛋白、LC3B-Ⅱ/Ⅰ蛋白表达比较 小鼠肺组织miR-3162-3p、β-catenin 蛋白、LC3B-Ⅱ/Ⅰ蛋白表达比较见表1。
表1 两组小鼠肺组织miR-3162-3p、β-catenin蛋白、LC3B-Ⅱ/Ⅰ蛋白表达比较()

表1 两组小鼠肺组织miR-3162-3p、β-catenin蛋白、LC3B-Ⅱ/Ⅰ蛋白表达比较()
注:与对照组比较,*P<0.05。
组别哮喘组对照组LC3B-Ⅱ/Ⅰ蛋白1.200 00±0.056 82*1±0 miR-3162-3p 2.362 0±0.116 2*1±0 β-catenin蛋白0.428 90±0.077 12*1±0
2.3 两组小鼠气道平滑肌细胞转染miR-3162-3p mimic 后LC3B-Ⅱ/Ⅰ蛋白表达比较 在TGF-β1诱导支气管平滑肌肥大增厚模型上,转染miR-3162-3p mimic后,免疫荧光技术检测结果显示LC3B-Ⅱ/Ⅰ蛋白在细胞质中荧光强度较对照组明显增强,提示自噬水平大幅上调(图2A)。WB 检测结果显示,Mimic 组LC3B-Ⅱ/Ⅰ蛋白比例明显增多,灰度值分析显示Mimic组和对照组LC3B-Ⅱ/Ⅰ蛋白比值分别为1.969 0 ± 0.174 1、1 ± 0,P<0.05,进一步证实自噬水平上升(图2B)。
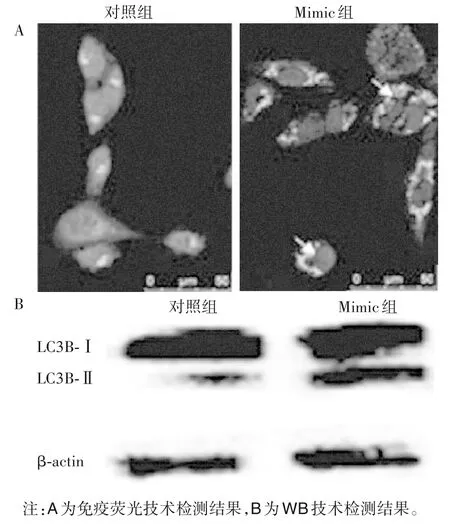
图2 两组LC3B-Ⅱ/Ⅰ蛋白表达分布和水平
3 讨论
慢性哮喘是呼吸科常见的一种气管慢性炎症反复发作的疾病,以气道炎症、咳嗽、喘息、呼吸急促、胸闷等典型特征和气流受限作为诊断的主要依据[18]。目前认为,慢性哮喘可以引起气道重构,是导致气道不完全可逆狭窄的重要原因。气道重构的主要表现包括气道平滑肌细胞增生和肥大、气道上皮基底膜增厚和基底膜下胶原沉积、气道上皮细胞增殖以及杯状细胞化生[19]。哮喘治疗方案中重要的手段之一是吸入糖皮质激素,但糖皮质激素的使用会对儿童的发育和成长产生深远的影响,如激素依赖和抵抗或是股骨头坏死或生长抑制等不良反应[20]。布地奈德福莫特罗粉吸入剂为吸入性糖皮质激素/长效β2受体激动剂,作为中至重度持续发作哮喘患者的长期治疗药而被使用,可获得优于加倍剂量糖皮质激素的功效,但仍存在不少不良反应。因此,探索哮喘新治疗方案一直是呼吸系统疾病研究领域关注的重点[10]。miRNA 在特定的组织和发育阶段、疾病发生的某个过程发挥调控功能。已有研究[21]证实,与疾病相关的多种miRNA 具有被开发成诊断试剂盒或治疗性药物的潜力。在急性哮喘小鼠模型上我们已经证实,miR-3162-3p可以靶向下调β-catenin蛋白,miR-3162-3p 抑制剂保护肺组织β-catenin 蛋白,降低肺组织的炎症水平[14]。本研究旨在慢性哮喘小鼠模型上研究miR-3162-3p 及靶蛋白的变化以及初步探讨其影响气道重塑的分子机制。目前已有研究表明,miRNAs 参与哮喘的发生及发展。文献[22]报道,miR-20b 诱导慢性哮喘小鼠肺髓源性抑制细胞增多。miRNA-142 通过抑制TGF-β 依赖性EGFR 信号通路,抑制哮喘大鼠气道重塑过程中气道平滑肌细胞增殖和凋亡[23]。研究[6]显示,miR-485通过靶向Smurf2 调节慢性哮喘小鼠TGF-β/Smads信号通路,肺组织中3 种miRNA 增高或者降低。采用OVA 雾化激发6 周建立慢性哮喘小鼠,发现气道壁miRNA 表达水平先上升后逐渐下降[4]。本文构建12 周的慢性哮喘小鼠模型,发现其气道反应性明显比对照组小鼠高,表明慢性哮喘小鼠的肺功能下降;BALF 细胞计数结果显示慢性哮喘小鼠气道炎症浸润明显增多;马松三色染色的结果显示慢性哮喘小鼠气道平滑肌增厚、胶原沉积显著增多,证明气道明显变狭窄;与对照组比较,慢性哮喘小鼠肺组织中miR-3162-3p 表达水平上升,提示miR-3162-3p 在慢性哮喘小鼠气道重塑中可能发挥重要作用。
有研究[24]显示,β-catenin 蛋白在调节慢阻肺气道重塑中有重要作用,比如miR-337。β-catenin 蛋白还可以影响人气道成纤维细胞[25]、人气道上皮细胞[26]或气道平滑肌细胞[27]进而影响气道重塑。本文观察到慢性哮喘小鼠肺组织miR-3162-3p 的靶蛋白β-catenin 明显下调。Wnt/β-catenin 通路和自噬相互关联,自噬基因Atg5 表达减弱导致β-catenin 蛋白表达增加;β-catenin蛋白表达增加,自噬减弱[11]。自噬激活Src,促进Src 相关的β-catenin 蛋白在Y-654磷酸化,形成 pY654-β-catenin/p-Smad2 复合物,促进TGF-β1诱导小鼠肾小管上皮C1.1 细胞的上皮间质转化[28]。在小鼠的 PanIN 细胞中,经典 Wnt3a 配体能诱导自噬标志物[29]。β-catenin 蛋白和自噬之间存在调控或者被调控的关系,但是没有明确一致的关系,可能与细胞或者组织的特异性有关[30]。TGF-β1是哮喘患者气道重塑的关键细胞因子,可以引起细胞外基质增加以及气道平滑肌细胞的肥大[31]。本文采用TGF-β1诱导气道平滑肌细胞肥大,证实miR-3162-3p mimic 能促使肥大型气道平滑肌细胞自噬水平上升。因此可以推测,在气道平滑肌细胞上,miR-3162-3p 靶向β-catenin 蛋白促进了细胞自噬水平上调,这可能影响慢性哮喘小鼠气道重塑的发病机制。
总之,miR-3162-3p 可能是通过下调β-catenin蛋白的表达,促进气道平滑肌细胞自噬水平上调,减轻OVA 诱导的慢性哮喘导致的气道平滑肌增厚和基底膜下的胶原沉积,缓解了气道狭窄。
