基于DNA 条形码技术对草莓丝核菌属病原菌的鉴定
2023-01-02史芳芳杨其享胡长军
史芳芳,杨其享,胡长军,李 明
(新疆生产建设兵团第十二师农业科学研究所,新疆乌鲁木齐 830088)
草莓(Fragaria×ananassaDuch.),属蔷薇科草莓属多年生常绿草本小浆果果树,果实色泽鲜艳、芳香多汁、酸甜适口、含有丰富的维生素C,被誉为“水果皇后”。近几年,随着中国草莓种植面积的不断扩大,其栽培模式也在发生转变,草莓栽培过程中的病害问题逐渐突显。草莓病害种类较多,除了地上部的灰霉病、白粉病等重要常发病害以外,还有重茬带来的土传根部病害,轻者引起植株生长不良,严重时可造成植株死亡,对草莓产量影响较大,给草莓种植者造成重大的经济损失。目前,草莓土传病害在全国的草莓种植区域逐渐加重。已报道的草莓根腐病的病原菌已达20 多种,主要有镰刀菌属(Fusarium)[1]、炭疽菌属(Colletotrichum)、丝核菌属(Rhizoctoni)a、柱孢菌属(Cylindrocarpon)、拟盘多毛孢属(Pestalotiopsis)等病原真菌。其中,由丝核菌属病原菌引起的草莓根腐病是影响草莓生产的重要病害之一[2],严重威胁草莓的生产并减少草莓的经济效益,此病原菌产生的病害在欧美国家,如美国、意大利等国均有报道。而中国对草莓丝核菌引起的根腐病研究比较少,前期已报道的丝核菌属病原菌一般为立枯丝核菌(R.solani)。2016年,钟珊等[3]首次报道了丝核菌属引起的草莓根腐病在中国北京发生,其病原真菌菌种为双核丝核菌(binucleateRhizoctonia)[4]。丝核菌属种类繁多,通过培养、分离和纯化,其在平板上的形态各有不同,有些形态很相近,利用形态学建立的分类系统很难对该属进行准确的分类鉴定。近年来,常见的分子生物学技术包括单核苷酸多态性[5]、限制性片段长度多态性、随机扩增多态DNA[6]、扩增片段长度多态性[7]以及简单重复序列分子标记[8]等扩增技术逐渐被应用于丝核菌属真菌的分类鉴定中。DNA 条形码鉴定技术作为一种新兴的分子生物学检测手段已得到快速的发展,该技术是利用一段相对较短的标准DNA 序列对物种进行准确而高效的分子鉴定,而不受物种发育阶段的限制,易扩增且具有较强的通用性[9]。通常鉴定使用的多种基因位点包括内转录间隔区(ITS)、细胞核翻译延伸因子(EF-1α)、β-微管蛋白(β-tubulin)、线粒体小亚基核糖体(mtSSU)[10-12]等,这些基因已被广泛用于植物病原真菌中属及种间的鉴定,目前应用最多的是ITS和EF-1α基因[13],而ITS、GAPDH(磷酸甘油醛脱氢酶)和CAL(钙调蛋白)基因常被用于丝核菌属菌种鉴定。
本研究利用DNA 条形码鉴定技术,选取GAPDH、ITS和CAL共3 个候选基因片段对2 种丝核菌进行检测鉴定,将获得各基因序列的难易程度和种内与种间遗传距离频率分布作为DNA 条形码主要的评价筛选基因标准,从而筛选出适合于准确鉴定丝核菌属的DNA 条形码基因,最终为丝核菌属病原菌的分子快速检测、分类鉴定及其系统发育研究提供有力的技术支持,为我国草莓根腐病其中一种病原真菌的快速鉴定提供技术支撑。
1 材料与方法
1.1 材料与仪器
试验菌株:试验中所用的丝核菌株见表1。

表1 丝核菌属菌株信息Table 1 The strain information of Rhizoctonia
马铃薯葡萄糖琼脂(PDA)购自北京索莱宝科技有限公司。
DNA 快速提取试剂盒、PCR 扩增试剂,生工生物工程(上海)股份有限公司;1×TAE 电泳缓冲液、DL2000 Marker,天根生化科技(北京)有限公司;DHP-9080B 电热恒温培养箱,上海琅轩实验设备有限公司;T100 梯度PCR 扩增仪、Power PacBasic 型电泳仪、凝胶成像仪,美国伯乐公司。
1.2 方法
1.2.1 菌株DNA 的提取及PCR 扩增
将草莓病株根部分离纯化,获得的菌株置于PDA 培养基上,培养3~5 d,采用真菌基因组提取试剂盒提取各菌株DNA,置于-20 ℃下保存备用。针对真菌DNA 条形码技术的研究进展及丝核菌属的分子系统分类学研究现状,本研究共选取了4 对候选基因序列对收集的19 株丝核菌属病原菌进行分子生物学检测鉴定,候选基因分别为ITS1/2、ITS1/4、CAL和GAPDH(表2)。25 μL PCR 扩增反应体系为10×PCR Buffer 溶液、0.5 μL Taq DNA 聚合酶,1.2 μL MgCl2,0.4 μL dNTP,上下游引物(10 μmol/L)各1 μL、1 μL 模板DNA,补ddH2O 至25 μL。扩增程序为94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃总延伸10 min,扩增结束后,置于-20 ℃冰箱保存备用。采用1.0%琼脂糖进行电泳检测,PCR 产物由上海生工生物技术有限公司进行双向测序,所有扩增出条带的序列提交至NCBI 数据库。

表2 本研究所用序列及引物信息Table 2 The information of sequences and primers in this study
1.2.2 候选基因序列的PCR 扩增与测序成功率
目标序列获得的难易程度用PCR 扩增与测序成功率表示,即PCR 扩增成功率乘以测序成功率的乘积。制备浓度为1.5%的琼脂糖放凉备用进行电泳检测,取5 μL的PCR 产物进行凝胶电泳,用1×TAE 电泳缓冲液在150 V 的电场下电泳30 min,电泳结束后,取出凝胶块置于凝胶成像仪上,观察照相并分析,电泳条带单一、明亮、特异性强、大小正确,则认为该序列扩增成功,可用于后续测序,若无条带或出现多条亮带,则是未扩增出目标条带或者特异性不强,需要调整扩增条件。
1.2.3 系统发育树建立及遗传距离分析
将测序成功的序列用DNAMAN 8 分子生物学专业软件进行序列比对,将比对后的序列输入系统进化树MEGA 5.05 分析软件,采用邻接法(neighbor-joining,NJ),并选择Kimura 双参数模型(Kimura2-parameter model,K2P)构建系统发育树,Bootstrap 自展重复选择1 000 次。使用MEGA 5.05 软件以K2P 模型计算种内与种间遗传距离,从而检验该物种的种内个体间与种间遗传变异的差异是否显著,同时利用Excel 2007 分析种间遗传距离频率分布对种内与种间距离的DNA 条形码间隙(DNA barcoding gap)进行检测。
2 结果与分析
2.1 候选基因序列PCR 扩增与测序
利用4 个候选的DNA 条形码基因ITS、CAL和GAPDH片段对收集的20 个菌株进行PCR 扩增和凝胶电泳检测,符合测序的要求。本试验中有19 个菌株测序成功,比对验证是丝核菌的菌株,包含两个菌种,分别为7 个Ceratobasidium(禾谷丝核菌)和12 个Rhizoctonia(立枯丝核菌)。3 个基因中ITS1/2引物PCR 扩增与测序成功率分别为100.0%和92.7%,其序列片段更易获得,而其余2 个基因引物PCR 扩增率很低。因此最终选择ITS 基因中的ITS1/2引物序列进行系统发育树的构建和分析。
2.2 丝核菌种内与种间遗传距离频率分布
采用K2P 参数模型计算了丝核菌种内和种间遗传距离,丝核菌ITS基因表现出种内与种间遗传距离的重叠,存在条形码间隙,重叠少则说明能更好地区分种内和种间,而种间遗传距离大,说明种间关系相距远。ITS基因种内与种间遗传距离分别为0~0.35 和0.28~0.54(图1A)。ITS基因存在种内与种间遗传距离部分重叠(嵌套部分),主要集中在0.28~0.33 之间,其中Rhizoctonia菌种内遗传距离为0~0.35,Ceratobasidium菌种内遗传距离为0~0.28(图1B),其中Rhizoctonia_sp._isolate_Rh_293_isolate 菌株与其它Rhizoctonia种内菌株遗传距离为0.29~0.35,其种间的遗传距离小于种内遗传距离,其它丝核菌种间差异明显大于种内的差异,较其它基因能更好地区分丝核菌,因此将ITS基因作为鉴定丝核菌属的DNA 条形码。
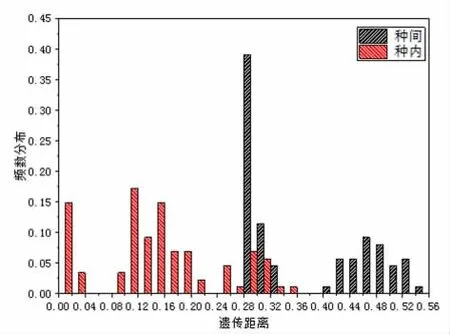
图1 A 候选基因ITS 种内和种间遗传距离的频率分布比较Fig.1 A Comparison of the frequency distributions intra and interspecific genetic distances for the gene ITS
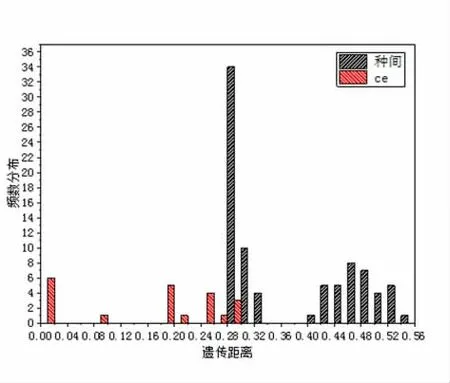
图1 B 候选基因ITS 种间遗传距离的频率分布比较Fig.1 B Comparison of the frequency distribution in the interspecific genetic distance of the gene ITS within Ceratobasidium species
2.3 基于ITS 基因构建系统发育树
将候选基因所得的测序结果在GenBank 数据库中进行BLAST 同源性比对,结果显示,各菌株样品与数据库中属、种的相似度大部分在99%以上,2 类丝核菌分别为立枯丝核菌(Rhizoctonia)和禾谷丝核菌(Ceratobasidium)。基于ITS基因构建的系统发育树中,不同菌种的菌株均位于不同的进化树分支末端,同一个菌种的菌株都不同程度地聚在一起,两个菌种的基因鉴定支持率在96%以上,表明该候选基因的鉴定能力较好。利用邻接法构建的NJ 进化树由19 条基因序列构成(图2),从聚类结果看,Rhizoctonia和Ceratobasidium分别聚集在两个大的进化树分支上,说明ITS基因能够较好地区分本研究中的两个丝核菌菌种。

图2 基于ITS 基因序列构建的19 株丝核菌属菌株的系统发育树Fig.2 The constructed phylogenetic tree of 19 Rhizoctonia strains based on ITS gene sequences
为实现物种快速而准确地鉴定DNA 条形码,必须满足2 个重要指标,首先要有较高的PCR 扩增与测序成功率,其次要有较好的种内与种间遗传距离频率分布。本研究结果中,ITS基因片段(ITS1与ITS2引物扩增出的序列)具备了较高的PCR 扩增与测序成功率92.7%,相对于其它3 个基因片段,扩增效率高,且种内与种间遗传距离重叠部分较少,除立枯丝核菌种内遗传距离大于立枯丝核菌和双丝核菌的种间遗传距离外,其余丝核菌种内差异明显小于种间差异,该基因片段能将丝核菌属菌种更好地区分开,因此选择ITS基因片段进行系统发育树构建和系统发育关系分析。本研究中,基于ITS片段构建的系统发育树,大部分相同种聚集在同一分支,不同种划分在不同分支,鉴别能力较好,并且支持率多数达到96%以上;在3 个候选基因中,ITS基因(ITS1/2引物)较其它候选片段更适宜作为丝核菌属DNA 条形码。
3 讨论
草莓根腐病病原菌较多,其中丝核菌是引起该病的重要病原菌。由丝核菌引起的是重要的草莓根部病害之一。研究报道,丝核菌属可被分为单核、双核和多核丝核菌不同类群。在国外,引起草莓根腐病的多数为双核丝核菌和多核丝核菌[14-17]。与草莓根腐病有关的多核丝核菌为立枯丝核菌(R.solani)。国内对草莓丝核菌根腐病的报道有限,在东北和华北地区发现的与草莓根腐病有关的丝核菌均为立枯丝核菌(R.solani)[18]。近几年,对于草莓病害的鉴定中发现,丝核菌也是引起新疆草莓病害的主要病原菌之一,其症状与其它草莓根腐病相似。因此,精准鉴定病原菌种类对后期针对性治疗草莓根腐病有重要意义。
近几年,很多研究学者利用DNA 条形码鉴定技术对病原菌分类系统发育展开研究,而对于丝核菌的鉴定多基于形态学、菌丝细胞核荧光染色、菌丝融合群测定、不同基因序列分析和柯赫氏法则验证,但该方法不仅检测程序复杂,而且不能确保一次性准确判断菌种的归类。本项目通过不同基因验证,筛选出一个较为合适的ITS基因序列鉴定丝核菌属。
ITS序列因其片段较短、物种间变异性强易扩增测序等优点被广泛用于真菌的分类研究,并在2011 年国际真菌DNA 条形码工作会议上确定ITS为真菌的通用条形码。本研究对于ITS基因的两个片段采用不同引物进行扩增,发现常用的ITS1/4引物扩增效果不佳,而ITS1/2引物扩增效率较好,这与很多科研工作者将ITS 作为真菌的通用鉴定基因一致[19]。在已有的关于丝核菌类鉴定的报道中,ITS基因可对大多数丝核菌进行鉴定,但大部分采用的是ITS1/4引物,且鉴定的是一个种[19]。通过研究多条序列对丝核菌属的鉴定能力,得出ITS 基因比其它基因更有利于丝核菌的分类鉴定。对于某些丝核菌,ITS1/4基因也有其优势,如能成功鉴定引起草莓丝核菌根腐病的双核丝核菌AG-A 融合群,但不能将立枯丝核菌和双丝核菌区分开。此外,本项目中丝核菌属菌株有限,在以后的工作中,还需补充丝核菌菌种的菌源进一步验证ITS基因的鉴定能力或寻找新的基因片段以及多基因联合鉴定的方法。
